超疏水表面材料在生物医学检测领域研究进展
2022-11-08林彦萍王庆成吕恕位杨晓东1a
林彦萍,王庆成,吕恕位,杨晓东1a,,2
超疏水表面材料在生物医学检测领域研究进展
林彦萍1a,2,王庆成1b,吕恕位1b,杨晓东1a,1b,2
(1.吉林工程技术师范学院 a.生物质功能材料交叉学科研究院 b.机械工程学院,长春 130052;2.吉林省秸秆基功能材料重点实验室,长春 130052)
近年来,超疏水表面材料在自清洁、防潮、油水分离、防污、防腐等领域有着广泛的研究与应用;同时,利用超疏水表面材料来研究生物系统成为了生物医学领域的研究热点,大大促进了生物医学检测先进技术的发展。综述介绍了超疏水表面材料在生物医学检测领域的应用研究进展,重点对痕量分子的浓缩和检测,分离生物混合物,精确定位纳米级别分子的位置,药物的控制释放,与多种光谱方法结合的检测方法,精确控制纳米液滴阵列,预防细菌黏附和生物膜形成以及抗血小板黏附、抗凝血等方面具有代表性的应用研究进行了简要概述,并分析了各自优缺点以及目前存在的问题;归纳总结了现有超疏水表面材料在生物医学检测领域研究存在的不足,超疏水表面材料在生物医学检测领域的研究还处于发展阶段,其中一些理论还存在着相互冲突的观点。最后,对今后的研究工作进行了展望,以期为超疏水表面材料在生物医学检测领域的研究与发展提供理论参考。
超疏水;表面材料;生物;医学
临床实践中分子标记检测的新型诊断工具需求日益增长[1-2],这对癌症等疾病的早期诊断很重要,这些标记的主要来源是血液、血浆和尿液等生物样本。然而,在许多疾病发生的早期,在临床检测过程中与疾病相关的分子标记物数量通常非常少,而且这些分子标记物的检测还受到每个生物样本中成分多样性的干扰,因此,从生物样本的分析结果中直接获取具有统计学意义的信息是个性化医疗时代的一项重要任务,使用少量液体将临床检测中的相关分子标记物与干扰素分离,并将浓度低的样本增加至可检测到的阈值是实现该重要任务的关键。
纳米技术为这些挑战提供了创新方法及策略,其中超疏水表面是重要的方法之一。疏水表面大大促进了现代生物学和医学领域的技术进步,在诊断和治疗实践中也具有多种应用[3-6]。超疏水表面接触角高于150°。根据Wenzel和Cassie–Baxter模型,这种润湿原理不仅是表面化学的结果,也是由微米和纳米结构组成的粗糙表面纹理造成的[7-9],这种结构的尺寸范围从几百纳米到几十微米,通过使用自上而下和自下而上的方法,科学家们已经开发出有效的策略来模仿天然存在的超疏水表面,实现具有超级润湿性的人造表面。近几十年来,超疏水表面在抗湿润和自清洁材料方面的技术应用引起了很多关注[10-11]。随后,科学家将他们的兴趣转移到更基本的问题上,例如优化表面特征、精确控制液体和固体间界面的润湿现象,这些研究工作促使新型和先进的超疏水表面材料的开发和利用,实现在实际操作中轻松处理微量的液体,达到几微升甚至纳升的级别。此外,精确的微观和纳米结构的实现不仅可以实现控制微量液滴,还可以实现在微米级和纳米级水平上控制、可视化和操纵液滴中包含的物质,这种精确控制在生物医学领域得到了广泛的应用,可以直接在液体环境中操纵细胞和大分子[6,12-26]。
新型超疏水表面能够实现集中极度稀释的溶液[5,16,18,20-21,27]、分离生物混合物[28,29]、改进超灵敏分子光谱[5,16,20,28-31]、在纳米级别传递和控制分子[12-14,17-19,32],为化学反应[33-34]提供智能载体并控制药物释放等[35-39],这些技术的改进为临床相关大分子的检测开辟了新道路,同时也有助于开发高通量细胞筛选的新型实验平台。本文重点介绍了生物和医学检测领域超疏水表面材料设计和实现方面的应用研究进展。
1 超疏水表面材料在生物医学检测领域的应用
1.1 X射线检测的超疏水样品架
X射线衍射技术能够在生理环境中探测样品,是研究生物系统的有效工具[21-22,33,40-51]。然而,阻碍X射线方法在医疗诊断中普及的主要障碍之一是其依赖于巨大的同步加速器源,新型台式光源的开发和提高信噪比的有效策略可以克服此缺点[40,42]。在这种情况下,检测方法也逐渐摆脱了样品架,摆脱样品架具有双重优势,一方面可消除样品架壁对样品的吸附,另一方面避免了液体和样品架壁之间的相互作用而导致样品污染。目前,已经开发了几种非接触式液体样品定位技术,例如液滴悬浮和弹道液滴等。但这些技术通常需要复杂的实验设置,会大大限制其实用性。新型超疏水表面可以克服这些限制,这些表面的主要特征之一是其迫使液滴呈现极高接触角的能力,从而限制了液体与表面的接触面积和样品污染,超疏水表面和基于X射线检测技术的结合使用可以解决许多生物学难题,例如生物矿化、蛋白质构象变化和聚集动力学等[20-21,33]。
Accardo等[22]研究了溶菌酶溶液在动态浓度状态下的构象变化和聚集,通过X射线照射样品溶液液滴使其连续收缩来诱导聚集过程,进而使蛋白质浓度增加。为了更好地了解生物矿化过程,Accardo等[33]使用了小角度X射线散射线(Small-Angle X-Ray Scattering,SAXS)同步加速器来探测沉积在超疏水表面的碳酸氢钙溶液液滴的液体/空气界面,操作过程如图1所示:用注射器在超疏水纳米结构表面上沉积溶液;蒸发过程中液滴的光栅衍射扫描;将残留物转移和附着到玻璃尖端,在残留物围绕特定点逐步旋转期间收集X射线衍射图。通过平均所有旋转图案确定粉末衍射图案控制碳酸钙沉淀反应过程,由于SAXS同步加速器和超疏水样品架的结合使用,避免使用反应池,因为反应池会通过成核、聚集或剪切过程影响结晶相的形成。

图1 样品溶液在超疏水表面并在蒸发过程中衍射扫描的由SAXS/WAXS图案组成的复合衍射图像过程示意图[33]
同步辐射X射线衍射[41]、台式X射线源[52]和超疏水表面[22]的组合解决了生物样品检测的瓶颈问题。Ciasca等[21]提出了一种实验装置,该装置可以利用便携式实验室设备同时收集X射线荧光(X–Ray Fluorescence,XRF)光谱和X射线相衬成像(X–Ray Phase Contrast Imaging,XPCI),XRF和XPCI首次与超疏水湿样品架结合使用,可以处理少量的微升液滴中的样品。该研究的另外一个创新点是在超疏水表面引入了一个亲水区域,由于周围存在超疏水区域,因此沉积在表面上的液滴会与亲水区域紧密结合,这可以改善样品的稳定性和X射线束的对准性。
外泌体是小的细胞外膜囊泡(直径40~100 nm),形状均匀,由多种哺乳动物细胞类型分泌,这些囊泡作为生物标志物的早期检测十分关键[53],极少量的外泌体与基于有机玻璃(Polymethyl methacrylate,PMMA)的超疏水表面的相互作用诱导了基于外泌体层状结构的形成,这种作用机制主要是物理作用,源自结肠直肠癌细胞和健康上皮结肠细胞系的外泌体在超疏水性PMMA基质上干燥时会形成结晶残留物,干燥过程中的对流会引起排序效应,这些效应可以通过X射线微束源对其进行分析,同步加速器和台式X射线测量均表明,来自结肠癌细胞的外泌体的层状组织与源自健康对照细胞的外泌体的层状组织显著不同,这表明超疏水表面可用于结肠癌的早期检测[22]。
相比液滴悬浮或弹道液滴,超疏水样品架虽然具有明显的优势,但在实验过程中,生物大分子和化学试剂的液滴组成很难改变,因此,超疏水样品架与自行式微流体泵技术[54]的结合可以实时更改液滴的分子组成,该流体泵是由表面张力驱动的,由连接2个微升液滴的微通道组成,其中一个液滴明显小于另一个,2个液滴之间的拉普拉斯压力差导致液滴从较小的通道流向较大的,当小液滴完全被大液滴吸收时,流动停止,最终将液滴集成到超疏水样品架中实现实时检测分子组成改变的待测样品,使超疏水样品架的检测灵敏度进一步提升。
1.2 浓缩效应和超敏蛋白光谱
在生物医学领域对于分散在大样本中的少量分子的检测是一个重要的研究热点,但是,在痕量水平上进行检测需要开发一种有效的流体机制,该机制能够将溶解在溶液中的少量分子直接传递至检测系统的敏感部分。图案化的超疏水表面提供了实现此任务的有效途径。
超疏水表面可用作“智能”浓缩器,其超疏水性提供的浓缩效果对于小的样本量(即几十纳升至几微升之间)有效,并且需要在Cassie状态下润湿表面[20-21,31],在这种状态下,蒸发液滴会减小其体积,同时保持球形结构,最终不仅液滴体积减小,而且液滴与表面的接触面积也减小。液滴尺寸会影响润湿状态。在蒸发条件下,如图2所示,可观察到Cassie状态和Wenzel状态之间的过渡。液滴在Cassie状态(图2a)和Wenzel状态(图2b)的超疏水表面沉积,当液滴蒸发后(图2c),通常会在图案化表面的底部观察到圆形污点(通常称为咖啡环)如图2d所示,证明液滴沉入了纹理中,这表明从Cassie状态到Wenzel状态的过渡损害了表面的自清洁性能,并且在液滴完全蒸发后,会形成残留物;残留物的形状可能取决于几个参数,例如溶质浓度、温度和柱的几何形状[55],如图2e和图2f所示。

图2 液滴在Cassie状态和Wenzel状态上沉积在超疏水表面示意图[55]
Gentile等[21]通过扫描电子显微镜(Scanning Electron Microscopy,SEM)在Cassie状态下使用超疏水表面估算了浓度因子,该研究表明,在蒸发过程的初始阶段,沉积在图案化的硅表面上的小液滴留下的初始足迹直径约为1 mm,当溶剂完全蒸发后,沉淀物被限制在几十微米的边界区域内,浓度因子约为103。Wallace等[31]使用相似的方法,在不同的超疏水表面上其浓度因子大于100。同时,Wallace等[32]还研究了溶剂液滴大小和离子强度对接触角的影响,研究表明,初始液滴尺寸和柱排列对初始接触角有很强的影响,而离子强度没有任何影响。
Ressine等[27]报告了首个提高生物分析读数的有效超疏水设备,该设备在多孔硅上对表面孔隙和晶粒实现精细控制,可在基质辅助激光解吸质谱(Matrix- Assisted Laser Desorption Mass Spectrometry,MALDI- MS)领域应用并鉴定极度稀释的蛋白质样品,其工作原理如图3所示。质子照射区域在常规多孔硅阳极氧化过程中不会孔隙化,因此完成了硅芯片上多孔和无孔区域的直接写入图案化。芯片被进一步多孔化以产生大孔层,大孔纹理硅层可以通过碳氟化合物偶联进行改性,以显示出高达176°接触角的超疏水性。仅接触锚点区域,样品与基质混合物的液滴在蒸发期间缩小到芯片上有限的点区域中,最终实现测量极度稀释的样品。铁蛋白是一种球形蛋白质,其在人体中的主要作用是储存铁元素,正常的铁蛋白最多可以结合4 500个铁原子形成多相晶体,开发表征血浆中铁蛋白的新方法在医学实验中具有重要的应用,浓缩效应可用于蛋白质检测的超灵敏等离子体传感器,目前已经设计出了几种用于组合表面增强拉曼散射(Surface Enhanced Raman Spectroscopy,SERS)和超疏水表面材料的设备,并已应用于生物医学领域的分子检测[56-57]。

图3 在多孔硅上直接写入质子束的示意图[27]
Wallace等[31]使用了一种具有嵌入式等离子纳米锥的超疏水设备,如图4所示,其工作原理主要是:通过浸泡将简单且流动稳定的Ag胶体添加到功能化的柱阵列系统中,产生SERS平台检测所需的等离子体基底,使用天然柱和具有疏水功能修饰的柱子提供一种液滴蒸发效应浓缩分析物的方法,研究证明了溶菌酶的检测范围达到了等摩尔浓度,组合的超疏水性SERS平台可用于检测治疗癌症(如白血病和乳腺癌)的蒽环类抗肿瘤药。最近,Tan等[30]通过毛细管力光刻技术制造了超疏水SERS平台,电磁场增强是通过Langmuir–Schaefer技术制造的Ag纳米立方体的等离子体共振提供的,使用4 μL的大分子荧光探针对装置进行测试,灵敏度很高。

图4 电渗传递系统示意图[31]
除了基于拉曼的传感器外,中红外(Mid-Infrared,MIR)生物传感器也在该领域广泛应用,该设备直接靶向蛋白质,通过对酰胺I(以1 660 cm‒1为中心)和II波段(以1 537 cm‒1为中心)的研究来收集有关其二级结构含量和构象变化的信息[58-60]。但是,与其他技术(例如基于荧光标记的方法)相比,MIR光谱会受到强烈的热发射背景的影响,使稀释样品的信噪比很小,通过结合使用超疏水性和等离子体纳米结构,可以克服这些缺点。目前已实现嵌入超疏水性表面的由等离子纳米天线阵列组成的阳极装置并对其进行了测试[16]。该设备检测到溶解在5 μL液滴中的大约10 pmol的铁蛋白,与其他在可见光范围内运行的超灵敏设备相比,该设备能够区分给定蛋白质的典型光谱特征,因此具有一定的特异性水平。
蛋白质错误折叠组装和淀粉样原纤维聚集是许多人类神经生殖疾病中的重要问题。Tau蛋白是阿尔茨海默病(Alzheimer disease,AD)、Pick疾病、慢性创伤性脑病(Chronic Traumatic Encephalopathy,CTE)、帕金森氏病和进行性核上性麻痹(Progressive Supranuclear Palsy,PSP)的主要病因之一,这种淀粉样蛋白原纤维聚集的分子结构表征对了解这些疾病的发病机理、对于新疗法的开发极为重要。流体流动是引起蛋白质聚集的重要因素之一,但无法对这种现象进行实时监测。Zhang等[61]开发了一种基于超疏水性底物(Super-Hydrophobic Substrate,SHS)的水滴蒸发的方法和集成的实时成像流场控制平台,借助这种方法和平台,能够在不借助任何聚集辅助因子进行分子结构表征的情况下产生淀粉样蛋白原纤维的聚集,SHS平台的先进设计使形成的原纤维聚集体的分子结构自悬浮,有助于通过共聚焦拉曼光谱、二维X射线衍射(2D-XRD)、SAXS和广角X射线散射(Wide-Angle X-Ray Scattering,WAXS)来分析。
以上研究结合了2种不同的前沿技术:表面增强光谱的等离子体纳米结构和超疏水表面,这2种技术的整合具有简单性、有效性和直观性,并且可促进检测和表征分子标记物的新型诊断工具的发展;这些潜在的生物标记的主要来源是血液,但不同血液中的分子和细胞无法进行直接分析,因此,上述装置都需要使用纯化后的蛋白质或分子,这极大地限制了该先进技术在临床实践中的适用性。这些集成的生物医学微设备应在个性化医学领域中得到充分应用,并能够对全血而不是分离和纯化后的血液进行检测。因此,未来的研究应聚焦在对样本进行更为全面和直观检测的新设备开发上。
1.3 低分子量蛋白质组分离
低分子量蛋白质组(Low Molecular Weight Proteome,LMWP)是血液蛋白质组的重要组成部分,蛋白质和肽的分子大小小于血液中平均蛋白质分子的大小[1]。研究表明,血液中发现的一些肽激素及小分泌蛋白在疾病早期诊断上具有重要作用,血液中的蛋白质占人类血浆蛋白的50%以上,受白蛋白等高度丰富的蛋白质的干扰,LMWP的分离具有很大的挑战性[62]。
Gaspari等[63-64]提出了一种使用纳米孔硅的方法来改善低分子量肽的选择性分离的方法,由于材料表面存在适当大小的孔,根据大小排阻原理来截留小肽。Gentile等[28-29]也进行了进一步的研究,对圆柱形硅柱制成的常规超疏水表面进行了修改,使其拥有纳米多孔硅(Nanoporous Silicon,NP-Si)的优点,NP-Si膜是通过Si 阳极溶解制备的,该平台如图5所示,在连续尺度下,基材看起来很光滑;在微观尺度上,柱子有助于基材的超疏水性;在纳米尺度上,多孔基质和银纳米颗粒开始发挥作用并将溶液滴在看起来光滑的超疏水表面上,超疏水表面由微柱构成,每个微柱都被一层纳米多孔硅覆盖并包含银纳米颗粒,由于超疏水性,将溶质浓缩到一个小区域,纳米多孔硅膜和银纳米颗粒将捕获严格小于孔径的分子,最后利用光谱技术测量这些分子。该平台具有2个优点:第一是超疏水性产生的浓度效应,双尺度粗糙度的存在使效应进一步加强,该粗糙度极大地将表面接触角增大到170°;第二是NP-Si膜中复杂网络中的纳米孔能够截留具有流体动力学直径小于孔径更小的分子。
纳米多孔硅捕获小于平均孔径分子设计的超疏水装置虽然具有很大的应用价值,但依然不能对血液中所有成分进行分析,应进一步结合其他先进技术研发能够处理全血样本的检测技术。
1.4 药物释放
智能药物递送系统(Drug Delivery Systems,DDS)的开发是当前提高几种药物治疗效果的有效策略之一,主要包括两类DDS,第一类是纳米和微米级可注射系统,例如基于纳米颗粒的DDS[65]、蛋白笼[66]、基于石墨烯的系统等[67-69];第二类包括可植入药物传递系统(Implantabledrug Delivery System,IDDS)设备,旨在监测健康状况并直接预防或治疗[70]。
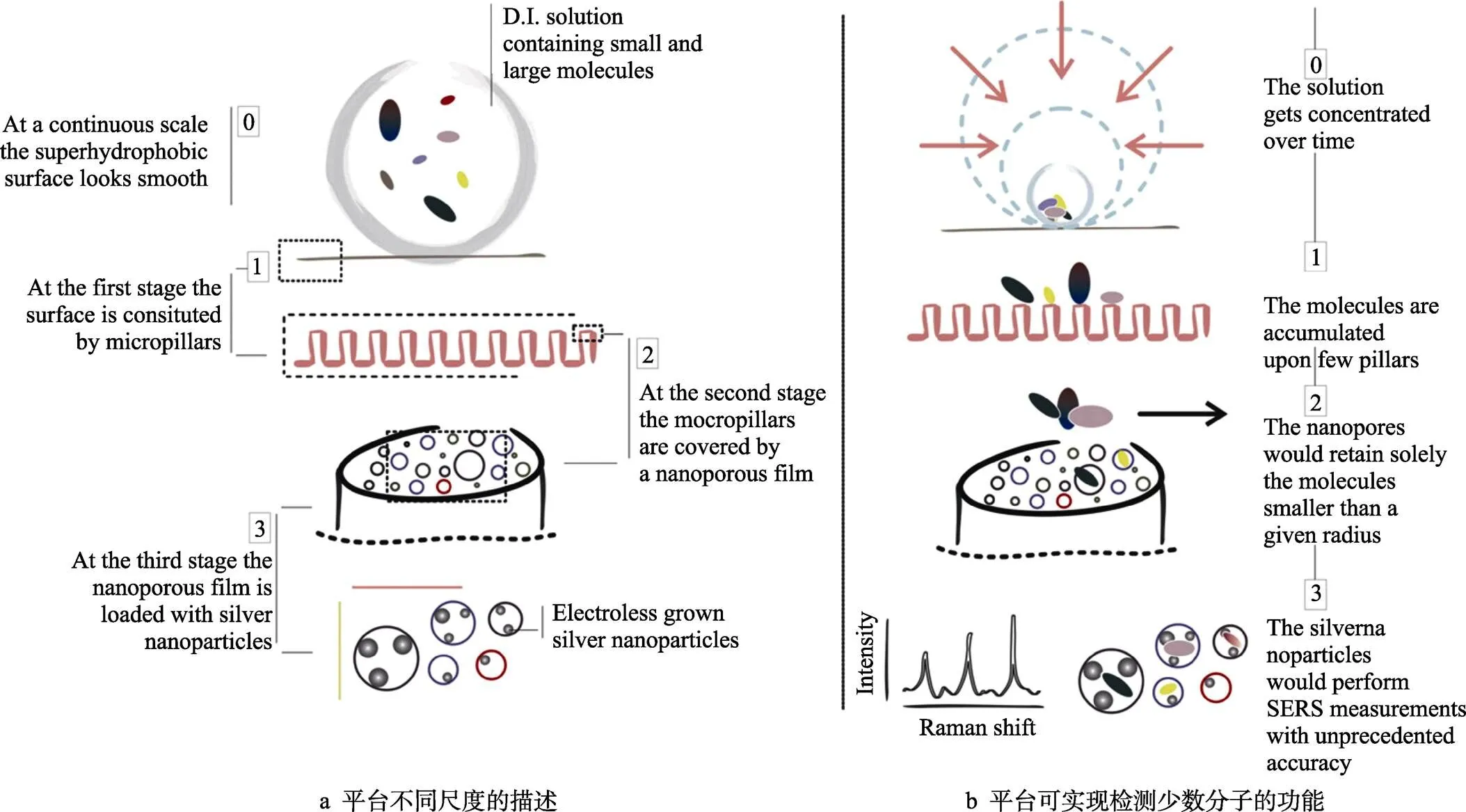
图5 设备设计示意图[29]
Yohe等[37]首先提出了将3D超疏水材料用于实现可植入药物递送系统的可能性,主要机理是水以与时间相关的方式渗透到结构中以置换滞留的空气,空气可以作为结构内可移除的屏障,通过控制内部聚合物表面积暴露于释放介质的速率来有效减缓药物释放,如图6所示。这种创新的概念可以应用于疼痛和慢性疾病的长期治疗以及预防肿瘤复发。在Cassie模式下,水最初并未润湿整个表面,但是,Cassie状态通常是亚稳态的,水最终会润湿整个表面,这种动态特性是在智能IDDS设计中使用超疏水性的关键。Yohe等[71]制造了一种生物相容性的超疏水聚合材料,该材料由电纺丝沉积的聚合物ε-共内酯纤维制成,聚单硬脂酸甘油酯-ε-己内酯用作疏水性掺杂聚合物以实现整体超疏水状态,并在电纺丝中负载抗癌分子SN- 38,该研究表明药物释放的速度很大程度上取决于3D聚合物网孔捕获空气的牢固程度。Yohe等[72]进一步探索了预防直肠癌复发的方法,将抗癌分子CPT-11和SN-38加载到超疏水材料中,对超疏水材料的机械阻力进行评估,结果显示,疏水表面具有适当的机械抵抗力,可用于手术,并且能够释放药物90 d以上。该系统经过体外测试,证明可有效对抗直肠癌细胞。
Antunes等[73]采用超疏水表面来快速制造可光交联的透明质酸-甲基丙烯酸/明胶-甲基丙烯酸明胶3D球状微凝胶,用于前列腺癌细胞和人类成骨细胞共培养模型,同时模拟细胞和肿瘤成分。超疏水表面实现了无溶剂、经济高效、可重现和适应性强的异型3D球形微凝胶的制备,可用于高通量药物筛选作为递送药物的良好载体材料。

图6 超疏水3D材料上的药物洗脱机理[37]
超疏水3D材料实现可植入医疗设备,这些材料为控制药物释放提供了有前景的策略[36-40]。虽然这些应用在临床实践中的发展已处于最成熟的阶段,但仍有一些方面需要改进。例如治疗时植入的设备,最后应该通过手术移除或者直接植入完全可降解的材料,同时最好是找到通过空气和药物为设备充电的有效策略。超疏水3D材料的特性之一是其机械耐用性,这使其可以用作外科加固材料[62]。该材料的弹性与硬脑膜(一种覆盖大脑和脊髓的弹性膜)非常相似,是理想的人工膜材料[74]。同时考虑到这种材料可以长期局部释放药物的能力,也可用其对抗神经外科手术后的细菌感染。
1.5 DNA可视化
生物体中许多重要的生命功能的发挥都需要依靠生物大分子之间以及生物大分子与其他化学结构之间的识别来实现,而其中DNA作为储存和传递遗传信息的生物大分子,对于生物体维持正常运转和物种长久持续发展显得尤为重要。因此DNA检测是分子生物学和医学健康重要的方面之一。图案技术和新型功能材料结合的技术领域正在飞速发展[75],这些先进技术为创新微型设备开辟了道路,可实现快速、低样本量和低成本来分析样品。DNA芯片技术是一种广泛用于遗传分析和诊断的技术,为DNA分子进行图案化提供了基础。但是,该技术需要基于浓缩的DNA样品,其空间分辨率限制在几个兆碱基之内。分子梳理是可以拉伸DNA纤维的缩合技术,该技术的开发可以将空间分辨率提高到几千个碱基以上,使其分辨率加大进而可视化[76]。但该技术制备的排列紧密的DNA细丝间距不均匀,DNA细丝间缺乏严格的有序排列[77]。先进的超疏水表面可以克服这些技术的局限性[15,17,19]。
Gentile等[15]开发了第一个能够使DNA缩合的超疏水装置,并可通过透射电子显微镜(Transmission Electron Microscope,TEM)直接成像,如图7所示。Gentile等[20]同时还成功地利用自下而上的方法基于Cassie Baxter模型制造了一个大型有序拉伸DNA细丝阵列的超疏水基底,且DNA细丝间距均匀;几微升含有DNA的液滴以Cassie状态润湿了表面,因此在表面特征之间桥接而不穿透分隔它们的空间,在蒸发条件下,缩回的液滴边缘拉伸DNA细丝,将其悬浮在柱子上方;具有精确纳米加工的尖端固定DNA链,从而能够精确控制其位置和方向,并通过倾斜超疏水表面,可以在很大的长度范围内保持严格有序的排列,在这种情况下,样品溶液的液滴向下方缓慢滑动,从而形成了严格对齐的1D DNA细丝。但是这种情况仅是当液滴稳定在润湿Cassie状态的表面时才能观察到。实际上,超疏水表面上复杂的水滴蒸发动力学可提供不同的DNA排列:当液滴在Cassie状态下润湿表面时,通常会形成大量薄而均匀且悬浮的1D DNA束[19]。随着蒸发的进行,溶质浓度增加,DNA束直径会从几十纳米增加到数百纳米[17],液滴状态由Cassie状态转变到Wenzel状态。

图7 超疏水DNA分子缩合装置和TEM成像[15]
传统的DNA检测方法往往需要应用纳米、有机分子等间接方法将DNA信息转化为可读出信号,即需要各种标记分子,从而导致检测过程复杂且存在对环境有污染的标记物。因此开发一种简便、不需要标记分子而同时具有高灵敏度和高选择性的可视化DNA检测方法意义重大。Gentile等开发的DNA分子可视化设备虽然克服了传统检测技术的局限性,但因为液滴从Cassie状态到Wenzel状态的转变会损害材料表面的自清洁性能,因此,还需要进一步对该设备及其超疏水基底进行完善。
1.6 高通量细胞筛选
细胞微阵列(Cell microarrays,CMs)是高通量细胞筛选非常有效的工具,目前已应用于许多领域,如细胞-蛋白质和细胞-药物相互作用的研究、细胞-生物材料的相容性以及全基因组筛选等[6,24-26,78]。但是,常规的微阵列方法受到很多限制,如在相邻样品孔之间存在交叉污染和细胞迁移的问题[25],这会影响分析数据的质量,虽然可以通过增加样品孔之间的距离或引入物理屏障来克服这个缺点,但这会限制微阵列密度,使高通量失去意义。超疏水/超亲水装置的开发为克服该局限性提供了有效策略,通过对表面张力的精细控制,将液体体积限制在小而高密度的样品孔中;超疏水/超亲水装置极大地减少了交叉污染问题,使细胞迁移受到超疏水屏障的阻碍[25]。此外,在许多常规的微阵列中,整个实验装置必须浸入相同的培养基中,但超疏水性的强封闭基板可实现测试分离良好的不同培养基中的液滴。
Geyer等[25]开发了一种超高密度细胞微阵列材料,它是通过对聚甲基丙烯酸2-羟乙酯-二甲基丙烯酸乙二酯共聚的超亲水性生物相容性纳米多孔膜进行紫外线照射引发的网格状超疏水图案而制成的,通过使用光掩膜来控制样品孔的大小和几何形状。同时还测试了该装置在细胞转染实验中的适用性,如图8所示,由图8a代表当前最先进的细胞微阵列,但是其细胞迁移不受控制,存在交叉污染,且转染试剂位于凝胶垫中,细胞沉淀在它们上面。而开发的新型细胞微阵列材料,如图8b所示,可以精确控制光斑几何形状、大小和密度,细胞只停留在含有转染试剂的微点上,形成分离的转染细胞簇,可以防止迁移和交叉污染,这种超高密度细胞微阵列可以显著提高全基因组细胞筛选的效率。
Neto等[24]使用类似的方法研究了聚苯乙烯超疏水图案表面上的细胞行为,测试了细胞与2种蛋白质相互作用:血液中大量存在的人血清白蛋白(Human serum Albumin,HSA)和促进细胞黏附的人纤连蛋白(human fifibronectin,HFN),超疏水微阵列材料的使用使得不同相对含量和总浓度的2种蛋白质的双元混合物可以轻松有效地沉积,将10 μL含有1 000个细胞的培养基分别分散在每个不同含量蛋白质的亲水点中,然后通过共聚焦显微镜对阵列成像,结果显示,含有HFN多的点中附着大量细胞。
Salgado等[26]开发了一种密闭微阵列来研究3D生物材料与细胞之间的相互作用,制备了以不同比例混合壳聚糖、胶原蛋白和透明质酸的藻酸盐基水凝胶,水凝胶的生物相容性是通过测试2种不同细胞类型的破坏性和非破坏性进行评估,超高密度超疏水性微阵列的使用可以同时筛选48个细胞-生物材料的组合,该研究为组织工程学的发展和同时筛选多种材料的新平台奠定了坚实的基础。
Wang等[79]开发了纳升离心式液体分配器(Nanoliter Centrifugal Liquid Distributor,NanoCLD)与超疏水微阵列芯片相结合技术,用于纳升规模的高通量细胞的测定。NanoCLD包括一个带有一系列通孔的塑料原料块,一个试剂微孔阵列芯片(试剂芯片)和一个在夹具中组装在一起的对准底部,在800 r/min下进行简单离心可在5 min内将约160 nL试剂分配到微孔中,然后通过将试剂芯片上下颠倒地夹在另一个微孔阵列芯片(细胞芯片)上,将分配的试剂输送到细胞中,在该微孔阵列芯片上培养细胞。然后使用NanoCLD将阿霉素梯度溶液分配到细胞芯片上,实现微芯片平台上进行药物测试的可行性,这种新颖的纳升体积液体分配方法简单,易于操作,适合同时向微孔重复分配许多不同的试剂。

图8 细胞微阵列对比图[25]
离体测试患者肿瘤细胞的敏感性可以帮助患者确定合适的治疗方法,并发现对特定疗法的耐药性,但可从活检获得的细胞数量通常不足以在常规微量滴定板中进行离体测试。Popova等[80]开发一种基于亲水-超疏水图案化表面的新型液滴微阵列(Droplet- Microarray)平台,该平台能够对仅100个细胞和30 pmol的药物进行筛选,实验表明,100个患者的原发性慢性淋巴细胞性白血病细胞对抗癌药物的剂量反应相当于384孔板中的每个孔需要20 000个肿瘤细胞的剂量反应。因此,Droplet-Microarray平台可对患者肿瘤细胞进行离体药物敏感性和耐药性测试,并实现精密测试。
Accardo等[22]报道的超疏水表面在X射线检测中可以收集外泌体,以期验证结肠癌标记物,该研究可依靠超疏水微阵列技术进行更深入的研究,实现外泌体的标记物的大规模研究[6,24-26],并结合使用微米级和纳米级的XRD技术和散射技术[32-34,40,52]对不同的微阵列点成像。
超疏水微阵列技术的研究为生物医学检测领域高通量筛选平台提供了高效的方法,应用范围广泛,未来可以结合其他先进技术解决更多的大样品量的生物医学检测难题。
1.7 抗菌、抗生物黏附
在大多数国家,医疗感染蔓延是持续存在的问题。抗生素和消毒剂的使用使微生物耐药性发展且加剧,每天使用侵入式医疗设备治疗的患者有数百万,细菌黏附在其表面形成生物膜,最终导致感染和并发症,住院时间变长,甚至会死亡。因此,预防细菌黏附和生物膜形成是医疗保健面临的主要挑战,应改善医疗装置的抗微生物性能。近年来,超疏水材料的抗黏表面为解决这一问题提供了有效方法。
许多超疏水材料在抑制微生物生长方面具有显著作用。PDMS-HNT(聚二甲基硅氧烷(PDMS)掺有埃洛石纳米管(HNT))复合材料在抑制细菌生长的功效方面显示出很好的优越性,如图9所示。研究表明,PDMS-HNT复合材料具有作为抗菌侵入性设备的涂层材料以及预防获得性感染的潜力[81]。
通过脉冲(直流)空心阴极等离子体增强化学气相沉积(HC-PECVD)将改性的类金刚石碳(DLC)涂层沉积到不锈钢圆盘上,并掺杂锗的多层膜,对涂层进行表征。修饰的DLC涂层和掺锗的DLC(Ge- DLC)均对革兰氏阴性细菌铜绿假单胞菌具有显著的抗生物结垢作用[82]。
调节溶液中的氧化石墨烯(graphene oxide,GO)稳定性,可以控制金黄色葡萄球菌和大肠杆菌的抗菌或生长增强作用。低浓度的GO切割微生物膜,高浓度的GO与病原体形成复合物,并以表面电位依赖性方式抑制或增强细菌的生长[83]。
通过使用抗黏性亲水性聚合物涂层在聚氨酯(PU)(一种用于导管制造的常用生物医学塑料)上制备AMP涂层,对涂层的PU表面进行表征。PU导管表面上的束缚肽具有广谱抗菌活性,并在体外具有长期活性,对于革兰氏阳性和阴性细菌,该表面涂层可防止细菌黏附达99.9%,对浮游细菌的生长可抑制高达70%[84]。
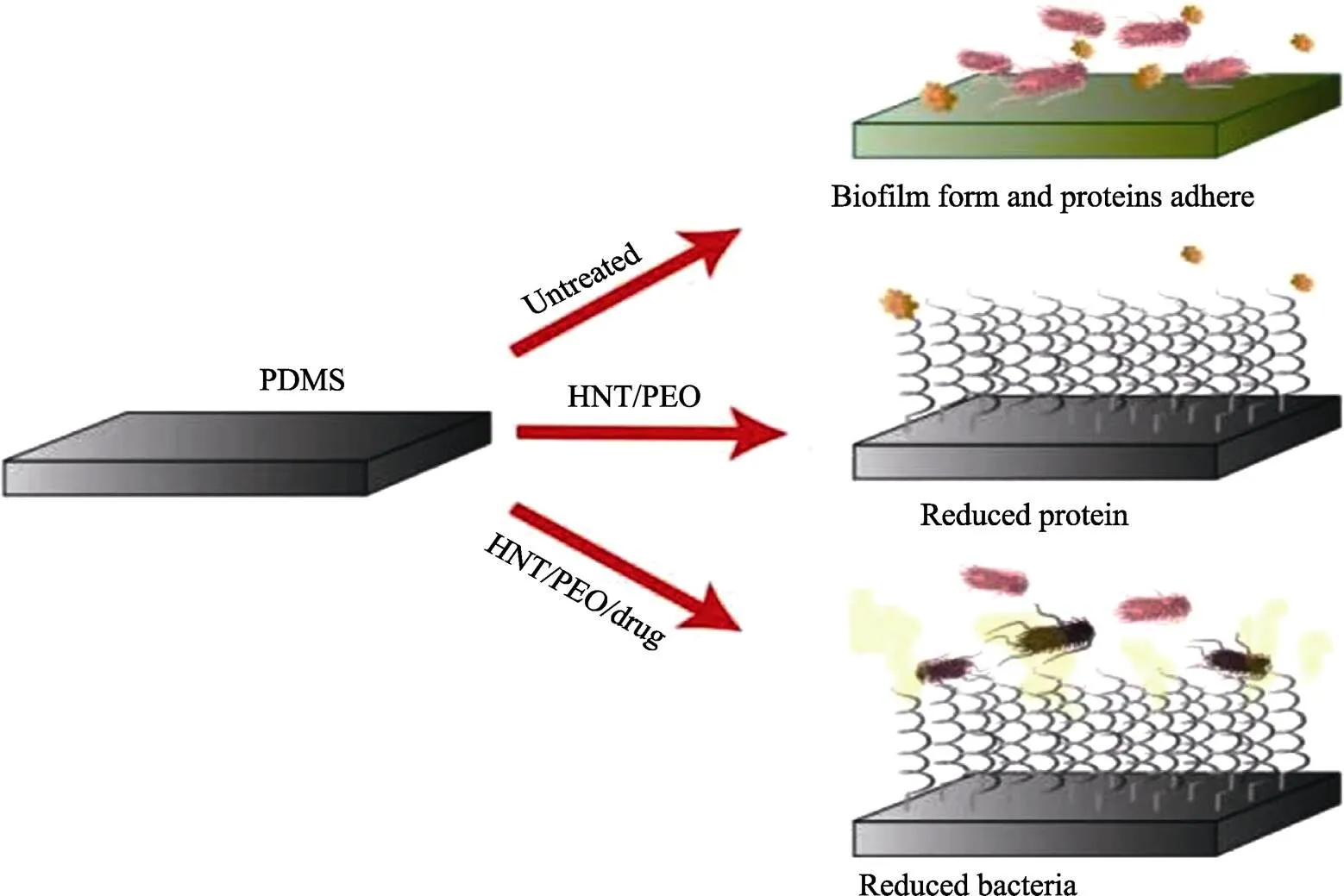
图9 PDMS表面和体外生物学效应[81]
在含氟聚合物的多孔材料基底灌注氟化润滑液体构筑的光滑多孔表面(Slippery Liquid-Infused Porous Surfaces,SLIPS)能够高效抑制细菌黏附,经过优化后的改性材料表面拥有较高的透明度,且能够实现抑制绿脓杆菌生物膜生长达7 d[85]。
通过阳极氧化和蚀刻工艺对纳米孔和纳米柱状铝表面进行工程处理,使其亲水(使用固有的氧化物层)或疏水(使用特氟隆涂层)。在静态和流动条件下,评估金黄色葡萄球菌和大肠杆菌在纳米工程表面的黏附力,与非结构化电抛光平整表面相比,纳米结构化表面菌落数量显著减少。在流动状态下,疏水表面上黏附的细菌数量的减少更为明显,抗金黄色葡萄球菌和大肠杆菌黏附分别超过99.9%和99.4%[86]。
综合以上的研究成果可以看出,超疏水抗菌表面材料结合了传统抗菌材料的优点,克服了传统抗菌材料的局限性,在绿色环保政策的要求下,超疏水抗菌表面材料的制备方法将实现更多的创新和突破。首先,惯用的长链全氟化合物等低表面能物质,价格昂贵且存在环境威胁,而有机硅材料多为进口、成本高。随着高分子材料结构设计的不断发展,若采用少量氟、硅元素接枝改性聚合物或天然高分子制备新型聚合物获得超疏水表面,不仅能够赋予基质低表面能,而且能避免全氟化合物、有机硅材料的大量使用,满足绿色环保与成本低廉的要求。为抗菌材料的发展提供了可行的方案,具备长期稳定性和普适性杀菌等优势。但是这一类材料仍然处于概念模型的阶段,多数停留在实验室制备阶段,如何真正实现生产应用是亟需解决的重要问题。
1.8 血液相容性
超疏水材料具有很低的表面自由能,与血液中各成分相互作用较小,因此,超疏水的材料具有良好的血液相容性。材料的血液相容性,即材料植入人体后不引起血液凝聚,不破坏血液成分,也不改变血液生理环境的性质,因此超疏水材料的低界面自由能使其具有良好的抗凝血性。超疏水材料在抗凝血方面的研究结论纠正了此前研究界认为的只有光滑表面才对血液相容性有利的片面结论,为通过简单的工艺提高大部分材料的血液相容性提供了新方法。
Jie等[87]通过逐层(LbL)颗粒沉积方法制备的分层结构的超疏水表面,包括单层、双层和三层3个粗糙度。三层结构的超疏水性表面表现出超低的蛋白质吸附;此外,还降低了血小板的黏附和活化。Sun等[88]在规整排列的碳纳米管基底上浸涂含氟聚合物,制得了超疏水纳米结构的薄膜。将富含血小板血浆与试样表面接触后,该聚合物薄膜比用同一材料制得的光滑膜具有明显的抗血小板黏附性和优异的血液相容性。
化学和结构修饰的超疏水表面成本高,需要后处理,并且通常不具有生物相容性。相比之下,卷对卷(R2R)的制造方法可以将塑料收缩成一层薄而坚硬的银和钙层,形成纯结构性超疏水材料。使用该方法压印的塑料表面可最大程度地减少血液黏附,从而无需使用抗凝剂,减少血液凝结[89]。
Movafaghi等[90]使用3种不同的形态(非纹理、纳米花和纳米管)制备了亲血、疏血和超疏血的二氧化钛表面,对于每种形态,使用了3种不同的表面化学策略(未改性、聚乙二醇化和氟化),对每个二氧化钛表面表征了血小板的黏附和活化作用。结果显示,Cassie-Baxter状态的超疏血表面与疏血性和亲血性表面相比,血小板的黏附和活化能力显著降低。
热解碳(PyC)是一种化学惰性的生物材料,具有优异的生物相容性,超疏水的PyC表面可以改善凝血、抑制血栓形成。Wang等[91]采用纳秒激光刻蚀法制备PyC表面,具有微观结构的粗糙PyC表面具有超疏水性,接触角大于150°,可以降低血流阻力并抑制血栓形成。
Sasha等[92]利用自上而下的可伸缩方法制备了柔性疏水疏血管,如图10所示。结果显示,该软管既可以减少阻力,又可以对液滴进行控制,血滴(35 µL)以15°滑动角在管中滚动,不会留下血迹,且该管无血小板黏附,Han等[93]基于仿生荷叶表面的超疏微纳复合结构、贻贝足丝的超高黏附性以及沙塔蠕虫带电荷分泌层,利用高效、精确的电荷控制纳米粒子层层自组装(ECLbL),制备了含巯基高黏附性兼具良好生物相容性的3D结构化不润湿性涂层表面。该表面在血管抗血栓、材料表面防污等方面具有重要应用。
从本质上看,任何界面抗凝血性能的研究都不能忽略血浆蛋白的黏附。对纯水超疏的表面对血小板血浆并不一定超疏。通常情况下,材料表面在与血液接触的数秒内首先被吸附的是血浆蛋白,在此过程中蛋白质吸附层中蛋白质的种类、构象等对后续步骤起着决定性作用。体外血小板静态黏附试验仅仅是表征血液相容性好坏的一个手段,要完整地评价界面的血液相容性,还应包括研究界面对血液的溶血现象(红细胞破坏)、血小板功能降低、白细胞暂时性减少和功能下降,以及补体激活等血液生理功能的影响。此外,还要求材料不导致血浆蛋白变性,不影响血液中存在的多种酶的活性,不改变血液中电解质浓度、渗透压,不引起有害的免疫反应等诸多问题。因此,在开发抗凝血的超疏水材料时,应进一步考察该材料对血液中其他成分的影响,以期实现全面的抗凝血材料。

图10 疏血软管的疏水表征[92](a在超疏水PDMS/二氧化钛表面上前进和后退的水滴接触角,b从倾斜7°的表面滚下的2 µL水滴的快照,c、d、e、f分别表示35 µL人血在超疏水样品上、光滑的PDMS/二氧化钛对照样品上、血滴从超疏水PDMS/二氧化钛样品上滑落、血滴从光滑的PDMS/二氧化钛表面滑落)
2 总结与展望
本综述总结了生物医学检测领域的超疏水表面材料的研究进展,重点是对微量大分子和细胞的操纵研究,该领域目前发展迅速,但本文介绍的还不够全面,只对部分具有代表性研究进行了综述。超疏水表面材料的先进技术在生物医学检测领域应用广泛,本综述主要包括以下几个方面:(1)痕量分子的浓缩和检测;(2)分离生物混合物;(3)精确定位纳米级别分子的位置;(4)药物的控制释放;(5)与多种光谱方法结合的检测方法;(6)精确控制纳米液滴阵列;(7)预防细菌黏附和生物膜形成;(8)抗血小板黏附、抗凝血。
超疏水性表面的开发技术已处于成熟阶段,但将其有效整合到生物医学检测实践中仍处于发展阶段。主要问题之一就是生物样品具有很大的多样性和变异性,需要进一步研究来控制这种可变性,标准化程序并完善各种生物标本与超疏水装置之间相互作用的机理研究。
[1] DRAKE R R, CAZARES L, SEMMES O J. Mining the Low Molecular Weight Proteome of Blood[J]. Proteomics Clinical Applications, 2007, 1(8): 758-768.
[2] SIDRANSKY D. Emerging Molecular Markers of Cancer[J]. Nature Reviews Cancer, 2002, 2(3): 210-219.
[3] LIMA A C, MANO J F. Micro-/Nano-Structured Superhydrophobic Surfaces in the Biomedical Field: Part I: Basic Concepts and Biomimetic Approaches[J]. Nanomedicine, 2015, 10(1): 103-119.
[4] LIMA A C, MANO J F. Micro-/Nano-Structured Superhydrophobic Surfaces in the Biomedical Field: Part I: Basic Concepts and Biomimetic Approaches[J]. Nanomedicine, 2015, 10(1): 103-119.
[5] GENTILE F, COLUCCIO M L, LIMONGI T, et al. The Five Ws (and one H) of Super-Hydrophobic Surfaces in Medicine[J]. Micromachines, 2015, 5(2): 239-262.
[6] UEDA E, LEVKIN P A. Emerging Applications of Superhydrophilic-Superhydrophobic Micropatterns[J]. Advanced Materials, 2013, 25(9): 1234-1247.
[7] OSONOVSKY M, BHUSHAN B. Superhydrophobic Surfaces and Emerging Applications: Non-Adhesion, Energy, Green Engineering[J]. Current Opinion in Colloid & Interface Science, 2009, 14(4): 270-280.
[8] LATTHE S S, TERASHIMA C, NAKATA K, et al. Superhydrophobic Surfaces Developed by Mimicking Hierarchical Surface Morphology of Lotus Leaf[J]. Molecules, 2014, 19(4): 4256-4283.
[9] SHIRTCLIFFE N J, MCHALE G, ATHERTON S, et al. An Introduction to Superhydrophobicity[J]. Advances in Colloid and Interface Science, 2010, 161(1-2): 124-138.
[10] KIJLSTRA J, REIHS K, KLAMT A. Roughness and Topology of Ultra-Hydrophobic Surfaces[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2002, 206(1-3): 521-529.
[11] JUNG Y C, BHUSHAN B. Contact Angle, Adhesion and Friction Properties of Micro-and Nanopatterned Polymers for Superhydrophobicity[J]. Nanotechnology, 2006, 17(19): 4970-4980.
[12] SU Bin, WU Yu-chen, TANG Yue, et al. Free-Standing 1D Assemblies of Plasmonic Nanoparticles[J]. Advanced Materials, 2013, 25(29): 3968-3972.
[13] SU Bin, WANG Shu-tao, WU Yu-chen, et al. Small Molecular Nanowire Arrays Assisted by Superhydrophobic Pillar- Structured Surfaces with High Adhesion[J]. Advanced Materials, 2012, 24(20): 2780-5.
[14] SU Bin, WANG Shu-tao, MA Jie, et al. Elaborate Positioning of Nanowire Arrays Contributed by Highly Adhesive Superhydrophobic Pillar-Structured Substrates[J]. Advanced Materials, 2012, 24(4): 559-564.
[15] GENTILE F, MORETTI M, LIMONGI T, et al. Direct Imaging of DNA Fibers: The Visage of Double Helix[J]. Nano Letters, 2012, 12(12): 6453-6458.
[16] NINNO A D, CIASCA G, GERARDINO A, et al. An Integrated Superhydrophobic-Plasmonic Biosensor for Mid- Infrared Protein Detection at the Femtomole Level[J]. Physical Chemistry Chemical Physics, 2015, 17(33): 21337-21342.
[17] CIASCA G, PAPI M, CHIARPOTTO M, et al. Controlling the Cassie-to-Wenzel Transition: An Easy Route towards the Realization of Tridimensional Arrays of Biological Objects[J]. Nano-Micro Letters, 2014, 6(3): 280-286.
[18] DE ANGELIS F, GENTILE F, MECARINI F, et al. Breaking the Diffusion Limit with Super-Hydrophobic Delivery of Molecules to Plasmonic Nanofocusing SERS Structures[J]. Nature Photonics, 2011, 5(11): 682-687.
[19] CIASCA G, BUSINARO L, PAPI M, et al. Self-Assembling of Large Ordered DNA Arrays Using Superhydrophobic Patterned Surfaces[J]. Nanotechnology, 2013, 24(49): 495302.
[20] GENTILE F, COLUCCIO M L, COPPEDÈ N, et al. Superhydrophobic Surfaces as Smart Platforms for the Analysis of Diluted Biological Solutions[J]. ACS Applied Materials & Interfaces, 2012, 4(6): 3213-3224.
[21] CIASCA G, BUSINARO L, DE NINNO A, et al. Wet Sample Confinement by Superhydrophobic Patterned Surfaces for Combined X-Ray Fluorescence and X-Ray Phase Contrast Imaging[J]. Microelectronic Engineering, 2013, 111: 304-309.
[22] ACCARDO A, TIRINATO L, ALTAMURA D, et al. Superhydrophobic Surfaces Allow Probing of Exosome Self Organization Using X-Ray Scattering[J]. Nanoscale, 2013, 5(6): 2295-2299.
[23] LIMONGI T, CESCA F, GENTILE F, et al. Nanostructured Superhydrophobic Substrates Trigger the Development of 3D Neuronal Networks[J]. Small, 2013, 9(3): 402-412.
[24] NETO A I, CUSTÃDIO C A, SONG Wen-long, et al. High-Throughput Evaluation of Interactions between Biomaterials, Proteins and Cells Using Patterned Superhydrophobic Substrates[J]. Soft Matter, 2011, 7(9): 4147- 4151.
[25] GEYER F L, UEDA E, LIEBEL U, et al. Superhydrophobic-Superhydrophilic Micropatterning: Towards Genome- on-a-Chip Cell Microarrays[J]. Angewandte Chemie, 2011, 50(36): 8424-8427.
[26] SALGADO C L, OLIVEIRA M B, MANO J F. Combinatorial Cell-3D Biomaterials Cytocompatibility Screening for Tissue Engineering Using Bioinspired Superhydrophobic Substrates[J]. Integrative Biology, 2012, 4(3): 318-327.
[27] RESSINE A, MARKO-VARGA G, LAURELL T. Porous Silicon Protein Microarray Technology and Ultra-/Superhydrophobic States for Improved Bioanalytical Readout[J]. Biotechnology Annual Review, 2007, 13: 149-200.
[28] GENTILE F, COLUCCIO M L, ACCARDO A, et al. Nanoporous- Micropatterned- Superhydrophobic Surfaces as Harvesting Agents for few Low Molecular Weight Molecules[J]. Microelectronic Engineering, 2011, 88(8): 1749-1752.
[29] GENTILE F, COLUCCIO M L, ACCARDO A, et al. Tailored Ag Nanoparticles/Nanoporous Superhydrophobic Surfaces Hybrid Devices for the Detection of Single Molecule[J]. Microelectronic Engineering, 2012, 97: 349- 352.
[30] TAN J M R, RUAN J J, LEE H K, et al. A Large-Scale Superhydrophobic Surface-Enhanced Raman Scattering (SERS) Platform Fabricated via Capillary Force Lithography and Assembly of Ag Nanocubes for Ultratrace Molecular Sensing[J]. Physical Chemistry Chemical Physics: PCCP, 2014, 16(48): 26983-26990.
[31] WALLACE R A, CHARLTON J J, KIRCHNER T B, et al. Superhydrophobic Analyte Concentration Utilizing Colloid-Pillar Array SERS Substrates[J]. Analytical Chemistry, 2014, 86(23): 11819-11825.
[32] CAMPI G, CIASCA G, POCCIA N, et al. Controlling Photoinduced Electron Transfer via Defects Self-Organization for Novel Functional Macromolecular Systems[J]. Current Protein & Peptide Science, 2014, 15(4): 394-399.
[33] ACCARDO A, BURGHAMMER M, DI COLA E, et al. Calcium Carbonate Mineralization: X-Ray Microdiffraction Probing of the Interface of an Evaporating Drop on a Superhydrophobic Surface[J]. Langmuir: the ACS Journal of Surfaces and Colloids, 2011, 27(13): 8216- 8222.
[34] ACCARDO A, GENTILE F, MECARINI F, et al. In Situ X-Ray Scattering Studies of Protein Solution Droplets Drying on Micro- and Nanopatterned Superhydrophobic PMMA Surfaces[J]. Langmuir: the ACS Journal of Surfaces and Colloids, 2010, 26(18): 15057-15064.
[35] STEFAN T Y, JONATHAN A K, TYRONE M P, et al. Triggered Drug Release from 3D superhydrophobic Meshes Using Ultrasound[J]. Abstracts of Papers of the American Chemical Society, 2012, 244: 569.
[36] YOHE S T, KOPECHEK J A, PORTER T M, et al. Triggered Drug Release from Superhydrophobic Meshes Using High-Intensity Focused Ultrasound[J]. Advanced Healthcare Materials, 2013, 2(9): 1204-1208.
[37] YOHE S T, COLSON Y L, GRINSTAFF M W. Superhydrophobic Materials for Tunable Drug Release: Using Displacement of Air to Control Delivery Rates[J]. Journal of the American Chemical Society, 2012, 134(4): 2016- 2019.
[38] MARK G. Superhydrophobic Biomaterials for Tunable Drug Release: New Organic Materials for the Prevention and Treatment of Recurrent Cancers[J]. Abstracts of Papers of the American Chemical Society, 2012, 244: 589.
[39] FALDE E J, FREEDMAN J D, HERRERA V L M, et al. Layered Superhydrophobic Meshes for Controlled Drug Release[J]. Journal of Controlled Release, 2015, 214: 23- 29.
[40] SIBILLANO T, DE CARO L, ALTAMURA D, et al. An Optimized Table-Top Small-Angle X-Ray Scattering Set-up for the Nanoscale Structural Analysis of Soft Matter[J]. Scientific Reports, 2014, 4: 6985.
[41] RIEKEL C, BURGHAMMER M, MÜLLER M. Microbeam Small-Angle Scattering Experiments and Their Combination with Microdiffraction[J]. Journal of Applied Crystallography, 2000, 33(3): 421-423.
[42] SARRAZIN P C, CHIARI G, GAILHANOU M. Aportable XRD/XRF Instrumentation for the study of works of art[J]. Powder Diffraction, 2008, 23(2):176-176.
[43] BATTISTI A, CIASCA G, TENENBAUM A. Transient Tertiary Structures in Tau, an Intrinsically Disordered Protein[J]. Molecular Simulation, 2013, 39(13): 1084-1092.
[44] CIASCA G, PAPI M, CHIARPOTTO M, et al. Transient State Kinetic Investigation of Ferritin Iron Release[J]. Applied Physics Letters, 2012, 100(7): 073703.
[45] CIASCA G, CHIARPOTTO M, CAMPI G, et al. Reconstitution of Aluminium and Iron Core in Horse Spleen Apoferritin[J]. Journal of Nanoparticle Research, 2011, 13(11): 6149-6155.
[46] CIASCA G, CAMPI G, BATTISTI A, et al. Continuous Thermal Collapse of the Intrinsically Disordered Protein Tau is Driven by Its Entropic Flexible Domain[j]. Physical Chemistry Chemical Physics Pccp, 2017, 19: 8435.
[47] CHIARPOTTO M, CIASCA G, VASSALLI M, et al. Mechanism of Aluminium Bio-Mineralization in the Apoferritin Cavity[J]. Applied Physics Letters, 2013, 103(8): 083701.
[48] CAMPI G, RICCI A, GUAGLIARDI A, et al. Early Stage Mineralization in Tissue Engineering Mapped by High Resolution X-Ray Microdiffraction[J]. Acta Biomaterialia, 2012, 8(9): 3411-3418.
[49] BATTISTI A, CIASCA G, GROTTESI A, et al. Temporary Secondary Structures in Tau, an Intrinsically Disordered Protein[J]. Molecular Simulation, 2012, 38(7): 525- 533.
[50] CAMPI G, MARI A, AMENITSCH H, et al. Monitoring Early Stages of Silver Particle Formation in a Polymer Solution byand Time Resolved Small Angle X-Ray Scattering[J]. Nanoscale, 2010, 2(11): 2447-2455.
[51] CAMPI G, MARI A, PIFFERI A, et al. Control of Silver- Polymer Aggregation Mechanism by Primary Particle Spatial Correlations in Dynamic Fractal-Like Geometry[J]. Nanoscale, 2011, 3(9): 3774-3779.
[52] ALTAMURA D, LASSANDRO R, VITTORIA F A, et al. X-Ray Microimaging Laboratory (XMI-LAB)[J]. Journal of Applied Crystallography, 2012, 45(4): 869-873.
[53] PALMIERI V, LUCCHETTI D, GATTO I, et al. Dynamic Light Scattering for the Characterization and Counting of Extracellular Vesicles: A Powerful Noninvasive Tool[J]. Journal of Nanoparticle Research, 2014, 16(9): 2583.
[54] HONG Ling-fei, PAN Ting-rui. Surface Microfluidics Fabricated by Photopatternable Superhydrophobic Nanocomposite[J]. Microfluidics and Nanofluidics, 2011, 10(5): 991-997.
[55] DICUANGCO M, DASH S, WEIBEL J A, et al. Effect of Superhydrophobic Surface Morphology on Evaporative Deposition Patterns[J]. Applied Physics Letters, 2014, 104(20): 201604.
[56] DI GASPARE L, CIASCA G, PEA M, et al. Ion and Plasma Based Treatments for Enhanced Chemical Speciation of Metals in Ferritin[J]. Microelectronic Engineering, 2014, 124: 86-89.
[57] DE SOLE P, ROSSI C, CHIARPOTTO M, et al. Possible Relationship between Al/Ferritin Complex and Alzheimer's Disease[J]. Clinical Biochemistry, 2013, 46(1-2): 89-93.
[58] BYLER D, SUSI H. Examination of the Secondary Structure of Proteins by Deconvolved FTIR Spectra[j]. Biopolymers, 1986, 25(3):469-487.
[59] BUSINARO L, LIMAJ O, GILIBERTI V, et al. Mid-Infrared Nanoantenna Arrays on Silicon and CaF2Substrates for Sensing Applications[J]. Microelectronic Engineering, 2012, 97: 197-200.
[60] BALDASSARRE L, SAKAT E, FRIGERIO J, et al. Midinfrared Plasmon-Enhanced Spectroscopy with Germanium Antennas on Silicon Substrates[J]. Nano Letters, 2015, 15(11): 7225-7231.
[61] ZHANG Peng, MORETTI M, ALLIONE M, et al. A Droplet Reactor on a Super-Hydrophobic Surface Allows Control and Characterization of Amyloid Fibril Growth[J]. Communications Biology, 2020, 3: 457.
[62] NICHOLSON J P, WOLMARANS M R, PARK G R. The Role of Albumin in Critical Illness[J]. British Journal of Anaesthesia, 2000, 85(4): 599-610.
[63] GASPARI M, CHENG M M C, TERRACCIANO R, et al. Nanoporous Surfaces as Harvesting Agents for Mass Spectrometric Analysis of Peptides in Human Plasma[J]. Journal of Proteome Research, 2006, 5(5): 1261-1266.
[64] HU Ye, BOUAMRANI A, TASCIOTTI E, et al. Tailoring of the Nanotexture of Mesoporous Silica Films and Their Functionalized Derivatives for Selectively Harvesting Low Molecular Weight Protein[J]. ACS Nano, 2010, 4(1): 439-451.
[65] WILCZEWSKA A Z, NIEMIROWICZ K, MARKIEWICZ K H, et al. Nanoparticles as Drug Delivery Systems[J]. Pharmacological Reports, 2012, 64(5): 1020-1037.
[66] MAHAM A, TANG Zhi-wen, WU Hong, et al. Protein- Based Nanomedicine Platforms for Drug Delivery[J]. Small, 2009, 5(15): 1706-1721.
[67] LIU Jing-quan, CUI Liang, LOSIC D. Graphene and Graphene Oxide as New Nanocarriers for Drug Delivery Applications[J]. Acta Biomaterialia, 2013, 9(12): 9243- 9257.
[68] PAPI M, LAURIOLA M C, PALMIERI V, et al. Plasma Protein Corona Reduces the Haemolytic Activity of Graphene Oxide Nano and Micro Flakes[J]. RSC Advances, 2015, 5(99): 81638-81641.
[69] ALLEN T M, CULLIS P R. Liposomal Drug Delivery Systems: From Concept to Clinical Applications[J]. Advanced Drug Delivery Reviews, 2013, 65(1): 36-48.
[70] LAVAN D A, MCGUIRE T, LANGER R. Small-Scale Systems for in Vivo Drug Delivery[J]. Nature Biotechnology, 2003, 21(10): 1184-1191.
[71] ZILBERMAN M. Active Implants and Scaffolds for Tissue Regeneration[M]. Berlin: Springer, 2011.
[72] YOHE S T, HERRERA V L M, COLSON Y L, et al. 3D Superhydrophobic Electrospun Meshes as Reinforcement Materials for Sustained Local Drug Delivery Against Colorectal Cancer Cells[J]. Journal of Controlled Release, 2012, 162(1): 92-101.
[73] ANTUNES J, GASPAR V M, FERREIRA L, et al. In-Air Production of 3D Co-Culture Tumor Spheroid Hydrogels for Expedited Drug Screening[J]. Acta Biomaterialia, 2019, 94: 392-409.
[74] YAMADA K, MIYAMOTO S, TAKAYAMA M, et al. Clinical Application of a New Bioabsorbable Artificial Dura Mater[J]. Journal of Neurosurgery, 2002, 96(4): 731- 735.
[75] LEBOFSKY R, BENSIMON A. Single DNA Molecule Analysis: Applications of Molecular Combing[J]. Briefings in Functional Genomics & Proteomics, 2003, 1(4): 385-396.
[76] MICHALET Xavier, EKONG Rosemary, FOUGEROUSSE Francoise, et al. Dynamic Molecular Combing: Stretching the Whole Human Genome for High-Resolution Studies[J]. Science, 1997, 277(5331):1518-1523.
[77] GUAN Jing-jiao, LEE L J. Generating Highly Ordered DNA Nanostrand Arrays[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(51): 18321-18325.
[78] YANG Yan-yin, BOLIKAL D, BECKER M, et al. Combinatorial Polymer Scaffold Libraries for Screening Cell- Biomaterial Interactions in 3D[j]. Advanced Materials, 2008, 20(11):2037-2043.
[79] WANG Yu-yi, WU Yu-shuai, CHEN Yue, et al. Nanoliter Centrifugal Liquid Dispenser Coupled with Superhydrophobic Microwell Array Chips for High-Throughput Cell Assays[J]. Micromachines, 2018, 9(6): 286.
[80] POPOVA A A, DIETRICH S, HUBER W, et al. Miniaturized Drug Sensitivity and Resistance Test on Patient- Derived Cells Using Droplet-Microarray[J]. SLAS Technology, 2021, 26(3): 274-286.
[81] BOYER C J, AMBROSE J Jr, DAS S, et al. Antibacterial and Antibiofouling Clay Nanotube-Silicone Composite[J]. Medical Devices, 2018, 11: 123-137.
[82] ROBERTSON S N, GIBSON D, MACKAY W G, et al. Investigation of the Antimicrobial Properties of Modified Multilayer Diamond-Like Carbon Coatings on 316 Stainless Steel[J]. Surface and Coatings Technology, 2017, 314: 72-78.
[83] PALMIERI V, BUGLI F, LAURIOLA M C, et al. Bacteria Meet Graphene: Modulation of Graphene Oxide Nanosheet Interaction with Human Pathogens for Effective Antimicrobial Therapy[J]. ACS Biomaterials Science & Engineering, 2017, 3(4): 619-627.
[84] YU Kai, LO J C Y, YAN Mei, et al. Anti-Adhesive Antimicrobial Peptide Coating Prevents Catheter Associated Infection in a Mouse Urinary Infection Model[J]. Biomaterials, 2017, 116: 69-81.
[85] KELLER N, BRUCHMANN J, SOLLICH T, et al. Study of Biofilm Growth on Slippery Liquid-Infused Porous Surfaces Made from Fluoropor[J]. ACS Applied Materials & Interfaces, 2019, 11(4): 4480-4487.
[86] HIZAL F, RUNGRAENG N, LEE J, et al. Nanoengineered Superhydrophobic Surfaces of Aluminum with Extremely Low Bacterial Adhesivity[J]. ACS Applied Materials & Interfaces, 2017, 9(13): 12118-12129.
[87] ZHAO Jie, SONG Ling-jie, YIN Jing-hua, et al. Anti- Bioadhesion on Hierarchically Structured, Superhydrophobic Surfaces[J]. Chemical Communications, 2013, 49(80): 9191-9193.
[88] SUN Tao-lei, TAN Hong, HAN Dong, et al. No Platelet can Adhere—Largely Improved Blood Compatibility on Nanostructured Superhydrophobic Surfaces[J]. Small, 2005, 1(10): 959-963.
[89] NOKES J M, LIEDERT R, KIM M Y, et al. Reduced Blood Coagulation on Roll-to-Roll, Shrink-Induced Superhydrophobic Plastics[J]. Advanced Healthcare Materials, 2016, 5(5): 593-601.
[90] SANLI M, VICTORIA L, WEI Wang, et al. Hemocompatibility of Superhemophobic Titania Surfaces[J]. Advanced Healthcare Materials, 2017, 6(4): n/a.
[91] WANG Ze, TAN Wen-sheng, Ye-Xia, et al. Preparation of Anticoagulant PyC Biomaterials with Super-Hydrophobic Surface[J]. Journal of Applied Biomaterials & Functional Materials, 2018, 16(1_suppl): 125-131.
[92] HOSHIAN S, KANKURI E, RAS R H A, et al. Water and Blood Repellent Flexible Tubes[J]. Scientific Reports, 2017, 7: 16019.
[93] HAN K, PARK T Y, YONG K, et al. Combinational Biomimicking of Lotus Leaf, Mussel, and Sandcastle Worm for Robust Superhydrophobic Surfaces with Biomedical Multifunctionality: Antithrombotic, Antibiofouling, and Tissue Closure Capabilities[J]. ACS Applied Materials & Interfaces, 2019, 11(10): 9777-9785.
Research Progress on Superhydrophobic Surface Materials in Biology and Medicine Molecule Detection
1a,2,1b,1b,1a,1b,2
(1. a. Institute for Interdisciplinary Biomass Functional Materials Studies, b. College of Mechanical Engineering, Jilin Engineering Normal University, Changchun 130052, China; 2. Jilin Provincial Key Laboratory of Straw-Based Functional Materials, Changchun 130052, China)
In recent decades, superhydrophobic surface materials have attracted much attention due to their research and technological applications for self-cleaning, anti-wetting, oil-water separation, antifouling and antiseptic materials. Simultaneously, superhydrophobic surface materials can be exploited to study biological systems, greatly promote the advancement of biomedical testing technology. This review introduces the application research progress of superhydrophobic surface materials in the field of biomedical detection, focusing on the concentration and detection of trace molecules, separation of biological mixtures, precise positioning of nano-level molecules, controlled release of drugs, a combination of multiple spectroscopic methods, the nanometer droplet array, the prevention of bacterial adhesion and biofilm formation, anti-platelet adhesion, and anticoagulation. A brief overview and analysis of their respective advantages and disadvantages as well as current problems. The research of superhydrophobic surface materials in the field of biomedical testing is still in the development stage, and some of the theories still have conflicting views. Finally, it summarized the shortcomings of the existing superhydrophobic surface materials in the field of biomedical detection, and prospected the future research work, hoping to provide theoretical reference and theoretical basis for the research and development of superhydrophobic surface materials in the field of biomedical detection. At the same time, it provides new technologies and equipment for clinical diagnosis of diseases and realizes a personalized medical system.
super hydrophobic; surface materials; biology; medicine
TB34
A
1001-3660(2022)10-0113-15
10.16490/j.cnki.issn.1001-3660.2022.10.012
2021–07–12;
2021–10–22
2021-07-12;
2021-10-22
国家自然科学基金项目(51875249);吉林工程技术师范学院校内博士启动基金(BSKJ201902)
National Natural Science Foundation of China (51875249); Jilin Normal University of Engineering and Technology on Campus Doctor Launch Fund (BSKJ201902)
林彦萍(1989—),女,博士,讲师,主要研究方向为材料科学与工程仿生。
LIN Yan-ping (1989-), Female, Doctor, Lecturer, Research focus: material science and engineering bionics.
杨晓东(1965—),男,博士,教授,主要研究方向为材料科学与工程仿生。
YANG Xiao-dong (1965-), Male, Doctor, Professor, Research focus: material science and engineering bionics.
林彦萍, 王庆成, 吕恕位, 等. 超疏水表面材料在生物医学检测领域研究进展[J]. 表面技术, 2022, 51(10): 113-127.
LIN Yan-ping, WANG Qing-cheng, LYU Shu-wei, et al. Research Progress on Superhydrophobic Surface Materials in Biology and Medicine Molecule Detection[J]. Surface Technology, 2022, 51(10): 113-127.
责任编辑:万长清
