生物可降解锌合金用于骨植入物的研究进展
2022-11-08孟晓丽吕萍崔旭东何学斌马胜强邢建东
孟晓丽,吕萍,崔旭东,何学斌,马胜强,邢建东
研究综述
生物可降解锌合金用于骨植入物的研究进展
孟晓丽1,2,吕萍1,2,崔旭东2,3,何学斌2,3,马胜强1,2,邢建东1
(1.西安交通大学 金属材料强度国家重点实验室,西安 710049;2.陕西省四主体一联合锌基新材料校企联合研究中心,西安 710049;3.陕西锌业有限公司,陕西 商洛 726007)
生物可降解锌合金是新型的具有发展前景的人体骨植入物材料。讨论了生物可降解锌合金在力学性能、腐蚀降解行为和生物相容性等方面作为骨植入物材料的开发潜力和应用前景。重点综述了近年来不同合金元素的选择和添加量对生物可降解锌合金的强韧化影响、生物可降解性及生物相容性评价。同时,讨论了塑性变形过程对生物可降解锌合金力学性能的影响。另外,还介绍了生物可降解锌合金的体内外降解行为、生物腐蚀机理、生物相容性及其要求。明确了各种增强手段对生物可降解锌合金的影响,并分析讨论了各种手段的可取与不足之处。针对当前制备技术存在的问题,结合已有研究成果,指明生物锌合金未来的发展方向。生物锌合金的强化方法,如合金化、改变添加量、变形加工操作、表面改性处理等,可以有效提高纯锌的综合性能。锌合金的降解速率适中,不产生氢气袋,降解产物能起到保护层的作用,有助于提高细胞黏附性,增强抗菌能力。锌合金的生物相容性与锌离子的释放量密切相关。制备ZnP涂层的表面改性技术能够有效降低锌离子释放量,进而改善生物相容性。目前,生物可降解锌合金在生物体植入物中已经取得部分进展,但是,其力学性能和生物相容性仍是较长一段时间内努力的方向,开发新的增强手段及体内动态模拟试验和性能评估方法也都是未来的重要发展趋势。
生物可降解;锌合金;机械性能;变形加工;降解行为;生物相容性
在日常生活中,人们常常因为某种不可抗力因素或外科手术等,必须向人体内部植入一些生物材料以用于骨骼或其他关键部位的固定和支撑。此外,当人体血管出现堵塞时,需要一种径向支撑强度优异的多孔结构微小血管支架作为血管扩张的器材。生物医用金属作为器官的负重承载骨植入体,具有刺激组织再生和生物兼容性,其发展主要存在两大类:第一类是永久性作为人体假体而保留在人体内的植入物;第二类是辅助受损骨骼或血管实现固定、修复和愈合,待受损部位治愈后需要从人体消失的植入体[1-2]。第二类生物植入材料或组织工程支架的最大特点是受损骨骼或者堵塞血管部位康复愈合后需要植入体从体内消失(亦即生物可降解),避免永久植入体长期存在对人体器官的应力效应及诱发组织器官病变或退化。因此,生物可降解材料一直是生物医学界和材料领域的研究热点[3-4]。实际上,最先用于植入物的材料是传统医用金属,主要包括316LL不锈钢(弹性模量为190~220 GPa)、Co-Cr合金(弹性模量为210~240 GPa)、Ti合金(弹性模量为90~110 GPa)等,这些材料的机械强度很高,而且其耐腐蚀性极强,因此,被广泛应用于医学领域,如关节置换,心血管支架,骨折固定用骨钉、骨板等。然而,这类材料有一个很大的缺点是降解性极低,弹性模量也远大于骨骼(3~30 GPa),这往往会导致二次手术、生物适配性以及应力屏蔽等诸多问题[5-6]。生物可降解聚合物凭借其出色的生物相容性、降解能力以及对心血管应用的弹性适配而在生物医学应用中备受赞誉,如聚乙醇酸(PGA)、聚L-乳酸(PLLA)、聚乳酸-共乙醇酸(PLGA)等[7-8]。这种材料的机械强度相较于传统金属大大降低,只能应用于一些软组织物的固定,对于一些承重部位的适应性能力不高。
生物可降解金属(BMs)是一类可以在生理环境中自然降解并且体液腐蚀产物还可被人体吸收代谢的新型生物金属,甚至在某些方面可诱导或刺激人体组织细胞再生与修复,对人体生物学功能有极大地促进作用[9]。目前,生物可降解金属主要包括铁(Fe)、镁(Mg)、锌(Zn)合金。虽然铁合金生物相容性优异,在生物可吸收支架方面应用甚广[10],但铁合金的弹性模量(200~210 GPa)太高,降解速率太慢,具有和永久植入材料同样的缺陷[11]。镁合金的弹性模量(40~45 GPa)和密度(1.7~2.0 g/cm3)更接近骨骼。镁及镁合金在骨愈合治疗器械方面的研究已经较为广泛,并成功转移到了临床应用上[12-13],包括AZ、LAE及WE型镁合金等[14]。尽管如此,生物可降解镁合金的最大问题是腐蚀速率过快,并且植入期间会导致人体体液pH值升高以及产生大量的氢气,极大地干扰骨骼的愈合过程,导致愈伤组织形成和皮质受损[15]。生物可降解锌合金可以有效解决镁合金存在的一些问题,具有极大的发展前景,近年来备受医疗人员及科技工作者的广泛关注[1-2]。锌可以强烈刺激成骨细胞成骨,并抑制破骨细胞分化,调节并促进组织细胞良性反应,与众多酶物质作用而促进人体骨骼愈合及生长发育。此外,锌基生物材料的生物相容性优异,降解吸收量一般在人体可接受范围内,对人体没有不良反应。然而,锌基合金也存在着一些限制,例如,锌合金的弹性模量(90~100 GPa)比镁合金高,与天然骨的差异更大,大多数的锌合金材料的机械强度也没有镁合金高。另外,人体对于锌离子的耐受性有限,过高的锌离子浓度可能会导致部分范围内的细胞毒性,对人体不利[16-17]。
为了将锌合金用于负重骨植入物,目前亟待解决的问题主要是提高其机械强度和韧性,控制锌离子低浓度释放,同时尽量使锌合金的弹性模量、密度与人体骨骼相适配。为此,本文重点论述了生物可降解锌合金的机械性能、腐蚀降解行为、生物相容性以及其未来的发展方向,为研究者提供一定的参考。
1 生物可降解锌合金的机械性能
1.1 不同合金化元素对纯锌机械性能的影响
目前,锌合金系统的研究主要集中在使用合金化技术控制第二相行为来提高力学性能[18],其掺杂元素为Mg、Ca、Sr、Li、Al、Cu、Fe、Mn、Ag等二元合金或少数三元合金系统上。表1总结了合金元素、变形加工处理对各种锌合金机械性能的影响。Mg、Ca、Sr是人体营养元素,植入人体后能够有效提高纯锌的综合性能[19]。Mg在Zn中的溶解度很低,在364 ℃下固溶度约为0.1%,纯锌中添加过量的Mg会形成第二相金属间化合物,对机械性能产生不同程度的影响。Vojtech等[20]研究表明,通过普通石墨模具铸造,采用电阻炉熔炼,熔炼温度不超过500 ℃,石墨棒强烈机械搅拌保证熔体均匀化的条件下,在纯锌(99.95%)中加入0~3%Mg(99.90%)后发现,Mg的添加使锌基体晶粒尺寸明显变小。从Zn-Mg二元相图可知,低Mg含量的锌合金生成的金属间第二相为Mg2Zn11,其与初生相形成共晶网络结构,起到了细晶强化的作用[21-22]。由于Mg2Zn11属于高脆性共晶相,其体积分数的增加导致生物锌合金的极限抗拉强度及延伸率都呈现先升后降的趋势,在Mg含量约为1%处出现峰值[20]。
Ca是人体必需的微量元素,每日的摄取量为800~1 200 mg/d,是很好的生物合金添加元素。不仅如此,Ca的密度很低,为1.55 g/cm3,且具有细化晶粒的作用,还可以增强抗蠕变性能以及加快纯锌的腐蚀速率[23-25]。Zou等[26]针对Zn-Ca(0、0.5%、1%、2%、3%)体系做了一系列的研究,Ca在Zn中的固溶度很低,第二相是CaZn13。由其研究结果可知,Ca元素的加入能够明显细化晶粒、提高强度以及加快腐蚀速率。另外,与纯锌相比,Zn-2%Ca、Zn-3%Ca的显微硬度可以提升约3倍,其中Zn-2%Ca的综合表征性能最佳。此外,有关Ca的细化机制及第二相是CaZn13强化相结构研究的报道目前仍然比较少,Ca与Mg、Zn的元素间相互作用机制和分配系数、偏析行为仍需要关注。
Sr元素是人体必需的微量元素之一[27],一般以1%的含量添加到纯Zn或者Zn-Mg合金中,Sr合金化后,Zn合金具有良好的降解速率,对强度的提升率高达100%。铸态Zn-3%Sr的硬度为110HV,相较纯锌(38HV)提高了约189%[28-29]。研究发现,在Zn-Sr(=0、0.1%、0.4%、0.8%)二元合金中,当合金中加入0.1%Sr时,就开始出现SrZn13相,随着Sr元素含量的增加,SrZn13相越多,尺寸越大。合金硬度的提高归因于Sr加入Zn后产生的固溶强化及第二相强化,且随着SrZn13相的增多,第二相强化起主要作用。Zn-Sr合金中SrZn13相由于其刚性和精细的特点,可以显著提高纯锌的极限抗拉强度和屈服强度(70~130 MPa),少量Sr含量(如0.7%Sr)的Zn-Sr合金拉伸断口呈韧窝状态,其余Sr添加量的Zn-Sr合金呈解理断裂状态,因此添加少量Sr在一定程度上可以提高材料的延伸率[30]。SrZn13相尺寸过大可能会导致应力集中进而产生裂纹,因此一般添加较少量的Sr同时结合性能增强手段来改进纯锌性能。
锌合金中的其他添加元素,如Li、Al、Cu、Fe、Mn、Ag等,其对锌合金的固溶强化效果也是非常明显的[31-41]。0.4%Li的加入可以显著改善纯锌的力学性能,而过量的Li会严重降低材料塑性[31]。Al元素常被用来作为合金化元素,其在锌中的溶解度可以达到1%,溶解度较高,一般不会产生第二相,可以起到固溶强化的作用[6,33]。Cu元素是一种常见的合金化元素,根据Cu-Zn相图可知,Cu在Zn中的溶解度约为2.75%(425 ℃)[34-35]。Tang等[36]研究了Zn-Cu(=1%、2%、3%、4%)合金,可能存在的第二相是CuZn5,随着Cu含量的增加,第二相体积分数增加,晶粒尺寸明显细化,Zn-4%Cu的延伸率达到(50.6±2.8)%,较大的延伸率有助于心血管产品的加工制造[36]。相较于纯锌,Zn-Fe合金的极限抗拉强度、延伸率都得到一定的提高,但Zn、Fe的熔点相差较大,在制备工艺上存在一定的难度。研究人员通过电沉积方法成功制备Zn-Fe二元合金,证实其在生物医学材料领域具有潜在的发展潜力[6,37]。Zn-Mn(Mn<1%)体系的研究表明[38-39],在合金化过程中,出现MnZn13第二相,使得屈服强度、极限拉伸强度以及延伸率都得到一定的提高。此外,Mostaed等[40]对 Zn-4.0Ag-Mn(=0.2%~0.6%)以及Li等[41]对Zn-4.0%Ag合金做了详细的研究,研究表明,晶粒尺寸直接影响了锌合金的机械性能,并且Mn的加入使凝固时的形核数量增加,起到了细晶强化的作用。
表1 合金元素、变形加工处理对各种锌合金机械性能的影响
1.2 生物可降解锌合金的变形加工处理
在铸态合金基础上采用热挤压方法可以提高材料强度。这种增强手段的性能提升机理在于,热加工变形处理后的生物锌合金晶粒破碎,变为长条状,晶界变多,且显著改善了强化相的形态及分布,第二相强化效果显著增强,阻碍了位错的运动,使得合金的极限抗拉强度得到进一步提升[42-43]。热挤压工艺容易诱发动态再结晶,从而进一步促进动态再结晶及晶粒重新形核过程,形成更为细小的晶粒[36]。Pachla等[44]对Zn-Mg二元合金采用累积流体静力挤压(Hydrostatic Extrusion,HE)工艺,与其他传统工艺相比,累积HE工艺在室温下产生较大的塑性变形,晶粒尺寸明显减小,对合金的强度和硬度也有所提升,如Zn-0.5%Mg的强度可以达到515 MPa,Zn-1.5%Mg的显微硬度达到120HV[44]。另外,Zn-4.0%Ag二元合金经过冷拔处理后,微观结构呈现出超细晶粒状态,而其周围聚集了富银沉淀均匀分布在整个基体中,这主要是由于晶界密度的增加加快了Ag的扩散,起到了晶界强化以及沉淀硬化的作用。因此,变形诱导工艺对综合机械性能的改善也起着重要的作用[40-41]。但是,对于锌合金,超细结构的产生有可能会导致异常软化现象。根据霍尔佩奇(Hall-Petch)公式可知,晶粒越细,材料的屈服强度越高。Zn-Ag合金在冷拔条件下(严重塑性变形条件)会出现超细晶结构,理论上材料的强度会大幅升高。但是超细晶结构的晶粒达到纳米级别将超出Hall-Petch的适用范围,此时小的晶粒尺寸不一定会导致屈服强度的升高,相反,此时析出相的动态再结晶软化作用及基本纤维织构变弱起主要作用,材料出现明显软化现象,机械性能降低。因此,在后续的研究中应尽量避免此种超细结构的产生[40-41]。
2 生物可降解锌合金的体内外降解行为与腐蚀机理
生物可降解性是指材料在人体生理环境中容易发生腐蚀的特点,在生物体功能恢复过程中植入体逐渐降解,待人体器官或者硬组织完全恢复后,植入体快速降解并完全消失,且降解产物不会造成人体危害且能够随排泄物排出体外的特性[45]。2014年,郑玉峰等[9]指出,可降解金属是指能够在体内逐渐被体液腐蚀降解的一类医用金属,它们所释放的腐蚀产物给机体带来恰当的宿主反应,协助机体完成组织修复使命之后将全部溶解,不残留任何植入物。目前,生物可降解金属主要是指可降解镁合金、可降解铁合金和可降解锌合金,其中,生物锌合金的可降解性表现最为优异。
2.1 生物锌合金的体外降解行为
体外降解主要通过电位极化试验(PPT)和静态浸泡失重测试(SI)进行评估。通过扫描电子显微镜(SEM)观察在体外腐蚀介质〔如模拟体液(SBF)、汉克斯平衡盐溶液(Hanks)等〕浸泡后的表面形态,评估植入体的降解属于局部腐蚀还是均匀腐蚀。局部腐蚀一般会造成应力集中,导致材料强度降低,使得支撑修复功能下降[32]。不同合金化元素的标准电极电位不同,不仅会对力学性能产生一定的影响,而且对材料的降解行为表现也起着关键的支配作用。基体晶粒与第二相之间形成微电偶,随着第二相体积分数的增加,低电位第二相增多,构成更多的微电偶腐蚀,从而加快了合金降解的速率[23]。另外,部分二元合金的降解产物会覆盖在合金材料上,降低了微电偶的活性,从而起到一定的保护作用[6]。图1为不同合金元素的锌合金腐蚀速率散点分布图,可以看出,合金化元素及合金含量可以显著改善腐蚀速率,当合金元素含量小于1%时,大部分二元合金的腐蚀速率小于0.04 mm/a且分布比较集中。
生物可降解锌合金的腐蚀速率的计算可以通过式(1)—(3)表征[47-48]。

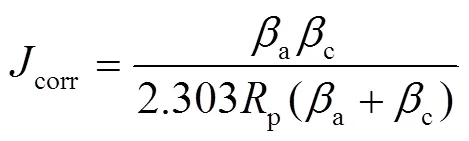


图1 不同合金元素的锌合金腐蚀速率散点分布图[6,20,23,32,46]

根据浸没测试获得的3个pH值下SBF中的腐蚀速率(如图2所示),发现纯Mg、热压AZ91、锌合金的腐蚀速率随着pH的增加而降低,暴露时间越长,pH值越大,但锌合金材料的增加幅度较小[20]。此外,在pH=7的生理环境中,纯Mg的腐蚀速率可以达到约250 μm/a,腐蚀速率顺序为纯Mg>热压AZ91>锌合金>纯锌[20]。根据腐蚀速率数据可以看出,锌合金材料具有适中的腐蚀速率。在pH=5~10的腐蚀介质中,腐蚀速率具有相同的趋势,值得注意的是,随着pH值的增加,纯镁与镁合金以及纯锌与锌合金都表现出整体腐蚀速率下降的现象。这可能是由于碱性环境的增强有利于惰性腐蚀产物的生长,从而隔断在植入物表面以降低腐蚀速率[20]。研究表明,体外浸泡一段时间后,腐蚀产物分布在锌合金表面,其力学性能有所下降,但是能够满足服役要求。不同的晶粒尺寸以及第二相对腐蚀速率有不同程度的影响[6,32]。Ke等[29]研究表面降解产物覆盖在植入物表面,起到一定的保护作用。但是当Zn-Sr添加量超过0.1%时,降解产物会出现聚集现象,导致植入物的均匀腐蚀转变为局部腐蚀。He等[37]体外浸泡实验表明,Zn-Fe合金的降解产物包含ZnO,ZnO有助于改善细胞黏附作用及改善增长分化功能,还具有良好的抗菌能力及细胞相容性。
2.2 生物锌合金的体内降解行为
选择表征性能较好的合金体系进行动物实验(例如小鼠、兔子等),植入生物体后需要观察动物体内植入物的变化及周边股骨的固定、炎症、愈合等情况。研究结果显示,Zn-X二元合金(X=Mg、Ca、Sr、Li等)均表现出良好的生物相容性,没有骨溶解、扭曲畸形或脱位的迹象[32]。为了同时实现加速和受控降解,应优先考虑电极电位较低的元素作为Zn的合金元素。结果显示,腐蚀产物在抑制Zn基体腐蚀的同时促进其余相的整体腐蚀[32]。进行体内降解速率的计算时可以用式(4)—(5)来计算,这种方法可以有效评估长宽比较大的样品[6,49]。
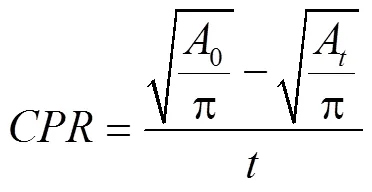

Yang等[50]将Zn-1%Mg-0.1%Ca合金植入大鼠大腿内侧皮下肌肉中,对其进行病理学观察分析。结果显示,与纯镁、AZ31相比,Zn-Mg-Ca明显具有较高的细胞密度。另外,在细胞形态上,骨髓间充质干细胞也更倾向于Zn-Mg-Ca的表面,说明锌合金对细胞黏附几乎没有阻碍作用。锌合金比纯锌的细胞黏附力高,而合金元素的添加量可以直接影响细胞黏附密度[50]。通过评估生物体内锌合金降解速率及腐蚀面积,Zn-Li合金具有均匀腐蚀特点及理想的腐蚀速率[51]。He等[37]重点聚焦了Zn-Fe的降解行为,浸泡实验表明锌合金表面覆盖了大量的腐蚀产物,主要包括Zn、Fe、Ca、P、O等,Zn-Fe的腐蚀速率远远大于铁合金。植入初期可能会伴随轻微炎症,但是后期经过巨噬细胞的吞噬,炎症细胞明显减少,炎症基本消除[37]。因此,人体微量营养元素的合金化可以有效改善生物锌合金的细胞相容性,进一步提升锌合金在医用领域的发展前景。
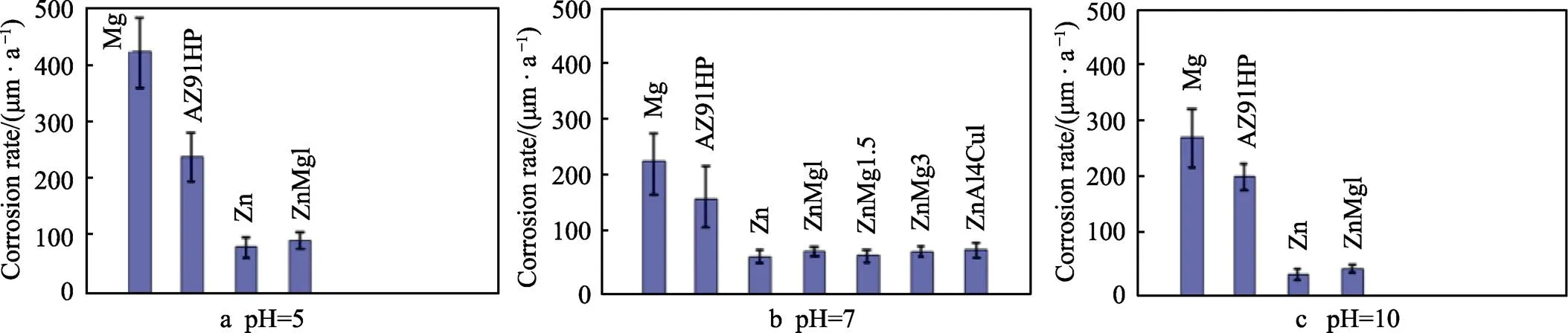
图2 通过浸没测试获得的3个pH值下SBF中的腐蚀速率[20]
2.3 生物可降解锌合金的腐蚀机理
虽然人体不同部位对于植入体降解速率的要求有所不同,但是一般来说,医用可降解金属要求降解合金从植入人体后的6~12个月范围内仍旧具有良好的支撑和固定作用,而在1~2 a内可以完全迅速降解,特别是1.5 a左右基本消失而排出体外。由式(6)—(11)可知[46],锌合金植入人体后,Zn作为阳极失去电子成为锌离子,阴极得到电子后与氧气反应生成氢氧根离子,并进一步生成氢氧化锌。不溶性氢氧化锌会被人体环境中的氯离子溶解成锌离子,锌离子与溶液作用最终形成不溶性磷酸锌、碳酸盐等产物。相较于镁合金[42],锌合金降解过程中不会有氢气产生,降解速率适中,符合人体降解速率要求。这可能是由于部分腐蚀产物形成了防腐蚀层,对电偶腐蚀起到了一定的阻碍作用。



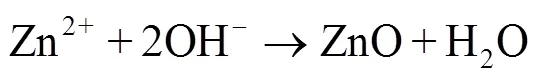

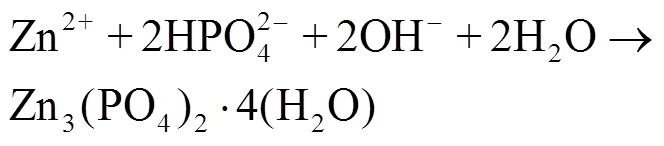
3 可降解锌合金的生物相容性
3.1 锌合金植入物对生物体的影响
国际标准化组织(International Organization for Standardization,ISO)指出,生物相容性是特定条件下植入材料与宿主之间的反应性能,要求生物材料低毒或者无毒,同时在特定条件下植入体能够适应性的刺激生物体相应的生物学功能,包括组织细胞相容性、血液相容性、免疫系统相容性和力学适配性[52-53]。
生物可降解材料植入生物体后,促进受伤组织愈合的同时,降解产物应该在各项生理指标范围内,且不会引起细胞中毒等状况。Zn-Ca合金主要的腐蚀产物是正磷酸钙,不会对人体造成伤害[26]。Sr元素可以刺激成骨细胞成骨,抑制破骨细胞的分化,对钙的代谢也起着重要的作用[27]。研究表明[31],适当的Li可以用于治疗脑损伤、肌肉萎缩症以及帕金森氏症等,但是 Li血清水平过高会导致一定的细胞毒性,对人体产生不同程度的损害,导致肾衰竭、甲状腺等问题[31]。Cu元素可以促进血管细胞重建以及骨骼生长,有望成为心血管支架的候选材料[36]。Al元素具有一定的神经毒性,会导致患者引发阿兹海默等病症[33]。因此,对于Al元素在锌合金中的添加及加入量仍具有争议,如Al元素一般以非常低的含量作为第三种元素掺杂到二元合金中[6]。Zn-Fe、Zn-Mn合金具有良好的生物相容性,具有潜在的应用价值,Mn元素也是人体生命元素,对于各种酶的催化起着重要的作用[38]。
在溶血率的测试结果中可以发现,无论是铸态还是挤压态,纯锌以及三元生物锌合金的溶血率都非常低,表明锌及锌基三元合金不会导致生物体出现严重的溶血现象[54]。另外,相较于纯锌,添加Ca和Sr元素的锌合金都可以提高MG63细胞活性,其中Zn-1%Ca-1%Sr的细胞活力最高[54]。Yang等[32]通过射线照片观察骨密度,进而表征植入物的成骨作用,锌合金具有良好的成骨能力。横截面染色结果显示,植入物周围有明显新骨形成,不同锌合金的中间纤维层厚度有所差异。Zn-0.1%Sr、Zn-0.8%Ca、Zn-0.4%Li、Zn-0.8%Mg的中间纤维层更薄,骨整合能力更强。评估植入生物体后血清中的Zn2+浓度水平,不同二元合金的Zn2+浓度差异不大,均在安全阈值范围内[32]。另外,在Zn-Li植入物周围动脉管腔较宽,新生成的内膜较少,具有良好的生物相容性[51]。在Zn-4Ag合金提取物中培养的细胞不存在明显的细胞毒性,细胞存活率不受影响[55]。低浓度锌离子释放能够诱导细胞成骨分化,相反高浓度锌离子起到抑制作用[55]。关于生物锌合金植入生物体后的生物理化影响及生命综合体征、细胞生长与代谢、周围组织的生长等相关作用规律及影响机制,还需要更多的研究工作来丰富细化生物学评价和临床检验。
3.2 生物可降解锌合金的表面改性处理
锌和镁是人体不可或缺的元素,但是人体对二者的需求量不同。Zn每日摄入量在6.5~15 mg/d,远低于Mg(375~700 mg/d)的每日摄取量[46]。锌合金中Zn元素是主要成分,而且在许多酶和细胞功能中起着重要的作用,但是部分合金在降解过程中如果释放出过量的Zn2+,如Zn2+浓度达到3.9~5.2 μg/ml后对细胞有益功能受限,表现出一定的细胞毒性和细胞排异现象,反而不利于细胞生长及人体健康[56]。表面改性是改善锌离子释放进而控制生物相容性的有效手段之一。目前生物可降解锌合金的表面改性已经得到广泛应用,虽然大部分涂层结构可以有效降低腐蚀速率和改善生物相容性,但是其无法满足植入物的组合生物特性,而CaP/ZnP涂层具有仿生结构,生物相容性优异,是目前主要的研究方向[56-57]。CaP涂层虽然具有良好的体外生物活性评估结果,但是可能会造成血管钙化,这种潜在风险在一定程度上阻碍了CaP涂层的应用[56]。在纯锌表面制备ZnP涂层可以有效控制锌离子释放量,明显提高细胞活力[56,58]。通过控制合成工艺来获得形态及尺寸优异的涂层结构,即获得均匀的微米/纳米级涂层结构,这种涂层结构的抗腐蚀性能较高且降解均匀,具有良好的抗细菌黏附性,显著改善了纯锌及锌合金生物相容性及降解速率,具有极大的生物医学应用潜力[56]。
4 分析与讨论
本文讨论了生物可降解锌合金的机械性能、降解行为及生物相容性。研究表明,添加低含量常规元素能够有效改善纯锌性能,细晶强化和第二相强化是主要的强化机制[18]。二元合金一般能满足机械性能标准,但是三元合金更有利于生物植入物材料的综合要求[46]。合金元素的选择及添加量至关重要,Mg、Ca、Sr的每日推荐食量很高,一般不会造成细胞毒性,Cu、Fe、Mn能有效改善生物相容性,Li、Al、Ag等添加量过高会对人体造成极大的损害。经过变形加工处理改善晶粒形态以及动态再结晶可以进一步提升材料性能,但是一般来说强度的升高会造成塑性降低,对人体不利,同时还要避免超细结构产生的材料软化行为[40-41]。目前累积挤压工艺的性能增强效果较好,但是挤压道次及温度的选择仍然是一个值得关注的问题[44]。另外,单一加工方法不能全方位提高材料性能,建议对混合加工方法做进一步的探究。锌合金降解速率适中且降解产物能够对植入体起到一定的保护作用,但是添加量过高容易造成腐蚀产物聚集,引起局部腐蚀现象,不利于植入物的力学完整性[29,37]。另外,锌合金一般不会造成溶血现象,但是高浓度的锌离子会抑制细胞成骨分化作用,在后续研究过程中应避免产生锌离子释放量过高的问题[16-17,54]。表面改性处理方法不仅可以有效调控锌离子释放量,而且制备方法简单,生物相容性较高,是目前改善生物相容性的常用手段[56,58]。不同的植入部位对植入物的性能要求有所差异。因此,根据植入部位的实际性能要求,选择适当的合金化元素、添加量、变形加工工艺、包覆涂层调控锌离子释放量等构建多元合金,才能充分发挥锌合金在生物体植入物中的作用。
5 展望
本文从机械性能、腐蚀行为与降解性、生物相容性等3个方面衡量了生物金属作为人体植入物的主要研究进展,回顾了生物锌合金是目前最具开发潜力的生物可降解金属,可应用于伤口闭合装置、骨科固定装置、心血管支架以及骨植入物等。尽管生物可降解锌合金具有良好的耐腐蚀性能,但更优异的力学性能表征和良好的生物相容性仍是未来努力改善的方向之一。
此外,生物锌合金的体内动态模拟测试与表征、生物植入体的3D模型构建与增材制造、锌基生物涂层设计与开发、生物锌合金的半固态加工技术、大塑性变形生物锌合金的关键工艺与控制、生物锌合金非晶涂层、生物锌合金的细胞毒性评估方法以及采用仿生结构设计生物锌合金等,都将成为未来生物锌合金的重要发展趋势。
[1] SEO H J, CHO Y E, KIM T, et al. Zinc may Increase Bone Formation through Stimulating Cell Proliferation, Alkaline Phosphatase Activity and Collagen Synthesis in Osteoblastic MC3T3-E1 Cells[J]. Nutrition Research and Practice, 2010, 4(5): 356-361.
[2] LI Guan-nan, YANG Hong-tao, ZHENG Yu-feng, et al. Challenges in the Use of Zinc and Its Alloys as Biodegradable Metals: Perspective from Biomechanical Compatibility[J]. Acta Biomaterialia, 2019, 97: 23-45.
[3] LIU Yang, ZHENG Yu-feng, CHEN Xie-hui, et al. Fundamental Theory of Biodegradable Metals—Definition, Criteria, and Design[J]. Advanced Functional Materials, 2019, 29(18): 1805402.
[4] TAN Li-li, YU Xiao-ming, WAN Peng, et al. Biodegradable Materials for Bone Repairs: A Review[J]. Journal of Materials Science & Technology, 2013, 29(6): 503-513.
[5] BIESIEKIERSKI A, WANG J, ABDEL-HADY GEPREEL M, et al. A New Look at Biomedical Ti-Based Shape Memory Alloys[J]. Acta Biomaterialia, 2012, 8(5): 1661- 1669.
[6] KABIR H, MUNIR K, WEN Cui-e, et al. Recent Research and Progress of Biodegradable Zinc Alloys and Composites for Biomedical Applications: Biomechanical and Biocorrosion Perspectives[J]. Bioactive Materials, 2020, 6(3): 836-879.
[7] GODAVITARNE C, ROBERTSON A, PETERS J, et al. Biodegradable Materials[J]. Orthopaedics and Trauma, 2017, 31(5): 316-320.
[8] NAIR L S, LAURENCIN C T. Biodegradable Polymers as Biomaterials[J]. Progress in Polymer Science, 2007, 32(8-9): 762-798.
[9] ZHENG Y F, GU X N, WITTE F. Biodegradable Metals [J]. Materials Science and Engineering: R: Reports, 2014, 77: 1-34.
[10] ZIVIC F A S, ZIVIC F, AFFATATO S, et al. Biomaterials in Clinical Practice: Advances in Clinical Research and Medical Devices[M]. Cham: Springer, 2017.
[11] LIU Xi-wei, SUN Jian-ke, YANG Ying-hong, et al. In Vitro Investigation of Ultra-Pure Zn and Its Mini-Tube as Potential Bioabsorbable Stent Material[J]. Materials Letters, 2015, 161: 53-56.
[12] TAHMASEBIFAR A, KAYHAN S M, EVIS Z, et al. Mechanical, Electrochemical and Biocompatibility Evaluation of AZ91D Magnesium Alloy as a Biomaterial[J]. Journal of Alloys and Compounds, 2016, 687: 906-919.
[13] STAIGER M P, PIETAK A M, HUADMAI J, et al. Magnesium and Its Alloys as Orthopedic Biomaterials: A Review[J]. Biomaterials, 2006, 27(9): 1728-1734.
[14] ERBEL R, DI MARIO C, BARTUNEK J, et al. Temporary Scaffolding of Coronary Arteries with Bioabsorbable Magnesium Stents: A Prospective, Non-Randomised Multicentre Trial[J]. The Lancet, 2007, 369(9576): 1869- 1875.
[15] WANG Jia-li, XU Jian-kun, SONG Bin, et al. Magnesium (Mg) Based Interference Screws Developed for Promoting Tendon Graft Incorporation in Bone Tunnel in Rabbits[J]. Acta Biomaterialia, 2017, 63: 393-410.
[16] SHEARIER E R, BOWEN P K, HE Weilue, et al. In Vitro Cytotoxicity, Adhesion, and Proliferation of Human Vascular Cells Exposed to Zinc[J]. ACS Biomaterials Science & Engineering, 2016, 2(4): 634-642.
[17] ZHANG Dong-mei, WONG C S, WEN Cui-e, et al. Cellular Responses of Osteoblast-Like Cells to 17 Elemental Metals[J]. Journal of Biomedical Materials Research Part A, 2017, 105(1): 148-158.
[18] SHI Z Z, GAO X X, ZHANG H J, et al. Design Biodegradable Zn Alloys: Second Phases and Their Significant Influences on Alloy Properties[J]. Bioactive Materials, 2020, 5(2): 210-218.
[19] LIU Xi-wei, SUN Jian-ke, QIU Ke-jin, et al. Effects of Alloying Elements (Ca and Sr) on Microstructure, Mechanical Property andCorrosion Behavior of Biodegradable Zn-1.5Mg Alloy[J]. Journal of Alloys and Compounds, 2016, 664: 444-452.
[20] VOJTĚCH D, KUBÁSEK J, ŠERÁK J, et al. Mechanical and Corrosion Properties of Newly Developed Biodegradable Zn-Based Alloys for Bone Fixation[J]. Acta Biomaterialia, 2011, 7(9): 3515-3522.
[21] SHEN Chao, LIU Xi-wei, FAN Bo, et al. Mechanical Properties,Degradation Behavior, Hemocompatibility and Cytotoxicity Evaluation of Zn-1.2Mg Alloy for Biodegradable Implants[J]. RSC Advances, 2016, 6(89): 86410-86419.
[22] GONG Hai-bo, WANG Kun, STRICH R, et al. In Vitro Biodegradation Behavior, Mechanical Properties, and Cytotoxicity of Biodegradable Zn-Mg Alloy[J]. Journal of Biomedical Materials Research Part B, Applied Biomaterials, 2015, 103(8): 1632-1640.
[23] 沈超. 医用可降解锌合金(Zn-1.2Mg-0.1Ca)的机械性能、降解性能和生物相容性研究[D]. 西安: 第四军医大学, 2017.
SHEN Chao. Mechanical Properties, Biodegradation and Biocompatibility Evaluation of Biodegradable Zn-1.2Mg- 0.1Ca Alloy for Medical Application[D]. Xi'an: The Fourth Military Medical University, 2017.
[24] HUANG He, LIU Huan, WANG Li-sha, et al. Revealing the Effect of Minor Ca and Sr Additions on Microstructure Evolution and Mechanical Properties of Zn-0.6 Mg Alloy during Multi-Pass Equal Channel Angular Pressing[J]. Journal of Alloys and Compounds, 2020, 844: 155923.
[25] LI Qing-lin, WEI Min, YANG Jing, et al. Effect of Ca Addition on the Microstructure, Mechanical Properties and Corrosion Rate of Degradable Zn-1Mg Alloys[J]. Journal of Alloys and Compounds, 2021, 887: 161255.
[26] ZOU Yan-long, CHEN Xia, CHEN Bin. Effects of Ca Concentration on Degradation Behavior of Zn-Ca Alloys in Hank’s Solution[J]. Materials Letters, 2018, 218: 193-196.
[27] LIU Xi-wei, SUN Jian-ke, YANG Ying-hong, et al. Microstructure, Mechanical Properties, in Vitro Degradation Behavior and Hemocompatibility of Novel Zn-Mg-Sr Alloys as Biodegradable Metals[J]. Materials Letters, 2016, 162: 242-245.
[28] 刘芳. Zn-Sr生物医用可降解材料的力学性能及耐蚀性研究[D]. 武汉: 武汉科技大学, 2018.
LIU Fang. Mechanical and Corrosion Resistance Properties of Zn-Sr Biodegradable Medical Materials[D]. Wuhan: Wuhan University of Science and Technology, 2018.
[29] KE Gui-zhou, YUE Rui, HUANG Hua, et al. Effects of Sr Addition on Microstructure, Mechanical Properties and in Vitro Degradation Behavior of As-Extruded Zn–Sr Binary Alloys[J]. Transactions of Nonferrous Metals Society of China, 2020, 30(7): 1873-1883.
[30] SU Ying-chao, FU Jia-yin, DU Shao-kang, et al. Biodegradable Zn-Sr Alloys with Enhanced Mechanical and Biocompatibility for Biomedical Applications[J]. Smart Materials in Medicine, 2022, 3: 117-127.
[31] LI Zhen, SHI Zhang-zhi, HAO Yuan, et al. Insight into Role and Mechanism of Li on the Key Aspects of Biodegradable ZnLi Alloys: Microstructure Evolution, Mechanical Properties, Corrosion Behavior and Cytotoxicity[J]. Materials Science and Engineering: C, 2020, 114: 111049.
[32] YANG Hong-tao, JIA Bo, ZHANG Ze-chuan, et al. Alloying Design of Biodegradable Zinc as Promising Bone Implants for Load-Bearing Applications[J]. Nature Communications, 2020, 11: 401.
[33] LIU Cui, LI Yi-ke, GE Qi-qi, et al. Mechanical Characteristics and in Vitro Degradation of Biodegradable Zn-Al Alloy[J]. Materials Letters, 2021, 300: 130181.
[34] GARCÍA-MINTEGUI C, CÓRDOBA L C, BUXADERA- PALOMERO J, et al. Zn-Mg and Zn-Cu Alloys for Stenting Applications: From Nanoscale Mechanical Characterization toDegradation and Biocompatibility[J]. Bioactive Materials, 2021, 6(12): 4430-4446.
[35] YANG Nan, BALASUBRAMANI N, VENEZUELA J, et al. The Influence of Ca and Cu Additions on the Microstructure, Mechanical and Degradation Properties of Zn-Ca-Cu Alloys for Absorbable Wound Closure Device Applications[J]. Bioactive Materials, 2020, 6(5): 1436- 1451.
[36] TANG Zi-bo, NIU Jia-lin, HUANG Hua, et al. Potential Biodegradable Zn-Cu Binary Alloys Developed for Cardiovascular Implant Applications[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2017, 72: 182-191.
[37] HE Jin, LI Da-wei, HE Feng-li, et al. A Study of Degradation Behaviour and Biocompatibility of Zn-Fe Alloy Prepared by Electrodeposition[J]. Materials Science and Engineering: C, 2020, 117: 111295.
[38] LIU Xi-wei, SUN Jian-ke, ZHOU Fei-yu, et al. Micro- Alloying with Mn in Zn-Mg Alloy for Future Biodegradable Metals Application[J]. Materials & Design, 2016, 94: 95-104.
[39] SHI Zhang-zhi, YU Jing, LIU Xue-feng. Microalloyed Zn-Mn Alloys: From Extremely Brittle to Extraordinarily Ductile at Room Temperature[J]. Materials & Design, 2018, 144: 343-352.
[40] MOSTAED E, SIKORA-JASINSKA M, ARDAKANI M S, et al. Towards Revealing Key Factors in Mechanical Instability of Bioabsorbable Zn-Based Alloys for Intended Vascular Stenting[J]. Acta Biomaterialia, 2020, 105: 319- 335.
[41] LI Ping, SCHILLE C, SCHWEIZER E, et al. Mechanical Characteristics, in Vitro Degradation, Cytotoxicity, and Antibacterial Evaluation of Zn-4.0Ag Alloy as a Biodegradable Material[J]. International Journal of Molecular Sciences, 2018, 19(3): 755.
[42] PERSAUD-SHARMA D, MCGORON A. Biodegradable Magnesium Alloys: A Review of Material Development and Applications[J]. Journal of Biomimetics, Biomaterials, and Tissue Engineering, 2012, 12: 25-39.
[43] JARZĘBSKA A, BIEDA M, KAWAŁKO J, et al. A New Approach to Plastic Deformation of Biodegradable Zinc Alloy with Magnesium and Its Effect on Microstructure and Mechanical Properties[J]. Materials Letters, 2018, 211: 58-61.
[44] PACHLA W, PRZYBYSZ S, JARZĘBSKA A, et al. Structural and Mechanical Aspects of Hypoeutectic Zn-Mg Binary Alloys for Biodegradable Vascular Stent Applications[J]. Bioactive Materials, 2020, 6(1): 26-44.
[45] 贾红梅. 新型生物医用镁合金的制备与性能[M]. 北京: 中国石化出版社, 2020.
JIA Hong-mei. Preparation and Properties of a New Biomedical Magnesium alloy[M]. Beijing: China Petrochemical Press, 2020.
[46] VENEZUELA J, DARGUSCH M S. The Influence of Alloying and Fabrication Techniques on the Mechanical Properties, Biodegradability and Biocompatibility of Zinc: A Comprehensive Review[J]. Acta Biomaterialia, 2019, 87: 1-40.
[47] Standard Test Method for Conducting Potentiodynamic Polarization Resistance Measurements: ASTM G59-97 (2014)[S]. ASTM International, 2014.
[48] Standard Practice for Laboratory Immersion Corrosion Testing of Metals: ASTM G31-72(2004)[S]. ASTM International, 2004.
[49] BOWEN P K, DRELICH A, DRELICH J, et al. Rates of in Vivo (Arterial) and in Vitro Biocorrosion for Pure Magnesium[J]. Journal of Biomedical Materials Research Part A, 2015, 103(1): 341-349.
[50] YANG L, GUO P, NIU Z, et al. Influence of Mg on the Mechanical Properties and Degradation Performance of As-Extruded ZnMgCa Alloys: In Vitro and in Vivo Behavior[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2019, 95: 220-231.
[51] ZHAO Shan, SEITZ J M, EIFLER R, et al. Zn-Li Alloy after Extrusion and Drawing: Structural, Mechanical Characterization, and Biodegradation in Abdominal Aorta of Rat[J]. Materials Science and Engineering: C, 2017, 76: 301-312.
[52] 杨柯, 王青川. 生物医用金属材料[M]. 北京: 科学出版社, 2021.
YANG Ke, WANG Qing-chuan. Biomedical Metal Materials[M]. Beijing: Science Press, 2021.
[53] SU Ying-chao, COCKERILL I, WANG Ya-dong, et al. Zinc-Based Biomaterials for Regeneration and Therapy[J]. Trends in Biotechnology, 2019, 37(4): 428-441.
[54] LI Hua-fang, YANG Hong-tao, ZHENG Yu-feng, et al. Design and Characterizations of Novel Biodegradable Ternary Zn-Based Alloys with IIA Nutrient Alloying Elements Mg, Ca and Sr[J]. Materials & Design, 2015, 83: 95-102.
[55] LI Ping, DAI Jing-tao, SCHWEIZER E, et al. Response of Human Periosteal Cells to Degradation Products of Zinc and Its Alloy[J]. Materials Science and Engineering: C, 2020, 108: 110208.
[56] SU Ying-chao, WANG Kai, GAO Ju-lia, et al. Enhanced Cytocompatibility and Antibacterial Property of Zinc Phosphate Coating on Biodegradable Zinc Materials[J]. Acta Biomaterialia, 2019, 98: 174-185.
[57] MO Xiao-shan, QIAN Jun-yu, CHEN Ying-qi, et al. Corrosion and Degradation Decelerating Alendronate Embedded Zinc Phosphate Hybrid Coating on Biodegradable Zn Biomaterials[J]. Corrosion Science, 2021, 184: 109398.
[58] HERSCHKE L, LIEBERWIRTH I, WEGNER G. Zinc Phosphate as Versatile Material for Potential Biomedical Applications Part II[J]. Journal of Materials Science: Materials in Medicine, 2006, 17(1): 95-104.
Research Progress of Biodegradable Zinc Alloys for Bone Implants
1,2,1,2,2,3,2,3,1,2,1
(1. State Key Laboratory for Mechanical Behavior of Materials, Xi'an Jiaotong University, Xi'an 710049, China; 2. Shaanxi Union Research Center of University and Enterprise for Zinc-based New Materials, Xi'an 710049, China; 3. Shaanxi Zinc Industry Co., Ltd., Shaanxi Shangluo 726007, China)
Biodegradable zinc alloy is a new and promising material for human bone implants. Its degradation rate conforms to the degradation rate standard of human implants and has good mechanical properties and biocompatibility. This paper briefly introduces the development potential and application prospects of biodegradable zinc alloys as bone implant materials in terms of mechanical properties, corrosion degradation behavior and biocompatibility. The effects of the selection and addition of different alloying elements on the toughening, biodegradability and biocompatibility evaluation of biodegradable zinc alloys in recent years are emphatically reviewed. At the same time, the effect of plastic deformation process on the mechanical properties of biodegradable zinc alloy was discussed. In addition, this overview also investigates the requirements of the in vitro and in vivo degradation behavior and biocorrosion mechanism of biodegradable zinc alloys, and briefly discusses the biocompatibility of biodegradable zinc alloys from the aspects of cell response, blood compatibility, tissue immunity. The effects of various enhancement methods on biodegradable zinc alloys are clarified, and the advantages and disadvantages of various methods are analyzed and discussed. In view of the problems existing in the current preparation technology, combined with the existing research results, the future development direction of bio-zinc alloys is pointed out. The enhancement methods of bio-zinc alloys, such as alloying, changing the addition amount, deformation processing operations, and surface modification treatments, can effectively improve the comprehensive properties of pure zinc. Alloying builds binary alloys or multi-component alloys, which play a role in fine-grain strengthening of the matrix and improve strength and hardness. The selection of the addition amount combined with comprehensive tests such as in vitro and in vivo experiments and biocompatibility tests show that the appropriate addition amount can induce osteoblast differentiation without causing cytotoxicity, but excessive additions such as Li, Al, Ag may cause a series of human disease. Deformation processing processes such as extrusion, cumulative extrusion, and cold drawing are strengthened by changing grain morphology and dynamic recrystallization, and the cumulative extrusion process can significantly enhance mechanical properties. It can be seen from the degradation behavior and corrosion mechanism in vitro and in vivo that the zinc alloy has a moderate degradation rate and does not generate hydrogen gas pockets. The degradation products can act as a protective layer, which helps to improve cell adhesion and enhance antibacterial ability. The osteogenic ability, serum level, and cell survival rate of zinc alloys implanted in organisms are closely related to the release of zinc ions. The amount of zinc ions released by zinc alloys is generally within the safe threshold range and will not cause cytotoxicity. Surface modification technology can further regulate the release of zinc ions. The preparation method of ZnP coating is simple, which is an effective means to reduce the release of zinc ions and can effectively improve the biocompatibility. At present, some progress has been made in biodegradable zinc alloys in biological implants. However, the mechanical properties and biocompatibility of biodegradable zinc alloys are still the direction of efforts for a long time. In the future, based on the advantages of the existing enhancement methods of biodegradable zinc alloys, the development of new enhancement methods and in vivo dynamic simulation tests and performance evaluation methods are all important development trends in the future.
biodegradable; zinc alloy; mechanical properties; deformation processing; degradation behavior; biocompatibility
tg174;tb34
A
1001-3660(2022)10-0066-10
10.16490/j.cnki.issn.1001-3660.2022.10.008
2022–03–31;
2022–05–31
2022-03-31;
2022-05-31
国家自然科学基金(52071254、51771143);陕西省四主体一联合锌基新材料校企联合研究中心(陕科办发[2021]118号);陕西锌业有限公司委托课题(20211136)
National Natural Science Foundation of China (52071254, 51771143); Shaanxi Union Research Center of University and Enterprise for Zinc-based New Materials (Shaanxi Science and Technology Office issued [2021]118); Shaanxi Zinc Industry Co., Ltd. (20211136)
孟晓丽(1998¾),女,硕士生,主要研究方向为生物金属材料。
MENG Xiao-li (1998-), Female, Postgraduate, Research focus: biometallic materials.
马胜强(1982¾),男,博士,副教授,主要研究方向为生物可降解金属、高强韧金属耐磨材料、金属腐蚀与防护技术。
MA Sheng-qiang (1982-), Male, Ph. D., Associate professor, Research focus: biodegradable metal, high-strength and tough metal wear-resistant material, metal corrosion and protection technology.
孟晓丽, 吕萍, 崔旭东, 等. 生物可降解锌合金用于骨植入物的研究进展[J].表面技术, 2022, 51(10): 66-75.
MENG Xiao-li, LYU Ping, CUI Xu-dong, et al. Research Progress of Biodegradable Zinc Alloys for Bone Implants[J]. Surface Technology, 2022, 51(10): 66-75.
责任编辑:万长清
