致初产母猪流产的产气巴氏杆菌分离鉴定及耐药性分析
2022-11-08刘燕
刘 燕
(河南农业职业学院牧业工程学院,河南中牟 451450)
Establishment and Application of Double Nested PCR for DetectingPasteurellamultocidaandBrucellain Sheep and Goats
WU Hao-tian,Manchuriga,LIU Ang,HE Mei-rong,HOU Si-meng,LI Chong-rui,DU Li,CHEN Qiao-ling,CHEN Si,WANG Feng-yang,LI Chang,JIN Ning-yi
(1.SchoolofAnimalScienceandTechnology,HainanUniversity,KeyLaboratoryofTropicalAnimalBreedingandDiseaseResearchofHainanProvince,HaikouKeyLaboratoryofAnimalGeneticEngineering,Haikou,Hainan,570228,China;2.InstituteofMilitaryVeterinaryMedicine,AcademyofMilitaryMedicalSciences,Changchun,Jilin,130122,China)
Abstract:In order to establish accurate and rapid detection method ofPasteurellamultocidaandBrucellain sheep and goats,two pairs of internal primers and two pairs of external primers were designed according to the gene sequence ofPasteurellamultocidakmt1 and the sequence ofBrucellaBCSP31.The results showed that the method can specifically amplify thekmt1 andBCSP31,and can accurately detectPasteurellamultocidaandBrucellafrom the DNA of various tissue samples.The detection ofSalmonella,Streptococcussuis,Escherichiacoli,Staphylococcusaureus,Pseudomonasaeruginosa,Acinetobacterbaumannii,PasteurellatrehaloseandPseudomonassterniiwere all negative; the lower limit of detection for kmt1 was 70.9 copies/μL,the lower limit of detection for BCSP31 was 89.5 copies/μL; the coincidence rate of detecting samples form infected animals is 100%.The results showed that the method established in this experiment has good sensitivity,specificity and adaptability,and can be used for animal quarantine or disease diagnosis.
Keywords:Pasteurellamultocida;Brucella; nested PCR
近年来,随着我国畜牧经济的迅速发展,猪养殖数量呈现逐年增多的趋势,猪养殖模式已规模化、集约化。在猪养殖过程中,母猪是养猪场的主要后备力量,母猪的胎次及产胎数直接影响着经济效益[1-2]。在临床上,母猪流产是常见的疾病之一,该病严重降低了母猪繁殖性能和终身繁殖能力,直接降低养殖场经济效益,给养猪业造成严重的经济损失[3-4]。相关研究表明,引起母猪流产、死胎的因素很多,传染性因素主要包括病毒性疾病如猪瘟病毒(Classical swine fever virus,CSFV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、猪伪狂犬病病毒(Porcine pseudorabies virus,PRV)、猪细小病毒(Porcine parvovirus,PPV)、猪圆环病毒2型(Porcine circovirus type 2,PCV-2)、日本脑炎病毒(Japanese encephalitis virus,JEV)等病原感染,细菌性疾病(布鲁氏菌、葡萄球菌、衣原体)感染及寄生虫病(弓形虫)等,非传染性因素主要与子宫内膜炎、阴道炎等生道疾病及饲养管理有关,临床中以传染性因素较为多见[5-7]。因此,对母猪流产性疾病的防控具有重要的意义。
产气巴氏杆菌(Pasteurellaaerogenes)是巴氏杆菌科巴氏杆菌属的一种革兰氏阴性菌,该菌因在生长过程中具有氧化酶和尿素酶阳性、分解多种糖类产气等生化特性而命名,该菌可以感染多种动物和人,引起流产和死胎[8-10]。产气巴氏杆菌于1974年由美国学者从病猪的肾脏、肠和鼻道中首次分离,随后英国、瑞士、德国等多个国家和地区分离到该菌,该菌在许多国家流行与分布[11-12]。国内关于母猪流产性产气巴氏杆菌报道的较少。本研究以从郑州地区不同养殖场采集初产母猪流产分泌物及胎儿等病料组织139份进行产气巴氏杆菌分离鉴定,并对分离菌株进行致病性和耐药性研究,为致初产母猪流产产气巴氏杆菌的流行病学调查及防控提供参考依据。
1 材料与方法
1.1 材料
1.1.1 病料来源 2019年-2021年,郑州地区不同养殖场初产母猪出现了流产、死胎等现象,尤其以妊娠11周~14周流产为主,其发病率在8%~11%之间,采集初产母猪流产分泌物及胎儿等病料组织139份,并进行病原检测。
1.1.2 主要试剂 普通营养琼脂培养基、麦康凯培养基、普通营养肉汤、革兰氏染色液试剂盒,均购自北京双旋微生物培养基制备科技公司;药物纸片,购自杭州天和微生物制剂有限公司;32E肠杆科菌生化鉴定试纸条,购自法国生物梅里埃公司;Marker DL 2000购于中科瑞泰生物科技有限公司;2×TaqMarker Mix,购于宝生物工程(大连)有限公司;组织、细菌DNA提取试剂盒、组织RNA提取试剂盒、胶回收试剂盒,均购自北京天根生物科技公司;7%脱纤维绵羊血培养基由本实验自制。
1.1.3 主要仪器 小型高速离心机(MC-15型)、多功能PCR仪(TC-312型)、凝胶成像仪(ZF-288型),ThermoFisher公司产品;全自动细菌生化鉴定系统(VITEK 2 COMPACT 30型),法国梅里埃公司产品;双人超净工作台(BBS-H1500型),博科(BIOBASE)公司产品;恒温培养箱(SPX-80B型),芜湖华测仪器设备有限公司产品。
1.1.4 实验动物 22 g~25 g的昆明系妊娠小白鼠,购自河南农业大学动物科学院实验动物中心,由本单位动物传染病实验饲养。
1.2 方法
1.2.1 病毒性病原检测 参考文献[13]报道的检测CSFV、 PRRSV、PRV、PPV、PCV-2、JEV引物,按照试剂盒说明提取病料组织中RNA 和DNA,采用RT-PCR/PCR检测其病原。
1.2.2 细菌分离培养 将采集的初产母猪流产分泌物及胎儿等病料组织,无菌条件下接种于7%绵羊血平板上37℃恒温培养12 h~24 h,挑取典型菌落三区划线接种于麦康凯培养基,37℃培养12 h~18 h,挑取单个菌落,接种于普通营养肉汤中37℃恒温培养振荡纯化培养后,取纯化培养菌株进行革兰氏染色镜检。
1.2.3 分离菌生化试验鉴定 参照32E肠杆科菌生化鉴定试纸条说明书,将纯化培养的分离菌株接种于32E肠杆科菌生化鉴定试纸条,阳性37℃培养12~24 h后,并观察试验结果,同时进行氧化酶和尿素酶试验。
1.2.4 分离菌的PCR鉴定 根据GenBank中细菌16S rDNA基因序列,设计扩增细菌的16S rDNA的通用引物,F:5′-CGCTATTTACCCAGTG-3′,R:5′-CGTTGAACACGAAGA-3′,目的基因1 500 bp,引物由上海生工生物工程股份有限公司合成。提取细菌基因组DNA,进行PCR检测,PCR产物送上海生工生物工程股份有限公司进行基因测序,其测序结果用NCBI中的BLAST进行同源性比对分析,判定标准:同源性百分比≥97%进行判定,选择代表株构建系统进化树。
1.2.5 人工感染致病性试验 参考文献[14],将分离菌株培养至对数期后菌落计数,每1株菌阴道注射5只小白鼠,剂量为0.2 mL(108CFU/mL),对照组接种等量的无菌PBS,接种12 h后观察6 d,记录发病及死亡情况。
1.2.6 药敏试验检测 参照药物纸片进行操作,根据美国美国临床实验室标准化协会(CLSI)推荐(2020年)的标准进行试验结果判断,统计耐药性及多重耐药性。
2 结果
2.1 病毒性病原检测结果
提取病料分泌物、胎儿等病料组织DNA和RNA,用CSFV、 PRRSV、PRV、PPV、PCV-2、JEV特异性引物进行RT-PCR/PCR检测,结果显示,PRRSV、PRV、PPV、PCV-2、JEV检测均为阴性。
2.2 细菌分离培养结果
分离得到了94株病原菌,其培养特性和形态学与与《伯杰细菌鉴定手册》中产气巴氏杆菌培养特性基本一致。疑似产气巴氏杆菌在 7% 绵羊血平板上生长湿润的、边缘整齐的、光滑的不溶血的单个菌落,菌落直径约在 0.8 mm~1 mm 之间,在麦康凯培养基上长出边缘整齐的、半透明、菌落直径约在 0.8 mm~1 mm之间,桃红色的菌落;革兰氏染色镜检可见镜检可见分离菌株阴性,呈现两端钝圆的短杆菌,呈现单个或成对排列的菌落(图1)。
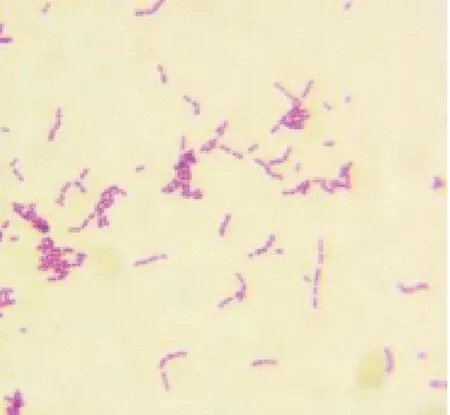
图1 分离菌株的形态学观察(40×)
2.3 细菌生化检测结果
分离的菌株均分解半乳糖、葡萄糖、蔗糖、甘露糖、鼠李糖、甘露醇、麦芽糖并产气,触酶反应为阳性、V-P试验为阴性、H2S试验、动力试验为阴性,氧化酶反应试验阴性、过氧化氢酶试验阳性。与《伯杰细菌鉴定手册》中的产气巴氏杆菌生化特性基本上一致,结果显示,分离的94株病原菌初步鉴定为产气巴氏杆。
2.4 细菌的PCR鉴定结果
分离培养结果和生化试验结果初步鉴定为94株产气巴氏杆菌,提取其基因组DNA,用细菌通用引物16S rDNA基因序列进行PCR鉴定,结果显示,分离的94株均扩增出1 500 bp大小的目的基因条带,与预期相符(图2)。其测序结果与GenBank中登录的17株产气巴氏杆菌参考株基因序列同源性在97.9%~99.9%之间,分离菌株与15株产气巴氏杆菌参考株聚为一支,亲缘关系最近,与其他参考菌株位于不同的分支,亲缘关系较远,参照判定标准,分离菌株可以判定为产气巴氏杆菌。

M.DNA标准DL 2 000;1~8.分离菌株;9.空白对照
2.5 人工感染致病性试验结果
攻毒组小白鼠在攻毒后的2 d~3 d,出现采食量减少、精神沉郁、流产等等不同程度发病状态,个别小白鼠未表现任何症状就出现急性死亡。剖检死亡的小鼠出现腹腔积液、胎儿死亡,子宫、肝脏、脾脏等器官出现不同程度的出血,从死亡的小白鼠体内再次分离到产气巴氏杆菌,直到试验结束,对照组小鼠健康存活。通过统计68株分离株能引起小鼠死亡,为致病性菌株,小鼠死亡率在40%~100%之间。
2.6 药敏试验结果
对68株致病性产气巴氏杆菌进行药敏试验,并分析其耐药性。结果由表1可知,68株致病性产气巴氏杆菌对链霉素、阿莫西林、新霉素、庆大霉素、氨苄西林、红霉素、磺胺间甲氧嘧啶、氟苯尼考、替米考星、多西环素等10种药物的耐药率在33.8%~95.6%之间,头孢噻呋、头孢噻肟、头孢曲松、恩诺沙星、环丙沙星、洛美沙星、大观霉素、林可霉素等8种药物的耐药率在7.4%~30.9%之间。

表1 耐药性试验结果
由表2可知,临床中分离的对68株致病性产气巴氏杆菌呈现多重耐药性,耐 14、5种药物各有2株、耐13、4种药物各有3株,耐12种药物有5株,耐11种药物有8株,耐7种药物的有6株,耐6种药物有4株,耐10、9、8种药物的分离菌株最多,分别占分离菌株的16.2%、17.6%和19.1%。
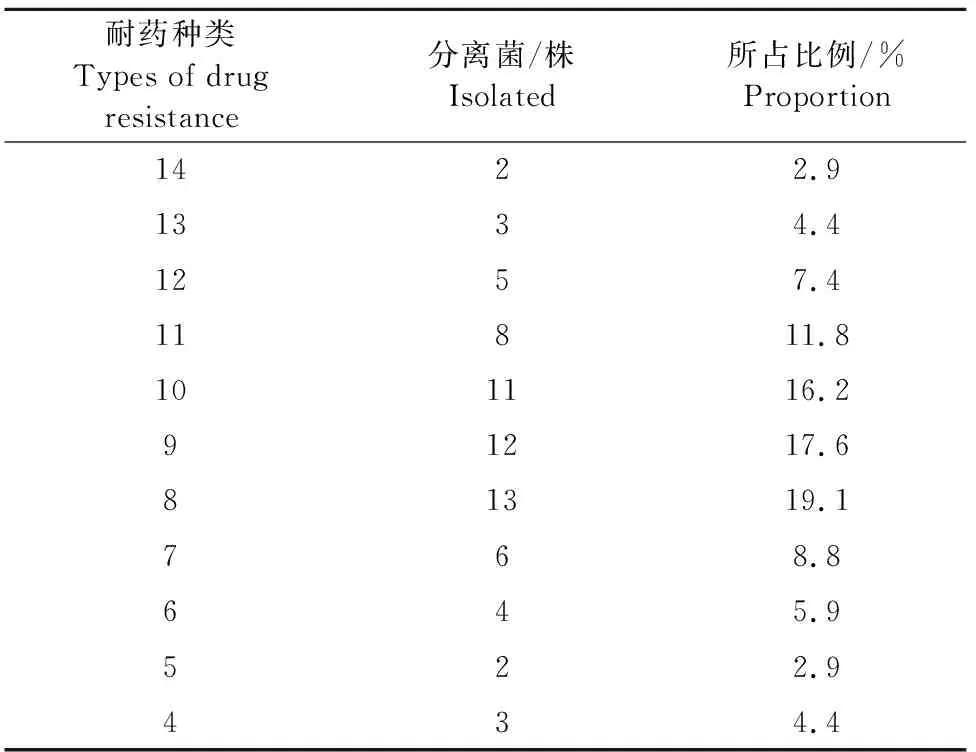
表2 多重耐药性检测结果
3 讨论
母猪流产、死胎等繁殖障碍是临床中常见的疾病之一,母猪在妊娠期间免疫力较低,外界病原微生物通过泌尿生殖道进入体内并引起感染,进而引起流产、死胎等疾病,临床中母猪感染相关疾病是造成其流产的原因之一,还与饲养管理相关[3-4]。近几年,关于流产、死胎等繁殖障碍性疾病报道逐渐增多。相关研究表明,临床中母猪流产、死胎等繁殖障碍以病毒性和细菌性疾病混合感染较为常见[15]。本试验研究表明,郑州地区不同养殖场采集的初产母猪流产分泌物及胎儿等病料组织139份中,CSFV、PRRSV、PRV、PPV、 PCV-2、JEV等5种引起母猪流产病毒性病原检测为阴性,分离得到68株致病性产气巴氏杆菌,说明产气巴氏杆菌是引起这些养殖场初产母猪流产的主要病原之一。李富祥等2014年报道云南省规模化种猪场流产病例中分离到尿素酶阴性产气巴氏杆菌[8]。陈胜男等[16]报道从广东某猪场中流产的病例中分离得到产气巴氏杆菌。说明该菌在我国猪场中流行,其来源有待研究。产气巴氏杆菌引起母猪流产的致病机理尚未明确,有待进一步研究,该菌可能对猪养殖业存在潜在威胁,应该引起重视,注意该病的防控。产气巴氏杆菌存在于养殖环境中,尤其妊娠时期母猪的机体免疫力下降时,该菌可以通过泌尿生殖道或者通过其他途径入侵宿主,在体内定植与繁殖,通过血液循环引起菌、毒血症,同时在毒素作用下可以促进炎性因子的释放,同时导致子宫异常收缩,从而导致妊娠母猪的死胎、流产。
临床中防治细菌性疾病主要依靠抗生素,随着抗生素的使用细菌的耐药性不断增强,治疗效果下降,因此,应该根据药敏试验结果合理使用抗菌药物,提高治疗效果。本试验研究表明,68株致病性产气巴氏杆菌对临床中常用的10种药物的耐药率在33.8%以上,且呈现多重耐药性。本试验结果与李富祥等[8]、陈胜男等[16]的报道存在一定差异性,可能与地区及抗菌药物使用频率及宿主自身有关。本研究为初产母猪流产产气巴氏杆菌的防控提供了研究基础。
