铁死亡发生机制及其在雄性动物生殖中的研究进展
2022-11-08赵源杰郑浩懿甘雅婷
赵源杰,秦 歌,郑浩懿,王 静,甘雅婷,彭 辉,2*
(1.福建农林大学动物科学学院(蜂学学院),福建福州 350000;2.海南大学动物科技学院,海南海口 570228)
细胞是生物体结构和功能的基本单位,细胞死亡是细胞生命周期中重要的一环,标志着细胞生命的终结。细胞死亡形式分为两大类,一类是细胞意外损伤死亡;另一类是程序性死亡,常见的有凋亡、程序性坏死、细胞自噬和焦亡等。细胞铁死亡(ferroptosis)是一种新型、铁依赖性的、由活性氧(reactive oxygen species,ROS)调控的细胞程序性死亡,其由多种基因调控,并参与了众多机体生理机能及病理过程的调节。种公畜繁殖力低,精子质量差原因复杂,研究发现多种可调控细胞铁死亡的蛋白及酶类在精子发生及精液液化等过程中发挥作用,并对精液质量造成影响。本文主要针对铁死亡的机制及多种关键蛋白在雄性生殖中起作用的方式进行论述。
1 铁死亡的发现
2003年,Dolma S等[1]发现了一种新的化合物erastin可以通过非凋亡形式选择性杀死工程瘤细胞。随后Yang W等[2]发现这种细胞死亡形式可以被铁螯合剂抑制,同时化合物RSL3也可导致相同特征的细胞死亡。Dixon S J[3]在2012年发现erastin可以抑制胱氨酸向细胞内转入,导致细胞合成谷胱甘肽原料减少、谷胱甘肽过氧化物酶4(glutathione peroxidase4,GPX4)失活而引起细胞死亡,并首次将这种细胞新型死亡形式正式命名为铁死亡。2018年,细胞死亡委员会建议将铁死亡定义为调节性细胞死亡(regulated cell death,RCD)的一种。
细胞铁死亡是由多种基因调控的细胞死亡过程,参与了很多机体生理过程的调节。研究发现铁死亡在缺血性脑卒中、退行性疾病(阿尔兹海默氏症、帕金森病)和脑出血等疾病中均有一定作用。铁死亡调节过程由多种通路介导,如铁代谢、System Xc-、脂质代谢和线粒体VDAC等,通常伴随着过量的铁离子和ROS积累、铁离子和过氧化氢结合从而影响机体微环境进而导致细胞死亡。铁死亡的主要表现为线粒体体积减小、膜密度增高、膜电位升高、线粒体嵴缩小或消失,而细胞质膜不破裂,细胞核大小不变[4]。
2 铁死亡的发生机制
铁死亡作为一种新型、不同于凋亡和坏死的细胞程序性死亡形式,其与缺血性脑卒中、动脉粥样硬化及肾病等多种疾病密切相关,并作为治疗肿瘤的靶点受到广泛关注,其主要发生机制如图1所示。
2.1 铁代谢
铁是动物体内最重要的金属元素之一,因其是过渡金属,容易得失电子参与氧化还原反应,所以铁与动物机体代谢有密不可分的关系。铁氧化还原的动态变化会增强细胞对铁死亡的敏感性。机体内铁含量过少可能会导致铁缺乏,损害机体含铁蛋白质的合成;铁过量则可能会发生铁超载、催化过氧化反应而导致细胞内积累过量的ROS,从而促使DNA和mtDNA损伤。
转铁蛋白(transferrin,TF)是一种血清糖蛋白,是铁死亡关键蛋白之一,一般与转铁蛋白受体(transferrin receptor,TfR)结合发挥作用[5]。TF向细胞内转运铁离子以供应细胞生长,在细胞分化中也起一定作用。TfR对铁离子有很高的亲和力,其第一种受体TfR1以同源二聚体的形式在细胞膜中选择性表达[6];第二种受体TfR2分为全长(α)和较短(β)型两种,α型在肝细胞和红细胞前体细胞中选择性表达,β型主要在多种细胞的胞质中低水平表达。TfR1与TfR2-α型两种受体可以有效地将与TF结合的铁离子转运到细胞中[7]。TF参与细胞内铁代谢的途径如下:二价铁离子在细胞中被铜蓝蛋白氧化为三价铁离子,Fe3+与脱铁转铁蛋白(apo-transferrin,ATF)结合为TF-Fe3+,接着铁负载转铁蛋白(holo-TF,TF-Fe3+·hTF)与TfR1结合为复合物后被细胞内吞进入细胞核内体。在细胞核内体中,Fe3+被前列腺6次跨膜上皮抗原3(six transmembrane epithelial antigen of prostate 3,STEAP3)还原为Fe2+。在酸性条件下,铁离子与TF分离并进入细胞,之后被储存在不稳定铁池和铁蛋白(ferritin)中。整个过程由亚铁离子膜转运蛋白1(ferrous ion membrane transport protein,DMT1)或锌铁蛋白家族8/14(solute carrier family 39 (metal ion transporter),member 8/14,ZIP8/14)介导[8]。研究证明TfR过表达会提高细胞内铁离子水平,而沉默TfR则可以保护细胞避免发生铁死亡[5]。一些蛋白也可通过调节TF及TFR的表达影响细胞内铁离子浓度进而抑制铁死亡,例如热休克蛋白B1(heat shock protein family B (small) member 1,HSPB1)可以抑制TfR1的表达,降低细胞内铁离子浓度,过表达HSPB1则可以显著抑制铁死亡[9]。
膜铁转运蛋白(ferroportin,FPN)是由SLC40A1基因编码的铁离子调节转运体蛋白,主要作用是进行铁离子的代谢。在机体内FPN控制铁的释放并能避免铁离子诱发ROS形成,在铁死亡敏感的细胞中,FPN表达会减少。抑制铁代谢的主要转录因子铁反应元件结合蛋白2(iron responsive element binding protein 2,IREB2)的表达可显著增加铁蛋白轻链(ferritin light chain,FTL)和铁蛋白重链(ferritin heavy chain 1,FTH1)的表达,从而抑制erastin诱导的铁死亡[10]。上述参与铁离子调节基因的转录可影响机体内铁离子丰度及细胞对铁死亡的敏感度。
2.2 SystemXc--GSH-GPX4
SystemXc-是一种广泛分布于磷脂双层膜中的氨基酸反转运蛋白,由轻链亚基溶质载体家族7成员11(solute carrier family 7A11,SLC7A11)和重链亚基溶质转运蛋白(solute carrier family 3 member 2,SLC3A2)两个亚基组成,其主要介导谷胱甘肽(glutathione,GSH)的合成,是机体中抗氧化系统中至关重要的一部分。GSH是铁死亡的负调节器,也是细胞内重要的抗氧化剂。谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)是谷胱甘肽过氧化物酶(glutathione peroxidase,GPXs)家族的众多成员之一,能减少膜中过氧化磷脂醇(PLOOH)含量并抑制微粒体脂质过氧化[11]。GPX4可以将GSH转化为氧化型谷胱甘肽(glutathione,GSSG),并清除细胞脂质过氧化物(L-OOH)的毒性,将其还原为相应的醇(L-OH)[12]。正常状态下细胞中胱氨酸(cystine)和谷氨酸(glutamic acid)以1:1的比例交换进出,并在细胞中被还原为半胱氨酸(cysteine)参与GSH的合成。抑制System Xc-活性会降低胱氨酸的吸收,影响GSH的合成从而导致GPXs活性下降,进而造成细胞抗氧化能力下降和脂质ROS积累,最终导致细胞氧化损伤和铁死亡[13]。
肿瘤抑制基因p53在铁死亡中扮演着重要角色。研究发现沉默p53后细胞经ROS刺激不发生变化,但p53基因激活后有90%的细胞发生铁死亡,证明了p53基因能够诱导铁死亡。进一步研究表明p53基因可下调System Xc-亚基之一SLC7A11的表达,从而影响GPX4的活性,导致细胞抗氧化能力降低、ROS积累继而导致细胞死亡[14-15]。然而另有研究显示p53能通过抑制二肽基肽酶-4(dipeptidyl peptidase 4,DPP4)活性或诱导p21的表达来抑制erastin诱导的铁死亡[16]。以上研究结果表明,p53基因可以双向调控铁死亡,但具体机制仍未明晰。
2.3 脂质代谢
脂质代谢影响细胞对铁死亡的敏感度及细胞发生铁死亡的程度。多不饱和脂肪酸(polyunsaturated fatty acid,PUFAs)含有双烯丙基氢原子,对脂质过氧化反应敏感,是铁死亡发生过程中关键的一环[17]。单不饱和脂肪酸(monounsaturated fatty acid,MUFA)在铁死亡中与PUFAs发挥着截然不同的作用。诸如花生四烯酸等PUFAs,是铁死亡中脂质过氧化的关键底物;而MUFA则在结构上抗脂质过氧化,可抑制铁死亡[18-19]。
磷脂含量也影响铁死亡的发生。长链酰基辅酶A合成酶家族成员4(acyl-CoA synthetase long chain family member 4,ACSL4)和溶血卵磷脂酰基转移酶3(lysophosphatidylcholine acyltransferase 3,LPCAT3)可将PUFAs结合到细胞膜磷脂中,促进细胞铁死亡。研究表明ACSL4是一种重要的促铁死亡基因,缺乏ACSL4使细胞内的脂质代谢平衡被打破,敲除参与磷脂合成基因LPCAT3时,脂质代谢的原料减少,这两种基因的缺乏均使细胞对于铁死亡的抗性增加[20-21];硬脂酰辅酶A去饱和酶(stearoyl-CoA desaturase,SCD)和长链酰基辅酶A合成酶家族成员3(acyl-CoA synthetase long chain family member 3,ACSL3)可介导MUFA的生成或激活,取代PUFAs抑制铁死亡的发生[22]。脂氧合酶(LOXs)是一种非血红素、含铁的酶促蛋白效应物,能够介导铁死亡中的过氧化。LOXs比起含有磷脂的多不饱和脂肪酸更易结合游离的不饱和脂肪酸。LOXs可将经LPCAT3酰化的磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)氧化为有毒性的脂质氢过氧化物,敲除LOXs可以减轻erastin诱导的铁死亡损伤[23]。维生素家族和黄酮类制剂等也被证实可以抑制脂氧合酶活性进而作为铁死亡的抑制剂。以上研究表明ACSL4、LPCAT3和LOXs均可导致脂质过氧化物积累,促进铁死亡的发生。
2.4 线粒体电压依赖性通道
线粒体是真核细胞中最重要的细胞器之一,由两层膜包被,是细胞进行有氧呼吸的主要场所。线粒体电压依赖性通道(voltage dependent anion-selective channel,VDAC)是转运离子和代谢物的跨膜通道,在铁死亡过程中起重要调控作用。哺乳动物VDAC家族由3个同源基因组成(VDAC1、2、3),经研究发现铁死亡诱导剂erastin作用于VDAC2和VDAC3,致使线粒体功能障碍进而导致大量氧化物释放,最终引发铁死亡。研究发现线粒体内膜的二氢乳清酸脱氢酶(dihydroorotate dehydrogenase,DHODH)可通过调控线粒体内膜中的CoQH2生成进而在线粒体中抵抗铁死亡发生[24],还有研究发现线粒体或可通过三羧酸(tricarboxylic acid,TCA)循环调控铁死亡[25]。这些研究表明线粒体调控铁死亡的方式不仅通过VDAC,还存在其它调控方式,更多调控铁死亡的分子机制仍有待研究。
2.5 自噬
细胞自噬命名于1963年,其作用机制是通过溶酶体清除细胞内受损的细胞器及失去功能的蛋白质,以维持细胞内的稳态,促进细胞的新陈代谢及自我更新。研究表明多种选择性自噬机制能促进铁死亡的发生发展,如铁自噬(ferritinophagy)、脂噬(lipophagy)和伴侣蛋白介导的自噬(chaperonemediated autophagy,CMA)等。铁自噬可通过调节细胞内铁离子的丰度进而调控细胞对铁死亡的敏感性。特定核受体共激活因子4(nuclear receptor coactivator 4,NCOA4)可介导铁蛋白自噬,研究发现在HT1080及MEFs细胞中均可通过抑制溶酶体的功能阻断erastin诱导的铁死亡。NCOA4通过与微管相关蛋白1-轻链3-磷脂酰乙醇胺(LC3-PE)及FTH1结合,将含铁离子的铁蛋白复合物隔离于自噬体中。自噬体成熟后与溶酶体结合,NCOA4及铁蛋白均被降解并释放游离铁[26]。适量的游离铁参与血红蛋白合成等生物过程,但过量游离铁则会促进细胞发生铁死亡。
脂噬则可通过自噬性降解细胞内的脂滴诱导脂质释放,进而发生脂质过氧化促进铁死亡发生。该过程由自噬相关蛋白5(autophagy related 5,ATG5)及Ras癌基因家族成员RAB7A参与。然而,肿瘤蛋白D52(tumor protein D52,TPD52)可增加脂质存储减轻铁死亡中的脂质过氧化[27]。因此,脂噬中脂质的合成,储存和降解间的动态平衡参与调控铁死亡。
自噬也可通过SLC7A11促进铁死亡。腺苷酸激活蛋白激酶(adenosine 5'-monophosphate (AMP)-activated protein kinase,AMPK)是维持自噬和细胞稳态的传感器,可促进苄氯素1(beclin 1,BECN1)磷酸化,进而形成BECN1-SLC7A11复合物,发生脂质过氧化促进铁死亡[28]。综上所述,更多自噬调节铁死亡的机制还有待进一步深入研究。
2.6 其他调控通路
铁死亡也受转硫信号通路的影响。转硫信号通路在氧化应激条件下,蛋氨酸转化为胱氨酸后合成GSH发挥其抗氧化作用,进而减轻氧化应激引发的铁死亡[29]。甲羟戊酸由3-羟基-3-甲基戊二酰辅酶A(3-hydroxy-3-methylglutaryl-CoA reductase,HMGCR)合成,其合成过程同时也是硒蛋白合成的重要途径。甲羟戊酸途径可以分解代谢为胆固醇及固醇类的前体物质焦磷酸盐,同时也可以转化成异戊烯焦磷酸(isopentenyl pyrophosphate,IPP),用于蛋白质的翻译后修饰。IPP是硒代半胱氨酸tRNA成熟及合成具有活性的GPX4必不可少的信号通路[30],因此,甲硫氨酸途径在铁死亡中也起一定调控作用。
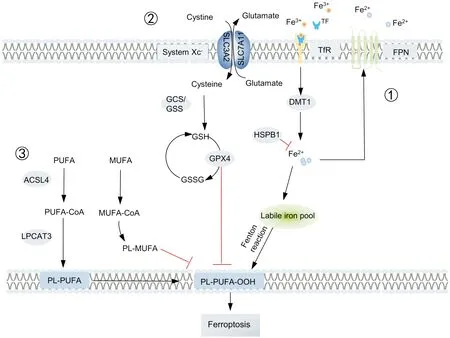
①:铁代谢调控;②:System Xc--GSH-GPX4调控;③:脂质代谢调控①:Regulation of iron metabolism; ②:Regulation of SystemXc--GSH-GPX4;③:Regulation of lipid metabolism
3 铁死亡关键蛋白及通路在雄性动物生殖中的作用
3.1 GPX4在雄性动物生殖中的作用
精液中的氧化应激可能会导致雄性不育。研究发现ROS的增加会影响精液成分,并导致精子脂质、蛋白质和DNA的改变,进而造成精子损伤[31]。铁死亡的关键调控因子GPX4在雄性不育中起重要作用。GPX4在睾丸中显著表达并在晚期精母细胞和精子细胞中大量分布,其定位于精子中段,尤其是在线粒体中。实验敲除GPX4后,附睾中畸形精子增多,输精管中各个阶段的精子数量均减少,受精后影响早期胚胎发育,表明GPX4可保持精子活力,维持雄性动物繁殖力。饲料中常通过添加硒提高种公畜精液质量,保障动物生殖机能。在动物体内硒常以硒蛋白形式存在,GPX4为精子中最重要的硒蛋白,其代谢水平的变动对公畜繁殖力的维持起着关键性作用。此外,GPX4能清除细胞内L-OOH的活性,是铁死亡中的关键调节蛋白之一,提示铁死亡也会对雄性动物繁殖力造成影响,但具体机制仍有待探究。
3.2 铁代谢在雄性动物生殖中的作用
铁离子在核酸及蛋白质的合成、细胞呼吸和增殖分化等过程中均扮演重要角色,影响雄性哺乳动物生殖的蛋白激酶C-β(protein kinase C beta,PKC-β)及抗酒石酸酸性磷酸酶5(tartrate-resistant acid phosphatase 5,TRACP5)基因的表达直接受铁离子调控。PKC-β在人类精液中能够检测到并参与鞭毛运动;TRACP5在精液中大量存在并证实与精液液化有关,同时其含量增加也与多种男性疾病如前列腺癌有关[32]。
精浆是精液中富含蛋白质的液体部分,在精子代谢和精子功能调节中起着重要作用。精浆中80%的TF由睾丸支持细胞分泌,参与将铁离子运输进入精母细胞的过程。精浆TF水平与精子日产量密切相关,也与精子浓度和运动特性呈正相关。精浆TF浓度是观察支持细胞功能、评价曲精小管生精能力的一个特异指标,TF水平下降提示可能出现了支持细胞功能异常或曲细精管生精功能障碍。TF表达也会对精子质量产生影响。实验发现若由于环境或遗传等因素TF无法调节机体内铁含量进而导致机体内铁积累,则会对精子发生造成负面影响。在人体,梗阻性无精症患者的精浆TF水平比健康的男性个体相比更低。同时有研究发现TF也可用于标记辅助选择(marker-assisted selection,MAS)来筛选高质量精子性状公牛群[33]。
铁代谢参与调节精子代谢过程及一些雄性生殖系统疾病,TF作为机体铁代谢的重要组成部分,是评价曲精细管生精能力的指标。上述结果提示精子发生过程中铁代谢途径很可能影响雄性动物的生殖能力。
3.3 线粒体VDAC在雄性动物生殖中的作用
VDAC是一种跨线粒体外膜的多功能通道蛋白,可在精子发生、获能和顶体反应中发挥作用,VDAC1主要存在于支持细胞中,VDAC2和VDAC3存在于生殖细胞中。VDAC2可通过调节线粒体膜通透性参与细胞凋亡和能量代谢,进而影响精子活力及浓度[34]。在对牛精子的研究中也表明VDAC能通过调节精子鞭毛中ATP的水平参与精子运动的调节[35]。各种迹象提示VDAC调控精子活力及精子质量还有很多未被发现的方式,仍需进一步探索。
4 展望
种公畜繁殖力及生殖健康一直是困扰畜牧业工作者的问题之一,之前大多将其与精子凋亡及自噬联系在一起。研究表明GPX4及铁代谢途径等在铁死亡中起关键调节作用的因素也参与精子发生等重要生理过程,提示铁死亡也会参与雄性生殖机能的调控,而铁死亡是否可以作为新的靶点治疗公畜精子密度低、活力差及精子畸形等问题还有待进一步研究。虽然已有大量研究揭示铁死亡发生的机制,但铁死亡在畜禽生殖中的作用机制还鲜有报道。随着进一步深入研究铁死亡在哺乳动物生殖中的作用机制,不仅能丰富和拓展铁死亡的研究思路,也能为揭示雄性动物精子发生过程以及提高公畜繁殖力提供参考和借鉴。