脂联素预处理对高糖诱导下HRMECs细胞损伤的保护
2022-11-08姚国敏王小娣
姚国敏,李 蓉,邓 颖,王小娣,张 勇
(西安医学院第一附属医院眼科,西安 710077;*通讯作者,E-mail:rechelrong198222@163.com)
糖尿病视网膜病变(diabetic retinopathy,DR)是一种最常见的对视力危害极大的糖尿病并发症,严重可致盲,在全球工作年龄人群致盲眼病中居首位[1,2]。DR属于视网膜血管性疾病,其损伤视网膜微血管系统,破坏血-视网膜屏障,出现渗出,发生黄斑水肿,视力下降,病情进一步发展出现新生血管,新生血管的生长会扭曲视网膜的微血管系统,导致视网膜脱离,最终导致失明[3]。DR的发病机制复杂不明,同时针对DR的控制也无特效方法。
近几年研究发现,脂联素(adiponectin,APN)与血管生成关系密切。APN是一种由脂肪细胞分泌的蛋白质,是唯一一个对人体起保护作用的脂肪因子[4],在糖尿病等多种代谢性疾病中发挥有益作用[5],并在视网膜的血管性损伤中发挥保护作用[6]。但APN对各种代谢性疾病保护的具体机制目前未完全阐明。本课题组前期研究显示APN对体外培养恒河猴脉络膜视网膜血管内皮细胞(RF/6A)有一定影响[7-10],并发现APN可以降低细胞在高糖及缺氧环境下的凋亡、自噬水平,减轻缺氧环境下的氧化应激,促进细胞存活和增殖。由于RF/6A与人类细胞不同源造成的基因差异,本次实验改用人视网膜微血管内皮细胞(HRMECs)作为研究对象,采用APN预处理后检测增殖率、凋亡率、凋亡相关蛋白量等指标,分析APN对高糖下HRMECs的影响。
1 材料和方法
1.1 实验试剂和仪器
HRMECs购自中国上海中乔新舟生物科技公司;APN购自中国南京金斯瑞生物科技公司;M199培养基、0.25%胰酶购自中国武汉普诺赛(Procell)生命科技有限公司;胎牛血清购自中国上海依科赛(Excell Bio)生物科技有限公司;青霉素、链霉素购自中国上海阿拉丁(Aladdin)生化科技股份有限公司;封闭液中NaCl、冰醋酸、吐温20购自中国国药集团化学试剂有限公司;封闭液中Tris-base购自德国Biofroxx公司;PVDF膜(0.45 μm)购自德国Millipore公司;AE-CK-A362型CCK-8增殖检测试剂盒、E-CK-A211型细胞凋亡试剂盒购自中国武汉伊莱瑞特(Elabscience)生物科技股份有限公司;RIPA裂解液、BCA蛋白浓度测定试剂盒购自中国碧云天生物技术公司;50599-2-Ig号兔多抗Bax、12789-1-AP号兔多抗Bcl-2以及19677-1-AP号兔多抗Caspase-3购自中国武汉三鹰生物技术公司;Multiskan MK3型全自动酶标仪购自美国Thermo scientific;MCO-15AC型CO2恒温培养箱购自日本SANYO;CytoFLEX型流式细胞仪购自美国BECKMAN。
1.2 细胞传代培养
HRMECs解冻后转移入离心管中,加入完全培养基,室温1 000 r/min离心5 min后收集细胞,用完全培养基(89% M199+10%胎牛血清+1%青霉素/链霉素)制成细胞悬液,接种至10 cm培养皿中,在37 ℃恒温、体积分数5% CO2细胞培养箱中培养。细胞覆盖率达到80%时,按1 ∶3的比例传代及扩大培养。
1.3 细胞分组及处理
根据实验目的随机将HRMECs分为3组:对照组、高糖组、高糖+APN组。对照组:DMEM培养基培养,无干预;高糖组:在DMEM培养基内加入25 mmol/L D-葡萄糖,制备成高糖培养基进行培养;高糖+APN组:细胞先用10 μg/ml APN预处理2 h(预处理同时段,对照组与高糖组均在DMEM培养基中正常培养),然后用高糖培养基培养。所有细胞均在饱和湿度、37 ℃恒温、体积分数为5% CO2的培养箱中培养24 h。
1.4 流式细胞术检测HRMECs凋亡率
细胞经不含EDTA的0.25%胰酶消化后收集;PBS清洗2次,1 500 r/min,5 min;检测按照凋亡试剂盒说明进行:加入500 μl缓冲液,使细胞悬浮;加入5 μl Annexin Ⅴ-FITC混匀,再加入5 μl PI混匀,同时设阴性对照(正常细胞不加Annexin和PI),阳性对照1(以凋亡效果最明显的溶剂组作为阳性对照,只加5 μl Annexin Ⅴ-FITC单标)以及阳性对照2(以凋亡效果最明显的溶剂组作为阳性对照,只加5 μl PI单标),室温避光染色15 min;上机检测。
1.5 Western blot检测HRMECs凋亡过程中Bax、Bcl-2以及Caspase-3的蛋白表达水平
各组细胞处理完成后并收集,PBS预冷至4 ℃,用其洗涤细胞3次,置细胞于冰上,用RIPA裂解液(含蛋白酶抑制剂)裂解30 min,12 000 r/min离心5 min,取上清,按照BCA法测定蛋白含量。蛋白变性,制备电泳胶,取40 μg等量蛋白上样。电泳分离,转膜,将PVDF膜浸泡于封闭液(含5%脱脂奶粉)中,室温摇床封闭2 h。用封闭液稀释一抗(Bax 1 ∶8 000、Bcl-2 1 ∶2 000、Caspase-3 1 ∶1 000),PVDF膜与相应的一抗4 ℃孵育过夜,再用封闭液充分洗涤5次去除多余的一抗,随后将PVDF膜浸泡于二抗孵育液(封闭液稀释HRP标记羊抗兔二抗至1 ∶10 000)中,室温摇床孵育2 h,ECL显色,成像,晾干后扫描胶片,使用Band Scan分析胶片各条带灰度值,通过计算指标灰度值与内参灰度值的比值,得出目的蛋白相对表达量。
1.6 CCK-8法检测HRMECs增殖
取培养中生长良好的细胞,配置密度为5×104/ml的细胞悬液,按每孔100 μl将细胞悬液接于96孔板,最外圈孔不作为测定孔,设置3组复孔及空白对照孔,将培养板放在培养箱中(37 ℃、5% CO2)预培养24 h。随后按分组要求培养细胞24 h,向每孔加入10 μl CCK-8溶液,培养箱内孵育2 h,最后测定各孔吸光值OD450。按公式计算,得出数值:细胞增殖率(%)=(OD实验组-OD空白孔)/(OD对照组-OD空白孔)×100%。
1.7 统计分析
2 结果
2.1 APN预处理降低高糖诱导下HRMECs凋亡率
检测结果显示,对照组细胞凋亡率最低,为7.03%±0.16%;与对照组比较,高糖组细胞凋亡率明显升高,为26.51%±1.18%;与高糖组比较,高糖+APN组细胞凋亡率下降,为12.35%±0.37%(见图1)。三组数据总体比较差异有统计学意义(F=588.35,P<0.001)。各组数据两两比较,高糖组和高糖+APN组细胞凋亡率均较对照组升高(P<0.001);高糖+APN组较高糖组的细胞凋亡率明显降低(P<0.001,见图2)。

图1 流式细胞仪检测各组HRMECs凋亡率Figure 1 Apoptosis rate of HRMECs in different groups by flow cytometry

与对照组比较,*P<0.001;与高糖组比较,#P<0.001图2 各组HRMECs凋亡率的比较Figure 2 Comparison of apoptosis rate of HRMECs among three groups
2.2 APN预处理对高糖环境下HRMECs表达凋亡蛋白的影响
与对照组比较,高糖组Bax、Caspase-3水平明显升高,但Bcl-2的表达量明显降低;与高糖组比较,高糖+APN组Bax、Caspase-3水平降低,但Bcl-2的表达量增强(均P<0.001,见图3)。提示高糖组的细胞凋亡最强,细胞经APN预处理后凋亡减弱。
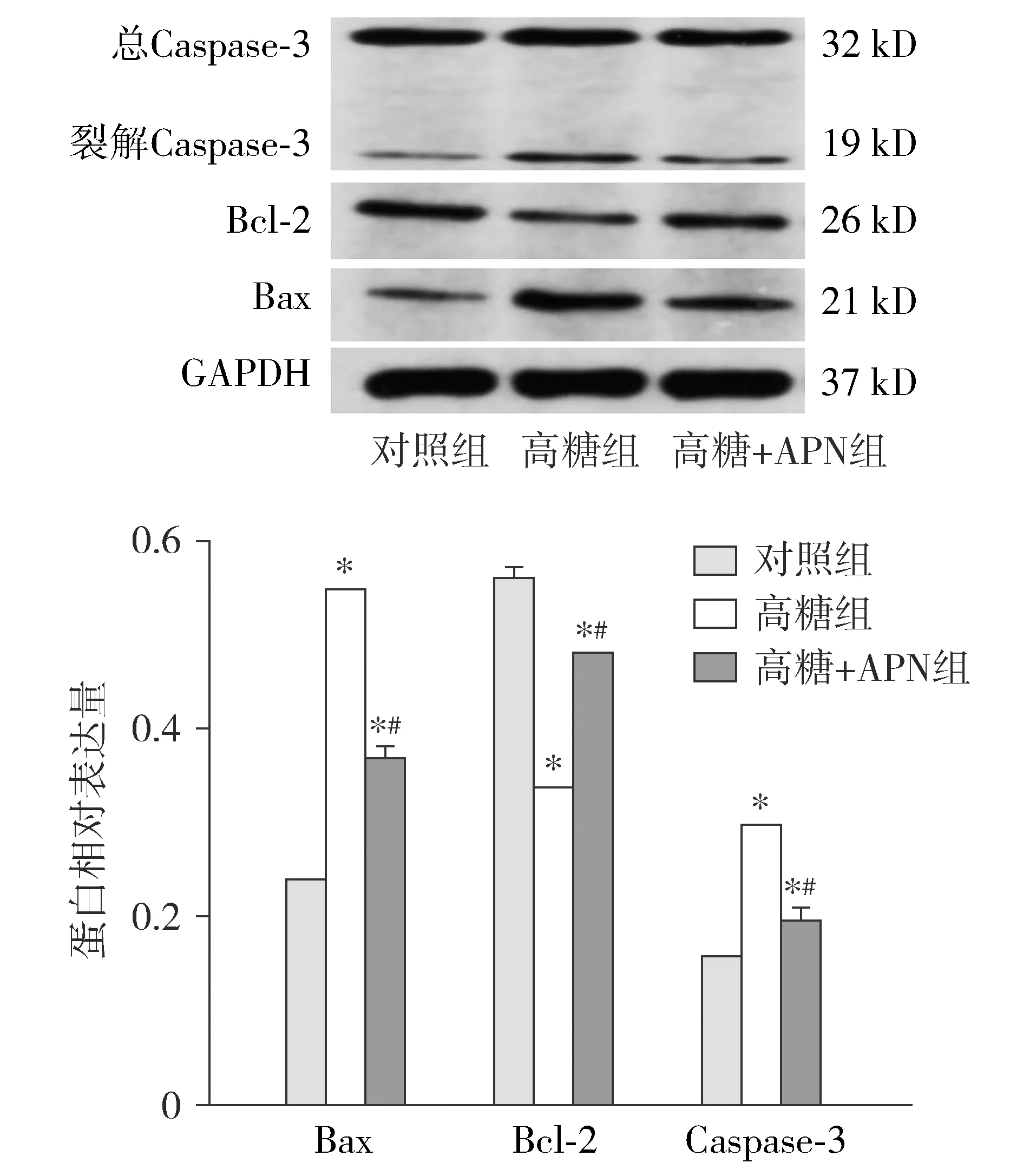
与对照组比较,*P<0.001;与高糖组比较,#P<0.001图3 Western blot检测各组HRMECs蛋白Caspase-3、Bcl-2、Bax的表达Figure 3 Expression of Caspase-3, Bcl-2 and Bax in HRMECs cells in various groups
2.3 APN预处理提高高糖诱导下HRMECs细胞增殖率
CCK-8检测结果显示,高糖组细胞增殖率为71.81%±0.65%,较对照组(100%±0%)明显降低,APN预处理后细胞增殖率明显回升,为89.50%±1.33%。三组数据总体比较差异有统计学意义(F=848.06,P<0.001,见图4)。组间两两比较,细胞增殖率差异均有统计学意义(P<0.001,见图4)。
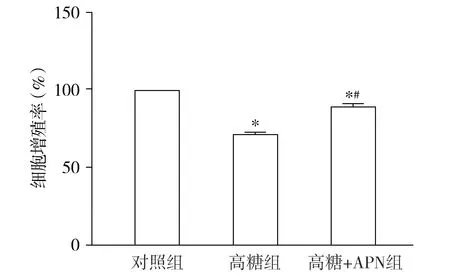
与对照组比较,*P<0.001;与高糖组比较,#P<0.001图4 各组HRMECs增殖率的比较Figure 4 Comparison of proliferation rate of HRMECs among three groups
3 讨论
糖尿病视网膜病变(diabetic retinopathy, DR)是糖尿病导致的视网膜微血管损害,影响患者视力甚至致盲,是工作年龄人群视力障碍的首要原因之一。目前关于DR的发病机制包括以下假说:炎症免疫机制、氧化应激学说、生物化学分子生物学机制、神经退行性改变和基因多态性。几种机制相互包含,互为因果从而共同构成复杂的发病机制[11]。早期,血糖升高即可使视网膜血管内皮细胞出现氧化损伤,细胞大量凋亡,损伤不可逆[12],且这种损伤是DR发生的基础[13]。视网膜血管内皮细胞是DR的主要参与者[14],故为研究DR病变过程中血管内皮细胞的凋亡及增殖等状态以及细胞状态的影响因素,本实验选择HRMECs作为体外培养观察的细胞。
细胞凋亡是一种程序化选择性细胞死亡,受到严格调控,需要多种因子、蛋白的参与并协调,和生物化学与形态表达关系密切[15]。很多常见眼病都伴有视网膜细胞凋亡如:视网膜脱离、年龄相关性黄斑变性、缺血性视网膜损伤、视网膜神经退行性变、青光眼等。高糖环境可以使视网膜神经节细胞、视网膜内核层细胞、视网膜色素上皮层细胞以及视网膜血管内皮细胞凋亡增加。糖尿病早期就见到视网膜神经节细胞凋亡和血管细胞凋亡[16]。体外研究表明,人视网膜血管内皮细胞在高糖培养下凋亡升高,以培养24 h细胞凋亡率升高较明显[17]。Bcl-2抑制凋亡,Bax促进凋亡,而Caspase-3为凋亡执行蛋白酶,占据凋亡过程中的核心地位[18],Caspase激活是凋亡过程中具有标志性的反应。凋亡过程的信号传导中,Bax、Bcl-2不仅是蛋白酶caspase-3的上游调控蛋白,也是蛋白酶caspase-3的直接作用底物,二者既相互联系又相互制约。本实验采用流式细胞仪检测了凋亡率;采用免疫印迹法检测了凋亡过程中相关蛋白Bax、Bcl-2、Caspase-3的表达水平。实验结果显示,相比对照组,高糖组细胞凋亡率及Caspase-3、Bax的表达量明显升高,Bcl-2的表达量明显降低,表明高糖刺激可以明显增加HRMECs细胞凋亡。另外本实验还检测HRMECs增殖率,结果显示高糖组的细胞增殖率较对照组明显下降,表明细胞凋亡增加是高糖导致细胞增殖活力下降的一个原因。
APN是一种具有生物活性的内源性多肽,由脂肪细胞分泌,可降低肝糖输出、促进糖转运、加速脂肪酸氧化[19,20],在正常人其血浆浓度为3~30 μg/ml[21]。有研究表明,APN是通过对一氧化氮和ET-1分泌的影响以及对内皮细胞一氧化氮合酶活性的影响来维持正常内皮细胞的功能,并对肿瘤坏死因子α所致的内皮细胞损伤起保护作用[19,20]。APN是视网膜病理性微血管形成的负向调控者[6],在缺血性视网膜病变进程中发挥视网膜血管的保护作用[22]。本实验研究了APN对高糖下HRMECs的作用,研究结果显示,高糖下细胞凋亡明显增加,细胞增殖明显下降,但高糖培养前加入APN干预2 h后细胞凋亡明显受抑制,增殖率明显好转,表明细胞凋亡增加是高糖导致细胞增殖活力下降的原因之一,且APN可以抑制高糖下HRMECs细胞凋亡,促进细胞存活及增殖,从而起到保护作用。
本研究团队前期通过体外培养细胞RF/6A,发现APN可以促进高糖条件下细胞的存活与增殖,抑制细胞的凋亡[7]。本次研究是前期研究的延伸。本次使用HRMECs作为培养细胞,没有了物种基因差异,更能贴近DR病变发生发展的本质,更有说服力;不同于前期实验APN是加入高糖培养基对细胞作用48 h,本次实验使用同样浓度的APN只在细胞高糖培养前干预2 h,结果依然显示APN有明显作用效果,提示APN的起效较快,作用时间可以缩短到2 h;另外本次实验较前期实验增加了凋亡执行蛋白酶caspase-3的检测,caspase-3可促进染色质浓缩,大范围降解细胞内蛋白,促进形成凋亡小体[23],最终使细胞走向不可逆死亡,故Caspase-3的水平更能直接反应细胞凋亡状态。
综上所述,高糖诱导下HRMECs凋亡增加,增殖下降,凋亡增加是高糖导致细胞增殖活力下降的原因之一,但APN预处理可以抑制高糖条件下细胞凋亡,促进细胞的存活及增殖,从而起到保护作用。APN是否还通过其他途径发挥其保护作用,需要进一步研究。
