甲基化CpG结合蛋白2的泛癌分析及其对肝癌Hep3B细胞生物活性的影响
2022-11-08孙瑞芳李玉龙
杨 阳,孙瑞芳,李玉龙,孙 娜*
(1陕西中医药大学公共卫生学院卫生毒理学教研室,咸阳 712046;2西安交通大学基础医学院病理学系;3陕西省人民医院消化内科;*通讯作者,E-mail:283529713@qq.com)
甲基化CpG结合蛋白2(methyl-CpG-binding domain protein 2,MeCP2)基因定位于染色体Xq28,是甲基化CpG结合域蛋白MBD家族(methyol-CpG-binding domain protein family,MBD)的重要的成员之一。现有研究表明MeCP2蛋白是一种多功能蛋白,广泛参与基因的转录调控、miRNA、lincRNA的表达、染色质重塑等过程[1-3]。现有研究表明MeCP2在结直肠癌[4]、口腔鳞状细胞癌[5]、前列腺癌[6]等肿瘤的发生发展中扮演着重要角色。MeCP2在乳腺肿瘤组织中表达水平高于在非肿瘤组织中的表达,且其能够影响乳腺癌的发展[7],linc-ROR/miR-194-3p/MeCP2轴在雷帕霉素治疗期间促进乳腺癌细胞的存活[8]。MeCP2通过与中性α-葡萄糖苷酶AB(GANAB)启动子的第2个甲基化CpG岛结合调控GANAB表达,从而改变糖模式并影响胃癌细胞的增殖和凋亡[9]。在人结直肠腺癌上皮细胞DLD-1中抑制MeCP2的表达可抑制DLD-1细胞的增殖及迁移,提示MeCP2可能作为结直肠癌基因治疗的潜在靶点[10]。有研究表明MeCP2参与circRNA对肝细胞癌索拉非尼耐药的调控[11]。为探索MeCP2在肿瘤中的作用,本研究应用生物信息学方法分析了MeCP2在不同肿瘤中的表达及其与多种肿瘤预后的关系,此外,本研究通过实验进一步确认MeCP2在肝癌细胞中的作用。
1 材料和方法
1.1 材料
Trizol裂解液、Lipofectamine2000购自Invitrogen公司,逆转录试剂盒及定量PCR试剂盒购自TaKaRa公司。MeCP2过表达载体及其对照购自上海吉凯基因化学技术有限公司。si-MeCP2购自上海吉玛制药技术有限公司。Hep3B细胞培养于10%胎牛血清的DMEM培养基,培养于5% CO2,37 ℃培养箱。
1.2 生物信息学分析MeCP2在肿瘤中的表达及预后
利用TIMER2.0[12](http://timer.cistrome.org)数据库分析MeCP2在多种肿瘤中的表达情况,应用GEPIA2[13](http://gepia2.cancer-pku.cn)数据库分析MeCP2的表达与肿瘤患者生存期的关系;应用cBioPortal[14](https://www.cbioportal.org)观察MeCP2在不同肿瘤中发生遗传变异的频率;应用UALCAN[15](http://ualcan.path.uab.edu)分析MeCP2在不同年龄段肝细胞癌患者中的表达及MeCP2在肝细胞癌患者TP53突变组及TP53未突变组的表达。
1.3 qRT-PCR检测MeCP2的表达水平
将si-MeCP2、si-ctrl、ov-MeCP2、ov-ctrl分别转染至Hep3B细胞,48 h后提取RNA,根据生物信息学设计的引物进行逆转录及荧光实时定量PCR,检测MeCP2的表达水平。
1.4 细胞体外实验
1.4.1 分组及干预 实验分为si-MeCP2组和si-ctrl组,分别转染si-MeCP2、si-ctrl至Hep3B细胞;实验分为ov-MeCP2组和ov-ctrl组,分别转染ov-MeCP2、ov-ctrl至Hep3B细胞。转染后于37 ℃ 5%CO2培养箱培养。
1.4.2 CCK-8实验检测MeCP2对Hep3B细胞生物学活性的影响 按上述分组将转染后的Hep3B细胞于37 ℃ 5%CO2培养箱培养,24 h/48 h避光加入CCK-8,培养箱放置1 h后,采用酶标仪在450 nm波长处测定各孔的OD值。分析沉默或过表达MeCP2对Hep3B细胞生物学活性的影响。
1.4.3 细胞周期实验检测MeCP2对Hep3B细胞周期的影响 按上述分组将转染后的Hep3B细胞于37 ℃ 5%CO2培养箱培养,48 h后,胰酶消化细胞收集于15 ml离心管中,1 000 r/min离心5 min。弃上清,PBS冲洗细胞2~3次。弃去PBS,重新加入4 ℃预冷的70%酒精(PBS稀释)重悬细胞,于4 ℃过夜固定。1 000 r/min离心5 min,弃上清液。用PBS冲洗细胞2次,离心弃上清PBS,避光加150 μl RNA酶和150 μl PI,轻柔混合,室温避光静置30 min后采用流式细胞仪检测。
1.5 统计学处理
应用SPSS13.0软件进行分析。数据以均数±标准差表示,采用Student’st检验分析两组间均数比较。P<0.05为差异有统计学意义。
2 实验结果
2.1 MeCP2在多种肿瘤中高表达
TIMER2.0基于TCGA数据库分析MeCP2在多种肿瘤中的表达,发现与正常组织相比,MeCP2在乳腺浸润癌、胆管癌、食管癌、头颈部鳞状细胞癌、肾嫌色细胞癌、肝细胞癌中的mRNA表达显著增加(见图1)。
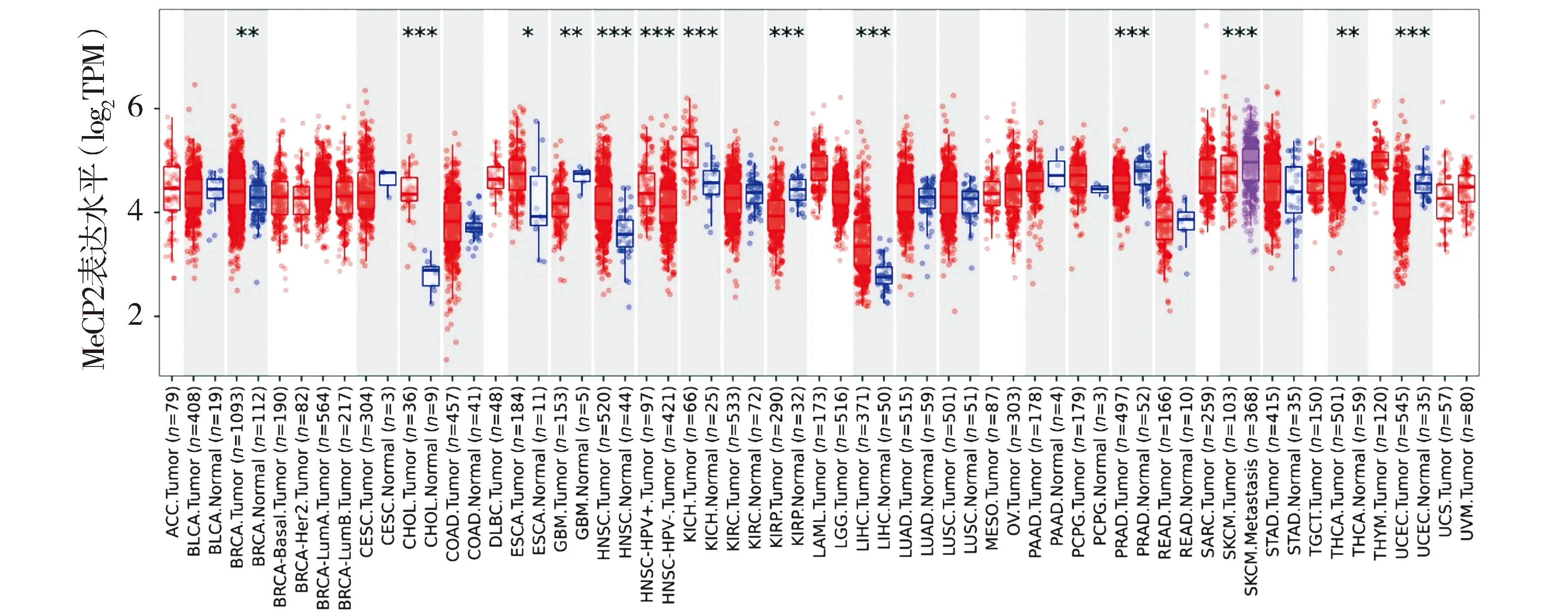
两样本比较,*P<0.05,**P<0.01,***P<0.001,横坐标为肿瘤种类(红色为肿瘤样本,蓝色为对应的正常样本)图1 MeCP2在多种肿瘤中的表达Figure 1 The expression of MeCP2 in various tumors
2.2 MeCP2的表达对肿瘤患者生存期的影响
应用GEPIA2数据库分析MeCP2的表达与肿瘤患者生存期的关系,结果显示显示在乳腺浸润癌(BRCA)、结肠癌(COAD)、肾乳头状细胞癌(KIRP)、肝细胞癌(LIHC)中MeCP2高表达的患者的总生存率显著低于MeCP2低表达组,而在肾透明细胞癌(KIRC)中MeCP2高表达的患者总生存率及无病生存率显著高于MeCP2低表达组,而在葡萄膜黑色素瘤(UVM)中MeCP2高表达的患者无病生存期率显著低于MeCP2低表达组(见图2)。
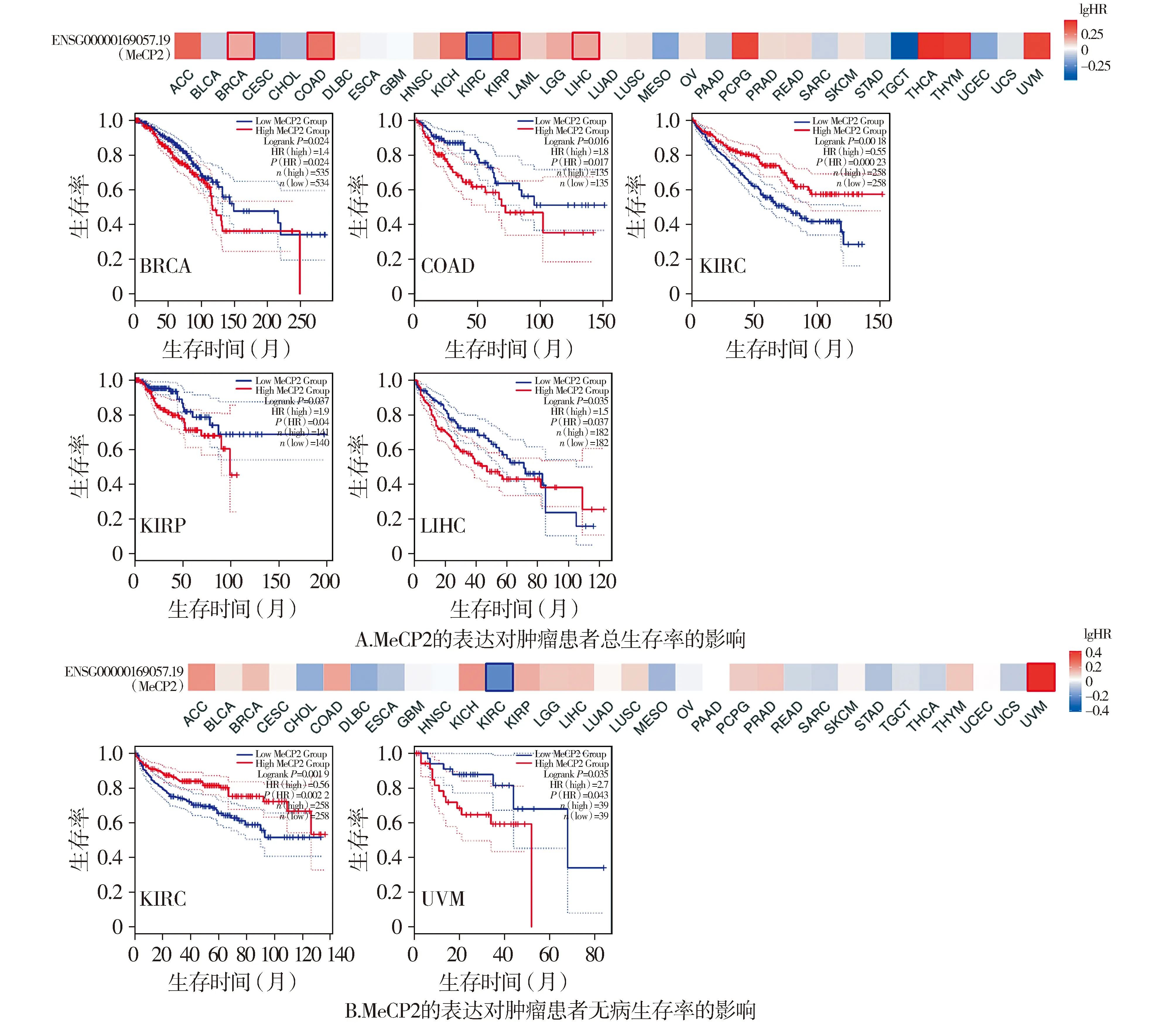
红色表示lgHR>0,蓝色表示lgHR<0图2 MeCP2的表达对肿瘤患者生存率的影响Figure 2 The effect of MeCP2 expression on the survival rate of tumor patients
2.3 MeCP2在多种肿瘤中的遗传变异情况
应用cBioPortal分析MeCP2在多种肿瘤中的遗传变异情况,结果显示,MeCP2的变异频率在弥漫性大B细胞淋巴瘤中最高(10.42%,见图3A)。MeCP2突变的位点如图3B所示,错义突变是其突变的主要类型。
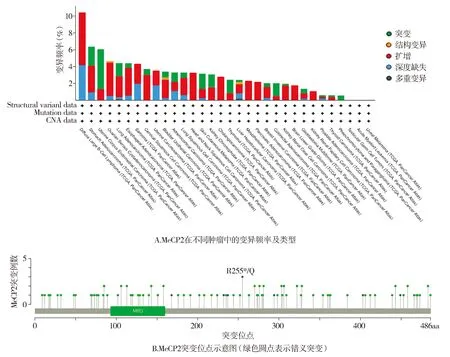
图3 MeCP2在多种肿瘤中的基因变异情况Figure 3 Gene variation of MeCP2 in various tumors
2.4 UALCAN分析MeCP2在肝细胞癌中的表达
应用UALCAN分析发现肝细胞癌不同年龄组患者中MeCP2的表达均显著高于正常对照(见图4)。发生TP53突变及未发生TP53的肝细胞癌患者MeCP2的表达均显著高于正常对照,TP53突变及未发生TP53的肝细胞癌患者中MeCP2的表达差异无统计学意义(见图4)。
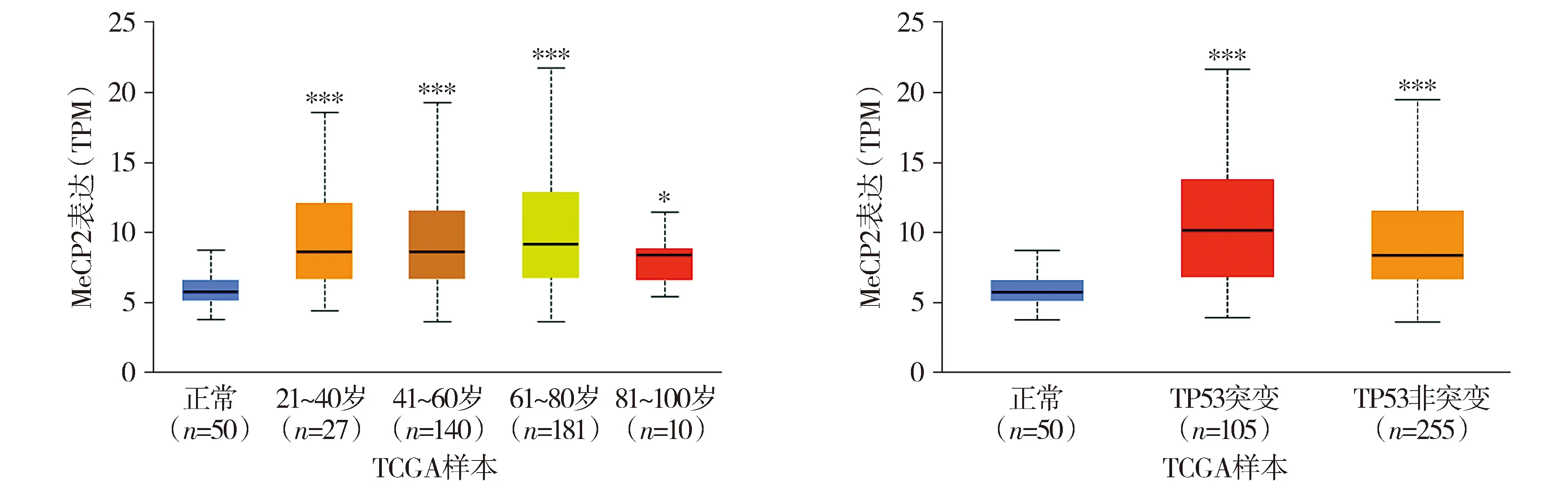
与正常组比较,*P<0.05,**P<0.01,***P<0.001图4 MeCP2在肝细胞癌中的表达Figure 4 Expression of MeCP2 in liver hepatocellular carcinoma
2.5 MeCP2在肝细胞癌中发挥癌基因的作用
应用qRT-PCR检测MeCP2的表达,发现与si-ctrl组相比,MeCP2在si-MeCP2组中的表达显著降低(P<0.05);与ov-ctrl组相比,MeCP2在ov-MeCP2组中的表达显著升高(P<0.01,见图5)。CCK-8实验表明抑制MeCP2表达可抑制肝癌Hep3B细胞增殖(P<0.01);过表达MeCP2可促进肝癌Hep3B细胞增殖(P<0.05,见图5)。细胞周期实验表明抑制MeCP2可将肝癌Hep3B细胞阻滞在G1期(P<0.01,见图5)。

与相应的ctrl组相比,*P<0.05,**P<0.01图5 MeCP2对Hep3B细胞增殖及细胞周期的影响Figure 5 Effect of MeCP2 on the proliferation and cell cycle of Hep3B cells
3 讨论
肿瘤是一种高发病率、高死亡率的严重威胁人类健康的疾病。探索肿瘤的发病机制,寻找肿瘤生物标志物,对优化肿瘤的诊疗及探寻潜在的治疗靶点有重要意义。肿瘤的发生发展过程受到多种因素的调控,目前研究表明表观遗传调控与肿瘤的发生发展密切相关。甲基化作为DNA的主要且最具特征的表观遗传修饰之一,引起人们的广泛关注[16]。哺乳动物DNA的甲基化可导致转录抑制和染色质结构改变,CpG二核苷酸是DNA甲基化发生的主要位点,甲基化CpG通过甲基-CpG结合蛋白介导[1]。MeCP2能够通过与甲基化DNA结合调控基因表达并调节染色质结构。MeCP2有两个重要的结构域,甲基CPG结合结构域(methyl-CpG-binding domain,MBD)和转录抑制结构域(transcriptional-repression domain,TRD),MBD能够结合mCpG,TRD可通过招募蛋白复合物在转录水平发挥调控作用。现有研究证据表明,MeCP2在多种肿瘤中存在异常表达,广泛参与肿瘤的发生发展[17-19]。本研究通过生物信息分析MeCP2在包括肝细胞癌在内的多种肿瘤中的表达,结果表明MeCP2在肝细胞癌中的表达水平高于正常组织,与之前文献报道一致[20]。本研究借助GEPIA2数据库分析MeCP2与肿瘤患者预后的关系,显示肝细胞癌患者中MeCP2高表达组的总生存率显著低于MeCP2低表达组,进一步通过实验检测MeCP2对Hep3B生物学活性的影响,发现沉默MeCP2可抑制Hep3B细胞增殖,将细胞周期阻滞于G1期。Wu等[21]的研究表明MeCP2在肝细胞癌组织中高表达,沉默MeCP2可抑制细胞增殖,而过表达MeCP2可促进SMMC-7721细胞增殖。结合既往研究结果,提示MeCP2在肝癌中可能发挥癌基因的作用,可能是肝癌治疗的潜在靶点。
本研究通过生物信息学分析MeCP2在泛癌中的表达及预后关系,为系统认识MeCP2在肿瘤中的作用提供依据,进一步通过体外实验揭示了MeCP2在肝细胞癌中发挥的作用,但仍存在不足之处。该研究仅在体外水平检测了MeCP2对肝癌细胞的影响且未涉及相关机制研究,后续还需要进一步的细胞和动物实验深入研究MeCP2基因在肝癌发生中涉及的具体机制。
