HBV感染免疫耐受期孕妇分娩前后临床指标及细胞因子水平变化特征
2022-11-07鲁俊锋祖红梅王莉林马丽娜郑素军陈新月胡中杰
鲁俊锋,祖红梅,王莉林,刘 丹,马丽娜,郑素军,陈新月,胡中杰
母婴传播是我国HBV感染的主要传播途径,约占全部HBV感染的40%[1]。根据国内外最新的慢性乙型肝炎(chronic hepatitis B, CHB)防治指南,对免疫耐受期、高病毒载量的HBV感染孕妇在妊娠晚期均推荐抗病毒干预,但这些患者分娩后肝功能并非依然呈“耐受状态”[2-4]。既往有研究发现,部分CHB孕妇分娩后可出现氨基转移酶升高或伴有自发的HBeAg清除/转换[5-7]。然而,HBV感染免疫耐受期孕妇分娩后临床指标的变化仍缺少相关的研究,具体免疫学机制仍不清楚。为此,本研究对HBV感染免疫耐受期孕妇分娩前后的生化、病毒学、血清学等临床指标以及细胞因子的变化进行分析,探讨潜在的免疫学影响因素,为产后抗病毒治疗提供理论基础。
1 对象与方法
1.1 对象 选择2015年1月—2017年12月就诊于首都医科大学附属北京佑安医院的52例HBV感染免疫耐受期孕妇作为研究对象。纳入标准:①既往未接受过抗病毒治疗;②妊娠前、妊娠期间至少2次血清ALT和AST在正常范围;③HBeAg≥500 COI,HBV DNA ≥ 6 lg IU/ml。排除标准:①合并HAV、HCV、HEV等病毒感染者;②合并自身免疫性肝病者;③代偿或失代偿期肝硬化患者;④妊娠期合并产科并发症如先兆子痫、肝内胆汁淤积等;⑤妊娠期并发其他疾病,需服用药物者。所有患者于妊娠28周给予替比夫定(telbivudine, LdT)抗病毒干预,分别于干预前(基线)、分娩前2周、分娩后6周进行生化、血清学及病毒学检测,同步留取相应节点外周静脉血标本,-80℃保存备用。本研究经首都医科大学附属北京佑安医院伦理委员会批准,患者均签署知情同意书。
1.2 检测方法 HBV血清学检测采用罗氏Elecsys HBsAgⅡ试剂盒进行检测,HBsAg定量检测下限为0.05 IU/ml,HBeAg>1.0 COI为阳性。HBV DNA检测采用实时荧光定量PCR系统检测,检测下限为20 IU/ml(COBAS Taqman,罗氏诊断公司)。肝功能检测采用OLYMPUSAU5400生化检测仪进行检测,ALT正常值上限(upper limit of normal, ULN)为 40 U/L。细胞因子采用多细胞因子检测试剂盒(Bio-Plex Pro Assays),包括 IL-2、IL-4、IL-6、IL-10、IFN-γ和 TNF-α。
1.3 统计学处理 用SPSS 20.0软件对数据进行统计分析。呈正态分布的计量资料以±s表示,非正态分布的计量资料以M(P25,P75)表示。不同时间点的ALT、HBV DNA、HBeAg、HBsAg比较采用重复测量方差分析,组间比较采用 LSD-t检验。不同组间细胞因子比较采用独立样本t检验或2样本比较秩和检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 基本情况 52例患者均为HBeAg阳性CHB,平均年龄为(29.3±4.3)岁,ALT基线平均水平为(18.4±7.6)U/L,HBsAg基线中位水平为4.6 lg IU/ml,HBeAg基线平均水平为(3.3±0.1)lg COI,HBV DNA 基线中位水平为8.2 lg IU/ml。16例患者的HBV为基因B型,36例患者的HBV为基因C型。
2.2 分娩前后生化、病毒学及血清学指标的变化 52例患者LdT干预前、分娩前ALT水平均在正常值范围,分娩后ALT≥2倍ULN者占28.8%(15/52),ULN< ALT< 2倍 ULN者占26.9%(14/52),ALT水平正常者占44.2%(23/52)。由于妊娠晚期LdT抗病毒治疗,分娩前HBV DNA水平较LdT干预前显著降低,平均降幅达(3.68±0.79) Ig IU/ml,但分娩后6周HBV DNA水平明显高于分娩前(P均<0.05);LdT干预前、分娩前、分娩后HBeAg和HBsAg水平均无明显变化。52例患者中,35例分娩后即刻停用LdT,17例分娩后6周停用LdT,中位ALT水平分别为32.8(21.45,70.25)U/L 和37.2(26.5,86.4)U/L,在分娩后无明显差异(Z=0.664,P=0.507);分娩后即刻停药的患者,71.4%(25/35)HBV DNA水平在分娩后6周完全恢复至LdT干预前水平。见表1。
表1 52例患者LdT干预前、分娩前、分娩后生化、血清学、病毒学指标变化(±s)Table 1 Changes of biochemical, serological and virological markers levles in 52 patients before LdT intervention, ante partum and post partum (±s)
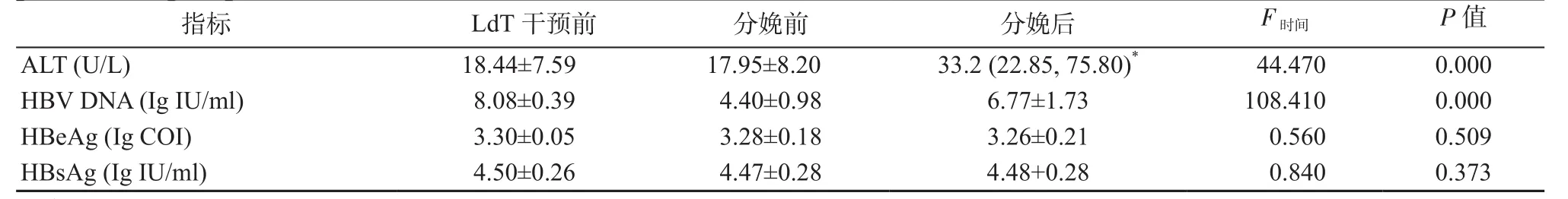
表1 52例患者LdT干预前、分娩前、分娩后生化、血清学、病毒学指标变化(±s)Table 1 Changes of biochemical, serological and virological markers levles in 52 patients before LdT intervention, ante partum and post partum (±s)
注:*. M(P25,P75)
指标 LdT干预前 分娩前 分娩后 F时间 P值ALT (U/L) 18.44±7.59 17.95±8.20 33.2 (22.85, 75.80)* 44.470 0.000 HBV DNA (Ig IU/ml) 8.08±0.39 4.40±0.98 6.77±1.73 108.410 0.000 HBeAg (Ig COI) 3.30±0.05 3.28±0.18 3.26±0.21 0.560 0.509 HBsAg (Ig IU/ml) 4.50±0.26 4.47±0.28 4.48+0.28 0.840 0.373
2.3 分娩前后细胞因子水平的变化 对52例患者在LdT干预前、分娩前、分娩后细胞因子水平进行检测,结果显示,IL-2、IL-4、IL-6、IL-10、IFN-γ、TNF-α在分娩前后均呈动态变化,其中,IL-2中位水平在分娩前与LdT干预前无明显变化,分娩后明显低于分娩前(P<0.05);TNF-α中位水平在分娩前明显低于LdT干预前(P<0.05),分娩后较分娩前无明显变化;余细胞因子水平在分娩前后的变化差异均无统计学意义。见图1。

图1 52例患者LdT干预前、分娩前、分娩后细胞因子水平的变化Figure 1 Changes of cytokine levels in 52 patients before LdT intervention, ante partum and post partum
2.4 分娩后ALT≥2倍ULN组和ALT<2倍ULN组间细胞因子水平比较 根据分娩后ALT水平的不同,分为ALT≥2倍ULN组和ALT<2倍ULN组,对2组之间细胞因子水平进行比较,结果显示,在LdT干预前,ALT≥2倍ULN组IFN-γ中位水平明显低于ALT<2倍ULN组,(Z=2.284,P=0.022),而IL-2、IL-4、IL-6、IL-10、TNF-α在2组之间差异均无统计学意义(表2);分娩后,ALT≥2倍ULN组患者中位IFN-γ水平明显高于ALT<2倍ULN组,差异有统计学意义(Z=2.223,P=0.026),余细胞因子水平在2组间差异无统计学意义(表3)。

表2 LdT干预前ALT≥ 2倍ULN组与ALT<2倍ULN组细胞因子水平比较(pg/ml)Table 2 Cytokine levels between ALT ≥ 2 times ULN group and ALT < 2 times ULN group before LdT intervention (pg/ml)
3 讨 论
所谓免疫耐受期是指HBsAg、HBeAg阳性,HBV DNA高载量,血清ALT和AST在正常值范围,肝组织学检查炎症不明显[2]。免疫耐受期患者不是抗病毒治疗的适宜人群[2]。妊娠晚期抗病毒治疗的目的是降低HBV母婴传播风险,并非针对HBV感染的孕妇本人进行治疗。然而,这些孕妇产后并非依然处于“免疫耐受”状态。从既往文献报道看,HBV感染孕妇产后可出现2种情况,一是产后较高比例的患者出现不同程度的氨基转移酶升高或伴有自发的HBeAg清除/转换[5-9];二是产后出现肝炎发作的患者,采用以IFN为基础方案抗病毒治疗疗效显著好于一般CHB人群[10]。本研究中入组患者HBeAg≥500 COI且HBV DNA≥6 lgIU/ml,明显为机体免疫耐受状态,产后6周观察到ALT≥2倍ULN者占28.8%,产后即刻停药组与产后6周停药组分娩后ALT水平无明显差异。这些临床现象间接提示产后ALT水平的升高可能与机体免疫功能的变化相关。
妊娠期是一个具有独特且复杂免疫状态的阶段,在整个胎儿的生长发育期间,为避免对胎儿的排异反应,机体免疫功能趋于抗炎内环境,而一旦胎儿发育完成,机体由抗炎内环境向促炎内环境的转变对促进分娩是必不可少的[11]。在非HBV感染人群中,文献报道,妊娠期间细胞因子趋于以Th2型为主,而分娩后转换为以Th1类细胞因子为主[12]。本研究中,虽2类细胞因子在分娩前后呈动态变化趋势,但总体未显示出一致变化的规律性,可能与HBV感染、机体的免疫应答均有一定的关系。既往文献报道,在HBV感染控制过程中,IFN-γ起到非常重要的作用。首先,IFN-γ可通过多种途径发挥重要的作用:①募集和活化T细胞、NK细胞及巨噬细胞来发挥它们的功能;②诱导T细胞形成抗HBV效应细胞;③上调感染HBV的肝细胞上的主要组织相容性复合体的表达,促进抗原加工和呈递;④直接抗病毒的作用[13]。其次,在模拟急性HBV感染的小鼠模型中,NK细胞通过分泌IFN-γ促进CD8+T细胞的抗病毒活性[14];在免疫激活的CHB患者中,NK细胞和CD8+T细胞均可分泌IFN-γ,且与ALT水平的升高呈正相关[13-16]。HBV特异性CD8+T细胞可通分泌IFN-γ,抑制HBV的复制,降低肝细胞内的cccDNA,使部分患者实现HBV的临床治愈[15]。因此,IFN-γ在HBV感染过程中免疫激活、抗病毒疗效及临床治愈等多个方面均起到重要的作用。本研究中,根据分娩后ALT水平的不同对细胞因子进行分析,结果显示分娩后ALT≥2倍ULN组患者,在妊娠期间中位IFN-γ水平呈低水平表达,而分娩后呈高水平表达,这些结果提示分娩前后IFN-γ水平的变化可能与产后ALT水平的升高有关。然而,本研究不足之处在于,妊娠期间体内多种免疫细胞、细胞因子形成复杂的免疫网络调节系统,在不同的妊娠阶段,呈现不同的免疫状态,以维持正常妊娠[11-12,17-19]。单个细胞因子变化尚不足以真实、完整地反映机体的免疫功能变化。
结合本研究团队前期研究,产后出现ALT升高的患者继续采用聚乙二醇IFN为基础方案抗病毒治疗,可获得较高的HBsAg/HBeAg血清学清除/转换率[10],提示HBV感染免疫耐受期孕妇分娩后若出现ALT水平的升高,可能与机体免疫功能的变化相关,或为产后的进一步抗病毒治疗创造合适的时机,须要更进一步的深入研究。
