环指蛋白6在肿瘤中的研究进展
2022-11-07孙翊乐牛晓敏陈智伟
孙翊乐, 牛晓敏, 陈智伟
(1. 上海交通大学医学院,上海 200025; 2. 上海交通大学附属胸科医院肿瘤科,上海 200030)
泛素是一种相对分子质量约为8 500的小分子蛋白质,可在翻译后水平修饰底物蛋白,参与细胞的增殖、分化、凋亡及DNA修复等生理活动的调控[1]。泛素介导的底物传递过程需要泛素激活酶E1、泛素结合酶E2及泛素连接酶E3的共同参与[2]。首先,泛素激活酶E1在ATP供能的条件下通过其半胱氨酸残基与泛素分子C末端甘氨酸残基形成高能硫酯键,激活泛素分子。随后,E1将泛素转移到泛素结合酶E2,形成E2泛素中间体。接着,在泛素连接酶E3的作用下,泛素与E2间的硫酯键发生断裂,并转移到靶蛋白赖氨酸残基的ε氨基集团上,形成异肽键,完成靶蛋白的单泛素化。最后,在E3的介导下,一些泛素分子可相继与连有底物的泛素分子的赖氨酸残基相结合,形成多泛素化靶蛋白,见图1。

图1 RNF6作为泛素连接酶E3介导泛素由E2到底物的转移Fig.1 As an ubiquitin ligase E3, RNF6 mediates the transfer of ubiquitin from E2 to the substrate
泛素连接酶E3可被分为RING(really interesting new gene)家族、HECT(homologous to E6-AP C-terminal)家族及RBR(RING-in-Between-RING)家族[3]。RING家族成员众多,是最大的泛素连接酶家族。环指蛋白6(ring finger protein 6, RNF6)位于人染色体13q12,隶属于RING泛素连接酶家族。研究发现,RNF6不但参与了胚胎分化[4]、卵泡发育[5]等生命活动的调控,与创伤性脑损伤[6]、妊娠期高血压[7]、慢性阻塞性肺疾病[8]等良性病变有关,还在多种恶性肿瘤中的发生发展过程中发挥促癌作用。本文对RNF6的发现历程、结构特征及其在恶性肿瘤发生发展过程中的功能及作用机制进行了综述,讨论其所具有的生理功能及对肿瘤发生的影响。
1 RNF6的研究概述
1.1 RNF6的发现历程
RNF6的发现迄今为止已过去了20余年。1999年,MacDonald等[9]利用荧光原位杂交(FISH)技术从骨髓纤维化患者标本中鉴定出位于人13号染色体断点(4号染色体长臂2区6带与13号染色体长臂1区2带发生易位)附近的RNF6基因。随后,Lo等[10]在食管鳞状细胞癌中发现了4种RNF6基因突变,即: R102K突变、A242T突变、G244D突变及S623N突变。其中,A242T突变和G244D突变可影响RNF6的蛋白结构;S623N突变可影响RNF6的环指结构域与DNA的结合。此外,该研究还发现了3种非同义单核苷酸多态性(single nucleotide polymorphism, SNP,即N48S、R572Q及I164T)与两种同义单核苷酸多态性(G127G、C635C)。由于RNF6在食管鳞状细胞癌中发生突变,Lo等初步猜测RNF6可在肿瘤发生过程中发挥抑癌作用。然而,后续研究发现: RNF6可促进前列腺癌[11]、急性白血病[12]、结直肠癌[13-15]、乳腺癌[16]、肝癌[17]、胃癌[18]、食管鳞癌[19]、宫颈癌[20]、多发性骨髓瘤[21]、胰腺癌[22]等多种恶性肿瘤的发生发展[23]。目前主要认为RNF6在恶性肿瘤中起促癌作用。
1.2 RNF6的结构特征
RNF6是由685个氨基酸编码的蛋白质,为RING家族的一员,其家族以具有环指结构域为特征。家族成员主要可被分成两大类: 即含RING结构域的E3单体和包含RING结构域的蛋白复合体,后者主要包括SCF(Skp1-Cullin1-F-box)复合体[24]、APC/C(anaphase-promoting complex/cyclosome)复合体[25]及CBCVHL(Cullin-Elongin-BC-VHL)复合体3类[26]。环指结构域是一个富含半胱氨酸/组氨酸的锌螯合结构域[27],可促进蛋白与蛋白及蛋白与DNA间的相互作用。其半胱氨酸/组氨酸残基序列为Cys-X2-Cys-X9-39-Cys-X1-3-His-X2-3-Cys/His-X2-Cys-X4-48-Cys-X2-Cys(X可为任意氨基酸)[28]。锌原子被认为是RNF6的辅酶,其具体作用有待进一步实验证实,见图2A。近来研究发现: 环指结构域除介导泛素从泛素结合酶E2到底物的传递外,还可调控转录[29]。
起初,研究者根据环指结构域基序中的半胱氨酸或组氨酸残基将其分为RING-HC(Cys5)或RING-H2(His5)两种亚型[9]。随着研究的进一步深入,其他较少见亚型(如: RING-v、RING-D、RING-G)逐渐被发现[30]。RNF6的C端所含RING结构域为RING-H2结构域,可赋予RNF6泛素连接酶的活性,同时也可能使其发生自泛素化。在RING-H2结构域上游,RNF6还含有1个KIL结构域及1个PSH结构域。此外,在RNF6的N端有1个CC结构域,见图2B。
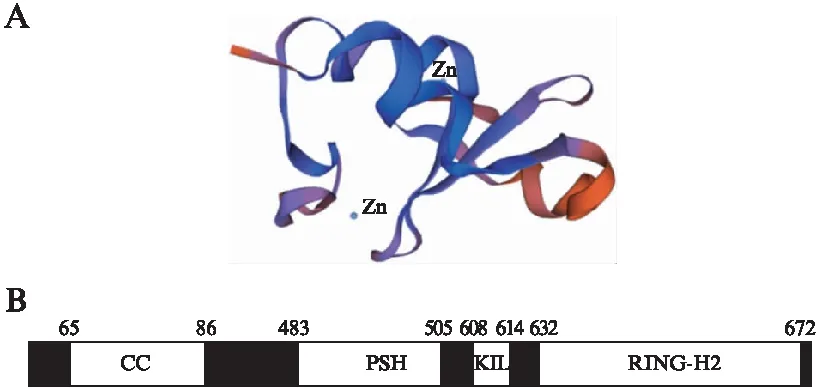
图2 RNF6结构Fig.2 The structure of RNF6A: 利用Swiss-model(https:∥swissmodel.expasy.org/)构建RNF6蛋白三维结构图;B: RNF6结构域示意图
2 RNF6与恶性肿瘤
2.1 RNF6在恶性肿瘤中高表达
虽然Lo等[10]一度曾以为RNF6为抑癌基因,但目前大部分研究均支持RNF6在恶性肿瘤中发挥促癌作用。RNF6在非雄激素依赖性前列腺癌(hormone-refractory prostate cancer)细胞中表达明显高于雄激素依赖性前列腺癌(hormone-naive prostate cancer)细胞及良性病变,提示RNF6可促进前列腺癌的发生发展,并与其雄激素依赖性相关。通过对结直肠癌及癌旁组织的全基因组测序,研究发现,RNF6为结直肠癌中表达上调最明显的基因之一,且其表达与总生存期(overall survival, OS)、AJCC分期及肿瘤复发相关[14]。Liang等[13]对TCGA数据库中结直肠癌患者的RNA芯片进行了CNV分析,发现RNF6显示出了最明显的拷贝数扩增,且其mRNA表达水平与患者预后相关。此外,RNF6在乳腺癌[16]、胰腺癌[22]、胃癌[18]、肝癌[17]、多发性骨髓瘤[21]组织中表达水平均有增高。这些均提示RNF6可能与恶性肿瘤的发生发展相关。
2.2 RNF6与肿瘤细胞增殖
细胞的异常增殖是恶性肿瘤最重要的特征之一。RNF6可通过促进细胞增殖介导多种恶性肿瘤的发生发展。Kexin等[11]通过克隆形成实验发现敲低RNF6可抑制前列腺癌细胞体外增殖,通过小鼠皮下瘤实验发现敲低RNF6可抑制前列腺癌细胞体内增殖。Xu等[12]发现PBX1可通过上调RNF6的表达促进白血病细胞增殖。Lei等[14]通过Western印迹法实验发现: 在结直肠癌细胞HT29、HCT116中过表达RNF6可下调增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)的表达,提示RNF6与细胞增殖相关。免疫组化染色实验表明: RNF6过表达结直肠癌细胞形成的小鼠皮下瘤组织中增殖细胞相关抗原ki-67表达增高,进一步提示RNF6可促进结直肠癌细胞增殖[14]。RNF6还可促进[13-15]、乳腺癌[16]、胃癌[18]、宫颈癌[20]、多发性骨髓瘤[21]等多种恶性肿瘤细胞的增殖。
2.3 RNF6与细胞周期,细胞凋亡
Lei等[14]采用流式细胞术检测RNF6对细胞周期进程的影响,结果显示: RNF6高表达可引起结直肠癌细胞G1期阻滞[14]。过表达RNF6可上调细胞周期相关蛋白的表达,如: G1/S特异性周期蛋白D1(cyclin D1)及细胞周期蛋白依赖性激酶4(CDK4)。此外,RNF6高表达可抑制细胞周期负调控因子p53、p21及p27的表达。在胃癌[18]、结直肠癌[14]、宫颈癌[20]、多发性骨髓瘤[21]及急性白血病[12]细胞中,过表达RNF6可降低凋亡细胞百分比,抑制细胞凋亡蛋白酶3、7、8、9的活化。脱氧核糖核苷酸末端转移酶介导的缺口末端标记(Tunel)法常被用以细胞凋亡的检测。RNF6过表达结直肠癌细胞形成的小鼠皮下瘤组织中Tunel染色阳性细胞数减少[14],提示RNF6抑制细胞凋亡。
2.4 RNF6与肿瘤转移
叉头样转录因子A1(FoxA1)又称肝细胞核因子3α(HNF3α),属于叉头框FOX转录因子家族成员之一,是细胞上皮-间充质转化(epithelial mesenchymal transition, EMT)重要的抑制因子。Jing等[17]使用共聚焦显微镜观察了肝癌细胞内RNF6与FoxA1蛋白定位情况,发现RNF6与FoxA1在肝癌细胞内共定位,且RNF6可通过泛素化降解FoxA1蛋白抑制上皮标志物E-钙黏蛋白表达,促进间质标志物N-钙黏蛋白表达,介导肝癌细胞的侵袭与迁移。通过分析肝细胞癌组织临床病理特征,研究发现RNF6高表达与血管侵犯及肿瘤微卫星灶的形成相关,提示RNF6可能与肿瘤转移相关。RNF6还可调控EMT相关蛋白Claudin-1、Vimentin、Snail1、ZEB1、ZEB2的表达,促进结直肠癌的转移[14]。在胰腺癌中,RNF6通过泛素化降解MAD1上调c-myc表达,促进细胞瓦伯格效应(Warburg effect)的发生,介导肿瘤转移[22]。乳腺癌中,RNF6通过泛素化降解MST1调控Yes相关蛋白(YAP)的转录,促进细胞的迁移与侵袭[16,31]。
2.5 RNF6与肿瘤治疗
肝癌细胞中,EMT与肿瘤耐药的发生密切相关[32]。敲低RNF6可通过抑制EMT抑制肝癌细胞对5-氟尿嘧啶(5-FU)的敏感性[17],提示RNF6可介导肝癌细胞的化疗耐药。浸润性乳腺导管癌中,RNF6可通过增强乳腺癌受体ERα的稳定性介导乳腺癌细胞化疗耐药[16]。PBX1突变白血病患者通常可受益于化疗,但治疗后期易出现耐药。研究显示PBX1通过上调RNF6的表达介导细胞对化疗药物的耐药,提示RNF6或可作为提高PBX1突变患者化疗疗效、抑制化疗耐药的作用靶点[12]。STAT3的过度激活可导致胃癌患者化疗耐药。RNF6可通过上调STAT3的表达介导胃癌细胞对阿霉素的耐药,提示抑制RNF6表达或可作为提高胃癌患者阿霉素疗效的一种方法[18]。环指蛋白结构域可与顺铂等化疗药物结合[33]。运用液相色谱质谱联用技术,Qin等[34]发现RNF6在顺铂耐药A549肺癌细胞中高表达,提示RNF6可能与肺癌顺铂耐药相关。RNF6在放疗耐受结直肠癌患者肿瘤组织中高表达,提示RNF6可能与结直癌放疗疗效相关[35]。此外,抑制肝癌细胞中RNF6的表达可增强紫外辐射对细胞的损伤,抑制细胞增殖,提示RNF6可能与肝癌放射治疗抵抗相关[17]。
3 RNF6的在肿瘤发生发展过程中的作用机制
3.1 RNF6与蛋白泛素化降解
泛素-蛋白酶体系统主要由泛素、泛素激活酶E1(ubiquitin-activating enzyme)、泛素结合酶E2(ubiquitin-conjugating enzyme)、泛素连接酶E3(ubiquitin ligase)、26S蛋白酶体及去泛素化酶(deubiquitinase, DUB)构成,是细胞内蛋白降解的重要途径之一。泛素连接酶E3对靶蛋白具有选择特异性,可通过介导靶蛋白K48位点的泛素化促使靶蛋白被26S蛋白酶体识别,引起蛋白降解[36]。
RNF6可通过泛素-蛋白酶体系统降解靶蛋白。RNF6可通过K48位点泛素化降解分裂蛋白转导素样增强子TLE3(transducin-like enhancer of split 3),促进TCF4与β-catenin的结合,激活Wnt/β-catenin通路,介导结直肠癌的发生[14]。在食管鳞癌、胃癌、结直肠癌发生过程中,RNF6可通过K48位点泛素化降解蛋白酪氨酸磷酸酶SHP1(SH2-containing protein tyrosine phosphatase 1),促进STAT3的磷酸化,激活JAK/STAT3通路[13,18-19]。RNF6还可与重要抑癌基因p53结合并通过泛素化下调其表达[37]。此外,RNF6还可通过K48位点泛素化降解FoxA1[17]介导肝癌细胞的迁移、侵袭及5-氟尿嘧啶耐药;通过泛素化降解MAD1上调c-myc的表达[22],通过泛素化降解MST1调控YAP转录[31]。
3.2 RNF6与泛素化修饰
除通过K48位点的泛素化介导蛋白降解外,RNF6还可通过泛素化修饰改变蛋白功能,如通过泛素化修饰转录因子增强其对靶基因转录的调控作用[38]。
前列腺癌是一种依赖雄激素(androgen receptor, AR)驱动的恶性肿瘤。RNF6可与AR结合,介导AR K6及K27位点的多泛素化。此外,RNF6还可诱导AR的AF2结构域发生K845位点的多泛素化,招募含有泛素结合域UBD序列的转录辅助因子ARA54,调控AR下游靶基因的转录[11]。RNF6可与糖皮质激素受体(glucocorticoid receptor, GR)的配体结合结构域相结合,促使其发生K63位点多泛素化,增强其稳定性,促进GR下游基因Bcl-xL、Mcl-1转录,介导多发性骨髓瘤的发生[21]。
3.3 RNF6与转录调控
此外,在化学诱导的转基因小鼠结直肠癌模型中,Hui等[39]通过ChIP实验发现RNF6可直接与SF3B2启动子结合,上调SF3B2表达。ChIP-seq/RNA-seq整合分析显示: RNF6对SF3B2转录调控作用可能与泛素化不相关。其具体作用机制有待进一步探索。
4 RNF6与其他疾病
除恶性肿瘤外,RNF6还与多种良性疾病的发生相关。Bin等[6]发现RNF6在创伤性脑损伤大鼠脑组织中高表达,且抑制RNF6表达可改善脑水肿及组织炎症反应。Li等[7]的研究显示曲克芦丁通过抑制STAT3/RNF6信号通路发挥降压作用,且过表达RNF6可抑制曲克芦丁对炎症和氧化应激的作用。在大鼠多囊卵巢综合征模型中,RNF6可介导雄激素受体K48位点的泛素化,下调GDF9及sKit-L的表达,阻滞窦卵泡的生长[5]。Stepaniants等[8]对43名吸烟者肺组织进行了RNA测序,鉴定出包括RNF6在内的181个与肺泡表面积/肺体积比值(SA/V)相关的差异基因,并验证了在慢性阻塞性肺疾病患者肺组织中,RNF6蛋白及mRNA水平表达均下调,提示RNF6与慢性气道炎症相关。

表1 RNF6在恶性肿瘤中的作用及机制
5 展 望
近年来,随着大量关于RNF6的研究的开展,人们对RNF6的生物学作用有了新的认识。作为E3泛素连接酶RING家族成员,RNF6可通过其C端所含RING-H2结构域介导底物蛋白K48位点的多泛素化降解。此外,RNF6还可介导底物蛋白K6、K27、K63、K845位点的多泛素化修饰,改变蛋白功能。然而,随着研究的进一步深入,其他泛素化位点(如: K11、K29和K33位点[41])受到了越来越多的关注。RNF6对靶蛋白K11、K29和K33等位点的泛素化是否具有调控作用需要进一步研究明确。
除多泛素化外,E3泛素连接酶还可通过引起靶蛋白的单泛素化调控蛋白的功能。单泛素化作用在RNF6对靶蛋白的调控过程中是否存在尚未明确。已有研究显示: RING家族成员(如RNF8[42]、RNF31[43])可通过诱导雌激素受体ERα的单泛素化提高其稳定性[42]。Zeng等[16]的研究显示: RNF6可提高ERα的稳定性,且这一作用是通过其RING结构域产生的,提示RNF6对ERα可能具有单泛素化作用,但仍需进一步实验证实。
此外,研究发现,RING家族成员可通过其环指结构域引起组蛋白泛素化[44]在转录调控方面发挥重要作用[45]。常见泛素化位点包括组蛋白H2A的K118、K119位点及组蛋白H2B的K120位点[46]。已有研究显示,环指蛋白RNF8可通过组蛋白H3的泛素化促进肿瘤细胞的糖酵解,与恶性肿瘤脑转移相关[47]。环指蛋白RNF20、RNF40可通过介导组蛋白H2B的单泛素化促进DNA双键断裂修复[48]。环指蛋白RNF168可通过单泛素化组蛋白H2A调控DNA复制[49]。RNF6可否引起组蛋白泛素化尚需实验证实[46]。
目前,针对RNF6的环指结构域的研究较为丰富,但其所含CC结构域、KIL结构域及PSH结构域的功能与作用尚未明确。Xu等[39]的研究显示: RNF6对SF3B2转录调控作用不依赖于泛素化,提示了其螺旋-卷曲结构域(CC结构域)、KIL结构域及PSH结构域对其分子功能或有重要影响。其中,CC结构域与转录调控密切相关[50]。如RNF20/RNF40/WAC复合体可通过其CC结构域与肿瘤抑制蛋白p53发生相互作用,调控p53下游基因转录[29]。RNF6是否通过CC结构域调控SF3B2转录有待进一步研究证实。
RNF6起初被认为可能是抑癌基因[10],但目前研究认为RNF6在恶性肿瘤中发挥促癌作用。RNF6可促进肿瘤细胞的增殖、迁移、侵袭及G1/S期转化,抑制肿瘤细胞凋亡。Liang等[13]通过基因集富集分析(GSEA)推测: RNF6或在补体激活及炎症反应调控方面具有重要的作用,但仍需实验验证。非酒精性脂肪肝是一种常见的获得性代谢应激性肝损伤[51],Jin等发现RNF6在非酒精性脂肪肝组织中表达上调[52],Yang等[53]发现RNF6在Ⅱ型糖尿病患者血清中表达上调[53],这些均提示RNF6在代谢方面或具有重要的作用,有待进一步研究明确。靶向抑制RNF6在抑制肿瘤发生发展,逆转化疗耐药性方面具有重要的意义。抗氧化酚剂鞣花酸可通过抑制RNF6的表达抑制食管鳞癌细胞的增殖[19],但其对临床的意义与价值仍需进一步研究验证。其他RNF6选择性抑制剂的开发具有重要价值,或可为肿瘤的治疗提供一个潜在的途径。
综上,RNF6介导前列腺癌[11]、白血病[12]、结直肠癌[13-15]、乳腺癌[16]、肝癌[17]、胃癌[18]、食管鳞癌[19]、宫颈癌[20]、多发性骨髓瘤[21]等多种恶性肿瘤的发生发展,并与顺铂[34]、5-氟尿嘧啶[17]、阿霉素[12,18]、5-氨基-8-羟基喹啉[16]等药物耐药相关。相信未来随着研究的深入,RNF6有望成为判断肿瘤预后和化疗疗效的分子标志,并为阻断肿瘤发生发展提供新的靶点。
