奥拉帕利联合GANT61对卵巢癌细胞增殖和凋亡的影响
2022-11-07江皓男古扎努尔阿吾提王家坡郭晓青
李 莉, 江皓男, 古扎努尔·阿吾提, 王家坡, 陆 芸, 刘 娜, 郭晓青
(同济大学附属第一妇婴保健院妇科,上海 201204)

胶质瘤相关癌基因同源物(glioma-associated oncogene homolog 1, GLI1)GLI1最初被鉴定为恶性神经胶质瘤中的扩增基因,是Hedgehog(Hh)信号通路转导的转录靶标[6-7]。研究表明,GLI1在共济失调毛细血管扩张突变基因ATM(ataxia-tela-ngiectasia mutated, ATM)介导的DNA损伤反应(DNA damage response, DDR)信号、细胞凋亡、肿瘤耐药中起着至关重要的作用,从而导致癌细胞存活和进展[8]。本研究前期通过String数据库验证GLI1与DNA损伤修复途径相关蛋白(BRCA1、BRCA2等)具有相互作用,并且进一步通过GEPIA数据库验证GLI1与BRCA1、BRCA2、ATM、H2AFX、DDB1、E2F1、CHEK1、XRCC5等DNA损伤修复途径相关蛋白具有密切相关性。GANT61是GLI1的靶向抑制剂,能阻断GLI1与DNA的序列结合[9-10]。对GLI1及其靶向抑制剂GANT61在卵巢癌细胞PARP抑制剂敏感性中的作用却鲜有报道。本研究旨在探讨GLI1及其靶向抑制剂GANT61对卵巢癌细胞PARP抑制剂敏感性的影响,并分析其作用机制。
1 材料与方法
1.1 标本收集及细胞系

1.2 细胞、试剂及仪器
正常卵巢细胞株IOSE80和卵巢癌细胞株HEY、A2780、SK-OV-3、ES-2购自中科院上海生命科学研究院细胞库。DMEM培养基、RPMI-1640培养基、PBS购自以色列BI公司;胎牛血清(FBS)购自美国Gibco公司;RIPA全蛋白裂解液购自上海威奥生物科技有限公司;CCK8试剂购自苏州新赛美生物科技有限公司;AnnexinⅤ-PE/7AAD凋亡试剂购自美国BD公司;结晶紫购自上海碧云天生物技术有限公司;Edu-555细胞增殖检测试剂盒购自上海雅酶生物医药科技有限公司;GANT61抑制剂和olaparib购自美国MCE公司;抗体GLI1、β-actin购自中国Proteintech公司;抗体γ-H2AX购自武汉赛维尔生物科技有限公司;荧光倒置显微镜购自日本Olympus公司;流式细胞仪购自美国BD公司。
1.3 实验方法
1.3.1 Western印迹法 收集组织或细胞系以及处理的细胞后,使用包含蛋白酶抑制剂、磷酸酶抑制剂和PMSF的RIPA全蛋白裂解液冰上(4 ℃)裂解组织和细胞30 min,随后4 ℃离心(离心半径13.5 cm,12 000 r/min,30 min),提取上清液后使用BCA蛋白质测定法测定蛋白质浓度。然后将样品在10%、12.5%的SDS-PAGE中分离并转移至PVDF膜。随后洗膜(TBST洗膜3次,每次10 min)。室温下在3%BSA封闭液中封闭1 h,洗膜。然后根据marker剪下目的蛋白所在的蛋白位置。然后与β-actin、GLI1、γ-H2AX的一抗一起4 ℃孵育过夜。孵育过夜回收一抗,洗膜,然后与兔或小鼠二抗在室温下孵育1 h,洗膜,最后利用显影仪进行ECL显色,并利用Image J系统对图像进行处理与分析。
1.3.2 CCK8检测细胞活力 取ES2对数生长期细胞制成单细胞悬液,100 μL的3 000个细胞每孔接种于96孔培养板中放置培养箱培养24 h后,将细胞分4组处理细胞(对照组、GANT61、olaparib、GANT61和olaparib联合组),分别加入GANT61、olaparib不同处理药物浓度,置常规培养箱中培养72 h后,每孔加入CCK8试剂10 μL,37 ℃孵育2 h;酶标仪检测波长450 nm处吸光度值(A450),求其平均值,并计算细胞抑制率,抑制率(%)=(1-实验组OD值/对照组OD值)×100%,并绘制细胞生长抑制曲线。
1.3.3 平板克隆 将细胞以每孔3 000个细胞接种到12孔板中。第2天将细胞分4组,每组3个复孔。细胞在不同的处理组下(对照组、GANT61 16 μmol/L、olaparib 16 μmol/L、GANT61和olaparib联合组)处理7 d后,弃掉原有培养基,用PBS洗涤,然后用4%的多聚甲醛固定15 min,固定后再同PBS洗涤3次,最后用结晶紫将菌落染色30 min。
1.3.4 EdU细胞增殖实验 以每孔8×104细胞密度接种到24孔板中,细胞接种24 h后将不同处理的药物处理细胞24 h,24 h处理后每孔加入10 μmol/L EdU在37 ℃下孵育2 h,然后在室温下用4%多聚甲醛固定15 min。然后3%BSA洗涤细胞3次,每次3 min,接着用0.3% Triton X-100处理15 min和500 μL Apollo®混合物避光处理30 min,然后加入DAPI处理20 min以标记细胞核。EdU染色的细胞(带有红色荧光)与DAPI染色的细胞(带有蓝色荧光)的比率用于评估细胞增殖。使用荧光显微镜以200倍放大率随机拍摄6个视野并用Image J软件分析图像。
1.3.5 流式细胞仪测凋亡 通过AnnexinⅤ-PE/7AAD双染色法评估不同处理组处理72 h后凋亡的细胞。然后根据制造商的说明书用AnnexinⅤ-PE和7-AAD-FITC染色细胞15 min。使用流式细胞仪进行检测,对细胞进行设门,AnnexinⅤ-PE和7AAD作为对照,AnnexinⅤ-PE+和7AAD-作为早期凋亡,AnnexinⅤ-PE+和7AAD+作为晚期凋亡。数据结果FlowJo V软件分析。
1.3.6 免疫荧光 以每孔8×104细胞密度接种到24孔板中,细胞接种24 h后将不同处理的药物处理细胞24 h,然后在室温下用4%多聚甲醛固定20 min,用0.3% Triton X-100透化15 min,然后用免疫荧光封闭液封闭30 min。用PBS冲洗细胞并在4 ℃下在含有一抗兔单克隆抗体γ-H2AX的稀释缓冲液中孵育过夜。用PBS洗涤细胞3次。然后,将细胞与山羊抗兔IgG的Alexa Fluor片段孵育1 h,并使用DAPI进行细胞核复染。最后,使用荧光显微镜以200倍放大率观察细胞。
1.4 统计学处理
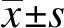
2 结 果
2.1 GLI1在卵巢癌组织和卵巢癌细胞系中高表达
通过蛋白质印迹分析以确定GLI1在正常卵巢上皮和上皮性卵巢癌组织中的表达情况,收集8例因其他子宫良性疾病手术切除的正常卵巢上皮组织和27例上皮性卵巢癌组织,结果显示,与正常卵巢上皮组织相比,GLI1在上皮性卵巢癌组织中的蛋白表达水平显著上调(P<0.01),见图1A、B。此外,与正常卵巢上皮细胞IOSE80相比,GLI1在卵巢癌细胞系中的蛋白表达水平显著升高(P<0.01),见图1C、D。其中,ES2细胞相较于其它卵巢癌细胞GLI1表达水平较高。因此,选用ES2细胞做进一步细胞生物学功能实验研究。

图1 GLI1在上皮性卵巢癌组织和细胞系的表达情况Fig.1 Expression of GLI1 in epithelial ovarian cancer tissues and cell linesA、B: Western印迹法检测正常卵巢上皮和上皮性卵巢癌组织中GLI1的表达情况(部分典型病例),其中N代表正常卵巢上皮组织,T代表癌组织;C、D: Western印迹法检测正常卵巢细胞IOSE80和卵巢癌细胞株GLI1表达情况;与IOSE80细胞相比,*P<0.05
2.2 GANT61抑制卵巢癌细胞生长和促进细胞凋亡
为了评估GLI1抑制对卵巢癌细胞存活能力的影响,首先使用梯度浓度GANT61(GLI1抑制剂)处理ES2细胞72 h,通过CCK8检测细胞活力。CCK8结果表明,随着GANT61浓度的递增,GANT61对ES2细胞的细胞生长抑制能力逐渐增加,表明GANT61以浓度依赖性方式抑制细胞活性,见图2A。与CCK8实验结果一致,平板克隆实验结果显示,随着GANT61浓度梯度增加,ES2细胞克隆形成数量逐渐减少,差异均具有统计学意义(P<0.05),见图2B、C。增殖和凋亡是评估肿瘤细胞存活能力的两大因素。因此,接下来评估GNAT61对卵巢癌细胞凋亡的影响。通过AnnexinⅤ/7AAD双染实验研究发现,在GANT61处理ES2细胞72 h后,细胞凋亡率随着GANT61浓度的增加而逐渐增加(P<0.05),见图2D、E。以上结果表明GLI1抑制剂GANT61能抑制卵巢癌细胞生长和促进卵巢癌细胞凋亡。

图2 GANT61对卵巢癌细胞增殖和凋亡情况Fig.2 The effect of GANT61 on the proliferation and apoptosis of ovarian cancer cellsA: CCK8法检测GANT61单药处理72 h后对卵巢癌细胞ES2增殖率的影响;B、C: 平板克隆实验检测不同浓度GANT61单药处理7 d后对卵巢癌细胞ES2克隆形成的影响;D、E: 流式细胞术检测不同浓度GANT61单药处理72 h后对卵巢癌细胞ES2凋亡率影响;与未处理组相比,*P<0.05,**P<0.01,***P<0.001
2.3 GANT61联合olaparib显著抑制卵巢癌细胞的生长和诱导细胞凋亡
为了评估GANT61与olaparib联合疗法在卵巢癌中的抗肿瘤效应,GANT61(16 μmol/L)和olaparib(16 μmol/L)分别以及联合作用于ES2细胞,通过平板克隆实验以及EDU实验检测肿瘤细胞克隆形成能力和增殖能力。平板克隆实验结果表明,与GANT61或olaparib单药处理相比,GANT61与olaparib联合组能显著抑制肿瘤细胞克隆形成能力(P<0.001),见图3A、B。与上述平板克隆实验结论一致的是,EdU实验也表明GANT61联合olaparib较GANT61和olaparib能显著抑制肿瘤细胞增殖能力(P<0.001),图3C、D。同时,为了检测GANT61联合olaparib在卵巢癌细胞中的凋亡诱导能力,通过AnnexinⅤ-PE/7AAD双染色法检测凋亡细胞比例。结果显示,GANT61联合olaparib诱导的ES2细胞凋亡比例为25.87%±0.82%,分别显著高于GANT61组(19.46%±0.18%)以及olaparib组(16.87%±0.58%,均P<0.001),表明GANT61联合olaparib能显著诱导卵巢癌细胞凋亡,见图3E、F。综上表明,GANT61与olaparib联合疗法能显著抑制卵巢癌细胞的生长并且诱导卵巢癌细胞凋亡。

图3 各药组对卵巢癌细胞增殖和凋亡情况Fig.3 Effects on the proliferation and apoptosis of ovarian cancer cells in the treatment groupsA、B: 平板克隆实验检测对照组、GANT61组、olaparib组和olaparib联合GANT61组处理7 d后对卵巢癌细胞ES2克隆形成的影响;C、D: EdU实验检测对照组、GANT61组、olaparib组和olaparib联合GANT61组处理72 h后对卵巢癌细胞ES2克隆形成的影响;E、F: 流式细胞术检测对照组、GANT61组、olaparib组和olaparib联合GANT61组处理72 h后对卵巢癌细胞ES2凋亡率影响;与对照组相比,*P<0.05,**P<0.01,***P<0.001;与olaparib联合GANT61组相比,#P<0.05,##P<0.01,###P<0.001
2.4 GANT61增强olaparib诱导的卵巢癌细胞DNA损伤
目前,γ-H2AX的水平已经成为公认的DSB发生早期的标志[11-12]。随后,为了探究GANT61联合olaparib在卵巢癌细胞中诱导DNA损伤的效应。通过Westorn印迹法发现,相较于GANT61或olaparib,GANT61联合olaparib显著上调了ES2细胞中DNA损伤标志物γ-H2AX的表达。从图4A中可以看出,用16 μmol/L GANT61单独处理ES2细胞后,与对照组细胞相比可观察到γ-H2AX蛋白水平增加。然而,GANT61和olaparib组合处理癌细胞,能观察γ-H2AX蛋白的表达明显增加。这说明GANT61可能诱导DNA损伤从而增强olaparib对癌细胞的DNA损伤功能。与上述结论一致的是,通过免疫荧光发现,GANT61联合olaparib诱导的γ-H2AX灶点形成(14.50%±3.55%)显著高于GANT61组(5.50%±1.80%)和olaparib组(4.33%±2.29%,均P<0.05)见图4B、C。以上结果表明,GANT61能够增强olaparib诱导的卵巢癌细胞DNA损伤。

图4 各药组诱导的卵巢癌细胞DNA损伤的情况Fig.4 The DNA damage induced by the treatment groups in ovarian cancer cellsA: Western印迹法检测对照组、GANT61组、olaparib组和olaparib联合GANT61组处理72 h后ES2细胞DNA双链损伤标志物γ-H2AX的表达水平;BC: 免疫荧光检测对照组、GANT61组、olaparib组和olaparib联合GANT61组处理72 h后ES2细胞中γ-H2AX灶点形成情况;与对照组相比,*P<0.05,**P<0.01,***P<0.001;与olaparib联合GANT61组相比,#P<0.05,##P<0.01,###P<0.001
3 讨 论
卵巢癌是死亡率最高的妇科恶性肿瘤[1]。近年来,随着PARP抑制剂陆续获批进入临床,靶向疗法已成为临床治疗卵巢癌的新兴疗法。多项大型临床试验均表明PARP抑制剂的应用为卵巢癌患者带来了巨大的临床获益[13-17]。但随着PARP抑制剂的广泛应用,卵巢癌患者对其耐受的风险亦随之增加,因此开发一种新的以联合疗法为核心的治疗策略以改善治疗反应和克服药物耐受势在必行。目前一些临床前证据表明,PARP抑制剂与靶向药物联合治疗癌症具有明显的抗肿瘤效应,包括共济失调毛细血管扩张突变基因Rad3相关激酶(ATM-and rad3-related, ATR)、ATM、组蛋白去乙酰化酶(histone deacetylase, HDAC)、蛋白激酶WEE1(wee1 g2 checkpoint kinase)、细胞周期检测点激酶1/2(checkpoint kinases 1 and 2, CHK1/2)抑制剂[18-21]。以上有效的PARP抑制剂联合治疗的基本原理是靶向药物通过产生DNA损伤或调节DNA损伤修复途径来增强PARP抑制剂的抗肿瘤作用。
PARP抑制剂的作用机制是抑制PARP酶介导的碱基切除修复(base-excision repair, BER)、上调非同源末端连接修复(non-homologous end joining repair, NHEJ)以及PARP酶捕获[22]。PARP抑制剂抑制PARP酶参与的BER途径,而基于BER途径修复的DNA单链断裂(single-strand breakage, SSB)进而被诱导成DNA双链断裂(double-strand breakage, DSB)。DNA损伤在每个细胞周期中频繁发生,HR通路能进行精确修复DSB以保护细胞基因完整性、稳定和利于细胞生存。BRCA1和BRCA2是HR修复通路的主要成分。然而,在HR缺陷的癌细胞中,由PARP抑制剂诱导的DSB通过容易出错的NHEJ进行修复,导致染色体重排、基因组不稳定和随后的细胞死亡[23-24]。
前期生物信息学分析发现,GLI1与同源重组修复途径相关蛋白的表达密切相关。Ming等[25]的研究发现GLI1过表达可上调ATM的磷酸化水平,增强DNA损伤修复能力,这提示GLI1表达或与卵巢癌的PARP抑制剂敏感性相关。本研究发现,与正常卵巢组织和正常卵巢上皮细胞相比,GLI1在上皮性卵巢癌组织以及卵巢癌细胞系中高表达,与既往研究报道一致[26]。据报道,GLI1异常激活与多种癌症预后不良相关,例如口腔鳞状细胞癌、乳腺癌、肺癌和急性髓性白血病等[27-30]。GLI1除了调控肿瘤生长,GLI1还在诱导癌细胞产生化学抗性方面发挥着突出作用。多项研究报道,GLI1通过诱导多药耐药基因MDR1(multidrug resistance 1)的表达促进卵巢癌细胞紫杉醇化疗耐药以及化疗后胶质瘤患者的复发[31-32]。以上报道提示了GLI1在多种癌症的发展和进展中具有重要作用,GLI1未来可能成为研究并治疗癌症的潜在的分子标志物。
为了深入探究GLI1在卵巢癌中的作用,通过使用GANT61(GLI1靶向抑制剂)发现,GANT61以剂量依赖性的方式抑制卵巢癌细胞的存活和增殖并诱导细胞凋亡。与对照组相比,GANT61(16 μmol/L)处理卵巢癌细胞株ES2 72 h后,DNA损伤标志物γ-H2AX 的表达水平上调以及γ-H2AX灶点数量增加。γ-H2AX作为DNA损伤标志物,在细胞出现DNA损伤时被检测到[33-34],而当DNA损伤持续存在时,细胞启动凋亡程序发生凋亡[35-36]。在Mazumdar等[9]的研究中,GANT61处理结肠癌细胞48 h可抑制GLI1,诱导细胞DNA损伤和广泛细胞死亡,并且上调ATM,H2AX和DNA损伤检查点蛋白1(mediator of DNA damage checkpoint protein 1, MDC1)的磷酸化水平。Mazumdar等[9]的研究和本研究结果提示了可能GANT61抑制GLI1的表达,从而诱导DNA损伤进而促进细胞凋亡,抑制细胞增殖。此外,本研究还发现GANT61联合olaparib能够显著抑制卵巢癌细胞增殖并诱导其凋亡,GANT61联合olaparib能够上调γ-H2AX表达并且诱导更多的γ-H2AX灶点形成,表明GANT61可能通过诱导DNA损伤从而使卵巢癌细胞对PARP抑制剂敏感。然而,GLI1抑制剂是否通过诱导DNA损伤从而导致卵巢癌的PARP抑制剂敏感性则需进一步的研究证实。
综上,本研究结果表明,与单一疗法相比,GLI1抑制剂和PARP抑制剂的联合疗法能有效抑制卵巢癌细胞的存活和增殖并且诱导凋亡。但GLI1抑制剂和PARP抑制剂的联合治疗卵巢癌确切作用机制仍需进一步研究。
