短时程脊髓电刺激治疗爆发痛合并触诱发痛的急性期带状疱疹的临床研究
2022-11-07王纪鹰薛旺生徐伟胜王兴金张孝谱林福清
王纪鹰, 薛旺生, 齐 慧, 潘 涛, 金 童, 姚 萍,徐伟胜, 王兴金, 张孝谱, 林福清
(同济大学附属第十人民医院疼痛科,上海 200072)
带状疱疹神经痛(herpetic neuralgia, HN)是水痘-带状疱疹病毒感染后累及周围神经所产生的严重并发症之一,属于典型神经病理性疼痛,表现为针刺样、烧灼样或电击样痛,还可出现触诱发痛、痛觉超敏、自发痛及异常性疼痛等[1-2]。临床上30%的急性期带状疱疹神经痛患者会同时合并痛觉敏化,常表现为爆发痛或触诱发痛,此类患者往往疼痛程度明显,神经损伤严重、常规药物或神经阻滞治疗效果不佳,治疗难度大,且后遗痛发生率高。所以寻求确切有效的急性爆发性带状疱疹神经痛的治疗方式是疼痛科医师临床关注的热点。

1 资料与方法
1.1 一般资料
本研究经过同济大学附属第十人民医院医学伦理委员会批准(伦理批件号: SHSY-IEC-4.1/20-190/01),选取了2020年1月—2020年12月在同济大学附属第十人民医院疼痛科住院的急性爆发痛难治性带状疱疹神经痛患者,初步筛选出63例接受tSCS治疗的急性爆发痛难治性带状疱疹患者,符合本研究纳入和排除标准的患者共52例。

排除标准: (1) 病程在3个月以上;(2) 带状疱疹疼痛区域累计头面部;(3) 因电极移位或感染而导致治疗中断的患者;(4) 在半年随访期间接受其他有创性治疗(针灸、植入永久电刺激或介入治疗);(5) 局部或全身感染;(6) 凝血功能异常;(7) 恶 性肿瘤活动期患者或者其他精神疾病患者;(8) 脊柱区域手术后或者椎关节强直或严重脊柱侧弯;(9) 不配合后续治疗或随访。
1.2 操作方法
1.2.1 术前准备 术前标记疼痛部位,美国Medtronic公司电极线及电脉冲发生器、穿刺针等。
1.2.2 手术操作 患者俯卧位,胸腹部垫高,手术区域消毒铺巾并局部麻醉,在数字减影血管成像技术(digital subtraction angiography, DSA)透视引导下,行硬膜外腔穿刺,有穿刺落空感即穿刺至硬膜外腔,回抽应无血液和脑脊液,侧位透视确认针尖位置。取出穿刺针芯,置入脊髓电刺激电极线(型号: 3874,美敦力,美国)。正位透视下将植入电极放置相应目标脊髓节段的背根神经,侧位透视确认电极线位置在脊髓背侧(图1)。术中测试,根据患者反馈结果,微调电极线位置,退出穿刺针,电极线绕圈形成“缓释环”,缝线固定。予以腹带固定,平卧位护送回病房。
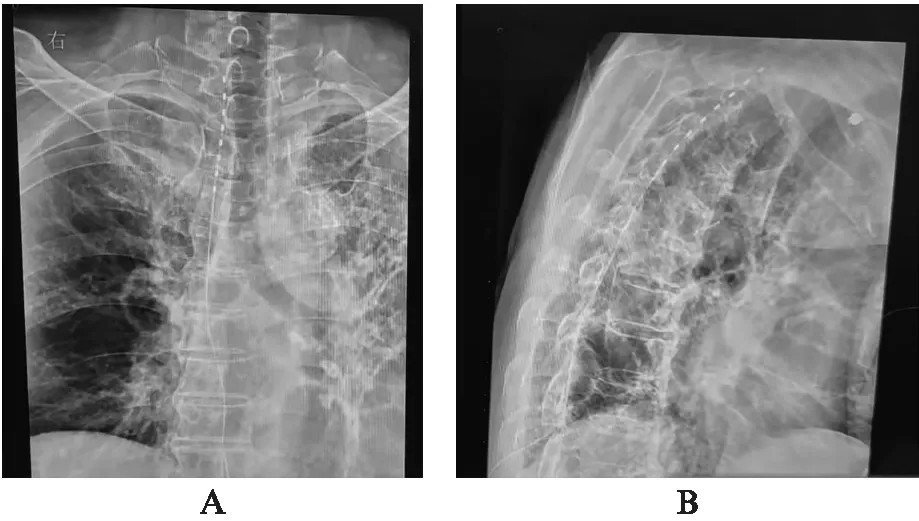
图1 短时程脊髓电刺激术中透视片Fig.1 X-ray diagram of temporary spinal cord stimulationA: 正位片;B: 侧位片确认电极线位置在脊髓背侧
1.2.4 术后用药 术后根据疼痛情况,在医生指导下继续服用或者逐渐停用各类止痛药(包括抗惊厥药物、非甾体抗炎药、弱阿片类药物),并做相关记录。
1.3 观察指标

1.4 统计学处理
2 结 果
2.1 一般资料

2.2 术前术后疼痛情况的比较
与治疗前比较,患者治疗后3 d、7 d、14 d、3个月、6个月 时的总体疼痛NRS评分、MCGILL评分明显降低,差异均有统计学意义(均P<0.001),见表1。与治疗前比较,患者治疗后3 d、7 d、14 d、3个月、6个月时的静息痛NRS评分明显降低,差异均有统计学意义(均P<0.001),见表1。随访3 d、7 d、14 d、3个月、6个月时的爆发痛的发生率分别86%(44/51)、27%(14/51)、8%(4/51)、6%(3/51)和6%(3/51);与治疗前比较,患者治疗后3 d、7 d、14 d、3个月、6个月时的爆发痛NRS评分明显降低,差异均有统计学意义(均P<0.05),治疗后14 d、3个月、6个月时的爆发痛次数以及持续时间都明显降低,差异均有统计学意义(均P<0.05),见表2。随访3 d、7 d、14 d、3个月、6个月时的触诱发痛的发生率分别92%(47/51)、86%(44/51)、78%(40/51)、75%(38/51)和75%(38/51);与治疗前比较,患者治疗后7 d、14 d、3个月、6个月时的触诱发痛的分级都明显降低,差异均有统计学意义(均P<0.05),见表3。
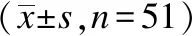
表1 治疗前后疼痛的NRS、McGill评分比较
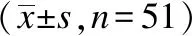
表2 治疗前后BTP的发生率、NRS评分、次数、持续时间
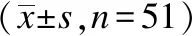
表3 治疗前后触诱发痛的发生率、分级比较
2.3 术前术后睡眠情况的比较
与治疗前比较,患者治疗后14 d、3个月、6个月时的夜间睡眠时长、睡眠中醒来次数无明显改变,差异无统计学意义(P>0.05),见表4。
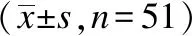
表4 治疗前后睡眠时长、醒来次数、PDI、KPS、PHQ-9、GAD-7的比较
2.4 术前术后生活质量的比较
与治疗前比较,患者治疗后14 d、3个月、6个月时的PDI明显减少,差异均有统计学意义(P<0.001),详见表5;与治疗前比较,患者治疗后各时间点的KPS无明显改变,差异均有统计学意义(均P<0.05),见表4。
2.5 术前术后心理情况的比较
与治疗前比较,患者治疗后14 d、3个月、6个月时的PHQ-9、GAD-7明显减少,差异均有统计学意义(均P<0.05),见表4。
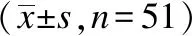
表5 治疗前后用药人数比较
2.6 术后带状疱疹后遗神经痛发生率
随访治疗后3、6个月带状疱疹神经痛发生率,分别是37.25%(19/51)、33.33%(17/51)的患者。
2.7 术后疗效评定
治疗后6个月时,显著患者例数8例(15.69%),良好患者例数24例(47.06%),中等患者14例(27.45%),无效患者5例(9.80%),总有效率32例(62.75%)。
2.8 不良反应
术中及整个随访期间未观察到严重不良事件。无患者因不良反应而退出tSCS治疗。随访6个月共有轻微电极移位(24例),但均不影响tSCS的治疗。
2.9 术前术后镇痛药物使用人数的比较
本研究中患者所使用的镇痛药物包括抗惊厥药物、非甾体抗炎药、弱阿片类药物。在治疗后14 d、3个月、6个月 的随访时间点,与术前的药物使用情况相比,各镇痛药使用人数普遍呈下降趋势,见图5。
3 讨 论
目前,急性期带状疱疹神经痛的治疗以药物治疗或联合微创介入治疗为主,大多数患者都能获得较好疗效。但临床上,仍有30%的急性期带状疱疹神经痛患者可能会同时合并爆发性疼痛或触诱发痛[10],爆发性疼痛,简称爆发痛(breakthrough pain, BTP),通常是指在已经使用阿片类药物进行持续镇痛治疗的基础上,出现超过背景疼痛的突发性、剧烈的、短时间恶性疼痛[11]。触诱发痛,是指非伤害性刺激对皮肤引起的疼痛,表现为受损区域不能耐受触摸或衣服摩擦,极大影响患者的生活质量[12]。此类患者通常疼痛程度较高,神经损伤严重,并且常规治疗效果不佳,带状疱疹性后遗痛(postherpetic neuralgia, PHN)发生率高。所以寻求确切有效的方法治疗急性期带状疱疹神经痛合并爆发痛和触诱发痛的患者是目前疼痛科医师临床关注的重点。
作为一种新型的神经调控手段,脊髓电刺激术(spinal cord stimulation, SCS)的镇痛理论是基于1965年由Melzak等提出的疼痛“闸门控制学说”,认为非伤害感受性纤维,作为一种可被激活但不传递疼痛信号的神经,能够干涉来自疼痛纤维(Aβ和C纤维)的信号,在疼痛的信号到达大脑前被电脉冲信号阻断,从而达到控制疼痛的目的[13]。国内外数篇文献报道;短时程脊髓电刺激术(temporary spinal cord stimulation, tSCS)能确实有效地治疗急性带状疱疹神经痛、改善患者生活质量并预防PHN的发生[3-9,14-16]。但tSCS对于“敏化”的带状疱疹神经痛——急性带状疱疹神经痛合并爆发痛及触诱发痛的疗效如何?目前只有极少数文献报道。2020年,蔡少康等[17]回顾性分析了使用tSCS治疗的33例带状疱疹后遗神经痛合并爆发痛患者的临床疗效并随访3个月,提示tSCS对带状疱疹后遗神经痛合并爆发痛有较好的临床镇痛疗效。这也与本研究结果相符,在本研究中术后6个月患者的总体疼痛、静息痛、爆发痛、触诱发痛的程度以及止痛药物的使用情况都明显下降,具有统计学意义(P<0.01),提示了tSCS的确对带状疱疹合并爆发痛及触诱发痛具有良好的临床疗效。
带状疱疹的爆发痛,是不依赖刺激的爆发痛,可能由于中枢敏化导致痛阈降低,而使损伤的脊髓背角的伤害性被刺激无限放大的结果。而SCS治疗通过将刺激电极置入椎管硬膜外间隙后部,持续性对脊髓背角、背根神经进行电刺激,减少疼痛信号的传导,从而降低神经可塑性改变,遏制中枢神经敏化[18-19]。在本研究中,患者术后3 d、7 d、14 d、3个月、6个月时的爆发痛的发生率分别86%(44/51)、27%(14/51)、8%(4/51)、6%(3/51)和6%(3/51);同时观察到术后3 d的爆发痛疼痛程度立刻有明显的改善,术后7 d的爆发痛发生率有明显的减少,术后14 d的爆发痛的次数和持续时间有明显的缓解。提示tSCS可能通过抑制中枢敏化而减少爆发痛的发生,有着良好的即时镇痛疗效,具有较快、较好的临床疗效。
有研究证实,触诱发痛是由脊髓背角的Aβ纤维上的受体受到非伤害性刺激诱发疼痛信号引起。而SCS不仅可以干扰疼痛纤维(Aβ和C纤维)的信号传导,还可通过增加脊髓后角抑制性神经递质y-氨基丁酸(y-aminobutyric acid, GABA)释放,进而抑制触觉性触诱发痛[20]。另外,有研究提示触诱发痛与外周敏化有关[21],外周神经损伤后DRG的Aβ神经元产生的大量异位自发放电活动与触诱发痛行为密切相关。在本次临床研究中,术后3 d、7 d、14 d、3个月、6个月时的触诱发痛的发生率分别92%(47/51)、88%(44/51)、78%(40/51)、74%(38/51)和74%(38/51);术后14 d的触摸痛发生率有明显的减少,术后7 d的触诱发痛的分级有明显改善(P<0.05),提示tSCS可能是通过减少外周神经有害神经递质的释放,抑制外周敏化的持续作用,达到治疗触诱发痛的目的[11]。进一步分析术后爆发痛和触诱发痛发生率的最早改善时间点,发现tSCS对触诱发痛的改善要迟于爆发痛的改善,提示置于背根神经的tSCS对中枢敏化的改善作用可能早于外周。
目前急性带状疱疹性神经痛对患者生活的影响已经逐渐被人们所重视,主要体现在以下4个方面,即: 身体状态、心理状态、生活技能、社会交际。在身体状态上患者会有疲劳、厌食、体质量减轻、失眠表现。心理状态上患者会出现焦虑、抑郁、情感障碍、恐惧的表现。且患者疼痛程度越强患者焦虑抑郁程度越高[22-24]。在本研究中,tSCS治疗后3个月、6个月的PDI、PHQ-9、GAD-7评分明显改善(P<0.05),较好地改善了急性爆发性带状疱疹患者生活质量和焦虑抑郁等状态。但在团队目前的临床研究中,患者的睡眠情况(夜间睡眠时长、睡眠中醒来次数)未有明显改善,其原因考虑可能是因为老年患者睡眠障碍的发病率高、治疗时间短等原因,未来还需要进一步研究。
带状疱疹后遗神经痛(postherpetic neuralgia, PHN)的发生风险与多因素[25-26]有关,对于年龄>50岁、合并糖尿病、皮损面积>5%、急性期即存在剧烈疼痛(爆发痛)、初始治疗时间<3 d的患者发生后遗痛的概率往往较高。而爆发痛和触诱发痛往往就是神经受损严重的表现形式之一,在临床工作中,伴有爆发痛和触诱发痛的带状疱疹神经痛的治疗难度较大,疗效较差。有文献提出,急性期带状疱疹并发剧烈疼痛时,带状疱疹后遗神经痛的发生率为47.9%[27]。而在本研究中: 对于爆发性合并触诱发痛的带状疱疹神经痛经脊髓电刺激的后遗痛发生率为33.33%,且总体有效率为62.75%,显著高于非干预治疗的急性期带状疱疹并发剧烈疼痛的后遗神经痛的发生率,提示tSCS对爆发性合并触诱发痛的急性期难治性带状疱疹神经痛患者能降低带状疱疹后遗神经痛的发病率。所以tSCS能降低PHN的发生率,不仅仅是因为其镇痛作用,更可能是神经修复作用。
本研究观察到47.06%(24/51)电极移位,但皆可以通过程序的调整,达到刺激的重新覆盖,不影响最终的治疗效果。且并未发现其他感染、硬膜外血肿、脊髓损伤或神经损伤等严重并发症。可见tSCS可安全有效治疗带状疱疹。
总之,在本临床研究中,短时程脊髓电刺激不仅能够有效地缓解急性期难治性带状疱疹神经痛的疼痛、特别是爆发痛和触诱发痛,而且明显地改善了患者的生活质量和心理状态,并未出现明显的并发症及不良反应,具有较好的短期临床疗效及安全性,但本研究目前只是回顾性分析,缺乏有效对照组,并且临床样本较少,长期临床疗效及安全性,还需要未来进一步研究。
