相分离视角下的应激颗粒研究进展
2022-11-07勾泓荃卞知玄孙奋勇
勾泓荃, 卞知玄, 孙奋勇
(同济大学附属第十人民医院检验科,上海 200072)
既往研究表明,mRNA常在细胞核中加工完成并出核进入细胞质,mRNA的生命周期一般持续到在细胞质中翻译成蛋白质,最后被降解[1]。但最近的研究发现,mRNA在进入细胞质后存在不同的结局。一部分mRNA被设定为“立即翻译”,进入细胞质后立即合成蛋白质并随之被降解或被储存。同时,还有一部分mRNA被设定为“延迟翻译”,即进入细胞质后暂时不参与翻译过程,并被包装成核糖核蛋白(ribonucleoprotein, RNP)颗粒,直到环境或某些特定条件激活其蛋白质翻译过程[2]。这些RNP颗粒是各种RNA和蛋白质的无膜聚集体,它们存在于细胞核和细胞质中,由蛋白质-蛋白质和RNA-RNA之间的一系列相互作用形成[3]。RNP颗粒包括一些核颗粒如核仁、Cajal小体等以及一些存在于细胞质的颗粒如应激颗粒(stress granules, SGs)和P小体等[4]。
真核生物在面对各种外界胁迫(如热刺激、氧化应激、病毒感染、辐射等)时会做出特定的反应,整体翻译水平被抑制而应激反应相关因子的表达上调,导致细胞质中翻译抑制的mRNA水平升高,最终形成被称为SGs的细胞质凝聚物[5-7]。因此,SGs是真核细胞在发生应激反应时所形成的凝聚物,它包含许多非翻译mRNA、翻译起始的组分和一些影响mRNA功能的蛋白质[8]。由于SGs的形成使一些组分在胞质中的局部浓度升高,这些组分的相互作用水平会增强以加快反应的效率。例如在病毒诱导的应激反应中,细胞的蛋白质翻译受到抑制,同时SGs中的真核起始因子2α(eukaryotic initiation factor 2α, eIF2α)激酶可高效激活NF-κB和IRF3这两个先天免疫信号通路上的关键分子以招募抗病毒蛋白,启动抗病毒反应[9]。了解SGs可以帮助进一步理解真核细胞在应对特殊环境时的复杂生物学过程。本综述探讨了SGs的结构、组分及其形成,并强调了其与相分离之间的关系。
1 SGs的结构与组分
近几年的研究证实RNA颗粒的积累依赖于液-液相分离(liquid-liquid phase separations, LLPS)模式,mRNA与具有低复杂性结构域的蛋白质结合所形成的复合物在细胞质中发生相变而形成液滴[10]。这些在应激条件下在局部形成的液滴细胞器,增加了RNA和蛋白质的局部浓度,从而有利于下游通路的相互作用[11]并发挥不同功能,如DNA修复[12],跨膜信号转导[13]等,并在应激条件停止时溶解[14]。有研究指出SGs的形成也是一种相分离过程,由于任何大于二聚体的组装都需要多价相互作用才能形成,而SGs是通过翻译沉默的mRNP交联形成的,组分之间的多价相互作用通过相分离得以形成高阶结构[7]。SGs的这种高阶内部结构又被分为两部分,一是通过显微镜技术发现的中心具有更高浓度的蛋白质与mRNA区域的“核心”结构,二是核心结构周围环绕着的略显松散但更富有动态性的“外壳”结构[7,15]。SGs在初形成时可能先通过LLPS以多价的、弱的相互作用形成一个动态的“外壳”结构。随着时间的推移,低复杂性结构域的蛋白质在内部持续过饱和,一个乏动态、更稳定的第二相会成熟,从而产生SGs的“核心”结构[7,16]。在“外壳”结构中的组分可以与所在的环境组分快速交换,因此更为动态,见图1。而“核心”结构更为稳定,在这一结构中,G3BP蛋白被认为是SGs核心网络中最高中心性的蛋白质,并且G3BP1在存在游离RNA的情况下,强烈自发相分离,并促进了细胞中SGs的组装[17-18]。相似的,在与神经退行性疾病密切相关的SGs中发现了蛋白质浓度依赖性相分离驱动SGs的组装,并且该蛋白质浓度存在最低阈值[19]。由此可见,相分离在SGs的组装中承担了重要的角色。
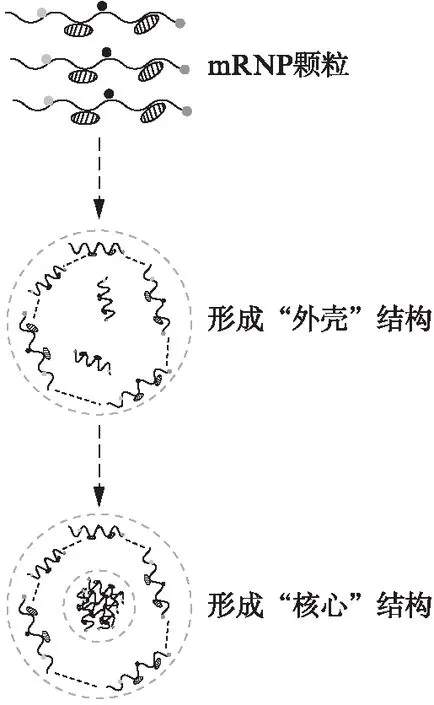
图1 SGs内部结构的形成Fig.1 Formation of SGs internal structure
2 SGs的组装与解聚是一种相分离过程
2.1 相分离的概念
就像水里的油一般,细胞内的物质可以被分离成一个个液滴,而这开创了细胞生物学的新纪元[20]。Brangwynne等[21]于2009年发现细胞内颗粒会像液体那样融合,并以一种特殊的方式让细胞内的特定分子聚集起来,从而在“混乱”的细胞内部创造“秩序”。从分子角度可以更好地理解相分离,大分子与大分子以及与溶液间普遍存在着弱的、低亲和力的、缺乏特异性的相互作用。当大分子间的相互作用弱于大分子与溶质之间的相互作用时,则意味着大分子可与任何浓度的溶液混溶,即该溶液是该大分子的良好溶剂。反之亦然,当大分子间的相互作用强于大分子与溶质之间的相互作用时,则意味着大分子溶解度有限,倾向于发生相分离[22]。在这样的体系中,当大分子与大分子在获得对其有利的能量后便可克服溶液保持均匀混合的熵趋势,然后发生相分离现象。因此在一个大分子与溶剂的混合体系中将会分成两相: 大体积、低浓度的“稀释相”和小体积、高浓度的“浓缩相”。这样的相分离状态将会保持平衡,两相中的化学势能相等,因此在体系中会存在持续的浓缩隔室,形成液滴[23]。这些大分子凝聚形成的浓缩隔室提供了一个高浓度的“浓缩相”反应条件,提供了一个独特的细胞生化反应环境,起到催化作用。例如Strulson等[24]通过建立体外细胞隔室调控RNA局部浓度,使核酶裂解活性增加了约70倍;Lu等[25]认为相分离是控制转录与RNA加工的枢纽。
分散在细胞质或核质(“稀释相”)中的RNA分子与蛋白质分子通过相分离组装形成RNP颗粒(“浓缩相”)[19,26]。这些RNP颗粒中的驱动蛋白通常包含内在无序区域(intrinsically disordered region, IDR),这些IDR与多价相互作用驱动的相分离蛋白形成有关[23,26]。SGs中的RNA结合蛋白(RNA-binding proteins, RBPs)上的多个IDR与SGs发生LLPS密切相关。Saito等[27]证明了RNA解旋酶DDX3X(DEAD-box helicase 3 X-linked)的N端IDR区域乙酰化会阻碍SGs的相分离过程。这些无序区域的翻译后修饰(posttranslational modifications, PTMs)可以调控相分离蛋白的组装与分解,因此IDR在SGs形成中具有重要作用[23]。此外,已有不少研究发现相分离与疾病密切相关,如一些神经退行性疾病[28-32]、肿瘤[31,33-37]、感染性疾病[38-39]、遗传性疾病[40-41]等都存在异常的相分离过程。
2.2 SGs的组装
当细胞内整体翻译水平受到抑制时,非翻译的mRNP相互交联聚集,形成SGs[7]。多项研究证明,G3BP是SGs蛋白质网络中的核心,其在SGs组装中作为关键分子发挥作用[17,42-43]。G3BP是一种含有3个IDR的蛋白,由4个结构域构成,其中主要由核转运因子2(nuclear transport factor 2, NTF2)样和RNA识别区(RNA recognition motif,RRM)这两个结构域介导了其向SGs中募集[44]。NTF2结构域可介导与自身的相互作用,其通过与内源性G3BP相结合而被招募到SGs中[45]。RRM结构可凭借其与RNA的结合能力被募集至具有高浓度RNA的SGs中[46]。Yang等[17]证明G3BP1在SGs的组装中起到分子开关的作用,G3BP1通过响应胞内RNA浓度的升高,诱导RNA依赖性相分离发生从而启动SGs的组装。在正常的生理环境中,细胞质中游离的非翻译mRNA浓度较低,G3BP蛋白呈紧凑的“关闭”构象,抑制其激活相分离的功能。在应激条件诱导的整体翻译停滞和多核糖体解离时,RNA会与G3BP结合引起G3BP的构象转变成“开放”构象,从而允许其参与其他蛋白质-RNA或蛋白质-蛋白质相互作用[47]。缺乏G3BP的细胞无法响应eIF2α而无法形成SGs,但在渗透压应激中这类细胞仍然具有形成SGs的能力,这暗示存在其他的SGs组装途径[43]。Yang等[65]在葡萄糖缺乏的应激条件下于酵母中发现Pbp1(PolyA binding protein-binding protein 1)可促进SGs的组装,但在热休克应激期间抑制SGs的形成。这提示SGs在不同的环境条件下可通过不同的途径进行组装,但这都与可发生LLPS的蛋白密切相关。
2.3 SGs的解聚
虽然已经有大量研究关注于细胞在各种压力条件下的SGs组装机制,但是对于SGs的解聚过程关注较少。Wheeler等[16]利用活细胞成像观察亚砷酸钠处理60 min后置于正常培养基中SGs的变化,发现较大的SGs被分解为较小的颗粒,随后这些小颗粒发生解聚或被清除。SGs的外壳会首先消散,边缘出现丝状结构,随后其核心部分被分解或清除[16]。许多伴侣蛋白可影响SGs的解聚。Walters等[48]发现热休克蛋白70(heat shock protein 70, HSP70)和热休克蛋白40(heat shock protein 40, HSP40)这两类伴侣蛋白均在SGs中积累,这些蛋白的缺陷可能导致SGs的分解和清除减少。但HSP40的两种不同的折叠(Ydj1蛋白和Sis1蛋白)在SGs解聚中的功能存在差异。Ydj1促进SGs的分解和细胞整体翻译水平的恢复,而Sis1蛋白促进SGs的靶向自噬清除[48]。这揭示了SGs中不同结构可以导致SGs不同的结局。
此外,SGs的命运及其解聚机制也取决于其形成的原因和组装的持续时间。例如通过慢性压力或疾病突变产生的颗粒,会被自噬依赖性降解清除。而短时间刺激形成的颗粒会迅速分解以回收组分。研究报道在热休克的情况下,SGs中的G3BP1发生泛素化修饰,解聚时,泛素化G3BP1退出颗粒核心并降解,SGs网络内的驱动力降低到相分离的渗透阈值以下,促使细胞分解SGs并在消除应激后重新启动正常的细胞活动[5]。SGs的清除异常会使胞内蛋白质异常凝聚。Marmor-Kollet等[49]利用基于工程抗坏血酸过氧化物酶(engineered ascorbate pero-xidase, APEX)的距离依赖性标记蛋白质组学的方法,通过对SGs解聚的时间轴分析揭示了9号染色体开放阅读框72(chromosome 9 open reading frame 72, C9orf72)对SGs解聚的影响以及其对于肌萎缩侧索硬化症发病的影响。这也提示了SGs的解聚或清除异常可能会导致某些疾病。
3 相分离与SGs的研究方法
研究SGs的方法多样,有研究利用亚砷酸盐诱导人骨肉瘤细胞U2OS细胞中SG的组装,使用小干扰RNA(small interfering RNAs, siRNA)筛选的方法鉴定了101个与SG组装有关的人类基因[50]。也可以采用亲和层纯化的方法(如通过GFP标记G3BP)与质谱分析结合使用,以确定SG中所富集的蛋白质[15]。相似的,Goodier等[51]利用酵母双杂交系统通过与SGs蛋白LINE-1 ORF1p(long inte-rspersed element-1 open reading frame 1 protein)进行免疫共沉淀确定了几种RBPs和SGs相关蛋白质。然而,最直接的研究方法是基于显微镜成像的观察方法,活细胞和固定细胞成像都可以提供相分离和SGs的最直接证据。如Markmiller等[52]在亚砷酸钠和热休克诱导的应激中利用高通量显微镜确定了150种先前未知的SGs。随着技术的革新,Wheeler等[53]对观察方式加以改进,将CRISPR-Cas9(clustered regularly interspaced short palindromic repeats-asso-ciated protein 9)技术、微筏阵列以及高内涵成像结合,开发了新技术“Craft-ID”(CRISPR-based microRaft followed by guide RNA identification)。该技术通过分离含有大于12 000条的单个导向RNA(single-guide RNA, sgRNA)的基因克隆微筏确定了影响SGs组装的RBPs。
鉴于SGs与相分离之间的紧密关系,利用SGs的相分离特性可进一步挖掘其组分。如Kato等[54]利用生物素化的异噁唑诱导细胞裂解物内的LLPS,通过物理方法分离沉淀和上清液以此分析RNA和蛋白质的组成。Molliex等[19]通过在SGs中引入hnRNPA1(heterogeneous nuclear ribonucleoprotein A1),促进SGs的相分离以观察SGs的组装和其在疾病中的机制。而近几年兴起的生物信息学预测手段,拓宽了研究思路,开启了对基因与蛋白研究的新认识。Boncella等[55]利用应激诱导的RNP颗粒氨基酸组成成分预测朊病毒样结构域(prion-like domains, PrLD)组装倾向,挖掘PrLD对SGs的定位。Yang等[56]利用距离依赖性生物素分析方法绘制了基于距离的高密度互作图谱,揭示了1 792种蛋白质的7 424种近距离相互作用并定义了114种SGs中的核心组分。Kuechler等[57]分析了近期发表的来自酵母与哺乳动物SGs的蛋白质组学数据定义了一种哺乳动物颗粒z分数(mammalian granule z-score, MaGS),该分数可以用于预测某种蛋白相分离进入SGs的可能性。
4 SGs的相分离与疾病
SGs的异常相分离与组装会为细胞创造不利于增殖的环境,从而导致疾病状态。如Schneider等[58]发现突变的RBM20(RNA-binding motif protein-20)会促进心肌细胞中SGs的相分离形成,阻止细胞增殖,最大限度地减少能量消耗并停止所有非必要的细胞功能,从而导致先天性扩张型心肌病。相似的,在肌萎缩侧索硬化症的患者中肉瘤蛋白(fused in sarcoma, FUS)的蛋白甲基化缺失会促进FUS的相分离,增强其与SGs的结合并抑制TNPO1(transportin-1)这一抑制FUS异常相分离的细胞质伴侣,从而导致FUS融合蛋白的大量积累[59-64]。而并非所有突变均会增强相分离而导致疾病状态,Yang等[65]发现青霉素结合蛋白1(penicillin-binding protein 1, Pbp1)的突变会减弱其相分离作用而导致线粒体功能障碍,并使细胞在营养应激期间的适应能力降低。
SGs也与肿瘤密切相关,肿瘤细胞应对与适应压力的能力对肿瘤进展具有重要作用,肿瘤细胞会遇到以缺氧、高渗、营养缺乏等特征为敌的肿瘤微环境,此时这些应激状态都有可能触发SGs的形成[66]。尤为重要的是,SGs是肿瘤细胞应对放化疗所产生的一种反应[6],SGs常常是为了增强细胞的生存能力而产生的,因此这种颗粒的产生可能会无意中影响肿瘤的治疗[67]。如Shi等[68]在前列腺癌中发现斑点型锌指结构蛋白(speckle-type POZ protein, SPOP)突变会上调SGs的组装以增强肿瘤细胞的存活率和对多西他赛的耐药性。而Li等[69]发现MG53[又称TRIM72(tripartite motif containing 72)]可通过调节非小细胞肺癌中的G3BP2活性抑制肿瘤中SGs的形成,从而增强肿瘤细胞对顺铂治疗的敏感性。因此,抑制SGs在肿瘤细胞中的组装或许可以成为一种新的肿瘤治疗方式。
由此可见,SGs可以作为一种潜在的治疗靶点,通过清除或降解这些异常积累的蛋白以治疗疾病,而在一些研究中已经发现异常的SGs被靶向至溶酶体降解,这或许可以成为一种潜在的治疗方式[70-71,80]。Fang等[72]通过利用具有芳香基团的平面分子抑制TDP-43(TAR-DNA binding protein 43)在肌萎缩侧索硬化症(amyotrophic lateral sclerosis, ALS)和额颞叶痴呆(frontotemporal dementia, FTD)中的累积,并以此调控了SGs相关分子的招募,而TDP-43被证明在ALS和FTD等脑病中发挥重要的调控作用[60],这也提示了SGs作为靶点在临床治疗中的可行性。近年来,纳米材料已被证明是一种新兴的疾病诊疗手段,可以利用其选择性结合以及其独特的细胞膜渗透作用,起到靶向治疗的作用[73-74]。Dittrich等[75]利用CD3ac肽基质、由Flutax-2一种癌症治疗药物分子构成的包埋货物和一个标记有Alexa Fluor 568荧光染料的铁蛋白冠(Tfn-AF568)组装成一种可以被细胞摄取并利用相分离机制将药物输送至细胞中的纳米颗粒(nano particle, NP)。也有研究表明,许多不同材料构成NP都可以与参与RNA加工机制的蛋白质发生相互作用,同时在与这些NP相关蛋白质组中,观察到了许多IDR结构,与天然SGs蛋白质组存在密切的相关性[76]。相似的,Klein等[77]发现基于二氧化硅制备的NP与IDR和RBPs之间具有高亲和力并且可捕获一些与SGs相关的RBPs,诸如多聚腺苷酸结合蛋白[poly(A)-binding protein,PABP1]、RNA结合蛋白肉瘤融合/脂肪肉瘤转运蛋白以及真核转录起始因子3(eukaryotic initiation factor, eIF3),它们均被证明在SGs组装中发挥重要作用[62,78-79]。这些证据表明,可以通过NP与IDR及RBPs等相关蛋白结合,调节胞内的相分离行为,从而干预诸如SGs等生物分子聚集体的组装与解聚,或许可以为疾病的诊疗提供新的思路。
5 总结与展望
细胞内调控蛋白质的合成以适应不断变化的外界条件对细胞的生长和生存至关重要,此过程需要对mRNA翻译进行快速协调及特异和局部化的重编程。尽管现在已对这种调控的机制有所了解,但由于SGs的动态性以及其缺乏细胞膜的特性,很难直接对其进行研究。因此,今后可从分析不同应激条件下SGs中的特征性蛋白组或基因组入手,挖掘其与其他蛋白的相互作用关系,探究其发生相分离的启动因素。同时也可以针对SGs对于细胞的生存影响,寻找SGs潜在的治疗靶点,或许可以成为一种全新的治疗手段。
