基于NLRP3通路探讨山药多糖对妊娠糖尿病大鼠胎盘滋养层细胞自噬侵袭的影响*
2022-11-07李玉琴俄洛吉巩海凤汪玉凤曾湘辉
李玉琴,俄洛吉,巩海凤,汪玉凤,曾湘辉
(青海省人民医院,青海 西宁 810000)
妊娠糖尿病(gestational diabetes mellitus,GDM)是一种常见的妊娠并发症,在妊娠期间会出现自发性慢性高血糖症。此类高血糖症大部分因在慢性胰岛素抵抗背景下,胰腺β细胞功能障碍导致葡萄糖耐量受损[1]。GDM的常见致病因素有肥胖(超重)、饮食、高龄产妇糖尿病家族史及胰岛素抵抗等,已上升为日益严重的公共卫生问题,影响全球约20%妊娠者,且患病率不断攀升[2]。通常GDM会在分娩后有所消退,但在发生期间也伴随其他并发症(如母体心血管疾病、2型糖尿病及巨婴儿等)[3]。迄今为止,临床上尚未出现能被大众广泛接受的GDM治疗或预防方案。常用干预方式为饮食或运动搭配胰岛素治疗,但体内出现胰岛素抵抗会导致治疗效果受限。因此,寻求安全、有效且易于施用的新疗法迫在眉睫。山药作为传统药食同源性植物,具有多种生物活性和生理学功能,引起了学者广泛关注和研究[4]。已有研究证实,山药多糖具有降血糖、降血脂、免疫调节、抗氧化、抗肿瘤、延缓衰老等药理作用[5]。本研究通过建立GDM模型,分析山药多糖对GDM大鼠影响,以期为相关药品研发和GDM治疗提供参考依据。
1 材料与方法
1.1 实验动物SPF级SD雌性大鼠60只和雄性大鼠30只,6周龄,体质量(200±20)g,购自广东药康生物科技有限公司,生产许可证号:SCXK(粤)2020-0054,购入后保持室内温度(24±1)℃,空气相对湿度(60±10)%,光照昼夜交替循环12 h,自由摄食水,饲养1周。本实验对动物的处置符合3R原则,并经医学实验动物管理委员会批准。
1.2 药物与试剂 山药多糖(批号:20201109,纯度:98%)购自上海永叶生物科技有限公司;盐酸二甲双胍(国药准字H11021518,批号:20200921)购自北京京丰制药集团;链脲佐菌素(Streptozotocin,STZ)(批号:20200631)购自北京Solarbio公司;白细胞介素-1β(Interleukin-1β,IL-1β)ELISA试剂盒(批号:20201105)、白细胞介素-18(Interleukin-18,IL-18)ELISA试剂盒(批号:20201018)、白细胞介素-6(Interleukin-6,IL-6)ELISA试剂盒(批号:20201206)均购自美国R&D公司;蛋白BCA试剂盒(批号:20200225)购自美国Sigma公司;兔抗鼠核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)多抗(批号:ab263899)、硫氧还蛋白结合蛋白(thioredoxin-interacting protein,TXNIP)单抗(批号:ab188865)、微管相关蛋白轻链3B(microtubule-associated protein light chain 3B,LC3B)多抗(批号:ab192890)、Beclin自噬蛋白1(Beclin1)多抗(批号:ab207612)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单抗(批号:ab9485)、羊抗兔二抗-HRP(批号:ab205718)均购自英国Abcam公司。
1.3 主要仪器Omnitest EZ型血糖仪(德国贝朗医疗有限公司);UniCel DxI 800型全自动电化学发光分析仪(美国贝克曼库尔特有限公司);7500 Fast型实时荧光定量PCR系统(Thermo Fisher Scientific公司);BIO-RAD电泳仪、垂直电泳槽均购自美国Santa Cruz公司。
1.4 造模与分组 在造模前大鼠使用基础饮食适应性喂养1周后,取50只雌性大鼠饲养高脂肪蔗糖饮食8周后,将其和雄性大鼠合笼过夜,其中笼内大鼠雌雄比例2∶1。次日,显微镜下观察到雌性大鼠阴道处出现精子或黏液栓现象,即妊娠成功,并记作妊娠第1天。42只雌性大鼠成功受孕,8只未受孕。42只受孕大鼠在妊娠5 d后禁食12 h,腹腔注射STZ溶液(35 mg/kg)诱导GDM模型[6]。72 h后用血糖仪检测雌鼠空腹血糖(fasting blood glucose,FBG)水平,若FBG>16.7 mmol/L,即提示造模成功[7]。取造模成功40只雌鼠(2只无症状予以剔除),按随机数字表法分为模型组、山药多糖低剂量组、山药多糖高剂量组、阳性药物组,每组10只。剩余10只未造模雌鼠作为正常组,正常饮食、妊娠,腹腔注射无菌生理盐水。
1.5 实验给药 造模成功后,使用山药多糖进行干预,依据参考文献[8]用量,山药多糖低、高剂量组依次按照200、400 mg/kg剂量灌胃,阳性药物组使用盐酸二甲双胍按照200 mg/kg剂量灌胃,正常组和模型组则给予等体积无菌生理盐水灌胃,1次/d,连续给药6周。
1.6 观察指标
1.6.1 血糖、胰岛素水平检测 末次给药后24 h,分别采用血糖仪、全自动电化学发光分析仪检测雌鼠血清FBG和空腹胰岛素(fasting semm insulin,FINs),并依据稳态模型评估法计算胰岛素抵抗指数(homeostasis model assessment-insulin resistance,HOMA-IR)。HOMA-IR[9]=FBG(mmol/L)×FINs(μIU/mL)/22.5。
1.6.2 血清细胞相关因子检测 血糖、胰岛素指标检测结束后,采集雌鼠血液,经4000 r/min离心10 min,离心半径20 cm,取血清。ELISA法测定血清IL-1β、IL-18、IL-6含量,严格按照IL-1β、IL-18、IL-6 ELISA试剂盒说明书操作。
1.6.3 Transwell法检测胎盘滋养层细胞侵袭 脱颈椎处死大鼠,取胎盘并分离滋养层组织,切片(约1 mm×1 mm),37℃水浴,0.25%胰蛋白酶消化3次,每次10min,3000r/min离心5min,去沉淀得细胞悬液,PBS洗涤2次,采用10%胎牛血清DMEM/F12重悬细胞,接种培养板并置于37℃含5% CO2培养箱过夜培养,在倒置显微镜下观察细胞形态和生长状况,当细胞攀爬至培养皿底面积约90%进行传代培养,取第三代滋养层细胞,配制1×105个/mL细胞悬液,Matrigel基质胶(1:4稀释)包被Transwell上室,室温放置过夜至凝固,将配制好的细胞悬液接种至Transwell小室,其中上室加入100 μL细胞悬液,下室加入500 μL含有10% FBS的培养基,37℃培养48 h,4%多聚甲醛固定30 min、结晶紫染色20 min,显微镜下随机取5个视野观察、计数,取平均值。
1.6.4 qRT-PCR检测胎盘组织Beclin1 mRNA、LC3B mRNA、TXNIP mRNA和NLRP3 mRNA水平 取胎盘组织,匀浆,Trizol法提取RNA,测纯度及浓度,逆转录得cDNA,实时荧光定量PCR反应。反应体系:Taq聚合酶1.6 μL,上下游引物0.8 μL,模板cDNA5 μL,双蒸水12.6 μL。扩增条件:预变性(95℃,30 s),变性(95℃,5 s),退火(59℃,30 s),共40个循环,加熔解曲线,降温(50℃,30 s)。GAPDH为内参对照,数据分析采用2-△△Ct法,重复多次,取Ct均值。引物序列见表1。

表1 引物序列
1.6.5 Western blotting法检测胎盘组织Beclin1、LC3B、TXNIP、NLRP3蛋白水平 取胎盘组织,加RIPA裂解缓冲液,5000 r/min离心15 min,离心半径20 cm,取上清,蛋白BCA试剂盒测定总蛋白浓度,待测蛋白样品电泳分离(100 V,80 min),转至PVDF膜,5%脱脂牛奶封闭2 h,样品与Beclin1(1∶200)、LC3B(1∶1000)、TXNIP(1∶500)、NLRP3(1∶1000)一抗4℃过夜孵育,TBST缓冲液洗膜,加二抗室温孵育(HRP标记IgG,1∶2000)2 h,洗膜、曝光、显影。Image J软件测样品和GAPDH条带灰度值。目标蛋白相对表达量计算,即目标条带和GAPDH条带灰度比值。1.7统计学方法 采用SPSS 26.0统计学软件进行数据分析,计量资料以“均数±标准差”(±s)表示,多组间比较采用单因素方差分析,两两比较进行LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血清FBG、FINs、HOMA-IR水平比较 与正常组比较,模型组大鼠血清FBG、FINs、HOMA-IR水平均明显升高(P<0.05);与模型组比较,山药多糖低剂量组、山药多糖高剂量组、阳性药物组大鼠血清FBG、FINs、HOMA-IR水平均明显降低(P<0.05);与山药多糖低剂量组比较,山药多糖高剂量组、阳性药物组大鼠血清FBG、FINs、HOMA-IR水平均明显降低(P<0.05),且阳性药物组低于山药多糖高剂量组(P<0.05)。(见表2)
表2 各组大鼠血清FBG、FINs、HOMA-IR水平比较(±s)

表2 各组大鼠血清FBG、FINs、HOMA-IR水平比较(±s)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与山药多糖低剂量组比较,cP<0.05;与山药多糖高剂量组比较,dP<0.05
组别 动物数(只)给药剂量(mg/kg)FBG(mmol/L)FINs(μIU/mL) HOMA-IR正常组 10 - 4.64±1.54 1.69±0.43 0.35±0.11模型组 10 - 18.75±2.17a 4.90±0.78a 4.08±0.20a山药多糖低剂量组10 200 14.56±1.90ab 3.83±0.70ab 2.48±0.17ab山药多糖高剂量组10 400 10.43±1.71abc 2.78±0.65abc 1.29±0.15abc阳性药物组 10 200 6.82±1.63abcd 1.92±0.56abcd 0.58±0.13abcd F 100.617 44.734 986.516 P 0.000 0.000 0.000
2.2 各组大鼠血清IL-1β、IL-18、IL-6水平比较 与正常组比较,模型组大鼠血清IL-1β、IL-18、IL-6水平均明显升高(P<0.05);与模型组比较,山药多糖低剂量组、山药多糖高剂量组、阳性药物组大鼠血清IL-1β、IL-18、IL-6水平均明显降低(P<0.05);与山药多糖低剂量组比较,山药多糖高剂量组、阳性药物组大鼠血清IL-1β、IL-18、IL-6水平均明显降低(P<0.05),且阳性药物组低于山药多糖高剂量组(P<0.05)。(见表3)
表3 各组大鼠血清IL-1β、IL-18、IL-6水平比较(±s)
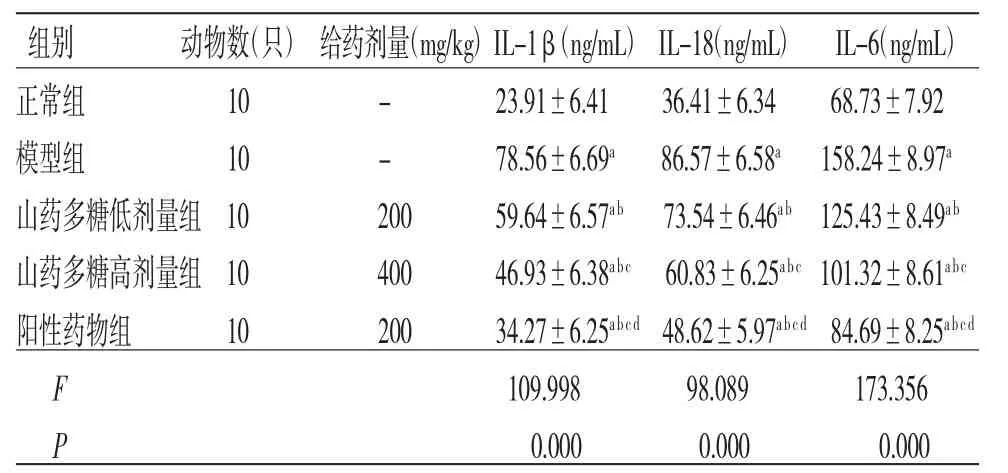
表3 各组大鼠血清IL-1β、IL-18、IL-6水平比较(±s)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与山药多糖低剂量组比较,cP<0.05;与山药多糖高剂量组比较,dP<0.05
组别 动物数(只)给药剂量(mg/kg)IL-1β(ng/mL)IL-18(ng/mL)IL-6(ng/mL)正常组 10 - 23.91±6.41 36.41±6.34 68.73±7.92模型组 10 - 78.56±6.69a 86.57±6.58a 158.24±8.97a山药多糖低剂量组10 200 59.64±6.57ab 73.54±6.46ab 125.43±8.49ab山药多糖高剂量组10 400 46.93±6.38abc 60.83±6.25abc 101.32±8.61abc阳性药物组 10 200 34.27±6.25abcd 48.62±5.97abcd 84.69±8.25abcd F 109.998 98.089 173.356 P 0.000 0.000 0.000
2.3 各组大鼠胎盘滋养层细胞侵袭细胞数比较 与正常组比较,模型组大鼠胎盘滋养层细胞侵袭数目明显减少(P<0.05);与模型组比较,山药多糖低剂量组、山药多糖高剂量组、阳性药物组大鼠胎盘滋养层细胞侵袭数目均明显增加(P<0.05);与山药多糖低剂量组比较,山药多糖高剂量组、阳性药物组大鼠胎盘滋养层细胞侵袭数目均明显增加(P<0.05),且阳性药物组多于山药多糖高剂量组(P<0.05)。(见表4、图1)

图1 各组大鼠胎盘滋养层细胞侵袭情况比较(×400)
表4 各组大鼠胎盘滋养层细胞侵袭数目比较(±s)
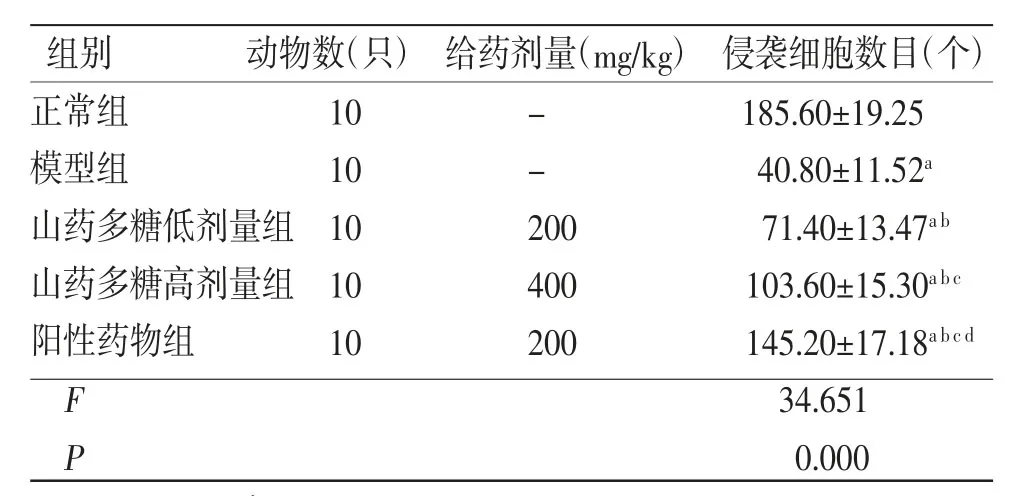
表4 各组大鼠胎盘滋养层细胞侵袭数目比较(±s)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与山药多糖低剂量组比较,cP<0.05;与山药多糖高剂量组比较,dP<0.05
组别 动物数(只)给药剂量(mg/kg) 侵袭细胞数目(个)正常组 10 - 185.60±19.25模型组 10 - 40.80±11.52a山药多糖低剂量组10 200 71.40±13.47a b山药多糖高剂量组10 400 103.60±15.30a b c阳性药物组 10 200 145.20±17.18a b c d F 34.651 P 0.000
2.4 各组大鼠胎盘组织Beclin1 mRNA、TXNIP mRNA、NLRP3 mRNA相对表达量及LC3II/LC3I比较 与正常组比较,模型组大鼠胎盘组织Beclin1 mRNA、TXNIP mRNA、NLRP3 mRNA相对表达量及LC3II/LC3I均明显升高(P<0.05);与模型组比较,山药多糖低剂量组、山药多糖高剂量组、阳性药物组大鼠胎盘组织Beclin1 mRNA、TXNIP mRNA、NLRP3 mRNA相对表达量及LC3II/LC3I均明显降低(P<0.05);与山药多糖低剂量组比较,山药多糖高剂量组、阳性药物组大鼠胎盘组织Beclin1 mRNA、TXNIP mRNA、NLRP3 mRNA相对表达量及LC3II/LC3I均明显降低(P<0.05),且阳性药物组低于山药多糖高剂量组(P<0.05)。(见表5)
表5 各组大鼠胎盘组织Beclin1 mRNA、TXNIP mRNA、NLRP3 mRNA相对表达量及LC3II/LC3I比较(±s)
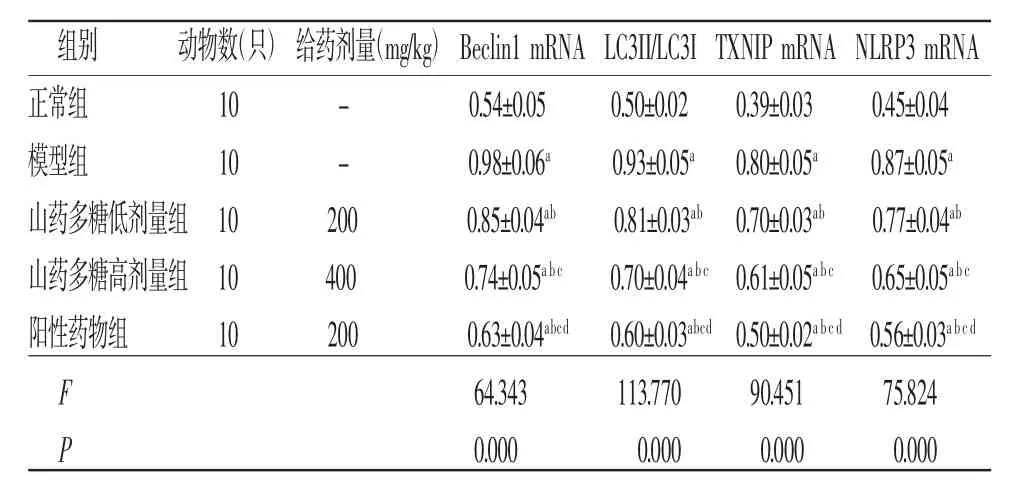
表5 各组大鼠胎盘组织Beclin1 mRNA、TXNIP mRNA、NLRP3 mRNA相对表达量及LC3II/LC3I比较(±s)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与山药多糖低剂量组比较,cP<0.05;与山药多糖高剂量组比较,dP<0.05
组别 动物数(只)给药剂量(mg/kg)Beclin1 mRNA LC3II/LC3I TXNIP mRNA NLRP3 mRNA正常组 10 - 0.54±0.05 0.50±0.02 0.39±0.03 0.45±0.04模型组 10 - 0.98±0.06a 0.93±0.05a 0.80±0.05a 0.87±0.05a山药多糖低剂量组10 200 0.85±0.04ab 0.81±0.03ab 0.70±0.03ab 0.77±0.04ab山药多糖高剂量组10 400 0.74±0.05a bc 0.70±0.04a bc 0.61±0.05a bc 0.65±0.05a bc阳性药物组 10 200 0.63±0.04abcd 0.60±0.03abcd 0.50±0.02a bc d 0.56±0.03a bc d F 64.343 113.770 90.451 75.824 P 0.000 0.000 0.000 0.000
2.5 各组大鼠胎盘组织Beclin1、TXNIP、NLRP3蛋白相对表达量及LC3II/LC3I比较 与正常组比较,模型组大鼠胎盘组织Beclin1、TXNIP、NLRP3蛋白相对表达量和LC3II/LC3I均明显升高(P<0.05);与模型组比较,山药多糖低剂量组、山药多糖高剂量组、阳性药物组胎盘组织Beclin1、TXNIP、NLRP3蛋白相对表达量和LC3II/LC3I均明显降低(P<0.05);与山药多糖低剂量组比较,山药多糖高剂量组、阳性药物组大鼠胎盘组织Beclin1、TXNIP、NLRP3蛋白相对表达量和LC3II/LC3I均明显降低,且阳性药物组低于山药多糖高剂量组(P<0.05)。(见表6、图2)
表6 各组大鼠胎盘组织Beclin1、TXNIP、NLRP3蛋白相对表达量及LC3II/LC3I比较(±s)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与山药多糖低剂量组比较,cP<0.05;与山药多糖高剂量组比较,dP<0.05
组别 动物数(只)给药剂量(mg/kg)Beclin1 LC3II/LC3I TXNIP NLRP3正常组 10 - 0.45±0.040.37±0.05 0.21±0.03 0.30±0.03模型组 10 - 0.91±0.06a 0.85±0.04a 0.76±0.05a 0.80±0.04a山药多糖低剂量组10 200 0.80±0.05ab 0.74±0.06ab 0.65±0.04ab 0.70±0.05ab山药多糖高剂量组10 400 0.69±0.04abc 0.62±0.05abc 0.53±0.05abc 0.59±0.04abc阳性药物组 10 200 0.56±0.03abcd 0.51±0.04abcd 0.40±0.04abcd 0.45±0.05abcd F 82.525 75.148 126.786 108.159 P 0.000 0.000 0.000 0.000
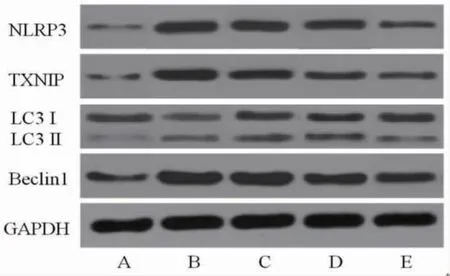
图2 各组大鼠胎盘组织Beclin1、TXNIP、NLRP3蛋白表达及LC3II/LC3I免疫印迹图
3 讨论
GDM被定义为“妊娠中期和晚期发生的葡萄糖耐受不良,且出现不同程度高血糖症”,并依据妊娠期高血糖状态分为GDM、显性糖尿病和孕前糖尿病[10]。在妊娠中期和晚期,拮抗胰岛素作用使胎盘激素增加进而导致胰岛素抵抗增加。此机制目的是为胎儿提供葡萄糖,而胰岛素分泌逐渐增加使女性正常葡萄糖水平得以维持。β细胞胰岛素分泌无法补偿妊娠诱导胰岛素抵抗,或与受损β细胞功能相结合,则导致GDM发生[11]。
GDM是一种代谢性疾病,也是一种低度炎症反应。GDM可能会导致胎盘发育不良、流产或胎儿畸形,这与高血糖症密不可分。胎盘是胚胎发育关键场所,也是妊娠期间母体和胎儿间重要连结组织,它可以表达几乎所有已知细胞因子(如能够影响自噬TNF-α、白细胞介素家族等),其正常生理功能和滋养层细胞息息相关[12]。此外,滋养层细胞作为重要组成细胞,其迁移、侵袭是一种正常生理现象,具有固定胎盘与胎儿作用[13]。本研究结果显示,与模型组比较,山药多糖高、低剂量组大鼠血清FBG、FINs、HOMA-IR、IL-1β、IL-18、IL-6水平均明显降低,炎症反应得以改善;Transwell侵袭实验结果显示,山药多糖高、低剂量组大鼠胎盘滋养层细胞侵袭数目均多于模型组,提示山药多糖能抑制GDM大鼠炎症细胞因子分泌,增强细胞侵袭能力。
自噬即在真核细胞中维持细胞稳态的催化过程,包括降解受损大分子和细胞器中细胞质成分,在胎盘形成过程中发挥了关键作用[14]。自噬可维持自身体内平衡,避免出现疾病、衰老和发育不良,且能反映细胞内代谢水平(如葡萄糖代谢)。当胎盘细胞内调节不平衡时,滋养层细胞自噬现象增加。在自噬过程中,自噬相关基因Beclin1和LC3参与了自噬体发育和成熟[15]。缺氧、营养缺乏、免疫信号刺激或炎症刺激可通过各种信号通路诱导自噬,维持细胞正常代谢,尤其是滋养层细胞自噬抑制可诱导IL-1β分泌,从而引发母体过度激活的炎症反应[16]。NLRP3是一类最具代表性炎症小体,可在多数细胞中进行表达。它不仅参与细胞炎症反应,在细胞生物学行为中也发挥着重要调控作用[17]。NLRP3作为免疫调控重要因子,可通过活化诱导促炎因子成熟,引起细胞或组织炎症损伤[18-19]。研究[20]发现下调TXNIP表达会导致胎盘滋养层细胞NLRP3表达降低,细胞侵袭能力增强。自噬反应可双向调控NLRP3炎症小体的激活,自噬反应对炎症小体激活是促进或抑制似乎和自噬程度相关。此外,炎症小体激活后也可以促进或抑制自噬反应。但目前具体双向调控机制尚不明确。本研究结果显示,与模型组比较,山药多糖高、低剂量组大鼠胎盘组织Beclin1、TXNIP、NLRP3的mRNA和蛋白相对表达量及LC3II/LC3I均明显降低,说明山药多糖能降低GDM大鼠胎盘滋养层细胞炎症反应和自噬现象,揭示山药多糖可能通过抑制NLRP3通路,进而调控GDM大鼠胎盘滋养层细胞自噬和侵袭。
综上所述,山药多糖可改善GDM大鼠炎症反应,抑制胎盘滋养层细胞自噬,增强细胞侵袭能力。山药多糖可能通过调控NLRP3通路发挥作用。
