过敏性紫癜患儿血清 IL-21、TGF-β、SST2、IgA1水平变化的临床意义
2022-11-05任宏伟行敏
任宏伟,行敏
(辽宁省健康产业集团抚矿总医院,辽宁 抚顺 113008)
近年来,过敏性紫癜(Henoch Schonlein purpura,HSP)在小儿的发病中有上升趋势。HSP发病时患者常有皮肤紫癜、腹痛、乏力及消化道出血等表现,极易发展成紫癜性肾炎(HSPN)[1]。报道显示,机体免疫因子及细胞因子在HSP发病过程中扮演重要角色,而明确其发病机制能够为后续治疗提供有利保障[2-3]。本文通过检测HSP患儿血清白细胞介素-21(IL-21)、转化生长因子-β(TGF-β)、可溶性受体(sST2)、免疫球蛋白(Ig)及补体水平变化,以为HSP发病机制提供免疫学支持。现报道如下。
1 资料与方法
1.1 研究对象 收集我院儿科2019年6月—2020年7月收治的HSP急性期患儿110例为研究对象。纳入标准:①符合《诸福棠实用儿科学》[4]中HSP的诊断标准,HSPN患儿符合《儿童紫癜性肾炎诊治循证指南》[5]的相关诊断标准;②首次发病入院治疗者;③HSPN患儿尿蛋白检测结果>150 mg/d,实验室检验为阳性,尿检红细胞结果超过3个;④7 d内未使用过糖皮质激素、免疫调节剂、抗菌药物者。排除标准:①伴有严重的白细胞降低及血小板减少症者;②有过敏性疾病史者;③伴有血液系统疾病、癌症或其他严重性疾病者。所有入组患儿及家属均知情同意。本研究通过我院伦理委员会批准同意。按照尿常规结果分为HSP组(n=59)和紫癜性肾炎(HSPN)组(n=51)。HSP组男 36例,女 23例,年龄 3~14岁,平均(7.81±2.53)岁。HSPN 组男 31例,女 20例,年龄 3~14岁,平均(7.76±2.49)岁。选取2019年6月—2020年7月在我院体检中心体检的33例身体康健儿童作为对照组,其中男15例,女18例,年龄 3~14岁,平均(7.88±2.46)岁。3组受试者一般资料比较差异无统计学意义(P>0.05),有可比性。
1.2 观察指标及检测方法 分别采集HSP组及HSPN患儿治疗前后及对照组儿童的清晨起空腹静脉血5 mL,离心10 min(速度为3 000 r/min,有效离心半径为10 cm)分离血清,将其放在-70℃的冰箱里保存留用。用汇松MB-580全自动酶标仪以酶联免疫吸附测定(ELISA)法测定患儿血清IL-21、TGF-β、sST2和IgA1水平;同上述处理方法,采用深圳迈瑞生产的型号为BS-280的全自动生化分析仪测定3组受试者血浆IgG、IgM、补体3(C3)和补体4(C4)水平,并通过计算得出IgA/C3值。
1.3 统计学分析 采用SPSS Statistics17.0软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较应用独立t检验,HSP组患者血清各因子及IgA、IgA/C3的相关性采用Pearson相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 3组对象血清细胞因子水平的变化 与对照组对比,HSP组、HSPN组患儿TGF-β、sST2及IgA1水平较高(均 P<0.05),IL-21较低(均 P<0.05),且HSPN组患儿TGF-β、sST2水平均高于HSP组(P<0.05)。见表 1。
表1 3组受试者血清因子水平变化 (±s)
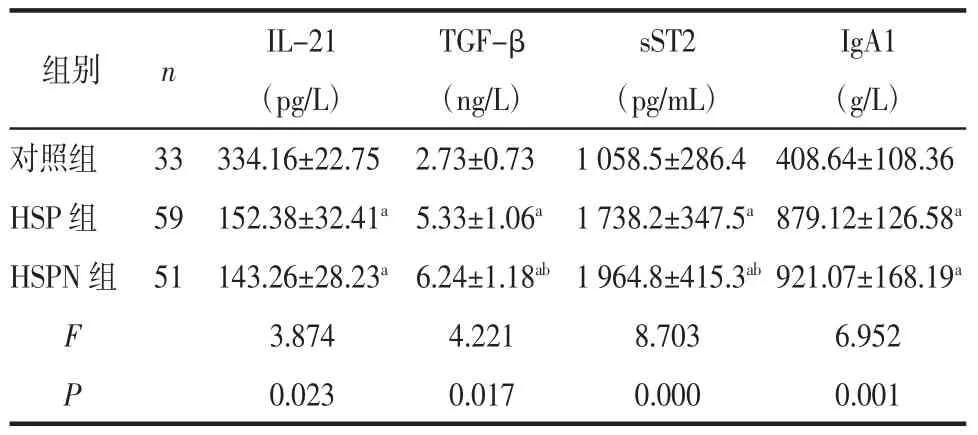
表1 3组受试者血清因子水平变化 (±s)
注:与对照组比较,aP<0.05,与 HSP 组比较,bP<0.05。
IgA1(g/L)对照组 33 334.16±22.75 2.73±0.73 1 058.5±286.4 408.64±108.36 HSP 组 59 152.38±32.41a5.33±1.06a 1 738.2±347.5a879.12±126.58a HSPN 组 51 143.26±28.23a6.24±1.18ab1 964.8±415.3ab921.07±168.19a F 3.874 4.221 8.703 6.952 P 0.023 0.017 0.000 0.001组别 n IL-21(pg/L)TGF-β(ng/L)sST2(pg/mL)
2.2 HSP组及HSPN组患儿治疗前后血清因子水平变化 治疗后,HSP组及HSPN组患儿TGF-β、sST2及IgA1水平均低于各组治疗前(P<0.05),IL-21水平高于各组治疗前(P<0.05)。见表2。
表2 HSP组及HSPN组患儿治疗前后血清因子水平变化 (±s)
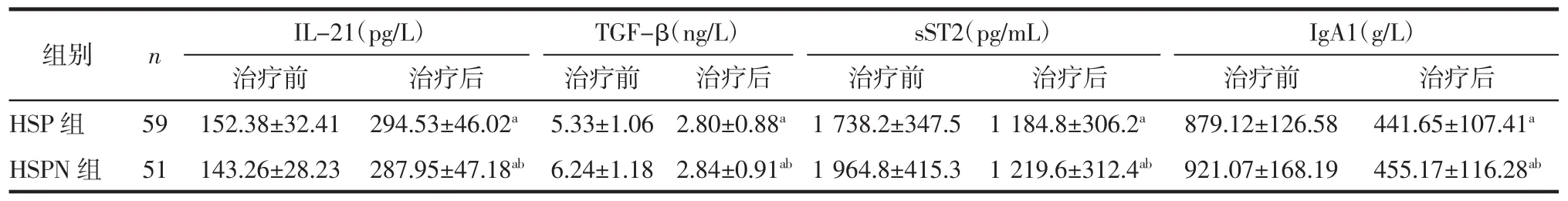
表2 HSP组及HSPN组患儿治疗前后血清因子水平变化 (±s)
注:与治疗前比较,aP<0.05,与 HSP 组治疗后比较,bP<0.05。
组别 n IL-21(pg/L)治疗前 治疗后 治疗前HSP 组 59 152.38±32.41 294.53±46.02a 5.33±1.06 HSPN 组 51 143.26±28.23 287.95±47.18ab 6.24±1.18 TGF-β(ng/L)治疗后2.80±0.88a 2.84±0.91ab sST2(pg/mL) IgA1(g/L)治疗前 治疗后 治疗前 治疗后1 738.2±347.5 1 184.8±306.2a 879.12±126.58 441.65±107.41a 1 964.8±415.3 1 219.6±312.4ab 921.07±168.19 455.17±116.28ab
2.3 3组Ig、补体水平及IgA/C3值对比 与对照组相比,HSP组、HSPN组患儿IgA、IgA/C3水平较高(均 P<0.05),IgG、IgM、C3、C4 与对照组比较差异无统计学意义(P>0.05),且 HSPN 组患儿 IgA、IgA/C3水平均高于HSP组(P<0.05)。见表3。
表3 3组对象Ig、补体水平及IgA/C3值对比 (g/L,±s)
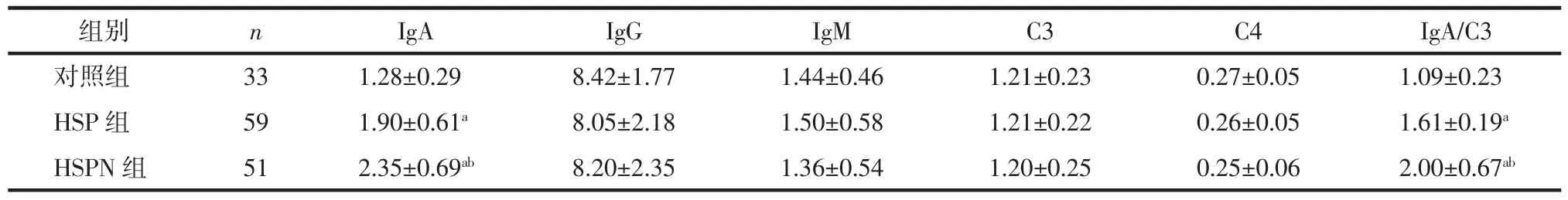
表3 3组对象Ig、补体水平及IgA/C3值对比 (g/L,±s)
注:与对照组比较,aP<0.05,与 HSP 组比较,bP<0.05。
组别 n IgA IgG IgM C3 C4 IgA/C3对照组 33 1.28±0.29 8.42±1.77 1.44±0.46 1.21±0.23 0.27±0.05 1.09±0.23 HSP 组 59 1.90±0.61a 8.05±2.18 1.50±0.58 1.21±0.22 0.26±0.05 1.61±0.19a HSPN 组 51 2.35±0.69ab 8.20±2.35 1.36±0.54 1.20±0.25 0.25±0.06 2.00±0.67ab
2.4 HSP组患者血清各因子及IgA、IgA/C3的相关性对比 TGF-β间呈正相关(P<0.05),IgA1与IgA、IgA/C3呈正相关(均 P<0.05)。见表4。
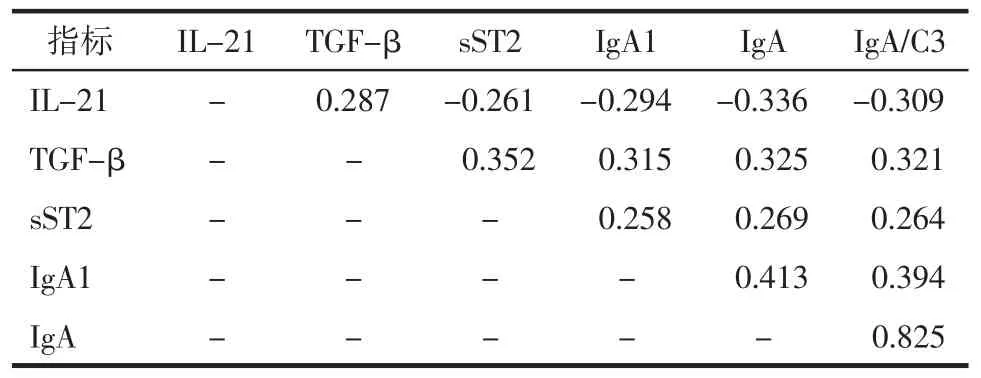
表4 HSP组患者血清各因子及IgA、IgA/C3的相关性
3 讨论
HSP是儿童时期发病率较高的全身性小血管炎性疾病,常累及关节、肌肉、胃肠道、肾脏、神经系统等[6]。在HSP进展过程中,HSPN是最严重的远期合并症之一[6-8]。报道显示,HSP患儿处于严重的免疫紊乱状态,促炎因子大量合成与释放,进而并发HSPN等多种并发症[9-10]。IL-21是一种新发现的由Th2细胞分泌的免疫调节因子,可较好的促进T细胞和自然杀伤细胞的增殖;TGF-β主要是Th3细胞分泌产生,对IL-21有显著的抑制作用,进而可加重肾损伤[11];sST2是IL-33的可溶性受体,研究指出,sST2可以抑制Th2型细胞因子及趋化因子的释放[12-13]。本研究中,与对照组相比,实验组血清TGF-β、sST2水平更高,HSPN组高于HSP组且HSPN组IL-21水平更低。这一结果证实HSP及HSPN患儿存在机体免疫系统紊乱,与报道结果一致[14]。分析可能是因为T细胞分泌IL-21能力被制约,加上患儿体内存在的TGF-β因子会进一步诱导IgA类因子的合成。有报道发现,IgA1在HSP患儿血清及皮损组织中均大量表达[15-16]。本研究中,与对照组相比,HSP组和HSPN组IgA和IgA1水平均显著上升,IgM和IgG在对照组、HSP组及HSPN组间比较未见明显差异,说明HSP对于Ig存在选择性的分泌异常,IgA特别是IgA1在HSP的发生进展中发挥不可替代的作用[17]。分析原因可是与IL-21水平降低,TGF-β水平升高有关,低IL-21、高TGF-β水平状态下机体肾脏受损,随着时间的延长肾脏受损加重[18]。临床中雷公藤多苷片因能够发挥较强的免疫调节及抗炎两大作用而被广泛应用[19],本研究中以雷公藤多苷片对HSP及HSPN患儿实施治疗,结果发现,与治疗前相比,治疗后HSP组及HSPN组血清TGF-β、sST2、IgA1水平更低,IL-21水平更高,且组间对比差异均无统计学意义。这提示治疗后HSP组及HSPN组患儿TGF-β水平显著下降,同时促进IL-21的表达上升,使患儿的HSP免疫紊乱状态得以纠正。畅晓元等[20]研究表明,IgA/C3值在HSPN评价中意义重大,其值可以较好地评估肾脏功能受损害的程度。本研究资料显示,与HSP组相比,HSPN组IgA/C3值更高,与上述报道结果一致。
综上所述,血清中 IL-21、TGF-β、sST2 和 IgA1与HSP的发病及进展密切相关,为HSP机制的研究及临床治疗提供了方向。但本研究纳入的样本量相对较少,观察时间较短,结果存在偏差性的可能,且各因子发病机制研究尚不深入,未来还需要进行大量试验及样本分析。
