基于网络药理学及分子对接技术探讨玉屏风散治疗慢性荨麻疹的作用机制
2022-11-05申倩李俊辰熊万涛郭晨琪张宇
申倩 ,李俊辰 ,熊万涛 ,郭晨琪 ,张宇
(1.中国中医科学院广安门医院,北京 100053;2.天津中医药大学,天津 301617;3.天津市中医药研究院附属医院,天津 300120)
荨麻疹是由于皮肤、黏膜小血管扩张及渗透性增加出现的一种局限性水肿反应,临床上表现为大小不等的风团并伴有瘙痒[1]。中医称荨麻疹为“风疹”、“瘾疹”和“白疹”[2]。中医学认为荨麻疹的病机多是由于先天禀赋不足,表虚不固,外邪侵袭,客于肌表,致使营卫失调而发[3]。慢性荨麻疹(CU)是指风团每天发生或者间歇发作,持续时间超过6周[4]。目前,西医治疗CU主要通过联合用药的方式,但长期大量用药给患者带来了很多的不良反应,中医药虽然在治疗CU有较好的临床效果,但由于具体的作用机制不明确,使其临床应用受限[5]。
玉屏风散源自《究原方》,录自《医方类聚》,方名玉屏风,谓其功用似御风之屏障,有贵重如玉之意[6]。方由防风、黄芪、白术三药组成,其中黄芪甘温,内补脾肺之气,外可固表止汗;白术益气健脾,协黄芪以益气固表实卫;黄芪得防风固表而不留邪,三药共奏益气固表之功。现代研究表明,玉屏风散能够通过增强机体免疫力、抗氧化、调节激素水平来治疗皮肤病[7]。同时也有系统评价表明,玉屏风散对CU有很好的治疗效果[8]。
在2007年Hopkins等[9]首次提出了“网络药理学”这一概念,网络药理学是一门运用网络方法分析药物与疾病和靶点之间“多成分、多靶点、多途径”协同作用关系的学科。中药有成分多、作用靶点多和作用途径复杂等特点,导致中药相关研究受限。通过网络药理学可以揭示中药与疾病靶点间的相互关系,从而阐释中药治疗疾病的作用机制,为作用机制的研究指明方向[10]。
1 资料与方法
1.1 筛选玉屏风散的化合物和靶点 在TCMSP(http://lsp.nwu.edu.cn/tcmspsearch.php)数据库中分别检索白术、防风、黄芪,得到每味中药的化学成分。根据口服利用度(OB)≥30%,类药性(DL)≥0.18的属性值对检索到的所有化学成分进行筛选,收集到玉屏风散的化合物。通过TCMSP数据库查化合物的作用靶点,根据已发表的文献对药物靶点进行补充。在Uniprot数据库中,将已知药物靶点蛋白转化为靶基因。
1.2 筛选疾病的疾病靶点 在GeneCards数据库中检索关键词“Chronic urticaria”,获取疾病靶点。在 Online Mendelian Inheritance in Man(OMIM)、PharmGkb 以及 Therapeutic Target Database(TTD)数据库中检索上述关键词,把获取的疾病靶点补充到在GeneCards数据库中得到的靶点中,在Excel表中进行去重,得到最终的疾病靶点库。使用Uniprot数据库将最终得到的基因靶点转化为靶基因。
1.3 疾病-化合物共同靶点的筛选 利用VennPainter软件,将玉屏风散化合物的作用靶点与疾病靶点取交集,筛选出二者共同的作用靶点。
1.4 药物-共同靶点-疾病网络的构建 将玉屏风散中化合物、疾病以及二者的共同靶点蛋白上传至Cytoscape软件(http://www.cytoscape.org/)生成体现药物-共同靶点-疾病相互作用的网络图。
1.5 蛋白互作网络(PPI)的构建 利用String(https://string-db.org/)蛋白互作数据库和Cytoscape软件分析共同靶点蛋白之间的相互作用,选择高相关性,并用R语言进行计数分析。
1.6 GO功能富集分析 利用Cytoscape软件对共同靶点蛋白进行GO功能富集分析,以了解共同靶点蛋白在基因功能中的作用,通过Omicshare软件(http://www.omicshare.com/tools/index,php/)对结果进行可视化处理。
1.7 KEGG通路富集分析 利用 David(https://david.ncifcrf.gov/)数据库和Cytoscape软件将共同靶点进行KEGG通路富集分析,对共同靶点蛋白在信号通路中的作用做注释分析,得到玉屏风散治疗CU的信号通路,通过Omicshare软件对结果进行可视化处理。
1.8 分子对接 选取“成分-靶点-通路”网络中度值排名前5的靶点,并反向寻找这些靶点对应的化合物,在 PDB 数据库(https://www.rcsb.org/)下载网络图中的核心靶点的结构,在PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/) 和 TCMSP(http://lsp.nwu.edu.cn/tcmspsearch.php)数据库下载主要化合物结构,使用AutoDock软件将主要化合物与主要靶点进行分子对接,并用PyMol软件将结果可视化。
2 结果
2.1 玉屏风散化合物及作用靶点的筛选 利用TCMSP分别查找玉屏风散中3味中药的化合物及作用靶点,以“OB≥30%,DL≥0.18”为条件经过整理发现,玉屏风散活性化合物共有44种,其中白术7种、防风18种、黄芪20种(其中黄芪与白术有共有化合物),见表1。查找玉屏风散中化合物的靶点,经Uniprot数据库基因注释后,筛选得到102个靶点。
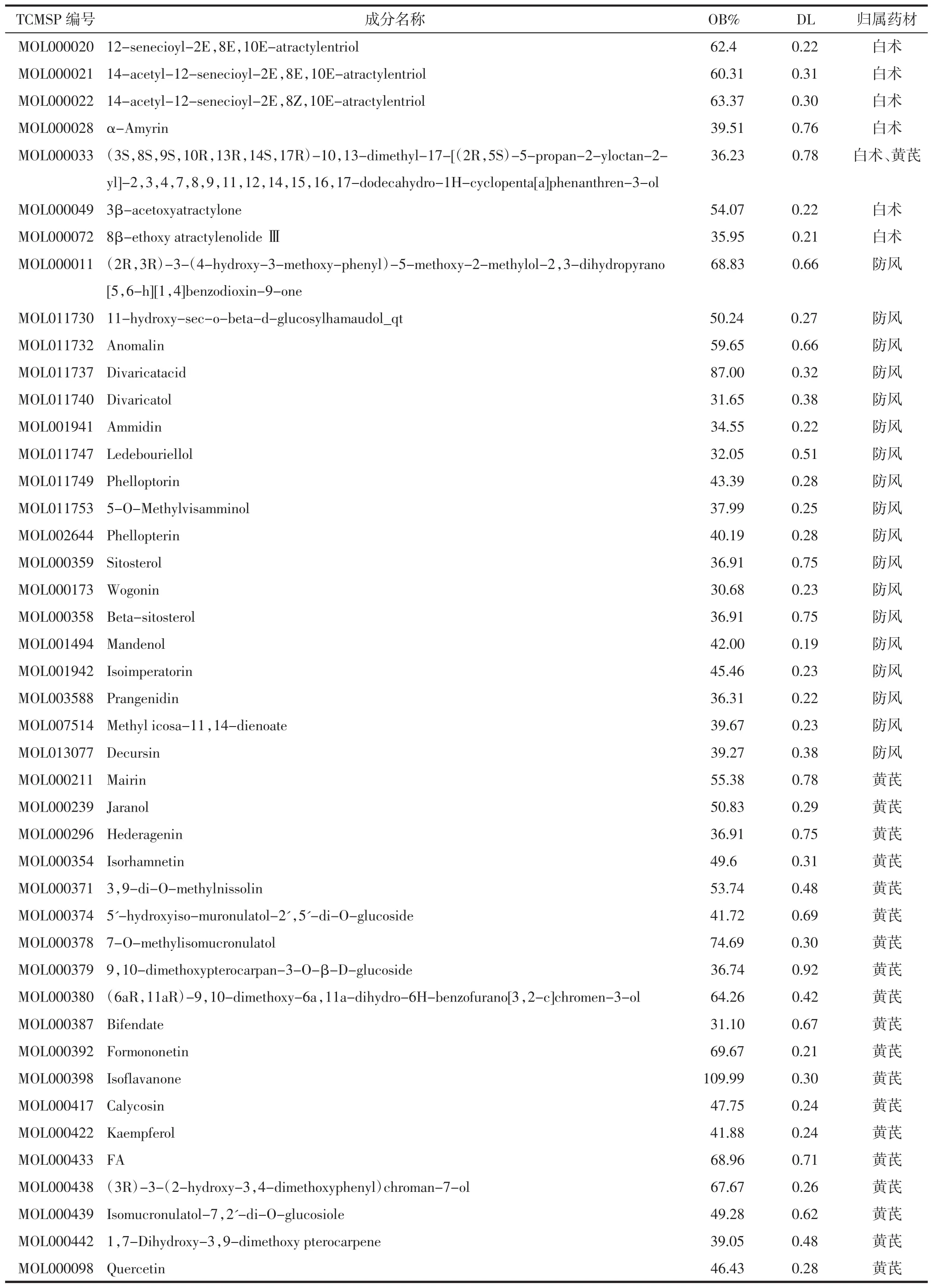
表1 玉屏风散中化合物的基本信息
2.2 疾病靶点及药物-疾病共同靶点的确定 利用OMIM、GeneCard、PharmGkb以及TTD疾病数据库经Uniprot数据库基因注释后,去除重复靶点,共筛选出960个疾病靶点。与102个化合物的靶点映射,利用VennPainter软件,分析得出玉屏风散与银屑病的共同靶点有35个,见图1。
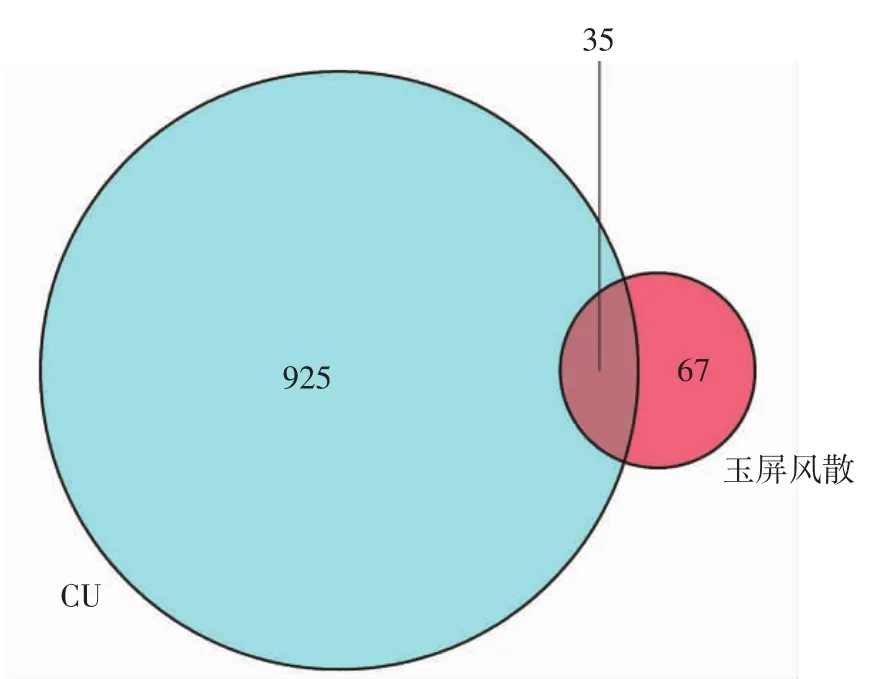
图1 药物疾病共同靶点Venn图
2.3 “药物-共同靶点-疾病网络”的构建与分析利用Cytoscape绘制的玉屏风散治疗CU的“药物-共同靶点-疾病网络”网络图,见图2。该网络图中共包括63个节点,其中疾病节点1个(红色),方剂节点1个(橙色),中药节点3个(黄色),靶点基因节点35个(蓝色),活性成分节点23个(绿色),其中包括白术1个,防风11个,黄芪11个。通过分析发现玉屏风散中最主要的前3种活性成分为槲皮素、山奈酚、β-谷甾醇。分析靶点节点度值较高的前3个靶基因为前列腺素内过氧化物合酶1(PTGS1)、毒蕈碱型胆碱受体M1(CHRM1)、乙酰胆碱酯酶(ACHE),提示这些基因可能是玉屏风散治疗CU的核心靶点。
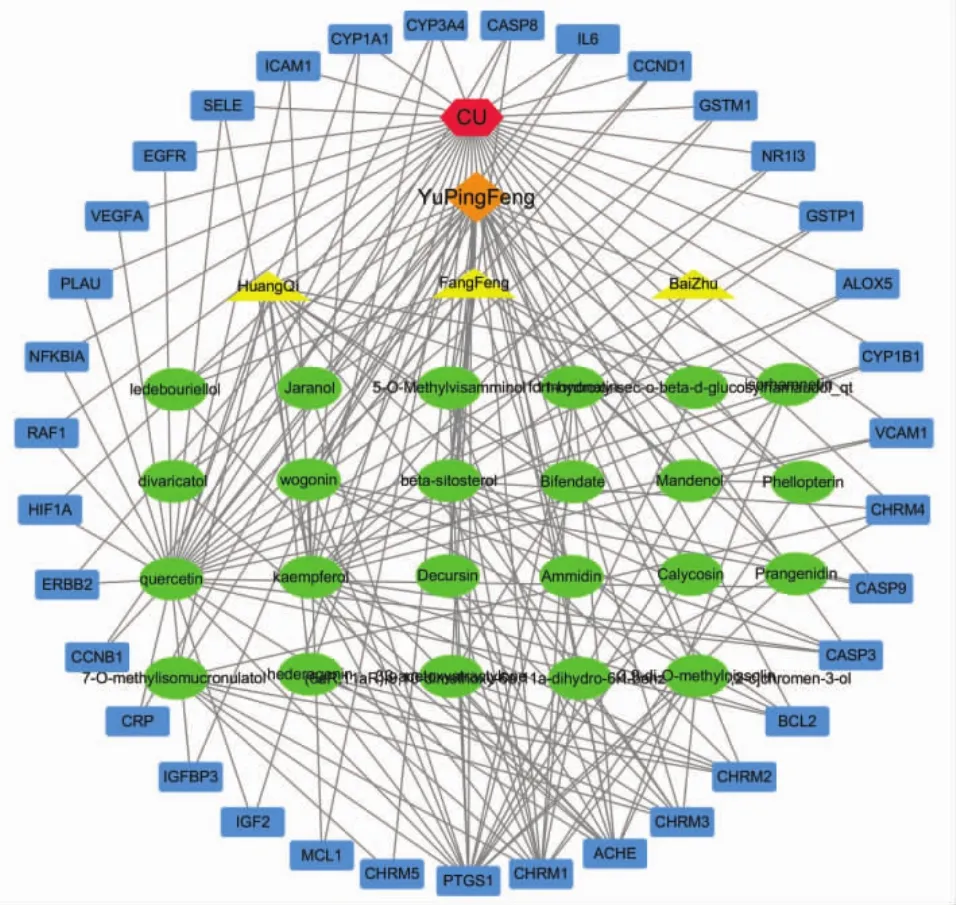
图2 药物-共同靶点-疾病网络
2.4 PPI的构建与分析 利用String蛋白互作数据库和R语言分析共同靶点蛋白之间的相互关系,见图3。对PPI中每个蛋白之间的相互关系进行计数,见图4,相互关系最多的蛋白前3位分别为白细胞介素-6(IL-6)、血管内皮生长因子 A(VEGF-A)、含半胱氨酸的天冬氨酸蛋白水解酶-3(Caspase-3)。
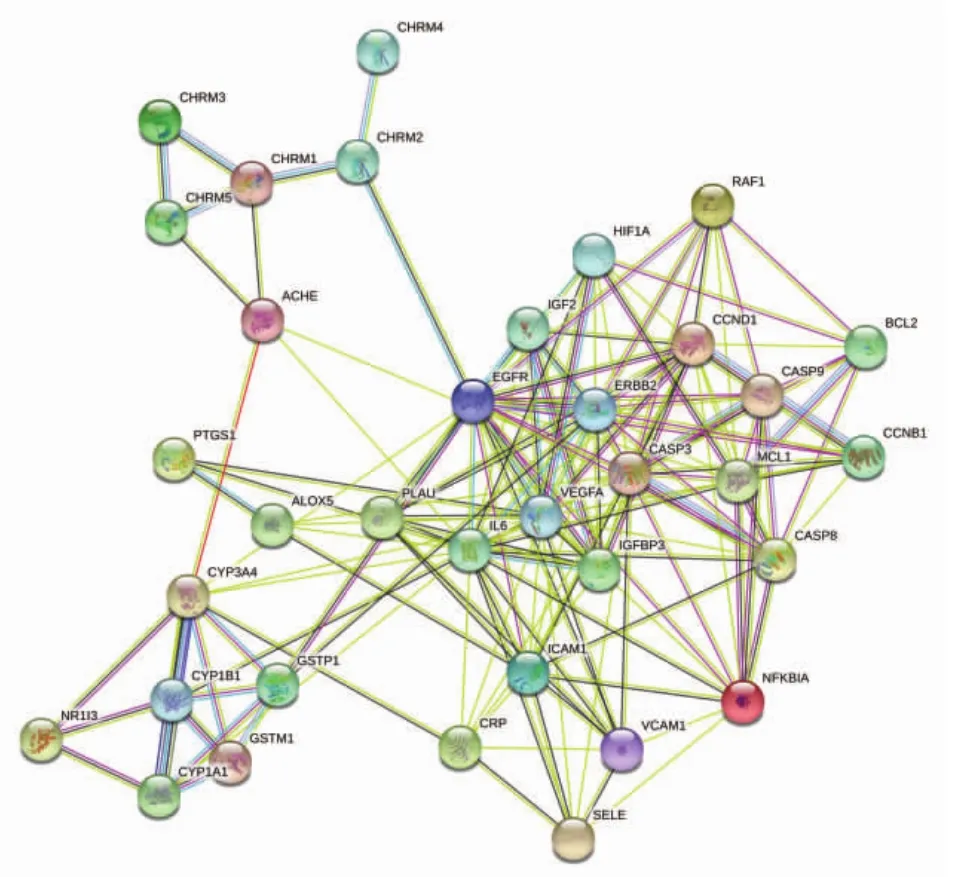
图3 PPI网络
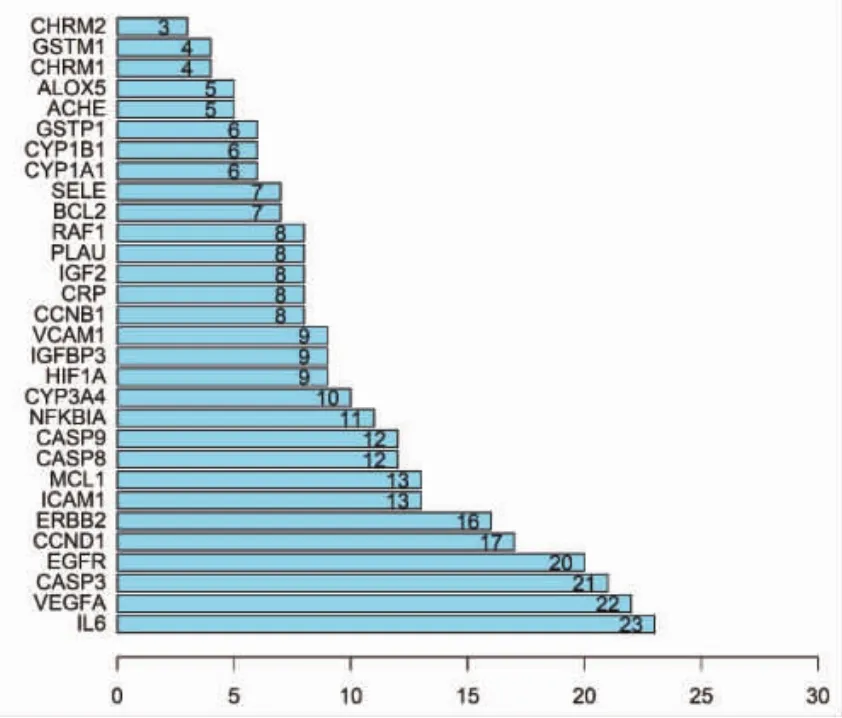
图4 PPI核心蛋白柱状图(前30)
2.5 GO功能富集分析 对玉屏风散与CU的共同靶点进行GO功能富集分析,以错误发现率(FDR)<0.05为标准,确认了395条结果,利用Omicshare软件对结果进行可视化处理,展示前20个共同的基因功能,见图5,分别是对抗生素的反应、细胞对异物的反应、对金属离子的反应、G蛋白偶联乙酰胆碱受体信号通路、对糖皮质激素的反应、对脂多糖的反应、对细菌源分子的反应。对皮质类固醇的反应、对缺氧的反应、对氧水平降低的反应、乙酰胆碱受体信号通路、对氧水平的反应、对乙酰胆碱的反应、细胞对乙酰胆碱的反应、对异型生物质的反应、对铁离子的反应、细胞对药物的反应、G蛋白偶联血清素受体信号通路、外源性凋亡信号通路、突触后信号传导。
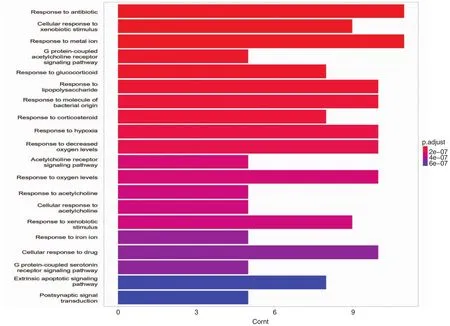
图5 GO富集分析
2.6 KEGG通路富集分析 对玉屏风散和CU的共同靶点利用DAVID数据库进行KEGG通路富集分析,以 P<0.01,FDR<0.05进行筛选,并将结果利用Omicshare软件可视化。共涉及95条信号通路,展示前20个信号通路,见图6,主要包括前列腺肿瘤、卡波西肉瘤相关疱疹病毒感染、在糖尿病并发症中的晚期糖基化终产物及其受体(AGE-RAGE)信号通路、磷脂酰肌醇3激酶-蛋白激酶B(PI3K-Akt)信号通路、抗药性、p53信号通路、在肿瘤中的蛋白多糖、人巨细胞病毒感染、在肿瘤中的MicroRNA、肿瘤坏死因子(TNF)信号通路、突触胆碱能、胰腺癌、膀胱癌、表皮生长因子受体(EGFR)酪氨酸激酶抑制剂耐药、细胞凋亡、结肠癌、EB病毒感染、麻疹病毒、流体剪切损伤和动脉粥样硬化通路、丙型肝炎。
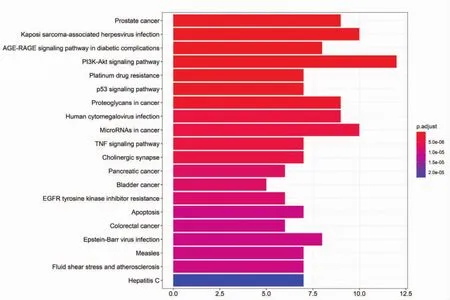
图6 KEGG通路富集分析
2.7 分子对接分析 在“药物-共同靶点-疾病”网络中节点数前 3位的靶点为 PTGS1、CHRM1、ACHE,反向找出调控其的活性成分,计算各个靶点与其对应化合物的结合能,见表2。从表中可以看出结合能均小于0,说明靶点与化合物都能结合,并且结合能越小,对接效果越好。根据对接结果做出热图,其中蓝色越浅,表明结合效果越好,见图7。取每个靶点结合最好的化合物进行分子对接,并将对接部位与氢键直接相连的氨基酸进行标记,见图8。
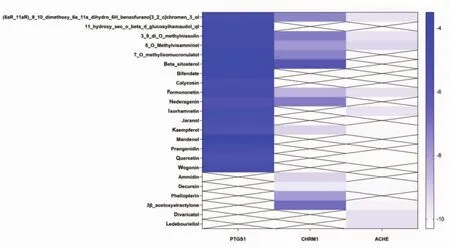
图7 对接结果热图分析
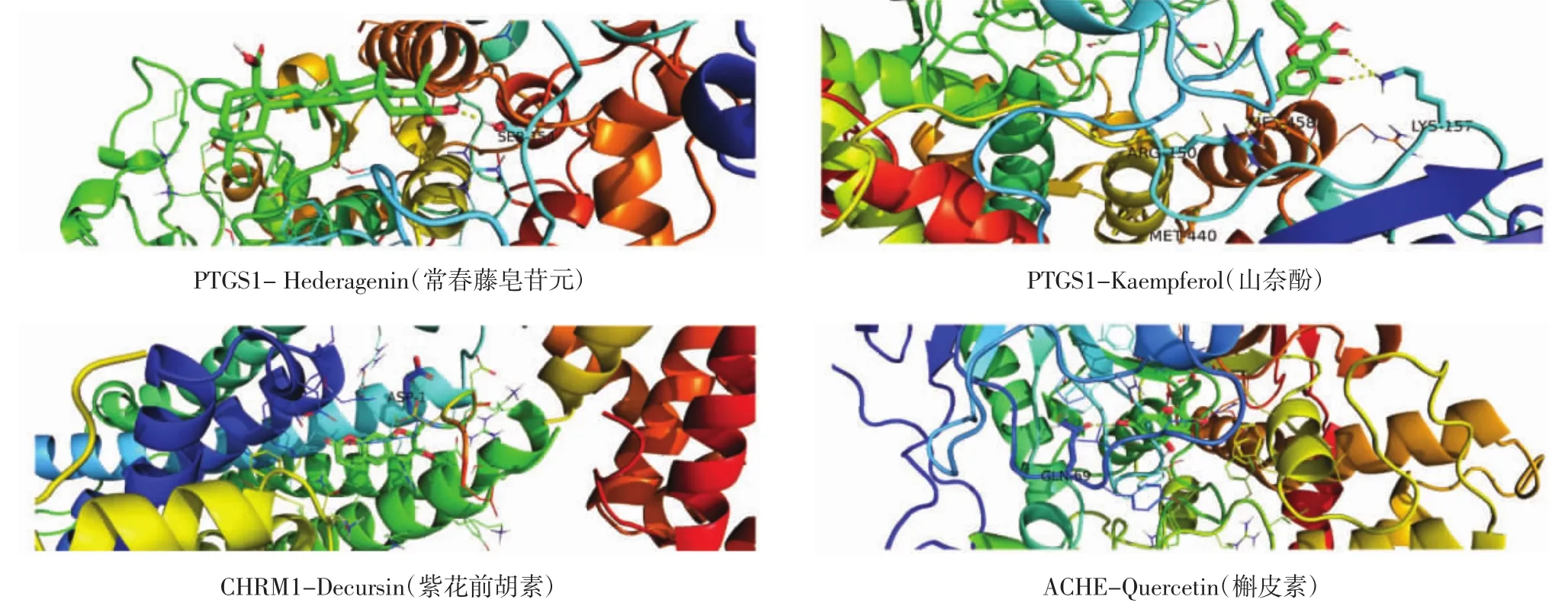
图8 对接结果模式图

表2 关键靶点与其对应化合物的对接情况
3 讨论
CU是一种肥大细胞介导的疾病,其特征是荨麻疹或血管性水肿的复发,临床上将其分为慢性自发性荨麻疹和慢性诱导性荨麻疹两类[11]。目前,CU的发病机制尚不明确,普遍认为是皮肤肥大细胞激活后释放组胺和其他促炎介质,这也是造成CU皮损血管扩张的原因,自身抗体如抗IgE抗体、抗高亲和力IgE Fc受体抗体也是荨麻疹重要的发病机制,但是该机制并不适用于所有荨麻疹患者[12-13]。
目前,关于玉屏风散治疗CU已有大量的临床疗效观察研究。符娟等[14]发现左西替利嗪联合玉屏风散加味治疗CU,临床疗效显著,能够有效减少不良反应且降低短期复发率。将玉屏风散合桂枝汤加味配合腹针能有效改善CU患者的免疫功能,从而提高治疗效果,并降低复发率及改善生活质量[15]。但是目前对于玉屏风散治疗CU的作用机制的研究较少,导致相关机制尚不明确。
根据“药物-共同靶点-疾病网络”网络图显示,槲皮素、山奈酚、β-谷甾醇是玉屏风散治疗CU的关键化合物。槲皮素有清除自由基和抗过敏的作用,其特征在于刺激免疫系统,抗病毒活性,抑制组胺释放,促炎性细胞因子减少,白三烯生成并抑制IL-4产生,其可以改善辅助性T细胞1(Th1)/Th2平衡,并抑制抗原特异性IgE抗体的形成[17-18]。因此,槲皮素可以通过增强机体免疫力和改善过敏反应达到治疗CU的目的。目前,山奈酚治疗CU的机制尚不明确,有研究表明山奈酚作为角菊叶乙醇提取物的成分之一,能显著抑制IL-6、IL-1和前列腺素(PG)E2的生成,而角菊叶乙醇提取物整体能够通过抑制细胞外调节蛋白激酶磷酸化而发挥抗炎作用[19]。山奈酚能够降低CD3+T细胞浸润和主要促炎细胞因子包括IL-6、IL-17A和TNF-α的表达,同时也承担监管皮肤上的促炎核转录因子信号[20],但具体的机制还需要进一步明确。β-谷甾醇能够使皮肤产生抗炎作用,减少TNF、IL-1β和IL-6的释放,但治疗CU的机制不明确[21-22]。
分析靶点节点度值较高的前3个靶基因为PTGS1、CHRM1、ACHE。PTGS也称环氧化酶(COX),其分为 PTGS1和 PTGS2,即 COX-1和 COX-2,能够催化花生四烯酸的PG生物合成[23]。PTGS1属于结构酶,主要在正常的组织和细胞中表达[24]。PTGS1催化产生的PGE2能够通过前列腺素E受体3(EP3)受体激活肥大细胞诱导急性炎性反应,同时也能通过Th1分化、Th17增殖和Th22通过EP2和EP4受体产生IL-22来诱导慢性炎性反应和各种自身免疫性疾病[25]。与CHRM1相关的疾病主要包括肿瘤、阿尔茨海默病和精神分裂症,CHRM1对于皮肤病的作用研究还比较少[26-28]。研究发现,ACHE可能参与皮肤创伤后炎性反应的调节和纤维化修复[29]。
基于网络药理学和分子对接技术研究玉屏风散治疗CU的作用机制,从生物信息学分析的角度明确了玉屏风散通过多成分、多靶点,调节免疫功能、缓解炎性反应治疗CU。同时根据分析所得数据,也为进一步明确CU的发病机制提供了今后研究的新方向。
