白藜芦醇-表没食子儿茶素没食子酸酯脂质体的制备及体外透皮性质研究
2022-11-05宋娟于绪东王栋
宋娟,于绪东,王栋
(大连市皮肤病医院,辽宁 大连 116021)
白藜芦醇是一种天然非黄酮类的多酚化合物,有抗肿瘤、抗炎、抗过敏、抗氧化、抗病毒、保护心血管系统及免疫调节等广泛的药理作用[1-4]。近年来,有研究报道白藜芦醇能够通过抑制多种炎性因子如白细胞介素-1β(IL-1β)、IL-6 及肿瘤坏死因子-α(TNF-α)等的表达,下调核因子-κB(NF-κB),而产生一定的银屑病治疗作用[5]。表没食子儿茶素没食子酸酯(EGCG)是绿茶提取物茶多酚的主要活性成分,EGCG则能够通过下调辅助性T细胞1(Th1)及Th17的特异性转录因子STAT1、STAT3及RORct,抑制新生血管形成、上调Caspase-14的表达,诱导角质形成细胞分化等来有效地治疗银屑病[6-7]。因此,联合应用白藜芦醇与EGCG对银屑病进行治疗将有广泛的应用前景,然而,白藜芦醇及EGCG均存在化学性质不稳定,易被氧化分解,生物利用度低的缺陷,且白藜芦醇难溶于水、EGCG皮肤渗透性差等问题进一步限制了二者的临床应用。
脂质体是由脂质双分子层组成闭合囊泡,脂质体作为经皮给药的载体,能够同时包载水溶性和脂溶性的药物,提高药物的稳定性,增加难溶性药物的生物利用度,改善药物的渗透性,并有缓控释的作用[8-10]。本文采用逆向蒸发法将白藜芦醇及EGCG共同包载于脂质体中制成白藜芦醇-EGCG脂质体,并对其制剂学性质及体外透皮性能进行研究,为白藜芦醇-EGCG脂质体进一步开发提供理论基础。
1 材料与方法
1.1 一般材料
1.1.1 仪器 UltiMate3000高效液相色谱仪(Ulti-Mate3000泵、UltiMate3000 UV检测器、Chromeleon Console色谱工作站,Thermo Fisher Scientific公司);TK-12A型透皮扩散实验仪(上海锴凯科技贸易有限公司);LP 220S型电子天平(赛多利斯科学仪器有限公司);BS110S型电子天平(赛多利斯科学仪器有限公司);JY92-II型超声波细胞粉碎机(宁波新芝科器研究所);Senco R型旋转蒸发仪(上海申生科技有限公司)。
1.1.2 试药 EGCG(杭州禾田生物科技有限公司,纯度为98%);白藜芦醇(大连市皮肤病医院刘之力主任馈赠);大豆卵磷脂(上海艾伟拓医药科技有限公司);甲基叔丁基醚(阿拉丁试剂网);胆固醇(上海艾伟拓医药科技有限公司)。
1.2 方法
1.2.1 白藜芦醇-EGCG脂质体的制备 采用逆向蒸发法制备白藜芦醇-EGCG脂质体。称取300 mg大豆卵磷脂、10 mg胆固醇及15 mg白藜芦醇溶解于6mL甲基叔丁基醚中,得到有机相;EGCG的水溶液即为水相;然后将水相与有机相混合(1∶3,V/V),采用超声波细胞粉碎机进行超声分散(600W×20min),室温减压旋蒸,除去有机溶剂后,加入4 mL纯化水作为水化介质,在40℃水浴中充分水化,待除去残存的甲基叔丁基醚后,将得到的水性混悬液超声(200 W×1 min),过0.22 μm滤膜,即得白藜芦醇-EGCG脂质体。
1.2.2 白藜芦醇-EGCG脂质体制剂学性质表征
1.2.2.1 白藜芦醇-EGCG脂质体的外观 采用目测法,观察白藜芦醇-EGCG脂质体的外观。
1.2.2.2 白藜芦醇-EGCG脂质体的粒径 取白藜芦醇-EGCG脂质体适量,以纯化水作为稀释介质,稀释10倍后采用激光粒度测定仪测定白藜芦醇-EGCG脂质体的粒度及其分布。
1.2.2.3 白藜芦醇-EGCG脂质体的包封率 采用超滤-离心法测定白藜芦醇-EGCG脂质体中白藜芦醇及EGCG的包封率。
游离药物的测定:精密量取白藜芦醇-EGCG脂质体加纯化水对倍稀释后,置滤膜截留分子质量为50 000的超滤离心管中,13 000 r/min离心15 min,离心半径为8.6 cm,精密量取超滤液0.2 mL 2份分别置10 mL量瓶中,一份加入甲醇稀释至刻度,摇匀,按照“1.2.2.4.2白藜芦醇-EGCG脂质体中白藜芦醇含量测定”项下色谱条件测定白藜芦醇的浓度,即为游离药物浓度(C游离),另一份加甲醇∶水∶乙酸=23∶75∶2稀释至刻度,摇匀,参照前期报道的色谱条件[11]测定EGCG的浓度,即为游离EGCG浓度(C游离)。
总药量的测定:精密量取白藜芦醇-EGCG脂质体0.1 mL置10 mL量瓶中,加甲醇5 mL超声后,分别加甲醇和甲醇∶水∶乙酸=23∶75∶2 稀释至刻度,摇匀,取上清液过0.22 μm滤膜。按照“1.2.2.4.2白藜芦醇-EGCG脂质体中白藜芦醇含量测定”项下色谱条件和文献报道的色谱条件[11]测定白藜芦醇和EGCG的浓度,即为总的药物浓度(C),按如下公式计算白藜芦醇-EGCG脂质体中白藜芦醇和EGCG的包封率。
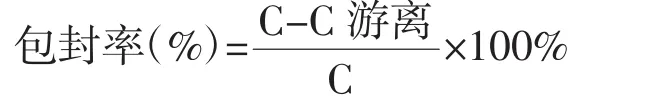
1.2.2.4 白藜芦醇-EGCG脂质体中药物含量测定
1.2.2.4.1 白藜芦醇-EGCG脂质体中EGCG含量测定 白藜芦醇-EGCG脂质体中EGCG的含量参照文献报道的色谱条件[11]进行测定,精密量取0.1 mL白藜芦醇-EGCG脂质体置10 mL量瓶中,加入甲醇5 mL超声后,加流动相稀释至刻度,摇匀,取上清液过0.22 μm滤膜。精密量取20 μL注入液相色谱仪,记录色谱图,另取EGCG对照品,精密称定,采用流动相定量稀释成每1 mL约含20.0 μg EGCG的溶液,同法测定,按外标法以峰面积计算,即得。
1.2.2.4.2 白藜芦醇-EGCG脂质体中白藜芦醇含量测定
①高效液相色谱(HPLC)条件 色谱柱为Elite-ODS 柱(200 mm×4.6 mm,5 μm);流动相为甲醇∶水=48∶52;柱温为 30 ℃;流速为 1.0 mL/min;检测波长为303 nm。
测定方法:精密量取0.1 mL白藜芦醇-EGCG脂质体置10 mL量瓶中,加入甲醇5 mL超声后,继续加甲醇稀释至刻度,摇匀,取上清液过0.22 μm滤膜。精密量取10 μL注入液相色谱仪,记录色谱图,另取白藜芦醇对照品,精密称定,采用甲醇定量稀释成每1 mL约含20.0 μg白藜芦醇的溶液,同法测定,按外标法以峰面积计算,即得。
②专属性考察 分别取对照溶液(“线性范围”项下20.0 μg/mL溶液),空白脂质体溶液及供试品溶液按“1.2.2.4.2白藜芦醇-EGCG脂质体中白藜芦醇含量测定”项下方法进行处理后,精密量取10 μL注入液相色谱仪,记录色谱图。
③线性范围 精密称取白藜芦醇对照品10.0mg,置100 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀;精密移取 0.5、1.0、2.0、4.0及 8.0 mL 置 10 mL 量瓶中,加甲醇稀释至刻度,摇匀,配制成浓度分别为5.0、10.0、20.0、40.0 及 80.0 μg/mL 系列标准溶液,精密量取10 μL注入液相色谱仪,记录色谱图。以峰面积A对浓度C进行线性回归。得到回归方程和相关系数。
④回收率实验 精密量取0.1 mL不含白藜芦醇的空白脂质体溶液置10 mL量瓶中,分别加入1.0 mg/mL 的对照溶液 0.16 mL,0.2 mL,0.24 mL 配制成低、中、高3个浓度的供试品,每个浓度各3份,加甲醇5 mL超声后,继续加甲醇稀释至刻度,摇匀,取上清液过0.22 μm滤膜。精密量取10 μL注入液相色谱仪,记录色谱图,计算低、中、高3个浓度平均回收率。
⑤重复性实验 按“1.2.2.4.2白藜芦醇-EGCG脂质体中白藜芦醇含量测定”项下方法,制备供试品溶液6份及对照品溶液,计算6份样品含量的相对标准偏差来验证重复性。
⑥精密度实验 取“线性范围”项下20.0 μg/mL溶液,精密量取10 μL注入液相色谱仪,记录色谱图,重复进样6次,计算白藜芦醇峰面积的相对标准偏差(RSD)值。
1.2.3 大鼠体外经皮渗透性及皮肤滞留量考察
1.2.3.1 体外经皮渗透性实验 采用Franz扩散法研究白藜芦醇-EGCG脂质体及白藜芦醇-EGCG乙醇溶液的体外透皮性质。处理好的SD大鼠皮肤置于供给池与接受池之间,通过取样管向接受池中注满20%的乙醇溶液,接受池体积为7 mL,排净皮肤真皮层与接受液之间的气泡,然后将样品缓缓加入供给池,扩散装置的温度维持在(32.0±0.5)℃,磁力搅拌速度为 400 r/min。分别于 0.5、1.0、3.0、5.0、8.0、12.0、24.0 h取出5 mL接受液,过滤,每次取样后立即补加同温同体积的新鲜接受液,采用HPLC法测定不同时间接受液中EGCG及白藜芦醇的浓度,按如下公式计算单位面积累积透过量(Q)。以时间(t)为横坐标,Q为纵坐标作图,分别得到EGCG及白藜芦醇体外经皮渗透曲线,对曲线中的直线部分进行线性回归,所得直线的斜率即为稳态透皮速率(Js,μg/cm2·h)
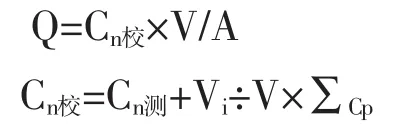
式中Q为t时间单位面积累积透过量(μg/cm2),Cn校为校正后接受液中药物的浓度;Cn测为第n次取样测得接受液中药物的浓度;V和Vi分别为接受池中接受液的总体积和每次取样体积;∑Cp为该取样点前各点的测定浓度之和;A为有效透皮扩散面积。
1.2.3.2 大鼠皮肤内药物滞留量实验 体外经皮渗透性实验结束后,取下鼠皮,用20%乙醇及蒸馏水反复清洗皮肤表面残存的药物,滤纸吸干皮肤表面的溶剂,并将多余的皮肤剪掉后称重,用剪刀将皮肤剪碎,置于超声管中,精密加入5 mL甲醇,用超声波细胞破碎仪超声5 min,取上清液移入至10 mL量瓶中,加甲醇稀释至刻度,过0.22 μm滤膜,精密量取10 μL进样,测定皮肤中白藜芦醇的滞留量,另取续滤液加甲醇∶水∶乙酸=23∶75∶2 对倍稀释,精密量取20 μL进样,测定皮肤中EGCG的滞留量。
2 结果
2.1 白藜芦醇-EGCG脂质体制剂学性质表征
2.1.1 白藜芦醇-EGCG脂质体的外观 脂质体外观是评价其质量的一个直观指标,白藜芦醇-EGCG脂质体的外观,肉眼观察白藜芦醇-EGCG脂质体为淡黄色的半透明乳状液,见图1。

图1 白藜芦醇-EGCG脂质体的外观
2.1.2 白藜芦醇-EGCG脂质体的粒径 激光粒度测定仪测定白藜芦醇-EGCG脂质体的粒度及其分布,白藜芦醇-EGCG脂质体的粒径为128.1 nm,其多分散指数(PDI)值为 0.115,见图 2。

图2 白藜芦醇-EGCG脂质体的粒径及分布
2.1.3 白藜芦醇-EGCG脂质体的包封率 采用逆向蒸发法制备的白藜芦醇-EGCG脂质体,对脂质体中的白藜芦醇及EGCG的包封率进行测定,白藜芦醇的包封率高达(91.70±0.42)%,EGCG的包封率为(91.10±2.84)%,见表 1。

表1 白藜芦醇-EGCG脂质体中药物的包封率
2.1.4 白藜芦醇-EGCG脂质体中药物含量测定
2.1.4.1 白藜芦醇-EGCG脂质体中EGCG含量测定 采用HPLC法对所制备的白藜芦醇-EGCG脂质体中EGCG含量进行测定,结果表明,白藜芦醇-EGCG脂质体中EGCG含量为(1.54±0.39)g/L。
2.1.4.2 白藜芦醇-EGCG脂质体中白藜芦醇含量测定
①专属性考察 专属性实验结果,白藜芦醇的保留时间为5.993 min,空白脂质体中的辅料对白藜芦醇的测定无干扰,所有峰均能达到分离,见图3。

图3 A空白脂质体的液相色谱图;B标准溶液的液相色谱图;C EGCG-PL的液相色谱图
②线性范围 以峰面积A对浓度C进行线性回归,得到白藜芦醇的回归方程为A=1.333 6C+0.403 9,白藜芦醇在浓度为 5.0~80.0 μg/mL范围内,色谱峰面积与浓度线性关系良好。
③回收率实验 通过计算得到白藜芦醇低、中、高3个浓度平均回收率分别为(100.85±0.59)%、(101.31±0.39)%、(100.77±0.02)%(n=3),RSD 分别为0.59%、0.39%、0.02%,回收率均符合要求。
④重复性实验 按照检验方法所述,制备供试品溶液6份及对照品溶液,计算6份样品含量的RSD来验证重复性,得到6份供试品的RSD为1.33%,证实该方法重复性符合要求。
⑤精密度实验 精密度实验结果表明,白藜芦醇峰面积的RSD为0.13%,表明该方法精密度良好。
⑥白藜芦醇含量测定 采用上述验证的HPLC法对所制备的白藜芦醇-EGCG脂质体中的白藜芦醇的含量进行测定,结果表明样品中白藜芦醇的含量为(2.53±0.11)g/L。
2.2 大鼠体外经皮渗透性及皮肤滞留量考察
2.2.1 体外经皮渗透性实验 体外经皮渗透曲线与白藜芦醇-EGCG乙醇溶液组相比,白藜芦醇-EGCG脂质体中的白藜芦醇和EGCG更容易透过大鼠皮肤渗透至接受液中,见图4。白藜芦醇-EGCG脂质体组中白藜芦醇24 h累积透过量(22.85±0.88)μg/cm2,EGCG 24 h 累积透过量(51.91±20.56)μg/cm2分别是白藜芦醇-EGCG乙醇溶液组的5.40倍和3.85倍。对曲线中的直线部分进行线性回归,计算不同制剂中白藜芦醇及EGCG的Js,白藜芦醇-EGCG脂质体及白藜芦醇-EGCG乙醇溶液中白藜芦醇的Js分别为0.983 0 μg/(cm2·h)和0.203 7 μg/(cm2·h),2种制剂中EGCG的Js分别为2.207 3 μg/(cm2·h)和0.584 3 μg/(cm2·h),其渗透均符合零级动力学方程,见表2。
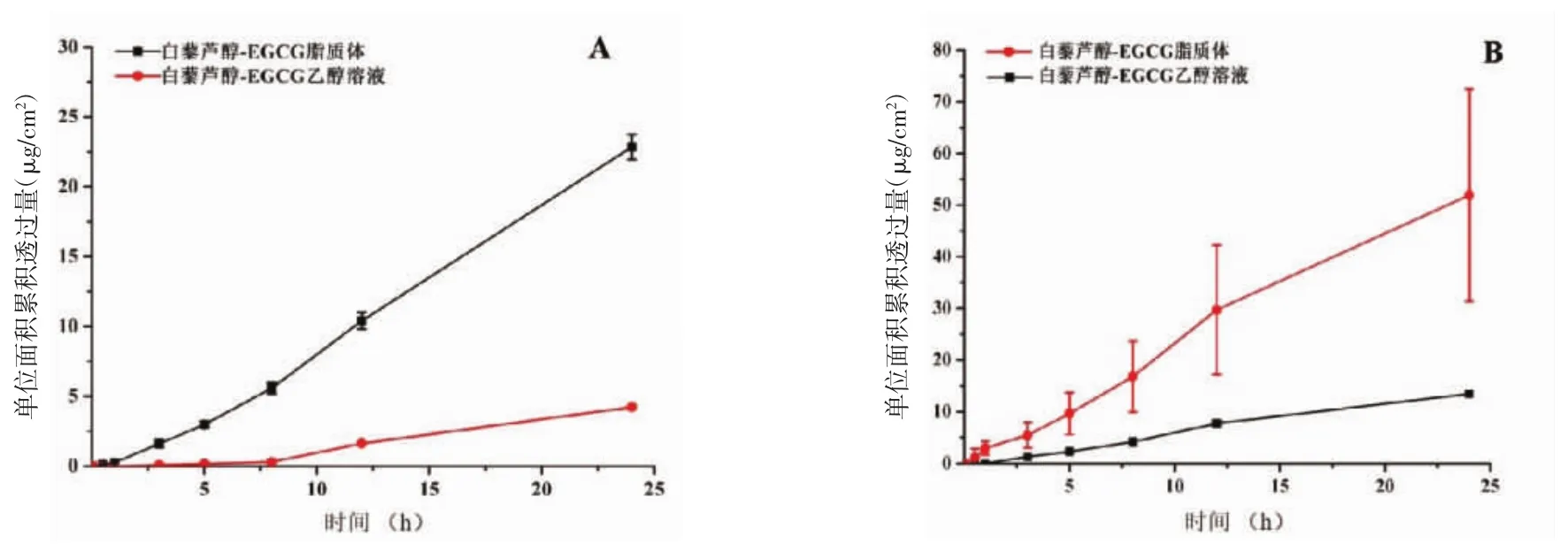
图4 A白藜芦醇-EGCG 2种制剂中白藜芦醇的大鼠经皮渗透曲线;B白藜芦醇-EGCG 2种制剂中EGCG的大鼠经皮渗透曲线

表2 白藜芦醇-EGCG 2种制剂中药物的渗透方程及渗透参数
2.2.2 大鼠皮肤内药物滞留量实验 白藜芦醇-EGCG脂质体组的大鼠皮肤内白藜芦醇及EGCG的滞留量分别为(695.07±130.29)μg/g及(473.14±93.02)μg/g要明显的高于白藜芦醇-EGCG乙醇溶液组(P<0.01),见表 3。

表3 白藜芦醇-EGCG 2种制剂中单位面积皮内药物滞留量 μg/g
3 讨论
白藜芦醇为难溶性药物且对光热均不稳定,白藜芦醇的水中溶解度仅为0.03 g/L,致使其很难在体内发挥良好的生物学效应。且有研究报道白藜芦醇在光照条件下放置0.5 h吸收度下降52%,因此,白藜芦醇需要进行避光保存。本研究证实将白藜芦醇包载于脂质体中能够有效地提高药物的溶解度及稳定性,白藜芦醇-EGCG脂质体中白藜芦醇的含量为(2.53±0.11)g/L,同时在前期的研究中发现该制剂在没有避光的条件下放置20 d,白藜芦醇的含量无明显变化,放置20 d后白藜芦醇-EGCG脂质体中白藜芦醇的含量为(2.51±0.10)g/L。
白藜芦醇的水溶性较差,为了增加白藜芦醇在供给池与接受池中的浓度,保证漏槽条件,本研究采用了20%的乙醇溶液作为接受介质,并以白藜芦醇-EGCG乙醇溶液作为对照组进行后续研究。
本研究发现,白藜芦醇-EGCG脂质体中EGCG的包封率为(91.10±2.84)%,而未加白藜芦醇的普通EGCG脂质体的包封率仅为(63.32±3.21)%。该结果证实白藜芦醇能在一定程度上提高EGCG的包封率,分析其可能的原因为一方面白藜芦醇能够调节脂质双分子层的流动性,降低磷脂双分子层的渗透性,从而提高水溶性药物EGCG的包封率,另一方面白藜芦醇分子中的羟基可能与EGCG中的羟基形成分子间作用力从而提高EGCG的包封率。
