玉米小曲酒糟发酵饲料对育肥猪肠道菌群的影响
2022-11-05王松简晓平潘婉舒张永光王涛游玲
王松 简晓平 潘婉舒 张永光 王涛 游玲
(1. 宜宾学院固态发酵资源与利用四川省重点实验室,宜宾 644000;2. 四川省宜宾高洲酒业有限责任公司,宜宾 645178;3. 宜宾学院农林与食品工程学部,宜宾 644000)
作为我国重要的生猪养殖基地,西南地区特别是四川盆周山区广泛种植玉米,其主要用途是直接用作猪饲料,同时也催生了在县乡一级大量分布的以玉米为原料的小曲酒生产作坊。这些作坊一般以整粒玉米蒸煮后加入根霉、酵母,按照川法小曲酒工艺固态发酵7-10 d后蒸馏,出酒率在50%左右(折合53%vol白酒计),仅相当于玉米理论出酒率的一半左右。因此小曲发酵后的玉米酒糟与生产食用酒精后的玉米酒糟有很大差异,小曲酒糟玉米粒形态较为完整,且富含淀粉、玉米胚芽蛋白、微生物菌体蛋白、微生物活性代谢产物等,具有较高饲用价值,可直接用于生猪养殖。这些作坊一方面以15 000-18 000元/t为当地中低端白酒市场提供“包谷酒”,另一方面以700-800元/t为当地养殖业提供玉米酒糟饲料,基本实现了零固废排放。但玉米小曲酒糟经过蒸馏后活菌均已死亡,不能起到补充肠道益生菌的作用,且营养不够均衡,还需要添加其他饲料才能满足生猪营养需求,增加了养殖过程中的繁琐程度及劳动力投入。因此,在玉米小曲酒糟中添加粮食及其他辅料,通过复合菌剂发酵生产全价育肥猪饲料成为当前乡村劳动力缺乏情况下的较优选择。
目前,无抗益生菌发酵饲料是我国饲料产业的主要发展方向,已有菜籽粕[1]、构树[2]、秸秆[3]、酒糟[4]等多种原料用于发酵饲料的生产,其发酵方式以固态发酵为主[5-6]。与普通饲料相比,发酵饲料除提供必要的大量或微量营养物质外,其最大的特色在于通过添加益生菌发酵产生多肽[7]、多糖等多种活性成分以改善动物健康状况[8],促进增重,改善肉质。目前,猪发酵饲料的研究主要包括新发酵原料的应用[9-10]、中草药[11-12]及饲料酸化剂[13]等辅料的添加,发酵菌种选育[14]、益生菌及其活性产物作用机制[15-16]等方面的研究,但多数研究成果由于应用效果不稳定、经济性较差、工艺复杂等原因未能转化应用。
在前期研究中,本课题组开发了一种玉米小曲酒糟全价饲料发酵技术,用于育肥猪饲养效果较好,因此,本研究通过探讨该全价发酵饲料对育肥猪肠道微生物的影响,初步揭示其影响育肥猪生长的主要机制,为该技术在生猪养殖中的进一步完善和推广应用提供科学依据。
1 材料与方法
1.1 材料
玉米小曲酒糟全价发酵饲料(以下简称发酵饲料):1 658 kg玉米小曲酒糟,添加玉米粉1 720 kg、豆粕560 kg、其他辅料56 kg及由干酪乳酸菌、酿酒酵母、黑曲霉、枯草芽孢杆菌组成的复合菌剂2 kg,混匀后按照40 kg /袋装入呼吸袋,常温发酵5 d后备用。
育肥猪:36头平均体重(116±2)kg的外三元育肥猪,由本地养猪场提供。
1.2 方法
1.2.1 饲喂实验 随机选择36头体重接近的育肥猪,分成两组,分置于两个面积50 m2左右的圈舍,其中18头采用养殖场自配的玉米-豆粕型日粮(以下简称常规饲料),另外18头饲喂发酵饲料(表1),自由采食,连续饲喂47 d,期间观察猪皮肤、毛色、神态等外观形态以及粪便颜色、气味。
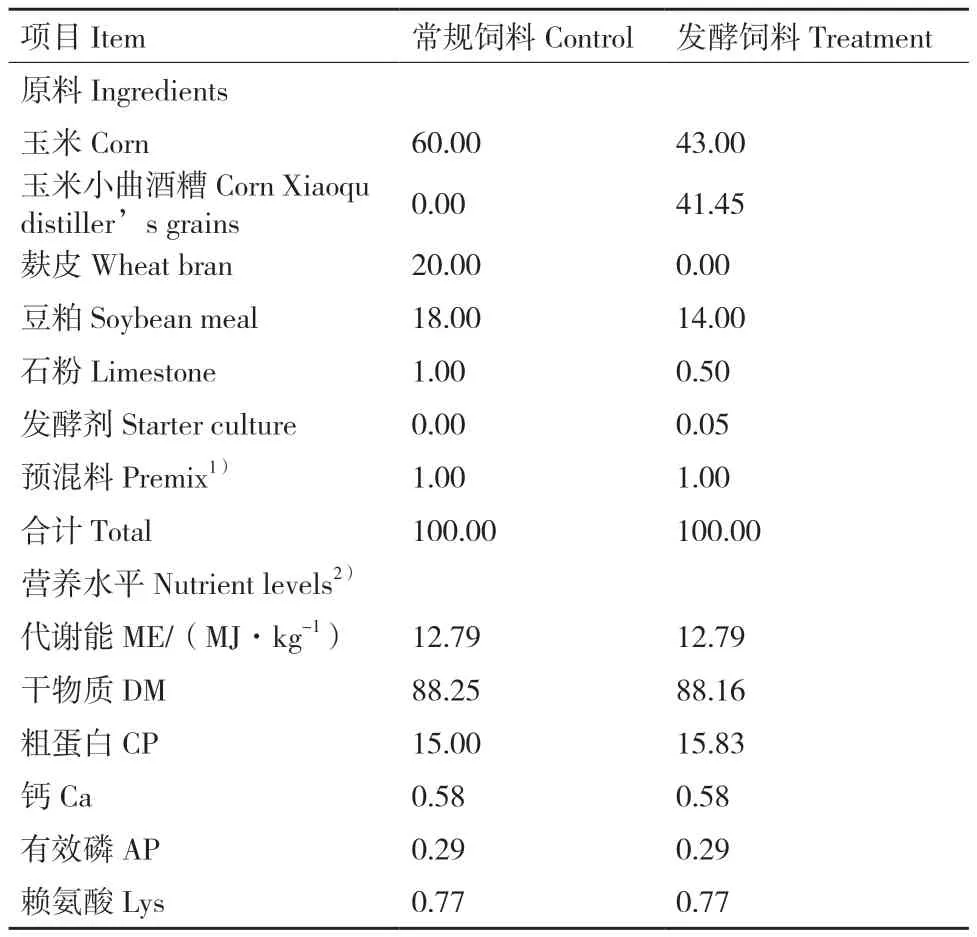
表1 试验饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of experimental diets(dry matter basis)%
1.2.2 育肥猪体重及饲喂饲料重量 饲喂前后,采用地磅对各组的18头育肥猪分别称重后合并取平均值(kg/d)。每天每个组分2次共添加36 kg饲料,自由采食后称重剩余饲料重量,计算每天1头育肥猪的平均采食量(kg/d)。
1.2.3 猪肉品质分析 采用常温烘干法测定猪肉水分[17],采用鲜样浸提法测定肌内脂肪含量[18],根据参考文献[19]用pH计对猪肉进行预处理及pH测定。
1.2.4 饲料中微生物计数 采用许东梅[20]的方法,对饲料中细菌菌落总数、乳酸菌、酵母菌和霉菌分别进行计数。
1.2.5 肠道细菌区系分析 宰杀后,用无菌取样方法将同一组育肥猪结肠和小肠内容物分别混合成一个样品,则有对照组结肠混合样品(Colctl)、对照组小肠混合样品(Intctl)、发酵饲料组结肠混合样品(Coltmt)、发酵饲料组小肠混合样品(Intmt)共4个样品,装入无菌取样袋-80℃保存,用干冰送样至北京微生态公司,采用土壤基因组DNA提取试剂盒(FastDNA SPIN kit for soil)提取总DNA,以338F(5'-ACTCCTACGGGAGGCAGCAG-3') 及 806R(5'-GGACTACHVGGGTWTCTAAT-3')为引物,采用ABI GeneAmp® 9700型PCR仪扩增其16S rDNA部分序列,获取PCR产物,并回收纯化,利用Illumina MiSeq PE300平台对测序样本进行双端测序,利用QIIME软件对测序序列进行质控[21]。对获得的OTU,选取代表性序列,与Greengenes Database 13.8数据库(按99%序列相似性聚类)进行比对获得物种注释信息[22],并基于物种注释信息,去除叶绿体、线粒体以及不能注释到界级别的OTU及其包含的序列。采用Mothur Version v.1.30.1 进行多样性分析[23]并对菌群代谢功能进行预测及功能差异性分析[24-25]。
1.2.6 数据处理与统计分析 生长性能和理化数据结果采用 SPSS 22.0 软件包中的 One-way ANOVA 程序进行单因素方差分析,采用 Duncan 氏法进行多重比较,以 P<0.05为差异显著性标准。
2 结果
2.1 发酵饲料微生物数量分析
发酵饲料中微生物计数结果表明(图1),发酵饲料菌落总数、乳酸菌数、酵母菌数均显著(P<0.05)高于对照组,而两组间霉菌数量无显著差异(P>0.05),甚至发酵饲料组还略低于对照组,可能与饲喂环境中霉菌在常规饲料富集有关。
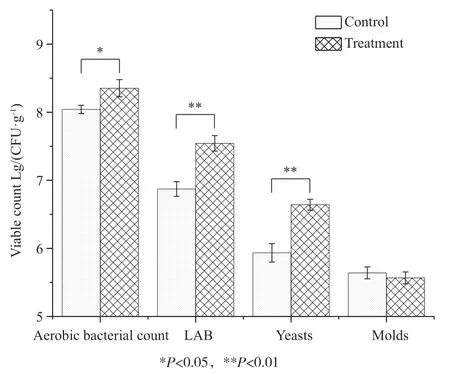
图1 两种饲料中微生物群落结构比较Fig. 1 Structure of microbial community in two kinds of experimental diets
2.2 发酵饲料对育肥猪增重及肉质的影响
使用常规饲料和发酵饲料饲喂的36头育肥猪增重情况如表2所示,统计分析表明二者平均日增重、平均日采食量均没有显著差异(P>0.05),但发酵饲料组料重比显著低于对照组(P<0.05),降低了4.01%。同时,在日常观察发现,饲喂发酵饲料的育肥猪皮肤色泽更红润有光泽,圈舍内臭味明显少于对照。比较宰杀后的生猪肉(表2),发现两个组的猪肉水分含量、肌内脂肪及pH均无显著差异(P>0.05),但取样现场我们发现发酵饲料组育肥猪肝脏色泽红润均匀,而对照组颜色偏暗、偏紫。
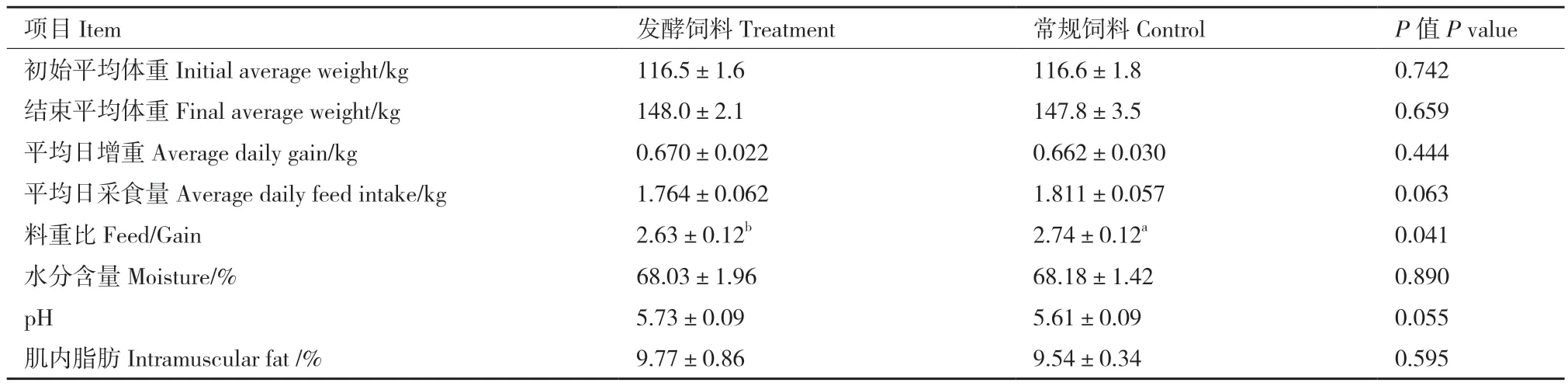
表2 发酵饲料对育肥猪生长性能和肉质的影响Table 2 Effects of fermented feed on the growth performance of growing-finishing pigs and quality of pork
2.3 发酵饲料对猪肠道细菌多样性的影响
从表3可以看出,与常规饲料组相比,发酵饲料组猪小肠和结肠中检测到的细菌序列条数和OTU数量均有所增加,特别是小肠增加幅度明显,其检测到的序列条数增加了165.6%,OTU数量增加79.7%,在一定程度上表明饲喂发酵饲料可增加肠道细菌的细胞数量和种属数量,且小肠比结肠的增加更加明显;另一方面,不管是常规饲料组还是发酵饲料组,结肠内的细菌OTU数量均低于小肠,可能是由于一些在小肠细菌群体中丰度较低的OTU进入结肠后逐渐衰亡所致。从小肠和结肠内的细菌α-多样性来看,不管是饲料类型,还是取样部位,对细菌菌群多样性均没有显著差异(P>0.05),但饲喂发酵饲料后小肠的shannon指数和simpson指数均小于结肠,也小于常规饲料组的小肠,与序列条数和OTUs结果相反。

表3 发酵饲料对育肥猪肠道菌群α-多样性的影响Table 3 Effects of fermented feed on the intestinal microbial alpha diversity of growing-finishing pigs
进一步对各组各部位OUT数量分析发现(图2),有16个OTU在发酵饲料组和常规饲料组的结肠和小肠中均有出现,可能这16个OTU是猪肠道中的核心菌群。发酵饲料组结肠(Coltmt)和常规饲料组结肠(Colctl)共有74个OTU,发酵饲料组小肠(Intmt)和常规饲料组小肠(Intctl)共有98个OTU。与之相反,Coltmt和Intmt仅共有28个OTU,Colctl和Intctl仅共有48个OUT。
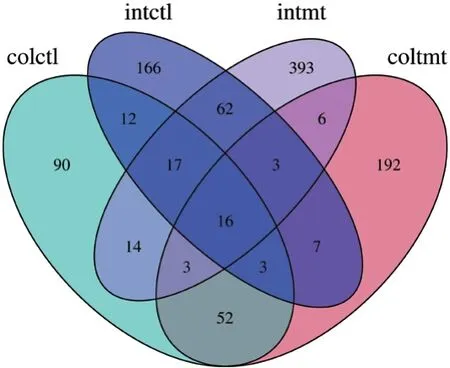
图2 发酵饲料对育肥猪小肠及结肠OTU的影响Fig. 2 Effects of fermented feed on the OTU of intestine and colon of growing-finishing pigs
采用Bray Curtis距离、Unweighted Unifrac距离和Weighted Unifrac距离均可用于比较不同样品间的微生物群落构成(β多样性)[26],其中Bray Curtis距离和Weighted Unifrac距离是结合OTU的丰度信息和系统进化关系获得的样本间距离,对丰度较高的物种更加敏感,Unweighted Unifrac距离主要考虑物种的有无,对稀有物种比较敏感,其值越小均表示两组样品在物种多样性方面存在的差异越小[27]。从图3可以看出,饲料种类和取样部位均可影响到育肥猪肠道细菌的β多样性。当饲料种类相同(发酵饲料),小肠(Intmt)和结肠(Coltmt)细菌区系分别以Bray Curtis距离、Unweighted Unifrac距离、Weighted Unifrac距离计算的相似性指数为0.929、0.034、0.910;而当取样部位均为小肠时,则发酵饲料组(Intmt)和常规饲料组(Intctl)的细菌区系三大相似性指数分别为0.854、0.093、0.785,取样部位均为结肠时,则分别为0.429、0.075、0.624。该结果表明,饲喂发酵饲料后,相对丰度高的种属表现出更大的差异性,且对育肥猪小肠细菌区系的影响大于结肠。
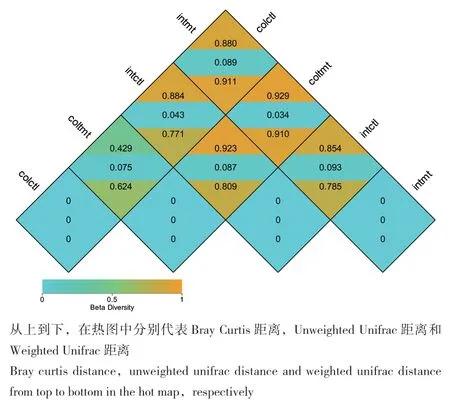
图3 两个组育肥猪肠道微生物β-多样性分析Fig. 3 Beta diversity analysis of gut microbiota from two groups
2.4 发酵饲料对育肥猪肠道细菌种属构成的影响
从图4可以看出,发酵饲料对育肥猪肠道细菌种属区系构成有明显影响。对结肠细菌群落来说,常规饲料组和发酵饲料组的优势种属都是Unspecified Clostridiaceae和乳杆菌属(Lactobacillus),分别为24.9%和29.0%、28.1%和13.7%。但与常规饲料组相比,发酵饲料组Unspecified_Lachnospiraceae、Unspecified_Clostridiales、密螺旋体菌属(Treponema)、瘤 胃 球 菌 属(Ruminococcus)、Unspecified_Ruminococcaceae、Unspecified_S24_7的丰度明显增加,而梭菌属(Clostridium)、链球菌属(Streptococcus)的丰度明显降低。
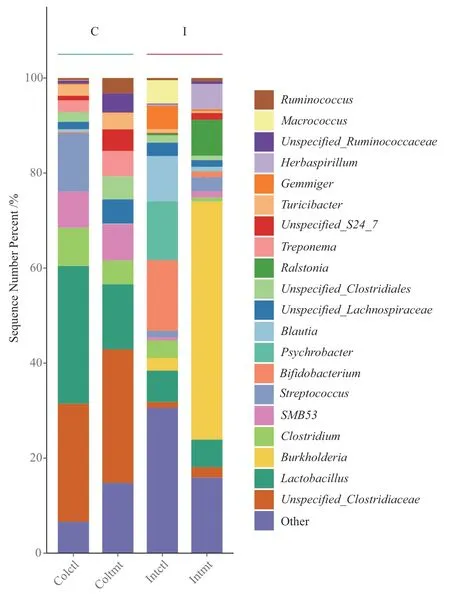
图4 两个组育肥猪小肠及结肠细菌种属构成热图Fig. 4 Hot map of bacterial species composition of intestine and colon from two groups
发酵饲料对育肥猪小肠细菌群落的影响更大。发酵饲料组小肠伯克氏菌属(Burkholderia)在群体中的丰度从2.7%增加至50.1%,另外罗尔斯通氏属(Ralstonia)、草螺菌属(Herbaspirillum)、Lactobacillus、Streptococcus的丰度等也有明显增加,而布劳特氏菌属(Blautia)、双歧杆菌属(Bifidobacterium)、嗜冷杆菌属(Psychrobacter)、芽殖菌属(Gemmiger)、Clostridium、巨型球菌属(Macrococcus)丰度明显下降。总体来看,发酵饲料组育肥猪小肠中的优势细菌从以厚壁菌门(Firmicutes)为主变成Firmicutes和变形菌门(Proteobacteria)共存,但这些变化对猪生长及健康状况的影响还有待进一步研究。
从物种之间的相关性来看(图5),相对丰度较高的种属中,Bifidobacterium、Psychrobacter及Blautia与其他细菌种属之间存在最为广泛的互作关系,而发酵饲料组中相对丰度大幅增加的Burkholderia却仅与少部分丰度较低的种属如CF231和Turicibacter存在显著负相关,推测Blautia、Bifidobacterium、Psychrobacter、Gemmiger、Clostridium、Macrococcus丰度下降可能与Burkholderia的增加并无必然联系。
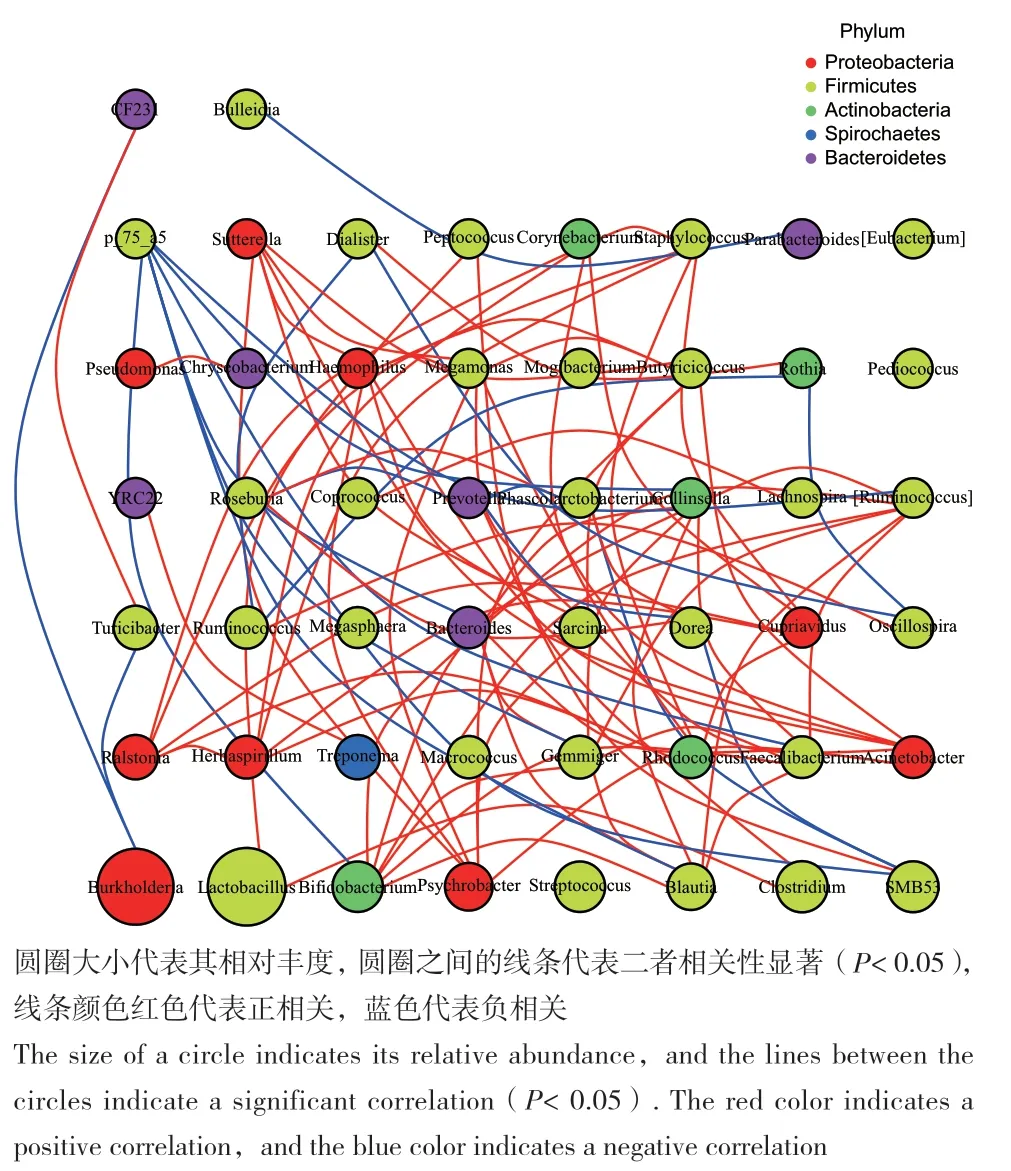
图5 属分类水平物种相互作用网络图Fig. 5 Interaction network diagram about classification level of genus
2.5 发酵饲料对育肥猪肠道细菌群落功能的影响
采用KEGG基于种属变化预测育肥猪肠道细菌功能,以初步评估发酵饲料导致的猪肠道菌群功能变化。从图6可以看出,两个组育肥猪结肠细菌菌群功能差异较小,但发酵饲料对育肥猪小肠细菌菌群功能影响较大。在L1级别上,发酵饲料组育肥猪小肠细菌群体代谢功能及细胞转化功能明显提升,在L3级别上,发酵饲料组育肥猪小肠内与细菌运动蛋白、物质跨膜运输、分泌系统、双组分系统等相关的代谢功能有所增强,而包括氨糖及核糖代谢,核糖体合成,DNA合成相关的嘌呤、嘧啶及DNA修复蛋白相关代谢等却相对减弱。
3 讨论
本研究发现发酵饲料对育肥猪的增重并无显著影响,而其他多个研究认为发酵饲料有助于育肥猪增重[28],这可能是由于本研究采用的对照已经是该养猪场经过优化后的日粮配方,其增重效果已较好,但发酵饲料的价值主要不在于增重,而在于无抗和健康养殖[29]以及减少农村面源污染[30]等方面。另一方面,与对照组相比,发酵饲料组的料重比显著下降说明应用发酵饲料喂育肥猪经济效益比较好。本研究同时观察到发酵饲料能够相对改善猪圈舍环境,育肥猪外观形态,宰杀后的肝脏色泽,甚至猪肉膻味也相对减少,猜测相对常规饲料,发酵饲料可能一方面营养更加均衡和更易消化吸收,另一方面对猪的肝脏功能有积极影响,后续可更加深入的研究发酵饲料消化率,以及对育肥猪肝脏酶活、血液生化指标、免疫功能等的影响。
样品OTUs数量在一定程度上表明饲喂发酵饲料可增加肠道细菌的细胞数量和种属数量,且小肠比结肠的增加更加明显。细菌多样性一般包括丰富度和均匀度两个方面[31],本研究发现饲喂发酵饲料后小肠细菌菌群虽然丰富度增加,但均匀度明显减小,即少部分菌群相对丰度显著增加,形成明显的优势菌群,表明发酵饲料主要通过影响各种属细菌的相对丰度(均匀度)而不是各种属的有无(丰富度)来影响其猪肠道细菌区系。β-多样性结果也进一步表明,本试验中因饲料种类不同所造成的育肥猪肠道细菌区系差异大于因取样部位不同造成的差异,且发酵饲料对育肥猪小肠细菌区系的影响大于结肠。结合前面发现发酵饲料组猪肉膻味减少,一般膻味主要是由猪肉脂肪组织中的雄烯酮和粪臭素引起,而粪臭素(3-甲基吲哚)是在后肠内由微生物降解色氨酸产生的挥发性化合物[32],推测正是由于发酵饲料组育肥猪肠道菌群改变导致减少此类化合物的生成。并且,不同发酵饲料对猪肠道微生物的影响也存在差异,如本研究发现玉米小曲发酵饲料主要影响小肠菌群,对结肠菌群影响较小,但张铮等[33]发现发酵饲料对生长育肥猪结肠微生物有重要影响。
从肠道菌群种属构成来看,发酵饲料对小肠细菌区系的影响更大,其中Burkholderia显著增加影响最为重要,该菌能够促进磷元素的转化代谢并产生大量有机酸[34],特别是作为新型抗生素和生物活性次生代谢物来源方面显示了巨大的生物技术潜力[35],但在育肥猪肠道菌群的作用还不清楚。另外,发酵饲料中接种发酵剂没有在肠道中发现对应种属及变化,推测发酵饲料对育肥猪的影响,更多的是因为其积累了大量微生物代谢物尤其是短链脂肪酸,而不是微生物本身。总体来说,发酵饲料组小肠菌群的变化对育肥猪生长和猪肉品质的影响还有待进一步研究。然而,我们也发现Burkholderia与其他优势菌群没有显著的相关性,而KEGG结果表明发酵饲料组小肠细菌群体的增殖在一定程度上有所削弱,推测发酵饲料可能抑制了小肠内Blautia、Bifidobacterium、Psychrobacter、Gemmiger、Clostridium、Macrococcus等土著细菌增殖,从而使其在群体中相对丰度下降。另一方面,发酵饲料组小肠内细菌群体通过调节信号传导系统、营养物质运输、产物分泌等功能以主动适应营养供给变化,如感受外界刺激,调节细胞生理代谢和行为的双组分系统功能的增强,推测发酵饲料对育肥猪小肠细菌群落这一整体生态系统功能的影响主要在于通过改变细菌区系构成来强化物质代谢,而这又在一定程度上给细菌增殖带来不利影响,下一步可以基于育肥猪生长性能、胴体品质和猪肉风味继续深挖肠道菌群与物质代谢之间的相关性。
4 结论
本研究通过研究玉米小曲酒糟全价发酵饲料对育肥猪增重和肠道微生物的影响,发现发酵饲料对育肥猪增重无显著影响,但对肠道菌群特别是小肠细菌区系有明显影响,饲喂发酵饲料后育肥猪小肠优势细菌从Firmicutes变成Firmicutes和Proteobacteria共存,主要体现为Burkholderia的增加以及Blautia、Bifidobacterium、Psychrobacter、Gemmiger、Clostridium、Macrococcus的减少,KEGG功能预测发现肠道细菌群体的代谢功能相对增强,增殖功能相对减少。
