原花青素对体外培养绵羊卵泡颗粒细胞增殖的影响
2022-11-05杨小峰秦小伟郭泽媛吕丽华
杨小峰 秦小伟 郭泽媛 吕丽华
(1. 山西农业大学动物科学学院,太谷 030801;2. 忻州师范学院生物系,忻州 034000)
卵巢中的颗粒细胞(granulosa cells,GCs)是卵泡形成和发育过程中的主要功能细胞,能为卵母细胞的生长和成熟提供必要的营养和RNAs,自身也进行着增殖和分化,因此,探究颗粒细胞增殖和分化的影响因素对雌性繁殖性能的提高有很重要的意义。
原花青素(proanthocyanidins,PC)是植物中常见的一类多酚化合物,是公认的天然抗氧化剂,通常以黄烷-3-醇单体为基本单位构成聚合体[1]。自然界中原花青素来源较广,沙棘果、蓝莓、葡萄籽、火龙果、黑玉米、黑枸杞等植物中原花青素含量较为丰富[2-3]。原花青素具有很强的清除自由基、抗氧化、抗衰老、调节血脂等生理活性[4-5]。有研究表明,原花青素能促进雌性生殖干细胞的增殖[6]。细胞的增殖受细胞周期相关基因和细胞凋亡相关基因的调控。细胞周期调控分子包括细胞周期蛋白(cyclin)、细胞周期蛋白依赖性激酶(CDK)和细胞周期蛋白依赖性激酶抑制剂(CDKI)三大类。氨基末端结构及功能高度相似的p21和p27都是细胞周期蛋白依赖性激酶抑制剂(CDKIs)。p21蛋白可通过抑制CDK活性而阻滞细胞进入S期,p27则是通过与CyclinD-CDK4或CyclinE-CDK2复合物结合在静止细胞和G1期细胞发挥作用[7]。p21、p27基因表达量上调可以引起周期阻滞在G1期[8]。半胱氨酸蛋白酶(caspase)家族是导致细胞凋亡的蛋白酶系统,在细胞凋亡机制中居关键地位[9]。在Fas引发的凋亡反应中,半胱氨酸蛋白酶级联式地活化,其中caspase-8的活化是第一步反应。活化后的caspase-8会引发下游的caspase活化,诱导细胞凋亡[10]。
本试验旨在研究原花青素对体外培养绵羊卵巢颗粒细胞增殖的影响,并找出促进颗粒细胞增殖的最佳时间和最适浓度,在此浓度和时间下培养颗粒细胞,测定细胞周期相关基因和细胞凋亡相关基因的表达量,以此进一步佐证原花青素对体外培养绵羊卵泡颗粒细胞的增殖效应。
1 材料与方法
1.1 材料
本试验以山西省太谷县绵羊屠宰场性成熟绵羊的健康卵巢为研究对象。本试验使用的主要试剂 为 :PC(Solarbio)、MTT 试 剂 盒(Solarbio)、PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒(TaKaRa)、TB Green®TMPremix Ex TaqTMⅡ 试 剂 盒(TaKaRa)、DMEM基础培养基、DMSO、胎牛血清(FBS)、胰蛋白酶、双抗、PBS、台盼蓝。
1.2 方法
1.2.1 细胞培养
1.2.1.1 绵羊卵巢颗粒细胞的收集 将在屠宰场采集的卵巢浸泡在灭菌的杜氏磷酸缓冲盐溶液(DPBS)中,置于冰上迅速带回实验室。用灭菌过的眼科剪剪离卵泡,选取大小适中的卵泡(3 mm<直径<5 mm)在75%的酒精中浸洗几秒,转至超净工作台中。剪开卵泡,用刮刀刮卵泡内壁,将刮取的颗粒细胞收集至培养基中。用细胞过滤筛过滤,去除杂质。收集含有颗粒细胞的培养液,在4℃,1 000 r/min离心5 min,弃掉上清液,加入完全培养液重悬细胞并在37℃,5% CO2的条件下培养。
1.2.1.2 活细胞密度测定 颗粒细胞铺满培养皿约80%-90%时,用胰蛋白酶消化细胞3-5 min,终止消化后离心,弃上清,再用完全培养液重悬细胞。取少量细胞悬液用等体积0.4%的台盼蓝染色1 min,用血球计数板计数活细胞数量,计算细胞浓度。用完全培养液稀释并调整细胞悬液浓度约为5×104个/mL。
1.2.2 MTT试验 将上述细胞悬液接种至3个96孔板中,每孔200 μL,每孔大约1×104个细胞。剩余细胞冷冻保存,备用。将96孔板置于37℃,5%CO2的条件下培养至细胞数量大约到整个孔的50%左右时,弃去原培养液,添加含有不同浓度(20、30、40、50、60、70和 80 μg/mL)PC的完全培养液并设置对照组(0 μg/mL),每个浓度的培养孔做3个重复,分别继续培养24、48和72 h。吸去上清液,每孔加入90 μL完全培养液,再加入10 μL MTT溶液,继续培养4 h。再次弃去培养液,每孔加入110 μL Formazan溶解液,低速震荡10-15 min,使结晶物溶解充分。在酶联免疫检测仪上,震荡15 s,然后在490 nm测量吸光值(OD值)[11],OD值的高低可间接反映细胞数量多少。
1.2.3 增殖基因表达量的检测
1.2.3.1 总RNA的提取 将1.2.2冷冻保存的细胞复苏后接种到6孔板中,细胞分为对照组(A组)和实验组(B组),每组3个重复(A1、A2、A3/B1、B2、B3),继续在 37℃,5% CO2的条件下培养 48 h。弃去原培养基,实验组(B组)添加浓度为50 μg/mL PC的完全培养基(依据1.2.2的实验结果),同时,对照组(A组)添加不含PC的完全培养基。然后用 Trizol法提取总 RNA[12]。
1.2.3.2 cDNA的合成 将对照组和实验组(A1、A2、A3/B1、B2、B3)按照 PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒说明书分两步进行反转录。第一步,去除基因组DNA反应,按照以下体系配制反应液 :1 μL gDNA Eraser,2 μL 5×gDNA Eraser Buffer,1 μL RNA,RNase Free dH2O 定容到 10 μL。反应条件为42℃,2 min,然后置于冰上。第二步,反转录反应,在第一步反应液的基础上依次加入下列液体 :1 μL PrimeScript RT Enzyme MixI,1 μL RT Prime Mix,4 μL 5×PrimeScript Buffer2,4 μL RNase Free dH2O,共计20 μL。反应条件为37℃,15 min;85℃,5 s;然后置于冰上。反应结束后,检测产物纯度以及浓度,于-20℃冰箱备用。
1.2.3.3 引物的设计与合成 依据NCBI上绵羊的预测序列(登录号:XM027973596),利用Primer 5.0和Oligo 6软件设计目的基因的引物,由上海生物工程股份有限公司合成。以绵羊18S基因作为内参基因,引物序列见表1。
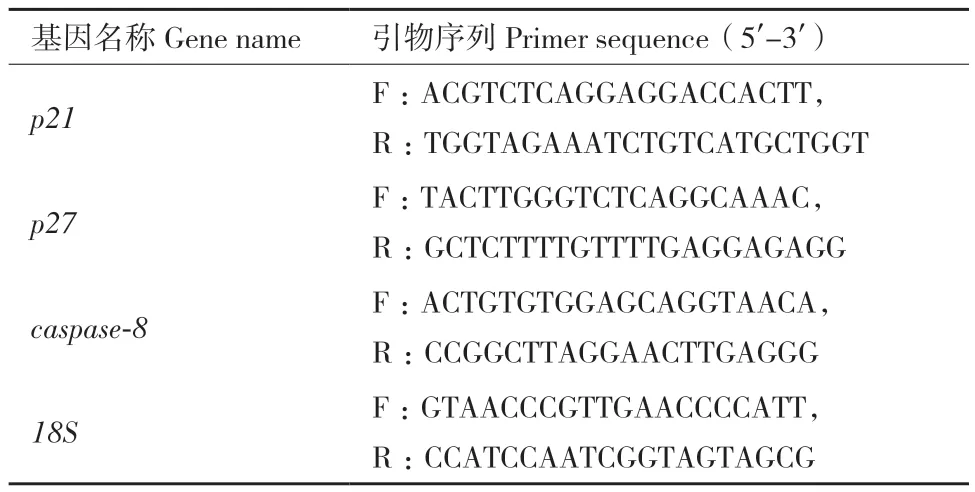
表1 RT-qPCR引物序列Table 1 Primer sequences of RT-qPCR
1.2.3.4 RT-qPCR反应 依据TB Green®TMPremix Ex TaqTMⅡ试剂盒说明书,以cDNA为模板,构建10 μL RT-qPCR反应体系:PCR上下游引物各0.4 μL(10 μmol/L),TB Green Premix Ex Taq Ⅱ 5 μL,cDNA 模板 2 μL,RNase Free dH2O 2.2 μL。反应条件为 95℃,30 s;95℃,5 s;60℃,30 s,共45个循环。扩增后生成扩增曲线、溶解曲线,利用其CT值分析结果。
1.2.4 数据分析统计 实验数据利用SPSS 22.0进行分析,采用单因素方差分析和显著性检验的方法。使用GraphPad Prism 8.0软件作图。RT-qPCR相对表达量检测结果采用2-ΔΔCt法计数,各基因表达量均经过内参18S校正。
2 结果
2.1 不同浓度PC处理GCs不同时间后生长状况
培养48 h后,与对照组(A1)相比,添加一定浓度PC的实验组(B1、B2、B3)均可促进细胞增殖,浓度为50 μg/mL(B2)时细胞数量最多,增殖较为明显。C为培养24 h,浓度为50 μg/mL时细胞数量图,与对照组(A2)相比细胞数量增多,但是与培养48 h的B2图相比,细胞数量较少。D为培养72 h,浓度为50 μg/mL时细胞数量图,与对照组(A3)相比细胞数量明显增多,与培养48 h的B2图相比,细胞数量有一定的增加(图1)。

图1 不同浓度PC处理体外培养绵羊卵泡颗粒细胞不同时间后的生长状况 (100×)Fig. 1 Growth status of sheep follicular granulosa cells in vitro cultured with different concentrations of PC for different time(100×)
2.2 MTT检测不同浓度PC处理GCs不同时间后细胞数量变化
由图2可知,体外培养绵羊颗粒细胞时,添加一定浓度的PC在一定时间内可以促进细胞增殖。当培养基中PC浓度为50 μg/mL时,培养24 h、48 h和72 h的OD值均为最大,细胞数量最多,24 h和48 h时显著度高于其它浓度(P<0.05)。随着浓度的增高,对细胞促进增殖效应减弱。
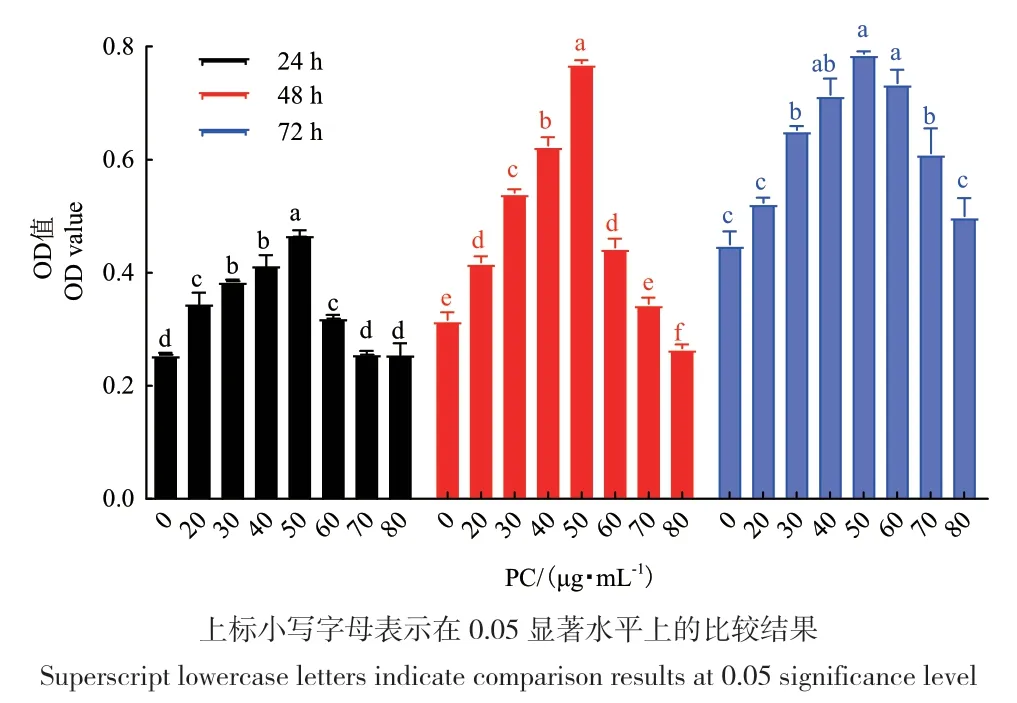
图2 不同浓度PC处理体外培养颗粒细胞24、48、72 h后的OD值Fig. 2 OD values of granulosa cells cultured in vitro after 24,48 and 72 h treatment with different concentration of PC
由于细胞处理48 h后的OD值较24 h高,且显著度高于其它浓度(P<0.05),因此后期实验组处理条件为PC浓度为50 μg/mL,处理48 h。
2.3 特定浓度PC处理GCs增殖相关基因表达差异
由图3可知,在PC浓度为50 μg/mL时,体外培养绵羊颗粒细胞48 h后,细胞周期蛋白依赖性激酶抑制剂p21和p27 mRNA的表达量显著降低(P<0.01),同时,半胱氨酸蛋白酶(caspase)家族中的caspase-8 的mRNA表达量显也显著降低(P<0.01)。
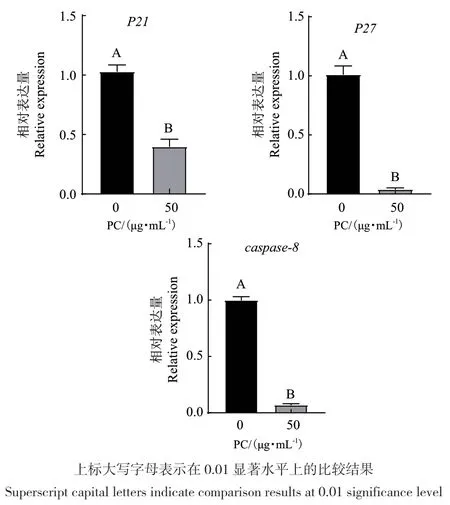
图3 绵羊颗粒细胞中增殖相关基因mRNA的表达Fig. 3 mRNA expression of proliferation-related genes in sheep granulosa cells
3 讨论
原花青素是一种良好的抗氧化剂,其抗氧化能力比常见的抗氧化剂如VC、VE等还强[13]。原花青素具有抗肿瘤[14]、降血压[15]、防治老年性疾病[16]、增强免疫功能[17]、抗辐射[18]等功效,还可以缓解女性更年期症状[19]。其在防止卵巢衰老中具有重要的作用,研究表明原花青素对生殖干细胞增殖具有促进作用,与长寿基因SIRT1有关[6]。沉默信息调节因子相关酶类(sir2基因家族)是一类依赖于NAD+的高度保守去乙酰化酶,其同源性最高的同系物SIRT1参与调控哺乳动物的生殖功能[20]。SIRT1可以依赖NAD+在C-末端赖氨酸-382残基处的p53脱乙酰化,降低p53介导的转录活性,进而降低下游蛋白质的表达,如p21、p27等。通过去乙酰化作用,SIRT1可以抑制p53调控的细胞周期阻滞和细胞凋亡,增强DNA修复机制,促进基因组完整性的维持,促进细胞存活及增殖[6,21]。
caspase-8以酶原形式(procaspase-8)形式存在于许多组织中。procaspase-8由479个氨基酸构成,8种同分异构体中有2种有酶活性,能启动受体介导的细胞凋亡。这2种酶原的N-端的两个串联的70个氨基酸左右死亡效应结构域与适配蛋白N-端的DED同源,所以procaspase-8可与FADD结合。在哺乳动物中,caspase的活化途径主要有细胞外和细胞内途径[10]。在凋亡的细胞内途径中,效应蛋白在线粒体外膜透性的信号级联后被激活,导致膜间蛋白的释放,促进“凋亡小体”的形成,以及介导细胞死亡的caspases的激活;外部细胞凋亡依赖于死亡诱导信号复合物(DISC)的形成,DISC通常包括FADD和caspase-8。在这两种凋亡形式中,细胞的死亡都是通过效应物caspase诱导的细胞水泡、DNA碎片化、磷脂酰丝氨酸外化和“凋亡小体”的形成来实现的[22]。本研究表明,添加原花青素的细胞培养基培养颗粒细胞可以使得caspase-8表达量下调。
体内研究表明,原花青素毒性较小,安全性较高。陈会从等[23]用原花青素对大鼠灌胃26周,剂量为 42、214、428 mg/(kg·d),大约相当于人日用量的10、50、100倍,过程中试验动物没有不良反应。停药观察几周,未发现蓄积毒性反应。Huang等[24]在研究葡萄籽原花青素对大鼠血压的影响时,未报到有不良反应。Rodriguez等[25]综述了原花青素在动物体内毒性较小。本试验对体外培养的绵羊卵泡颗粒细胞进行研究,发现原花青素可以促进卵泡颗粒细胞的增殖,一定程度上填补了原花青素对离体细胞生理机能影响的研究空白。
研究表明,通过抑制SIRT1的表达发现颗粒细胞凋亡率和卵泡闭锁数增多,造成卵巢功能下降[26]。在小鼠实验上发现可通过提高SIRT1的表达来提升卵泡的质量与数量,达到延缓卵巢衰老的作用[27]。原花青素促进雌性生殖干细胞增殖与其调控SIRT1对下游底物p53去乙酰化使之转录活性失活,进而无法激活下游基因p21,其机制与SIRT1-p53-p21信号通路有关[6]。本研究从基因mRNA表达量水平做了分析,可以进一步从蛋白质水平作分析研究;此外,原花青素促进GCs增殖的机理有待进一步证实。
卵巢衰老表现为卵泡的不断丧失和卵泡质量持续下降,导致雌性动物失去生育机能[28]。卵巢衰老及病变严重影响雌性动物的生殖机能,而卵巢衰老与GCs的衰老和凋亡有密切的联系。研究表明原花青素可以促进体外培养的卵泡颗粒细胞增殖,为抗卵巢衰老机能乃至促进动物繁殖提供一定的理论研究支持。
4 结论
添加一定浓度的原花青素可以促进体外培养的绵羊卵泡颗粒细胞的增殖,培养48 h,在原花青素浓度为50 μg/mL时,促进效果最明显,颗粒细胞的增殖可能与周期相关基因和凋亡相关基因表达量的变化有关,其机制可能与SIRT1-p53-p21信号通路有关。雌性动物的颗粒细胞在卵巢形成和发育过程中起着重要的作用,原花青素可能对雌性绵羊的生殖起到积极的作用。
