芘降解菌Pseudomonas sp. PR3的植物促生特性及其对芘胁迫下水稻生长的影响
2022-11-05高晓蓉丁尧吕军
高晓蓉 丁尧 吕军
(1. 大连理工大学生物工程学院,大连 116024;2. 辽宁省水稻研究所,沈阳 110101)
多 环 芳 烃(polycyclic aromatic hydrocarbons,PAHs)是一类强疏水性、难降解的持久性有机污染物,它们可通过多种途径进入人体,威胁人类健康,而且随着分子量的增加,其毒性也增加[1-2]。PAHs易被土壤颗粒吸附,环境中90%的PAHs都积累在表层土壤中,已成为我国农业土壤中的主要有机污染物,是影响作物生长及食品安全的主要因素之一[3]。调查显示,我国许多地区的小麦等粮食作物均受到不同程度的PAHs污染[4]。在PAHs胁迫下,植物体内的氧化应激反应增强,造成活性氧(reactive oxygen species,ROS)和丙二醛(malondialdehyde,MDA)过度积累,导致蛋白质变性、脂质过氧化、核苷酸降解等[5]。此外,PAHs还会影响叶绿素和植物激素的合成、糖和氨基酸的代谢,以及降低植物对水分及养分的利用率,从而抑制植物的生长和发育[6]。植物为应对胁迫会产生可溶性物质(糖、脯氨酸等)、抗氧化剂或抗氧化酶来降低氧化应激造成的损伤,然而当植物长期暴露于PAHs污染时,ROS的积累超过了抗氧化系统可处理的水平,损伤仍会发生,进而影响植物的生长[7]。通过提高土壤中PAHs的去除率或降低土壤中PAHs的生物利用度等途径可减少PAHs对植物的胁迫[8]。然而,在不破坏土壤生态功能和不中断农业生产的前提下,许多常规的物理和化学方法显然不适合在农业污染土壤中广泛应用。多项研究结果表明,土壤微生物在提高根际PAHs降解、降低植物对PAHs的吸收积累以及缓解PAHs胁迫等方面有很大潜能[9]。但是,也有研究认为,降解菌株仅可缓解污染物对植物生长的不良影响,并且污染物常与土壤贫瘠、盐碱化等其他环境胁迫共存,因此降解菌株对植物生长的促进作用往往十分有限,极大限制了降解菌在农业生产中的应用[10]。植物根际促生菌(plant growthpromoting rhizobacteria,PGPR)作为与植物根际环境密切相关的微生物,能够通过溶磷作用、产铁载体等提高植物对营养物的利用能力、分泌植物激素(IAA、赤霉素等)、提高抗氧化酶活性等途径提高植物抗逆性和促进植物生长,被广泛研究应用于各种环境中[11]。因此,降解菌与PGPR的联合应用较单一菌种更具优势,但这种方式大大增加了操作的复杂性和不确定性[12]。在此基础上,Ghosal等[13]提出,兼具植物促生特性和降解污染物能力的菌株具有更广阔的应用前景。目前已分离到一些具有植物促生能力的PAHs降解菌,Li等[14]分离到的克雷伯氏菌(Klebsiella sp.)PD3不仅在12 d内对菲的降解率达到78.6%,而且还具有植物促生特性,可显著降低水稻体内的ROS积累、乙烯产生和电解质渗漏,但多数PAHs降解菌的植物促生特性仍未得到充分研究。
多环芳烃分子中,含4个及以上芳香环的高分 子 量 PAHs(high-molecular-weight PAHs,HMWPAHs),由于其更强的生物毒性以及难降解性成为近年来研究的重点,分离获得具有HMW-PAHs降解能力和同时兼具植物促生特性的菌株尚不多见。本研究从石油污染地的芦苇根际筛选获得一株具有芘降解能力和促进植物生长特性的菌株Pseudomonas sp.PR3,通过探究其对芘的降解能力,以及芘胁迫下对水稻生长的促进作用,减少水稻体内芘的吸收积累效果,以期为PAHs污染农田中保障作物安全高效生产提供优质的菌种资源。
1 材料与方法
1.1 材料
1.1.1 植物及土壤样品 从盘锦市某石油开采场地附近采集长势良好的芦苇(Phragmites australis)根及根际土壤,封装于无菌保鲜袋中,带回实验室4℃保存备用。无PAHs污染的土壤样品取自附近村庄的农田,自然风干后过1 mm筛备用。水稻种子(‘越光’品种)由辽宁省水稻研究所提供。
1.1.2 试剂 萘(naphthalene,Nap)、菲(phenanthrene,Phe)、芘(pyrene,Pyr)标准品均购自百灵威科技有限公司(北京),苯并(a)芘(benzo(a)pyrene,Bap)购自东京化成工业株式会社(TCI),纯度超过98%。丙酮、正己烷和乙腈均为色谱级,其他试剂均为分析级。
1.1.3 培养基 菌株生长及检测促进植物生长特性所用的LB、King’s B、NBRIP和CAS检测培养基与之前的研究描述的一致[15-17]。无机盐培养基(MSM,pH7.0)含KH2PO44.4 g/L,K2HPO41.7 g/L,NaCl 2.1 g/L,NH4Cl 3.0 g/L,MgSO40.195 g/L,MnSO4·H2O 0.05 g/L,FeSO4·H2O 0.01 g/L,CaCl2·H2O 0.003 g/L。配置20 mg/mL芘的丙酮溶液,待丙酮完全挥发后,按比例加入灭菌的MSM,配制成不同芘浓度的无机盐培养基(PMM)。
上述液体培养基中添加15 g/L琼脂制备固体培养基。
1.2 方法
1.2.1 芘降解菌的筛选 用毛刷轻轻去除芦苇根表黏附的土壤后,用无菌水缓慢冲洗根部30 s,滤纸吸干后,剪取5 g根浸泡在10 mL无菌水中,超声处理1 min,得到根表菌悬液[18]。取5 mL菌悬液接种到含有50 mg/L芘的100 mL PMM培养基中,30℃、170 r/min振荡培养。每7 d取5 mL富集培养物接种至新鲜的PMM培养基中,共转接3次,并逐步提高PMM中芘的浓度至200 mg/L。将最终的富集培养物用无菌水进行梯度稀释,涂布于芘浓度为50 mg/L的PMM平板上,30℃培养7 d至长出可见菌落,将生长状态良好的菌落初步标记为芘降解菌[19]。
将各菌株分别接种至LB培养基中,30℃ 170 r/min培养过夜,5 000 r/min离心10 min收集菌体,用新鲜的MSM清洗两次,最后用MSM重悬菌液至OD600值为0.5。将5 mL菌液转移至20 mL无菌棕色瓶,其中芘的终浓度为10 mg/L,30℃、170 r/min振荡培养7 d后,采用HPLC测定残余芘含量。
芘的测定采用HPLC(Agilent-1200,美国),色 谱 柱 为 Agilent ZORBAX Eclipse Plus C18,4.6 mm×250 mm,柱温25℃,流动相为乙腈和水(80∶20,V∶V),流速 1 mL/min,进样量 20 μL,检测波长为375 nm。
1.2.2 菌株植物促生特性测定 将菌株以1%接种至含有L-色氨酸(200 mg/L)的LB培养基中,30℃ 170 r/min振荡培养48 h后测定培养物中IAA含量。检测方法参照文献[20]。
利用改进的双层平板法对铁载体产生进行定性检测[21]。取 2 μL过夜生长的菌液(OD600=1.0)接种于King’s B固体培养基上,30℃ 培养12 h,在上层缓慢倒入等体积的CAS检测培养基(含1%琼脂),30℃倒置培养4 h后观察黄色晕圈的产生,测量显色圈直径/菌落直径(D/d)的比值。利用King’s B液体培养基进行铁载体的定量检测[22]。菌株以1%的接种量于King’s B培养基中30℃ 170 r/min培养4 d后,10 000 r/min离心10 min,将上清液与等体积的CAS检测液混合,静置1 h后于630 nm处测得吸光值As,将未接菌的培养基与CAS检测液混合测得吸光值Ar。培养物中产生的铁载体含量以铁载体活性单位(SU)表示,计算公式为:铁载体活性单位(SU)=[(Ar-As)/Ar]×100%。
利 用 含 0.5%(W∶V)Ca3(PO4)2的 NBRIP培养基检测菌株溶磷能力。将菌株以2%(OD600=1.0)接种量接种至NBRIP培养基中,30℃ 170 r/min培养7 d,根据钼锑抗比色法测定上清液中可溶性磷含量[23]。
1.2.3 菌株16S rRNA基因序列分析 根据芘降解能力和促生特性筛选得到目的菌株PR3,将菌株送至生工生物工程(上海)股份有限公司进行16S rRNA基因扩增及测序,选择通用引物926F(5'-AAACTYAAAKGAATTGACGG-3') 和 518R(5'-ATTACCGCGGCTGCTGG-3')。 测 序 结 果 利 用NCBI Blast进行序列比对分析,然后利用MEGA-X软件Neighbor-joining法构建系统发育树。
1.2.4 菌株PR3对PAHs的降解能力测定 参照1.2.1所述方法检测菌株PR3对20 mg/L芘的降解能力,在30℃ 170 r/min震荡培养14 d。每隔24 h整瓶取样,测定培养基中芘的浓度,并用稀释涂布平板法测定其生长曲线。利用相同的方法,检测PR3对5、10、50 mg/L芘以及50 mg/L萘、50 mg/L菲、10 mg/L苯并(a)芘的降解能力。萘、菲、苯并(a)芘的HPLC检测基于之前的研究,作部分改进[24- 25]。
1.2.5 芘胁迫下的植物促生长试验 将一定量芘的丙酮溶液均匀喷洒到土壤样品中,使得土壤中芘的理论含量为10 mg/kg、50 mg/kg和100 mg/kg。将土壤样品暗处静置7 d,待其中的丙酮完全挥发后,将其充分搅拌均匀,在室温下暗处老化6个月。盆栽试验前,检测到不同污染水平的土壤样品中芘的初始浓度分别为 0 mg/kg(S0)、9.58 mg/kg(S1)、43.80 mg/kg(S2)和 90.67 mg/kg(S3)。
选取籽粒饱满、大小均匀的水稻种子,在50℃下孵育15 min,用0.5%的次氯酸钠表面消毒后,立即用无菌水清洗3次,选取颗粒饱满的种子转移至湿润的滤纸上,30℃避光发芽。
试验共设置4组处理:CK,仅含污染土壤;CB,污染土壤中仅接种了PR3菌株;CP,污染土壤中仅种植水稻;CPR,污染土壤中种植水稻,并通过灌根法接种PR3菌株。每个处理设3个重复。在烧杯中称取300 g不同污染水平的土壤,浇灌无菌水使其含水量在60%左右。取避光发芽7 d后的幼苗接种至烧杯中,每盆12株,用菌株PR3的无菌水菌悬液(OD600=1.0)灌溉土壤(CB和CPR),每个烧杯添加20 mL,并用等体积的无菌水浇灌CK和CP对照组的土壤,将所有样品置于光照培养箱中培养30 d,光照周期为16 h光照/8 h 黑暗,培养温度为(28±2)℃,定期浇水并交换烧杯位置以保证均匀的光照。
1.2.6 植物生物量及叶绿素含量测定 从土壤中取出植物样品,洗掉根表黏附的泥土,用吸水纸吸干植物表面的水,测量植物株高、根长,分离新鲜植物的根与茎叶,分别测量其鲜重(fresh weight,FW)。然后将植物组织在70℃烘箱中烘干48 h,以确定其干重(dry weight,DW)。
采用分光光度法测定植物中叶绿素的含量[26]。称取0.02 g植物的叶片,剪碎后加入2 mL 80%的丙酮溶液,室温条件下置于暗处静置提取12 h,使用多功能酶标仪(瑞士帝肯公司)测定提取液在663 nm和645 nm处的吸光度值A663和A645。根据公式计算叶绿素a和叶绿素b的含量:
叶 绿 素 a含 量 Ca(mg/g FW)=(12.7×A663-2.69×A645)×V/W ;
叶绿素 b含量 Cb(mg/g FW)=(22.9×A645-4.68×A663)×V/W。
1.2.7 抗氧化酶活性及丙二醛含量测定 称取新鲜的植物叶片,剪碎后加入5 mL预冷的含有1% PVP的0.1 mol/L PBS(pH 6.8)中,研磨制成匀浆,然后将其转移至灭菌的离心管中,4℃ 10 000 r/min离心30 min。收集上清液作为粗酶提取液,4℃保存。取上清液用Bradford法测定总蛋白含量,过氧化物酶(peroxidase,POD)、超氧化物歧化酶(superoxide dismutase,SOD)酶活性以及丙二醛(MDA)含量均使用Solarbio试剂盒(北京)进行测定,根据总蛋白含量进行计算[27]。
1.2.8 植物及土壤中芘含量的HPLC测定 植物样品和土壤中芘的提取和检测如前所述,并稍作改进[28]。称取一定量冻干后的植物样品,剪碎后加入10 mL丙酮和二氯甲烷的混合溶液(V∶V=1∶1),超声萃取30 min,重复3次。收集萃取液,30℃旋转蒸发后加入4 mL丙酮溶解,用0.22 μm滤膜过滤后得到芘提取液,用HPLC对其进行分析。土壤中残余的芘的提取方法与之相同。HPLC检测条件与1.2.1中描述的一致。
1.2.9 统计学分析 实验数据用Microsoft Excel 2016进行处理和制图,数据以均值±标准差(SD)的形式表示,图中的每个数据表示至少有3个平行,平行样品的标准差用误差线表示。用SPSS软件进行数据分析,用单因素方差分析确定数据组间的统计学差异。不同字母标记表示P<0.05水平下差异显著。
2 结果
2.1 具植物促生特性的芘降解菌株的分离筛选
30℃培养7 d后,在含有芘(50 mg/L)的PMM固体培养基上随机挑取生长良好的单克隆菌落,分别在10 mg/L芘浓度下测定降解能力。其中有6个菌株具有明显降解能力,7 d内对芘的降解率均在90%以上。分别测定了这些菌株溶解无机磷、产IAA和铁载体的能力(表1)。结果表明,6株菌均具有较强的溶磷能力,7 d内溶磷量可达736.77-893.46 mg/L。而IAA合成能力差异较大,编号为1、3、4、5菌株具有较强的IAA合成能力,其中PR3菌株合成量最高,可达(14.46±0.20)mg/L。CAS固体培养基检测和铁载体单位测定均显示菌株PR1、PR2、PR3的铁载体合成能力远高于其他3株,铁载体活性单位在57.67%-62.57%之间。综合以上结果,选择促生特性最明显的菌株PR3作为目的菌株。
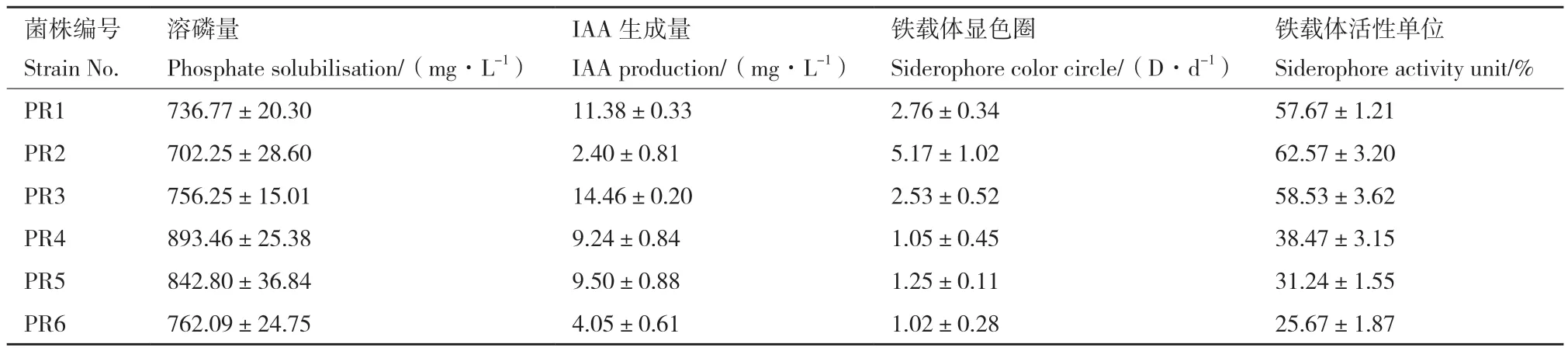
表1 菌株的植物促生特性Table 1 Plant growth-promoting traits of the isolated strains
2.2 菌株PR3的鉴定
对菌株PR3进行多次划线纯化后,挑取单克隆菌落进行基因测序分析。通过在NCBI上进行Blast序列比对分析,菌株PR3的16S rRNA基因序列与Pseudomonas putida和Pseudomonas monteilii最为接近,同源性达到99%以上。菌株PR3为假单胞菌Pseudomonas sp.,构建的系统进化树如图1所示。

图1 菌株PR3的系统发育树Fig. 1 Phylogenetic tree of strain PR3
2.3 菌株PR3对PAHs的降解
2.3.1 菌株PR3对芘的降解动力学 菌株PR3接种在含有20 mg/L 芘的PMM培养基中培养,连续14 d测定其降解效果和生长情况。从图2-A可以看出,第0-2天是菌株PR3生长的适应期,之后进入对数生长阶段,随着菌株生物量的明显增加,芘的降解速率也达到了最高。第10天时PR3的生物量达到最大值,为8.19 Log CFU/mL,此时芘降解率为80.30%,之后生长速率逐渐降低进入平台期,其对芘降解速率也趋于平缓。培养14 d后,芘的降解率达到94%。
比较了不同芘浓度下菌株PR3的降解效果。如图2-B所示,菌株PR3对5、10和20 mg/L的芘均具有较强的降解能力,分别在第8、12和16天降解完全(降解率大于99%),但当芘的浓度达到50 mg/L时,其整体降解速率明显较低,第15天时降解率为62.18%,之后降解趋于停止,第20天时降解率为63.82%,可能是高浓度芘对菌株PR3的生长产生抑制作用所致。
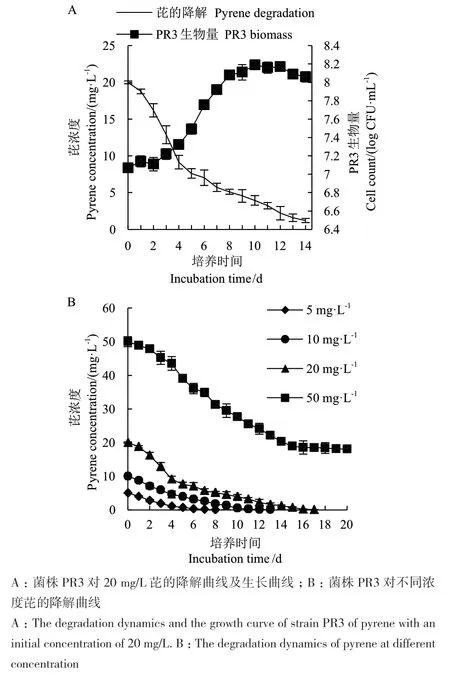
图2 菌株PR3的芘降解能力Fig. 2 Degradation of pyrene by strain PR3
2.3.2 菌株PR3对其他PAHs的降解动力学 为探究菌株PR3对不同分子量的多环芳烃是否具有降解能力,选择2环的萘(Nap)、3环的菲(Phe)和5环的苯并(a)芘(Bap),分别测定了该菌株培养7 d及14 d后的降解率(表2)。培养7 d后,PR3对Nap(50 mg/L)、Phe(50 mg/L)、Bap(10 mg/L)的降解率分别为91.56%、52.39%和46.37%,14 d后的降解率达到了92.45%、84.70%和47.16%。上述结果可以看出,菌株PR3对不同分子量的多环芳烃降解能力差异较大,这可能是由于随着PAHs分子量的增加,其在水中的溶解度降低且生物毒性升高所导致。PR3对低分子量的多环芳烃(2环、3环)降解效率高,而对高分子量的苯并芘的降解速率明显较低,但仍能实现部分降解。
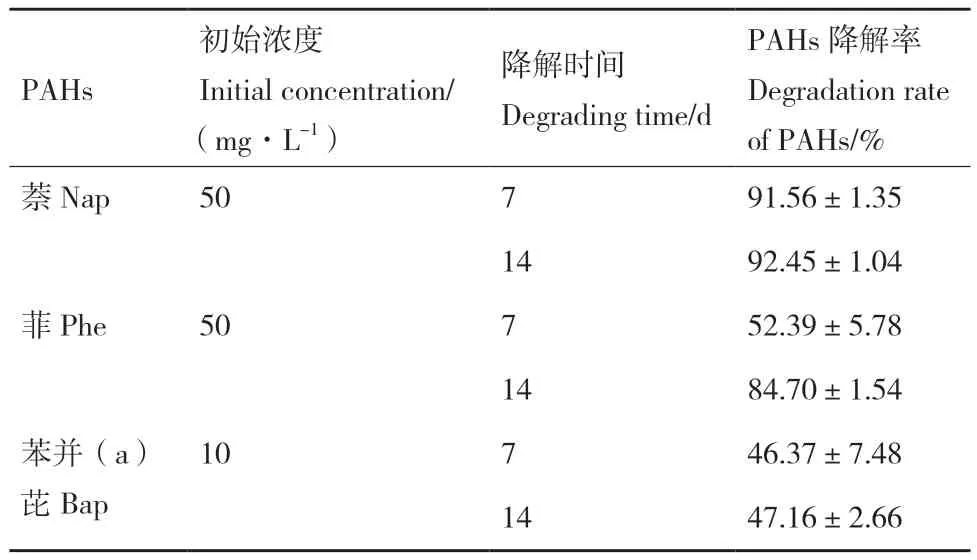
表2 菌株PR3对其他PAHs的降解能力Table 2 Degradability of strain PR3 for other PAHs types
2.4 菌株PR3对芘污染土壤中水稻生长的影响
2.4.1 菌株PR3对水稻生物量的影响 图3显示出芘含量为未污染土壤(S0)、9.58 mg/kg(S1)、43.80 mg/kg(S2)和90.67 mg/kg(S3)不同污染水平下接种PR3对水稻生长的影响。如表3所示,芘对水稻生长的抑制作用与土壤中芘含量成正相关,低浓度芘(S1)胁迫对水稻生长的影响不明显,在较高浓度芘处理(S2和S3)下,水稻地上部及根的生物量均显著减少(P<0.05)。在S3水平下,水稻地上部鲜重和干重分别降低了27.69%和36.27%,根鲜重和干重分别降低了34.96%和15.70%。接种PR3后水稻的生物量均显著提高(P<0.05),说明PR3可有效促进不同芘污染水平下水稻的生长。在S3水平下接种PR3,水稻地上部鲜重和干重分别增加了69.82%和69.91%,根鲜重和干重分别增加了82.95%和35.24%。
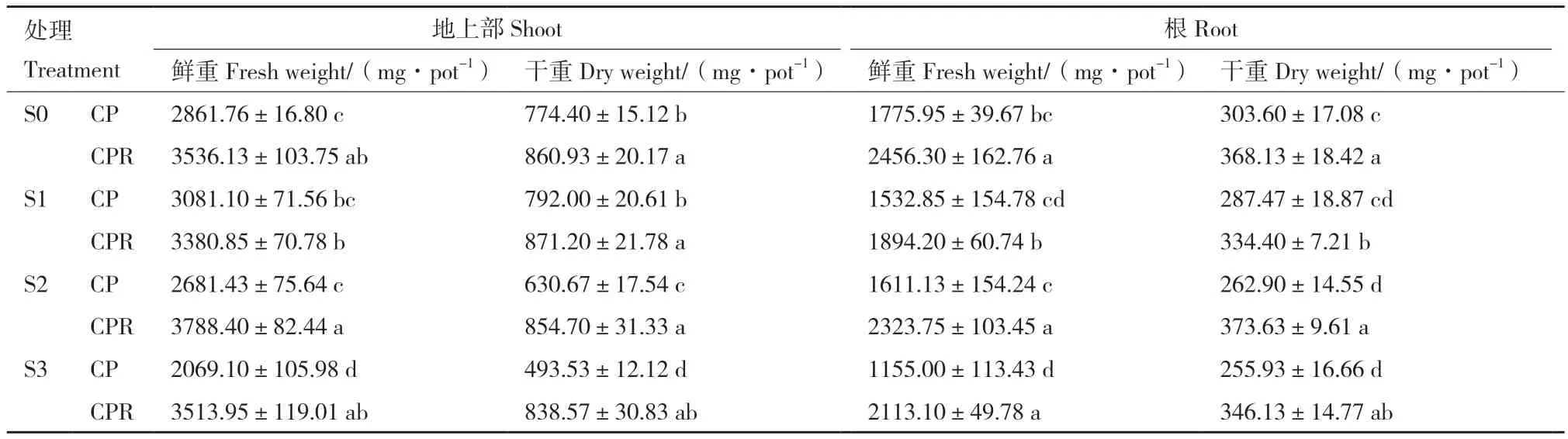
表3 接种菌株PR3 30 d后水稻的生物量Table 3 Biomass of rice at 30 d after inoculation with strain PR3

图3 接种菌株PR3对水稻生长的影响Fig. 3 Effects of inoculated strain PR3 on rice growth
2.4.2 菌株PR3对水稻光合作用及氧化应激水平的影响 为探究芘胁迫及接种PR3对水稻光合作用的影响,测定了不同处理下水稻的叶绿素含量。随着芘含量的升高,水稻中总叶绿素的含量均呈逐渐降低趋势(图4-A)。在高浓度芘(S3)胁迫下,叶绿素含量显著降低(P<0.05),其中叶绿素a和叶绿素b含量分别降低了20.81%和21.62%。接种PR3可显著提高不同浓度芘胁迫下的叶绿素含量,对无污染条件下的叶绿素含量影响很小。其中,在S3水平下接种PR3,水稻叶绿素a和叶绿素b含量分别提高了56.15%和47.54%,表明接种PR3可显著改善芘胁迫下水稻的光合作用。
SOD、POD等抗氧化酶可用于清除植物体内在胁迫环境下产生的ROS,因此其酶活性可反映出植物氧化应激的水平和自身调控以降低氧化损伤的能力,MDA则间接反映出植物体内ROS的水平和膜损伤程度。如图4-B、4-C所示,水稻叶片中SOD酶活性均显著高于无污染对照组(P<0.05),随着芘污染浓度增加,SOD酶活性呈先升高后下降的趋势,这表示其SOD酶活性的调控范围有限,高浓度的芘胁迫下(S3),SOD酶活性受到一定抑制,而POD酶活性则与芘污染浓度呈正相关,显示出其较强的调节能力。在接种PR3后,水稻的SOD和POD酶活性均有所提高。与未接菌对照组相比,SOD酶活性分别提高了21.31%(S1)、9.62%(S2)和11.49%(S3),POD酶活性分别提高了7.85%(S1)、36.74%(S2)和36.10%(S3)。如图4-D所示,水稻叶片MDA含量与芘污染浓度呈正相关,与无污染对照组相比,其MDA含量上升了36.26%-75.08%,接种PR3后,其MDA含量均降至较低水平。以上结果均表明芘胁迫导致水稻中ROS增加以及膜损伤,接种PR3可提高水稻清除ROS的能力,减轻芘造成的氧化损伤。
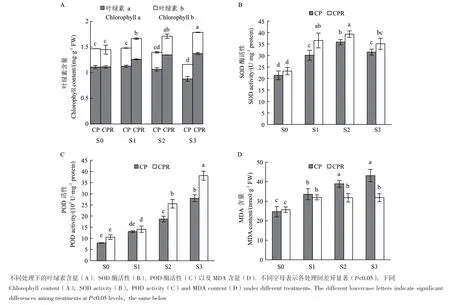
图4 菌株PR3对水稻光合作用及氧化应激的影响Fig. 4 Effects of strain PR3 on photosynthesis and oxidative stress of rice
2.5 菌株PR3对土壤及水稻中芘含量的影响
随着芘污染水平的提高,水稻中芘的积累量也逐渐增加,且根中芘含量显著高于地上部(图5-A)。接种菌株PR3后,各个污染水平下水稻中芘的含量均显著降低(P<0.05),与未接菌对照组相比,地上部中芘含量分别降低了57.17%(S1)、50.96%(S2)和49.81%(S3),根中芘含量分别降低了34.10%(S1)、53.01%(S2)和21.81%(S3),表明PR3在根际的定植可显著减少水稻对芘的吸收积累。
根据图5-B可知,在水稻(CP)、菌株PR3(CB)以及水稻与PR3协同(CPR)作用下,污染土壤中芘的含量均显著降低(P<0.05),其去除能力从高到低依次为CPR、CP和CB。接种PR3后,在水稻与PR3协同作用下,土壤中芘的去除率分别达到了86.22%(S1)、72.02%(S2)和74.31%(S3),与仅种植水稻(CP)相比,去除率提高了76.08%(S1)、14.15%(S2)和18.28%(S3)。此外,仅接种PR3对污染土壤中芘亦具有较强的去除能力,降解率可达37.19%(S1)、61.82%(S2)和55.28%(S3)。以上结果表明,根际接种PR3可有效降低土壤中芘含量,从而减少水稻对芘的吸收,降低芘对植物的损伤。
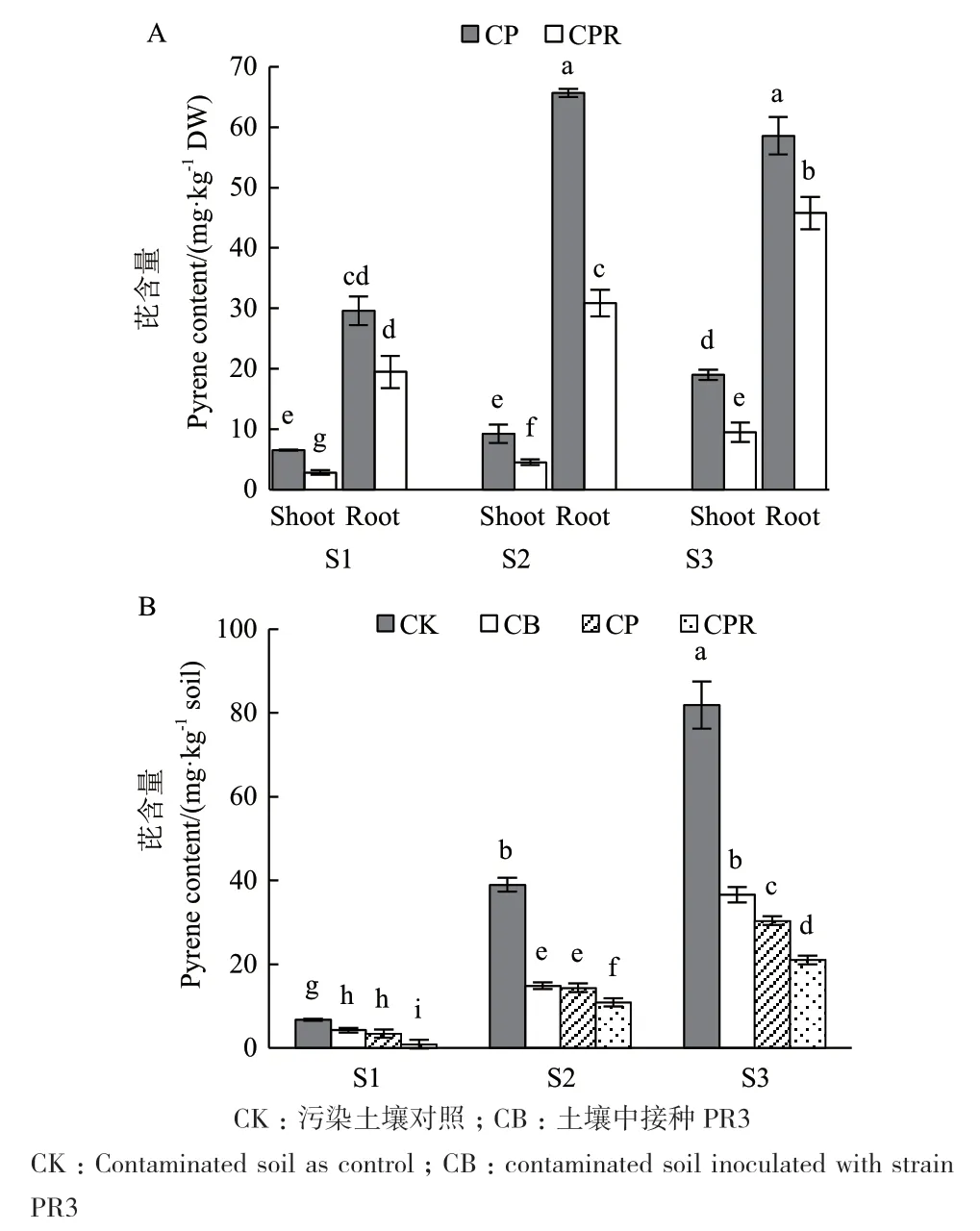
图5 接种菌株PR3对水稻(A)及土壤(B)中芘含量的影响Fig. 5 Effects of strain PR3 on pyrene content in rice(A)and soil(B)
3 讨论
由于燃煤、工业生产、石油开采等人类行为导致PAHs持续增加,近年来在许多农田土壤及粮食作物中检测到PAHs污染极大的引起人们关注,如何将粮食安全生产与污染物修复相结合是其中的关键。微生物修复由于其成本低,潜力大、对生态系统影响较小而得到了广泛研究[29]。虽然污染土壤中普遍存在可降解PAHs的细菌,但有关高效降解HMW-PAHs的菌株研究较少。Nzila等[30]分离得到芘降解菌株Achromobacter xylosoxidans PY4,15 d内对100 mg/L芘的降解率可达50%。Vaidya等[31]从污染土壤中分离得到由Pseudomonas sp. ASDP1,Burkholderia sp. ASDP2和Rhodococcus sp. ASDP3三个菌株组成的混合菌群,可在10 d内有效降解100 mg/L的芘,同时对萘、菲也具有一定的降解能力。本研究从污染地植物根表分离到一株芘降解菌PR3,可在14 d内降解20 mg/L芘,对萘、菲和苯并(a)芘也具有降解能力,对于较高浓度芘(50 mg/L)降解能力较低,降解率最高为63%,这可能由于高浓度芘具有更强的生物毒性,进而影响了菌株PR3的生长,该菌株降解芘的代谢路径有待于进一步研究。
目前对于降解菌在土壤中的研究显示,多数降解菌对老化土壤中PAHs的去除能力仍然有限,仍需与物理/化学/植物修复技术相结合,这也限制了其在农业土壤中的应用。张金宝等[32]将高效芘降解菌B4(单菌)和H4(混菌)与电修复相结合,90 d内对老化土壤中芘(100 mg/kg)的降解率达到46.8%和64.4%,而仅接种降解菌的降解率仅为26.7%和31.4%。本研究中菌株PR3对老化6个月的土壤中不同浓度的芘均具有较强的降解能力,在30 d内对初始浓度为90.67 mg/kg的芘降解率可达55%,显示出其对土壤中结合的芘具有较强的利用能力,可为后续的作物生长提供良好的土壤环境。多项研究显示,细菌胞外多糖可提高PAHs的生物利用度,同时也为在土壤颗粒及植物根际定植奠定了基础[33]。在液体培养基中降解芘时,观察到菌株PR3在未溶解的芘晶体上大量增殖并分泌胞外基质形成生物膜,显示出其具有较强的成膜能力以及分泌胞外多糖的能力,可能是其利用难溶性PAHs以及在植物根际有效定植的重要途径。Chen等[34]研究发现菲降解菌RS1可有效定殖于多种植物根际及根组织内,使得植物根部及地上部的菲含量分别降低了93.7%和75.2%。Liu等[35]利用菲降解菌Massilia sp. Pn2定殖于黑麦草根表及根内,使得根系和地上部分菲的含量降低了54%和57%,有效降低了菲对植物的胁迫。本研究中,在根际接种菌株PR3可显著降低水稻叶片及根中的芘积累量,显示出其在安全的农业生产中具有巨大的潜力,但其在植物根际的定植情况仍需进一步研究。
芘相较于更高分子量的PAHs,其更易通过根系吸收并转运至地上各组织中积累,增加其在食物链中的暴露风险[36]。长期胁迫或高浓度PAHs胁迫下,植物抗氧化系统表达受阻,导致ROS积累造成机体损伤。本研究中,在芘胁迫下,水稻叶片中叶绿素含量均显著降低,进一步显示出芘胁迫可通过影响植物光合作用等基础生理活动来抑制植物生长。PGPR作为一类有益微生物,可通过多种途径促进植物生长,还可通过刺激根系分泌多种氧化酶,促进根际环境中污染物的降解[37]。PGPR的溶磷作用通过将不溶的无机磷或有机磷转化为可溶磷,易于被植物利用,在农业生态系统中发挥着重要作用,目前分离到的解磷菌的溶磷量大多为200-700 mg/L[38]。本研究中分离到的 Pseudomonas sp. PR3 在7 d内的最大溶磷量可达(756.25±15.01)mg/L,具有较强的溶磷能力。研究显示,PAHs导致的氧化应激可影响植物激素(IAA、赤霉素等)和叶绿素的含量,进而抑制植物生长,在PAHs胁迫下IAA可通过提高植物根系表面积来促进植物生长,同时IAA还有利于植物根际菌群的建立[39]。目前分离到的产IAA菌株的合成能力差异较大,多数合成菌IAA的生成量在5-30 mg/L之间,在优化培养条件后,某些菌株的IAA合成量甚至在数十至100 mg/L以上[40]。本研究中菌株PR3的IAA生成量为(14.46±0.20)mg/L,在常见IAA生成菌中处于中等水平。铁载体是微生物分泌的可高效结合铁的小分子有机物,能促进植物对铁元素的吸收,在促进植物生长发育、提高抗逆性等方面发挥重要作用,目前利用铁载体活性单位来评价菌株的合成能力[41]。菌株PR3产铁载体活性高于50%,属于高产铁载体菌株。有研究显示,PGPR的促生能力往往受到环境胁迫的抑制。Kotoky等[24]分离得到苯并(a)芘高效降解菌株Acinetobacter sp. PDB4,具有溶磷、产铁载体及ACC脱氨酶等植物促生特性,但在苯并芘存在下,其促生特性均受到抑制。本研究表明,菌株PR3同时具有溶磷、产铁载体和IAA几种植物促生特性,且其植物促生能力在不同浓度芘胁迫下均保持较高水平。本研究由于在人工污染土壤中进行,而实际污染土壤中微生物与微生物以及不同污染物之间还会存在相互作用[42],同时还受到不同温度、湿度以及土壤pH影响,对污染物的修复效果以及植物吸收积累的水平亦会产生不同影响,因此本研究对芘污染条件下安全的作物生产提供一定依据,后续仍需在实际污染土壤中进行进一步研究。
4 结论
本研究从油田污染地植物根表分离到的菌株PR3具有溶磷、产IAA和铁载体等促进植物生长特性,同时有较强的芘降解能力和对其他几种PAHs的降解潜力,可在不同浓度人工老化芘污染土壤中有效降低氧化应激水平,改善水稻的生长,提高土壤中芘去除率的同时减少植物组织中芘的吸收积累。
