核桃CONSTANS-Like基因家族全基因组鉴定及表达分析
2022-11-05袁星郭彩华刘金明亢超全绍文牛建新
袁星 郭彩华 刘金明 亢超 全绍文 牛建新
(石河子大学农学院园艺系 特色果蔬栽培生理与种质资源利用兵团重点实验室,石河子 832003)
成花诱导是从营养生长到生殖生长的转变,对植物的生命周期至关重要[1]。既受外部因素影响,又受内部因素影响,其中光周期就是一个重要因素。CONSTANS-Like(COL)是植物特有的转录因子,属于锌指转录因子家族,含有2个保守元件,即N端的B-Box结构域和C端CCT结构域[2]。COL基因是植物对光周期反应的重要调节因子,是植物开花调控的核心元件[3]。
在不同的植物中,COL基因对开花过程中的调控是保守的,但不同成员之间的传递通路可能不同。例如,在拟南芥中,CO在长日照(LD)条件下发挥积极作用并促进其开花[4];过表达COL5可以诱导短日照(SD)栽培的拟南芥开花[5]。然而,过表达COL8和COL9导致了拟南芥的晚花表型[6-7]。在水稻中,OsCOL3在SD条件下通过抑制Hd3a和RFT1的转录来调控开花[8];OsCOL13和OsCOL10在水稻光周期开花途径中起负调控作用[9-10]。在大麦中,过表达HvCO1可使其加速开花时间,并导致HvFT1 mRNA在LD条件下上调[11]。
COL基因除了调节开花外,在植物生长发育的其他方面也起着重要作用。拟南芥AtCOL1和AtCOL2、牵牛花PnCOL1以及大豆GmCOL10都可调节昼夜节律[12-14]。此外,AtCOL3促进侧根发育和地上部分枝,而AtCOL4促进对非生物胁迫的耐受性[15-16];马铃薯StCO参与光周期块茎的形成[17];香蕉MaCOL1可能参与胁迫反应和果实成熟[18];莱茵衣藻CO调节脂质的合成[19];VvCO和VvCOL1调控葡萄花蕾的开花诱导和休眠,且CO同源基因在卷须中表达,这可能与卷须的发育有关[20]。
核桃(Juglans regia L.)是胡桃科胡桃属的落叶乔木,分布和栽培遍及世界多个国家和地区,是重要的经济树种[21],但核桃在实际产业中面临花芽分化的数量不均的问题,导致坐果率低。COL基因作为光周期途径的关键基因,对开花有着直接或间接的促进作用。目前,COL基因在许多植物中被鉴定,如拟南芥[22]、水稻[2]、大麦[2]、大豆[23]、白菜[24]、野菊花[25]和葡萄[26],但目前还缺乏对核桃COL家族基因的全面分析。
本研究以‘新新2号’(Juglans regia cv. Xinxin No. 2)为材料,利用生物信息学方法对核桃中COL基因家族进行全面分析,并分析其在不同组织及不同时间雌花芽的表达,旨在为进一步研究核桃中COL基因家族的分子功能奠定生物学基础。
1 材料与方法
1.1 材料
根据课题组前期对新疆核桃在南疆地区花器官分化的石蜡切片观察和徒手切片观察,于2021年5月31日-6月10日,采集新疆维吾尔自治区南疆阿克苏地区同一核桃园内的早实核桃品种‘新新2号’(Juglans regia cv. Xinxin No. 2)的叶、叶芽和雌雄花芽为试材,每2天1次,每个品种分别选取3棵各自立地条件、树龄,树体状态与栽培管理水平一致的树,于树冠外围东、西、南、北4个方向随机采取进行混样,将采集的样品用锡箔纸包好,迅速放入液氮中冷冻,于-80℃保存备用。
1.2 方法
1.2.1 核桃JrCOL家族成员鉴定 核桃的基因组文件、蛋白序列以及注释文件下载于NCBI(https://www.ncbi.nlm.nih.gov),以拟南芥的17个AtCOL蛋白序列为查询序列,利用BioEdit(v7.0.9.0)进行Blastp,E-value设定为1e-10;在Pfam数据库中下载CTT(PF06203) 和 zinc finger B-box(PF00643) 的保守结构域模型,通过本地hmmsearch命令进行筛选,E-value设定为1e-10;将上述筛选序列进行整理,去掉重复序列。通过SMART(http://smart.embl.de/smart/batch.pl) 和 CDD(https://www.ncbi.nlm.nih.gov/cdd/)数据库进一步确定候选序列所包含的结构域,保留含有CTT或zinc finger B-box结构域的序列,最终确定为JrCOL家族成员。
1.2.2 核桃JrCOL蛋白特征和进化关系 将JrCOL蛋 白 序 列 输 入 ExPASy(https://web.expasy.org/protparam/)网站,对其氨基酸数量、分子量信息以及等电点进行分析。利用在线网站WOLF PSORT(http://www.genscript.com/wolfpsort.html) 对 JrCOL 家族成员分别进行亚细胞定位。从拟南芥(https://www.arabidopsis.org/)网站下载AtCOL蛋白序列,与核桃JrCOL蛋白进行对比,利用MEGA-X软件采用邻接法(neighbor-joining method,NJ)构建系统发育树,设置Bootstrap值为1 000,置换模型选择P-distance,其他参数选择默认。
1.2.3 核桃JrCOL蛋白保守基序、基因结构及启动子顺式作用元件分析 利用MEME(http://memesuite.org/index.html)在线网站预测保守基序;采用TBtools工具绘制JrCOL基因在核桃上的基因结构。利用MEGA-X对核桃JrCOL家族基因成员进行系统发育树构建,参数与上述方法相同。从核桃的基因组中获取COL基因翻译起始位点ATG上游1 500 bp的序列为启动子区域,提交至PlantCAR(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)网站进行启动子顺式作用元件分析。
1.2.4 核桃JrCOL家族基因共线 采用TBtools工具绘制JrCOL基因在核桃染色体上的位置,并利用其Dual Systeny Plot for MCscan X和Advanced Circos程序对核桃,拟南芥以及葡萄进行共线性分析。利用KaKs_Calculator 2.0软件计算基因对之间的Ka、Ks和Ka/Ks值。葡萄基因组下载于NCBI(https://www.ncbi.nlm.nih.gov)。基于课题组核桃‘新新2号’(Juglans regia cv. Xinxin No. 2)转录组数据,提取JrCOL家族成员的FPKM值并绘制热图。
1.2.5 核桃JrCOL家族基因的组织表达分析 利用Plant RNA Extraction Mini Kit试剂盒提取不同组织的总RNA,利用琼脂糖凝胶电泳与Thermo Nano Drop 2000仪器检测完整性和浓度;利用反转试剂盒HyperScriptTMIII RT SuperMix for qPCR with gDNA Remover合成cDNA第一链。利用在线软件 Primer3Plus(http://www.primer3plus.com/cgi-bin/dev/primer3plus.cgi)设计定量引物,并通过NCBI的Primer-BLAST(https://blast. ncbi.nlm.nih.gov/Blast.cgi)进行引物特异性验证,以18S作为内参基因(表1)。用2×S6 Universal SYBR qPCR Mix进行实时荧光定量PCR,所有操作均按照说明书进行。试验设3次生物学重复。各基因成员相对表达量的数据分析采用 2-ΔΔCT[27],利用 SPSS 23 对结果进行单因素方差分析(analysis of variance,ANOVA),显著性水平为P<0.05,并用Origin作图。

表1 引物序列Table 1 Primer sequences
2 结果
2.1 核桃COL家族成员鉴定及分析
利用Blastp和HMMER搜索,结合NCBI Batch CD-search和SMART网站对候选成员的结构域完整性进行确认,最终获得由55个JrCOL基因编码的90个蛋白序列。根据在染色体上的顺序,命名为JrCOL1-JrCOL55(表 2)。
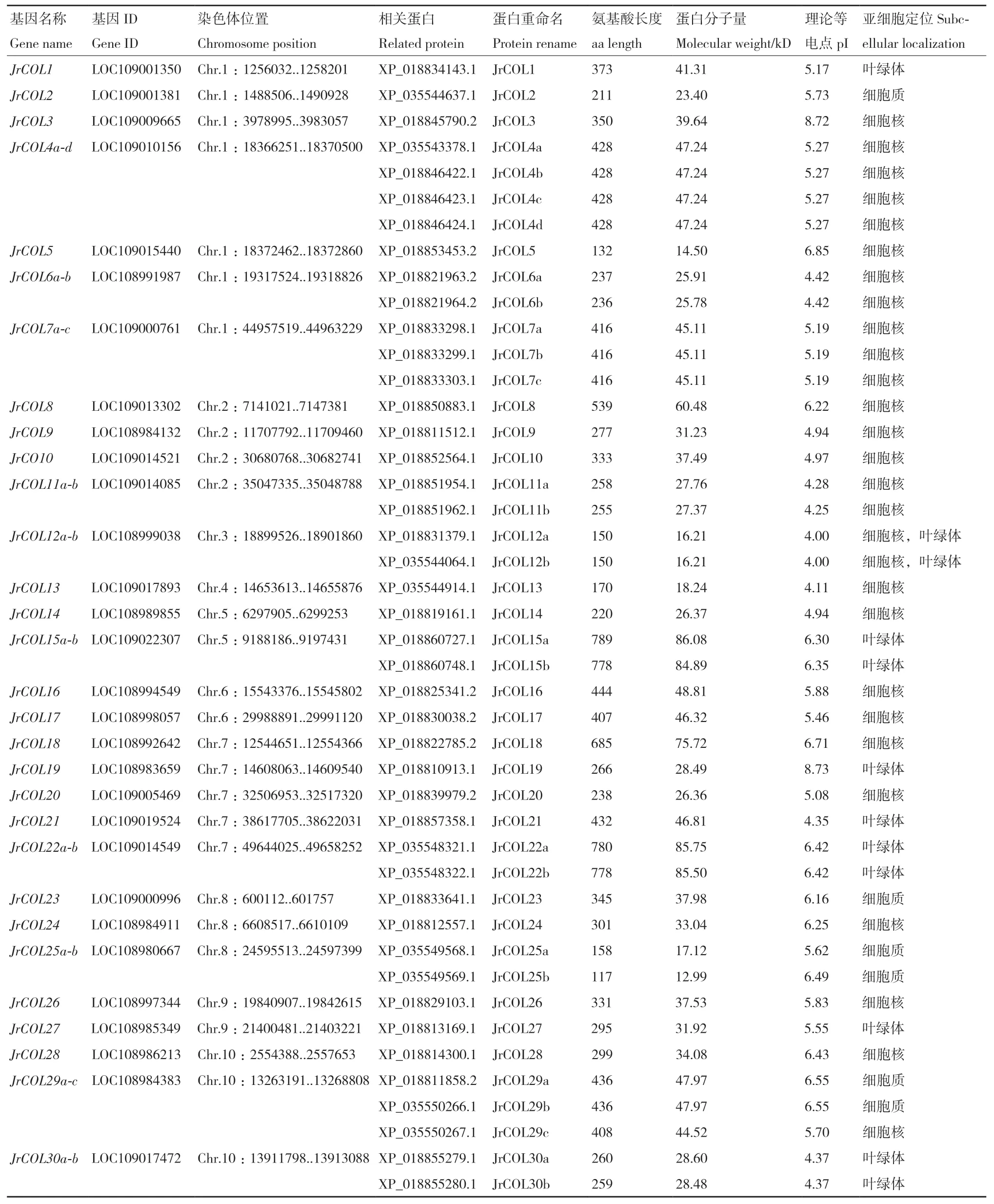
表2 核桃的COL基因家族鉴定Table 2 COL gene family identified in Juglans regia
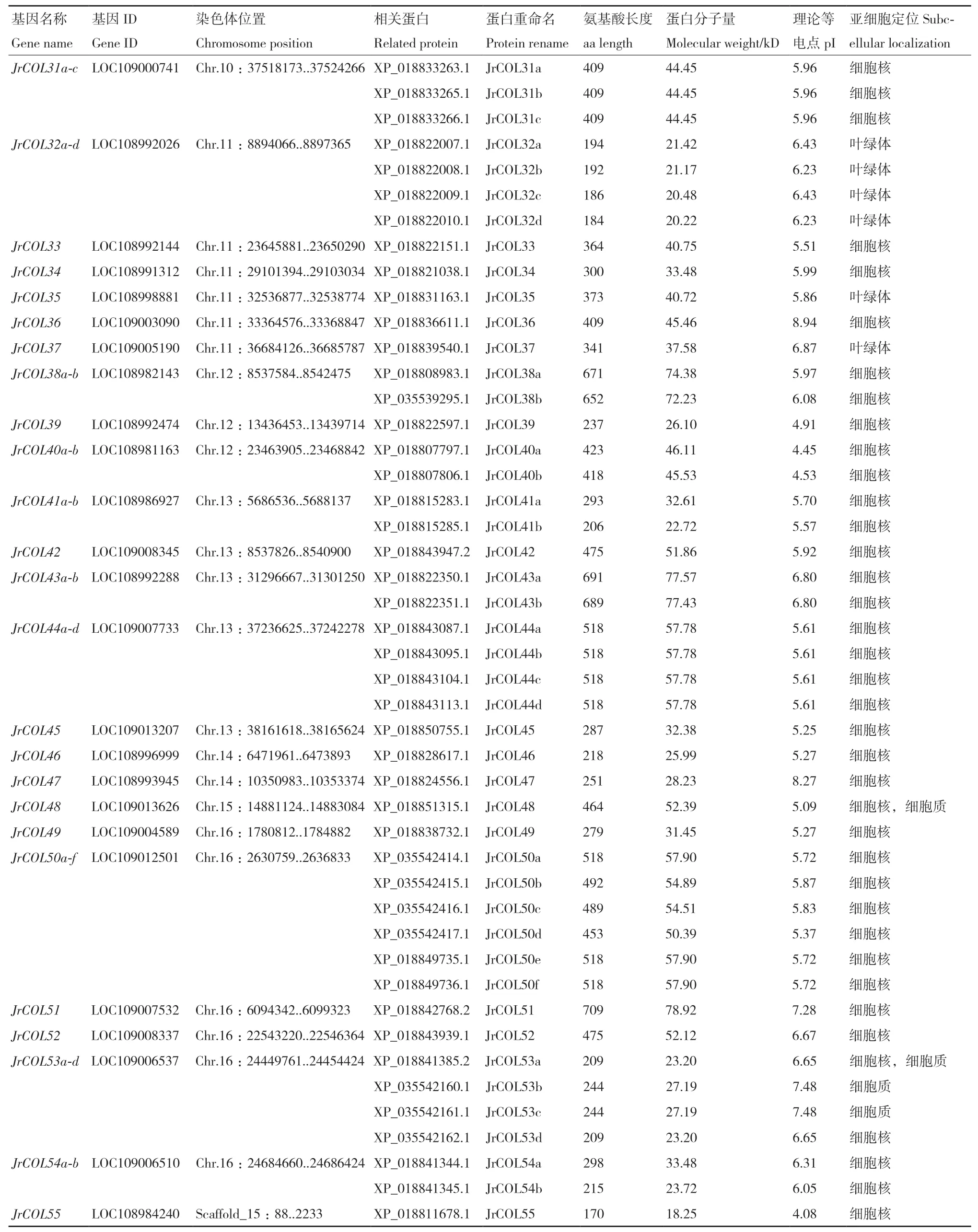
表2 续表 Continued by Talbe 2
JrCOL基因不均匀地分布在核桃的16条染色体和1条scaffold上,其中,Chr.16上所含JrCOL基因最多,为6个,Chr.3、Chr.4和Scaffold15所含基因最少,为1个。此外,JrCOL成员的氨基酸长度为117-789 aa;分子量为12.99-86.08 kD;等电点为4.00-8.94,其中,83个蛋白等电点小于7,呈酸性;7个蛋白等电点大于7,呈碱性。对JrCOL家族成员亚细胞定位预测发现,JrCOL蛋白主要定位于细胞核,也有少数成员定位于其他亚细胞结构,如细胞质和叶绿体等。
2.2 核桃COL家族进化分析
从拟南芥数据库中下载COL蛋白序列,构建核桃(Jr)和拟南芥(At)COL蛋白系统进化树(图1)。根据进化树可分为3组(Group Ⅰ、Group Ⅱ和Group Ⅲ),其中Group Ⅰ含有的有JrCOL家族成员最多为32个,其次是Group Ⅲ含有30个,Group Ⅱ含有的最少为28个。此外,Group Ⅰ中没有AtCOL家族成员,Group Ⅱ含有5个AtCOL家族成员,Group Ⅲ含有12个。

图1 拟南芥、核桃COL基因家族的系统发育关系Fig. 1 Phylogenetic relationship of the COL gene family of Arabidopsis and walnut(Juglans regia)
2.3 核桃COL家族蛋白保守基序和基因结构分析
核桃JrCOL蛋白序列进行进化分析(图2-A),根据进化关系可分为Group Ⅰ、Group Ⅱ 和GroupⅢ 3个亚家族,这与图1结果一致。利用MEME在线网站对JrCOL蛋白进行保守基序的预测,共搜索获得的10个保守基序(图2-B),且同一分支基因的motif的种类、数量和位置较为一致。此外,所有JrCOL蛋白都含有motif1或motif2,将motif1和motif2输入到Pfam在线数据库进行注释,结果表明motif1代表CTT结构域,motif2代表zinc finger B-box结构域,其保守结构域序列与图2-D一致。进一步基因结构分析发现,JrCOL基因都具有外显子和内含子,且同一亚家族的成员具有相似的基因结构,但JrCOL基因家族内含子数在不同分支之间具有较大变异(1-9个内含子),这表明不同分支基因功能可能具有特异性。
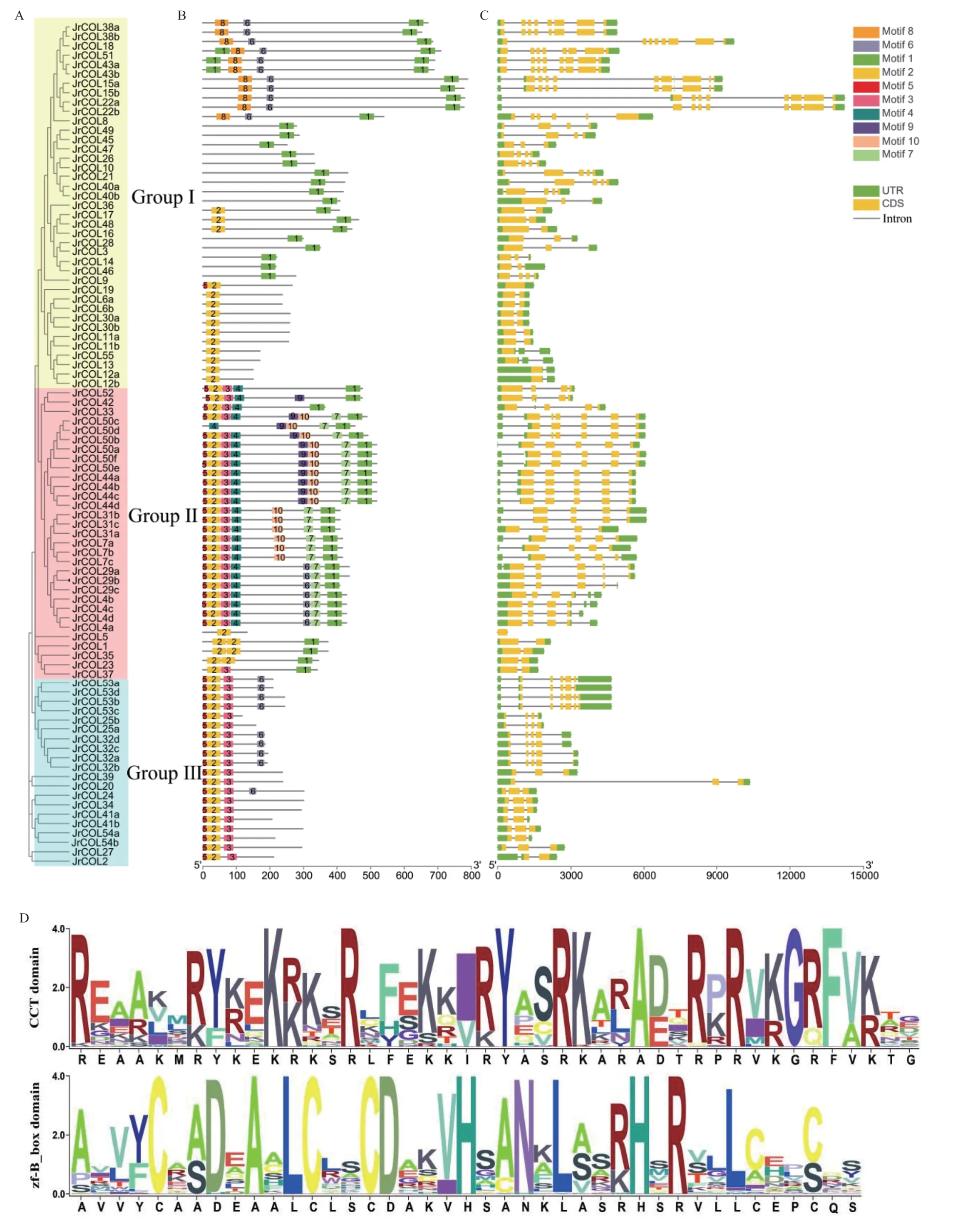
图2 JrCOL蛋白进化(A)、保守基序分布(B)、基因结构(C)及保守结构域(D)分析Fig. 2 Analysis of JrCOL protein evolution(A),conserved motif(B),gene structure(C)and conserved domain(D)
2.4 核桃COL基因家族启动子顺式作用元件分析
为分析核桃COL家族基因不同成员之间的功能差异,对该家族基因的启动子进行顺式作用元件分析(表3)。结果表明,发现核桃COL家族基因中9种胁迫相关顺式元件、8种激素相关顺式元件和6种生长发育相关顺式元件。其中,有46个JrCOL基因含有厌氧诱导所必需的响应元件ARE,43个JrCOL基因含有脱落酸响应元件ABRE,49个基因含有光响应元件G-box。表明JrCOL可能对光,厌氧诱导以及脱落酸有响应。此外,在6个生长发育响应元件中,有5个光响应元件,进一步佐证了COL基因在光反应起到重要作用。

表3 JrCOL启动子上顺式作用元件的预测Table 3 Prediction of cis-element in the JrCOL promoter
2.5 核桃COL基因家族共线性分析
根据核桃染色体基因组信息,分析了55个JrCOL基因在染色体上的分布情况(图3-A)。其中有35对基因存在基因复制事件,且均为片段复制;利用KaKs_Calculator 2.0软件计算片段复制基因对的Ka/Ks值(表4),结果表明Ka值介于0.061-0.627,Ks值介于 0.309-3.152,Ka/Ks值 <1,表明 JrCOL在物种进化过程中主要受纯化选择的作用。因JrCOL6a-b与 JrCOL12a-b、JrCOL6a-b与 JrCOL13、JrCOL11a-b与 JrCOL12a-b、JrCOL11a-b与 JrCOL13以及JrCOL24与JrCOL25a-b之间的CDS相似度在75%以上,未能计算出Ka/Ks值。

表4 JrCOL基因家族Ka/Ks值反映的复制时间分析Table 4 Analysis of duplication time reflected from Ka/Ks values of JrCOL gene family
为研究不同物种间COL基因的进化关系,对核桃(Jr)、拟南芥(At)和葡萄(Vv)进行共线性分析。结果(图3-B)表明,拟南芥与核桃共有67对基因具有同源性,核桃与葡萄共有73对基因具有同源性,这表明核桃与葡萄的亲缘关系更近。有43个 JrCOL基 因(JrCOL2、JrCOL3、JrCOL4a-d、JrCOL5、JrCOL6a-b、JrCOL7a-c、JrCOL8、JrCOL10、JrCOL11a-b、JrCOL14、JrCOL15a-b、JrCOL16、JrCOL17、JrCOL18、JrCOL20、JrCOL21、JrCOL24、JrCOL25a-b、JrCOL26、JrCOL28、JrCOL29a-c、JrCOL30a-b、JrCOL31a-c、JrCOL32a-d、JrCOL33、JrCOL34、JrCOL35、JrCOL36、JrCOL38a-b、JrCOL39、JrCOL40a-b、JrCOL41a-b、JrCOL42、JrCOL43a-b、JrCOL45、JrCOL46、JrCOL47、JrCOL48、JrCOL49、JrCOL51、JrCOL52、JrCOL53a-d、JrCOL54a-b)在拟南芥和葡萄中同时具有同源性,表明这43个JrCOL基因可能是从不同植物的共同祖先进化而来的。
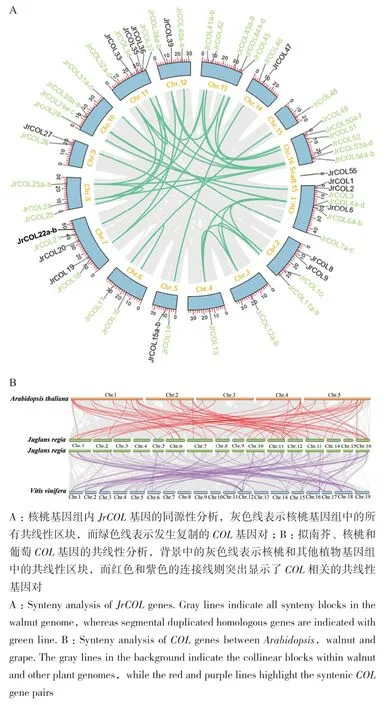
图3 核桃COL基因的复制模式分析Fig. 3 Duplication models of the COL genes in walnut
2.6 核桃COL基因家族在不同组织的表达模式
前期将早实核桃品种‘新新2号’雌花芽分化时期划分为形态未分化期(F_1)、形态分化始期(F_2)、雌花原基分化期(F_3)[28]。基于其转录组数据对JrCOL家族基因在不同时期核桃雌花芽和F_2同时期叶芽(Juglans regia leaf buds,JRL)中的表达模式进行了分析。结果(图4)表明,有31个基因在叶芽和雌花芽中表达,其余24个基因没有表达。其中,JrCOL16、JrCOL4a-d和JrCOL29a-c在叶芽的表达量显著高于其他基因,推测其在叶芽的生长发育中起到重要作用;此外,JrCOL18、JrCOL28、JrCOL46、JrCOL8、JrCOL52、JrCOL44a-d、JrCOL43a-b、JrCOL51、JrCOL3、JrCOL22a-b、JrCOL42、JrCOL9和 JrCOL50a-f在雌花芽F_1时期的表达量显著高于叶芽(JRL)和F_2、F_3时 期, 而 JrCOL17、JrCOL48、JrCOL37、JrCOL1和JrCOL23显著低于叶芽和F_2、F_3时期。另外,在同一分支的基因表达模式相似,表明该分支下的JrCOL基因可能具有相似的作用。

图4 JrCOLs的表达分析Fig. 4 Expression analysis of JrCOLs
2.7 核桃COL家族基因的组织表达分析
为研究不同组织中JrCOL基因家族的表达情况,随机选取10个基因在采样第7天的‘新新2号’叶芽、叶、雌花芽和雄花芽中进行RT-qPCR分析。结果(图5)表明,除JrCOL42和JrCOL52外,其余8个基因在‘新新2号’中叶的表达量显著高于其他组织,推测这8个基因在叶的生长发育过程中起到重要作用;JrCOL1、JrCOL7a-c、JrCOL8、JrCOL23和JrCOL31a-c在叶芽中的表达量显著高于雌花芽和雄花芽;JrCOL1、JrCOL23和JrCOL50a-f在雌花芽中的表达量显著高于雄花芽,而JrCOL42在雄花芽中的表达量显著高于雌花芽(图5),表明JrCOL家族在‘新新2号’中表达具有组织特异性。
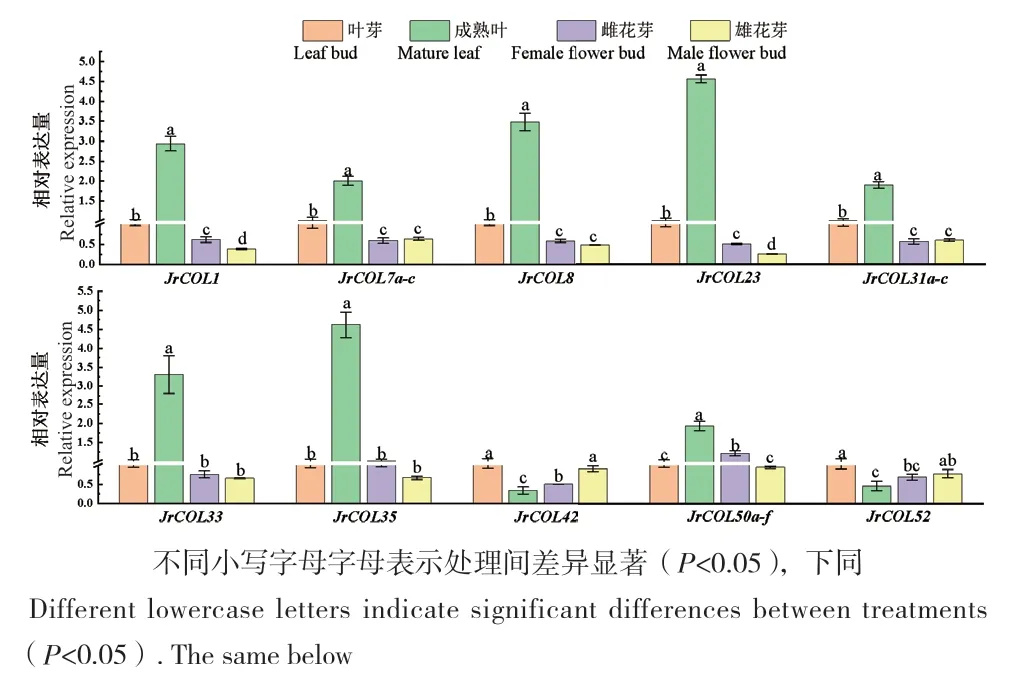
图5 ‘新新2号’JrCOL基因在不同组织中的相对表达量Fig. 5 Relative expressions of JrCOL genes in Juglans regia cv. Xinxin No. 2 in different tissues
2.8 核桃雌花芽发育过程中JrCOL基因表达变化
为探究JrCOL基因在核桃雌花芽分化过程中的作用,分析4个基因在‘新新2号’不同时间雌花芽中的相对表达量。结果(图6)表明,JrCOL1、JrCOL35、JrCOL50a-f和 JrCOL52在‘ 新 新 2号 ’雌花芽采样第1天的表达量显著高于其他时间;JrCOL50a-f和JrCOL52在采样第5天的表达量显著高于其他时间(除采样第1天);此外,回归分析发现,在‘新新2号’中,JrCOL1、JrCOL35、JrCOL50a-f和JrCOL52的表达趋势相一致且在采样第7天表达量最低。

图6 ‘新新2号’雌花芽不同发育阶段JrCOL基因家族表达量及其回归分析Fig. 6 Expressions and regression analysis of the JrCOL gene families at different developmental stages of Juglans regia cv. Xinxin No. 2
3 讨论
随着核桃基因组测序的完成,使得从基因组层面对核桃COL家族基因进行全面的鉴定和分析。本研究从核桃基因组中共鉴定出55个JrCOL基因不均匀的分布在16个染色体和1个Scaffold,且系统发育分析将这些基因分为3组,这与Li等[29]研究相一致;不同的基因家族有着独特的基序,在核桃中55个JrCOL基因都存在motif1(CTT)或motif2(zinc finger B-box),另外在同一分支基因的基序和基因结构相对位置基本一致,与Griffiths等[2]研究相一致,这同时说明JrCOL基因具有高度保守性。此外,在JrCOL家族中共发现39个基因复制事件,这些基因复制事件Ka/Ks值<1,表明JrCOL基因家族在核桃进化过程中主要受纯化选择的作用,与Song等[30]结果一致。
植物开花的途径有温度途径、光周期途径和赤霉素途径等。各种途径相互交织形成一个复杂的基因调控网络,从而精确的调控植物的开花时间[31]。光信号和赤霉素信号在促进植物开花过程中发挥着重要作用[32]。研究表明,拟南芥在LDs下,通过DELLA蛋白与CO的直接相互作用调控GA信号使其开花[33];核桃雌花芽分化需一定水平的ABA,且ABA的积累能使其生长和分化过程停止,并引起休眠[34];在水稻中,OsCOL9通过水杨酸和乙烯信号通路调节稻瘟病抗性[35];在SD条件下,水稻中CO同源基因Hd1通过调控FT同源基因Hd3a的表达诱导其开花,但在LD条件下抑制Hd3a的转录,从而抑制其开花[36]。核桃启动子顺式作用元件分析发现,该家族成员含有与胁迫、激素及生长发育相关的顺式作用元件,其中含有光响应和激素相关的顺式作用元件的基因最多,推测JrCOL家族基因参与调控核桃开花过程且功能复杂。
COL基因在植物叶片中发挥重要作用,且植物对光周期信号感知主要发生在叶片器官中。研究表明,CO是拟南芥晚花期突变体叶片中LDs花诱导过程中的关键调控因子[37];杨树中9个PtCOL基因均在其各组织器官中广泛表达,且在叶片中优先表达[29];在黑皮诺中COL11a和COL11b在其花芽中特异表达,而COL16b仅在叶片中表达[38];梨中PbCOL1在其叶片中显著表达[39];此外,在LDs下,植物可稳定表达CO转录因子,并激活叶维管组织中FT的转录[40-41]。在对‘新新2号’不同部位JrCOL基因相对表达量分析中发现,JrCOL1、JrCOL7a-c、JrCOL8、JrCOL23、JrCOL31a-c、JrCOL33、JrCOL35和JrCOL50a-f在‘新新2号’叶片中的表达显著高于其他部位;推测这些基因在核桃叶片发育过程中可能发挥重要功能,具体的功能还需进一步的实验验证。
通过对‘新新2号’雌花芽不同时间JrCOL家族基因的RT-qPCR分析发现,JrCOL1、JrCOL35、JrCOL50a-f和JrCOL52在‘新新2号’雌花芽中,具有一致的表达趋势且采样第7天表达量最低,这表明它们可能在‘新新2号’雌花芽分化过程中发挥着重要作用;此外,JrCOL50a-f的表达趋势与转录组趋势相一致,这表明采样第7天可能是‘新新2号’雌花芽分化的转折点。大量研究表明,CO是通过激活下游FT基因的表达从而诱导植物开花,但对于CO是如何调控核桃雌花芽分化,需要进一步研究。
4 结论
在核桃全基因组中,共鉴定55个COL家族基因。不均匀地分布在16个染色体和1个Scaffold上,且同一亚族基因的保守基序和基因结构位置相似。该家族基因在核桃不同发育时间和不同组织器官表达存在差异;该家族成员含有与胁迫、激素及生长发育相关的顺式作用元件。推测JrCOL家族基因在核桃叶片发育过程中发挥重要功能。
