水稻盐敏感突变体ss2的鉴定与基因功能分析
2022-11-05陈光李佳杜瑞英王旭
陈光 李佳 杜瑞英 王旭
(1. 广东省农业科学院农业质量标准与监测技术研究所,广州 510640;2. 农业农村部农产品质量安全检测与评价重点实验室,广州 510640;3. 广东省农产品质量安全风险评估重点实验室,广州 510640;4. 杭州师范大学生命与环境科学学院,杭州 311121)
盐胁迫严重影响作物的产量,特别是对生长在灌溉条件下或容易受到海水侵蚀的沿海低地的作物[1]。目前,全球超过20%的耕地受到土壤盐分的影响[2]。预测到2050年,由于全球气候的迅速变化,几乎一半的耕地将处于盐渍化状态[3]。在单子叶作物中,水稻对盐胁迫较敏感,土壤盐分积累带来的影响包括渗透胁迫、离子毒害和营养缺乏,最终导致生长抑制和产量降低[4]。渗透调节是水稻适应盐胁迫的一个重要机制,通过调控体内无机离子(Na+、K+、Cl-)和有机溶质(可溶性碳水化合物、氨基酸等)的积累,在高盐逆境下维持水分吸收和细胞膨压[5]。在分子水平上,调控参与不同代谢途径的基因表达来控制盐分的摄取、维持离子稳态以及细胞的生长速率[2]。
碳水化合物(主要是蔗糖),在源器官中通过光合作用产生并经维管组织在植物体内转运。作为营养物质,糖分的合成、存储和长距离转运到库器官(例如,根、花和种子),是维持植物生长和发育所必需的[6-7]。作为重要的渗透调节物质,糖分较多的积累在受胁迫的植株液泡中,产生较高的膨压。在盐胁迫下,高耐受性小麦中葡萄糖、果糖、蔗糖和果聚糖的含量远高于敏感小麦[8]。胡杨对高盐胁迫的响应是可溶性总糖在幼叶中增加,在成熟叶中减少[9]。在玉米中,接种丛枝菌根真菌的植株耐盐性显著高于未接种植株,原因在于其体内可溶性糖含量更高[10]。盐胁迫导致籼稻品种叶片、根系以及韧皮部汁液中蔗糖含量增加[11]。
尽管已有研究发现糖分代谢变化是植物对非生物胁迫响应的重要生理表征,但是糖分转运和分配与水稻耐盐性的关系研究鲜有报道,并且通过调控糖转运来影响水稻对高盐胁迫响应的关键功能基因和信号转导通路尚不清楚。本研究筛选鉴定出一个水稻盐胁迫超敏感突变体,图位克隆到基因SS2,通过表型、生理、遗传解析,明确其参与的糖分代谢与水稻耐盐性之间的相互关系和作用机制,完善水稻响应高盐胁迫的分子调控网络,进而针对性开展以抗性为目标的分子设计育种,为农业生产可持续发展创造新的耐盐稳产种质。
1 材料与方法
1.1 材料
盐敏感突变体ss2是武运粳7号经甲基磺酸乙酯(EMS)诱变和NaCl胁迫筛选后获得。以突变体ss2为母本,籼稻南京6号为父本杂交得到 F1,自交后生成的 F2分离群体用于遗传分析和基因定位。上述材料种植于广东省农业科学院农业质量标准与监测技术研究所广州大丰试验基地和中国水稻研究所海南陵水试验基地。盐胁迫筛选和处理在人工气候室进行,光照14 h(30℃),黑暗10 h(25℃),相对湿度保持在70%,每隔 2 d更换一次营养液,营养液配方详见Chen等[12]。筛选盐胁迫响应突变体和鉴定遗传互补转基因材料的耐盐性,将长势一致的10 d龄幼苗用终浓度为100 mmol/L NaCl的营养液处理4 d,分析表型和测定生理指标。为考察分蘖期ss2与野生型(WT)植株对盐胁迫响应的差异,用正常营养液培养至6周苗龄,然后转入终浓度为150 mmol/L NaCl的营养液中培养4 d,处理后检测生理参数和基因表达模式。实验重复3次,每次实验每个处理单个种质5株苗。
1.2 方法
1.2.1 Na+和K+浓度的测定 胁迫处理后收获植株,在0.1 mmol/L CaSO4溶液中漂洗5 min,地上部和根系分开,105℃烘干30 min,70℃烘干至恒重,研磨成粉末后称样,消煮冷却后用蒸馏水稀释至50 mL。用Optima 2100DV ICP发射光谱仪(PerkinElmer公司,美国)测定消化液中Na+和K+浓度。
1.2.2 叶绿素含量的测定 参照Chen等[13]的测定方法,收获植株叶片,称重并用95%(V/V)的乙醇溶液提取,使用分光光度计(Shimadzu UV2400,日本)在波长663和645 nm处记录提取液的吸光度(A)。总叶绿素含量的计算公式为8.02A663+20.21A645。
1.2.3 净光合速率(Pn)的测定 参照Chen等[13]的方法,利用Li-COR6400便携式光合仪(Li-COR,美国)测定上午9:00-11:00水稻叶片的净光合速率。
1.2.4 过氧化氢(H2O2)和丙二醛(MDA)含量测定 胁迫处理后收获植株的地上部,液氮研磨成粉末,利用H2O2和MDA试剂盒(苏州科铭生物技术有限公司)分别提取并参照Chen等[14]的方法进行测定。
1.2.5 蔗糖含量的测定 胁迫处理后收获植株的叶片和根系,液氮研磨成粉末,利用蔗糖试剂盒(苏州科铭生物技术有限公司)提取并参照Chen等[15]的方法进行测定。
1.2.6 蔗糖外运速率(SER)的测定 从源叶中收集韧皮部渗出液,叶片的切口端立即浸入20 mL 30 mmol/L EDTA溶液中(pH 7.0),黑暗中浸泡15 min。为了避免木质部渗出液的影响,弃去第一次的EDTA溶液,然后将叶片洗净,转移至10 mL 30 mmol/L EDTA溶液中,整个采集过程中,叶片置于高相对湿度的密闭暗室。4 h后,利用蔗糖试剂盒测定收集液中的蔗糖浓度。
1.2.7 实时荧光定量PCR (RT-qPCR)分别提取正常和盐胁迫条件下植株源叶的RNA。水稻UBQ5(LOC_Os01g22490)为内参基因,参照Chen等[16]的算法确定相对表达丰度,实验中使用的各种定量引物序列见表1。
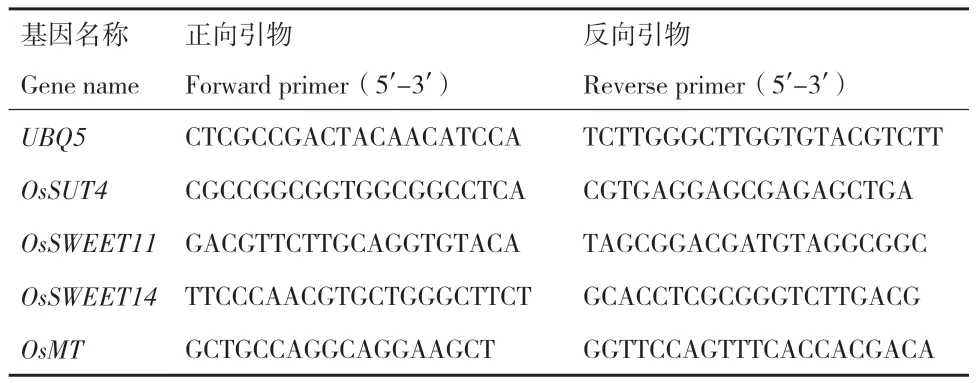
表1 荧光定量PCR所用引物Table 1 Primer sequences used for RT-qPCR assays
1.2.8 基因定位与候选基因确定 用CTAB法提取亲本及群体的DNA,用实验室已有的分布于水稻12条染色体上的SSR标记引物,通过混池法初步确定连锁位点,对初定位区间内的粳稻日本晴与籼稻9311序列进行差异分析,利用 Primer Premier 5 软件设计加密引物,进一步基因定位,相关引物序列见表2。根据GRAMENE网站(http://ensembl.gramene.org/),分析定位区间内所有的编码框(ORF),设计引物对野生型武运粳7号和ss2分别进行测序,用DNAstar软件序列比对,明确候选基因和突变位点,构建遗传图谱。
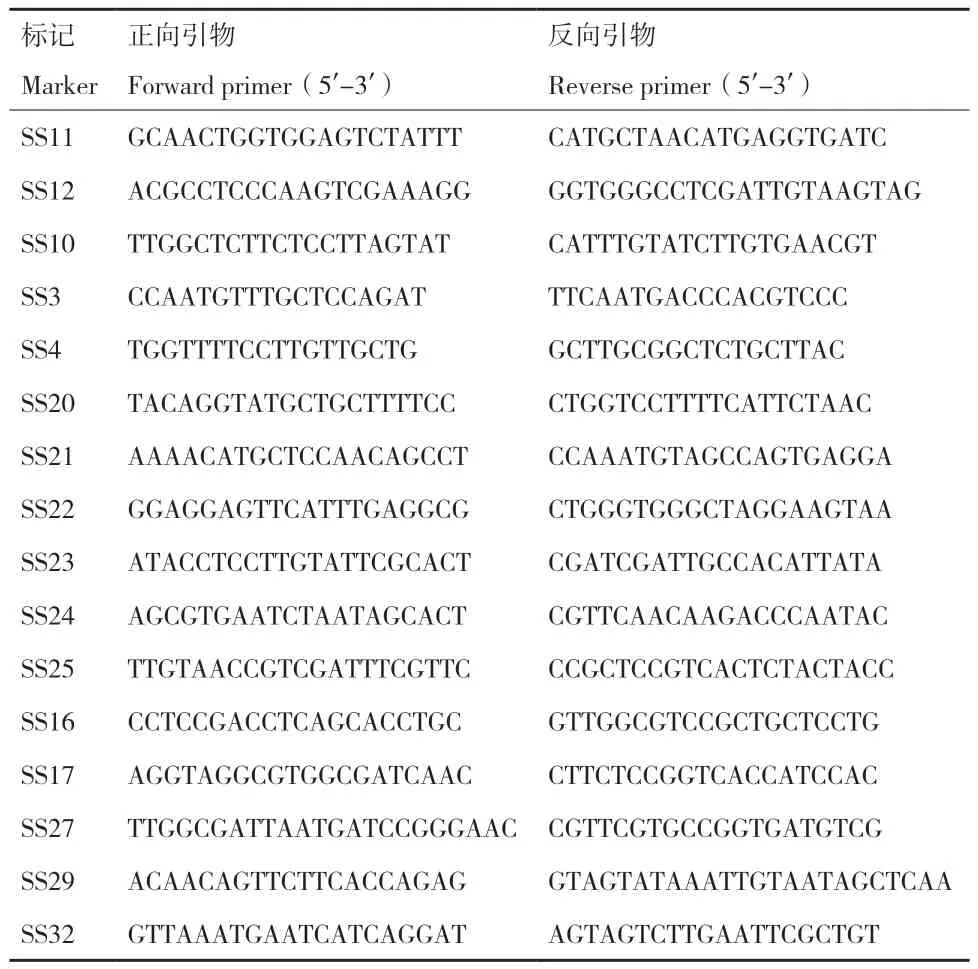
表2 基因定位所用的标记引物Table 2 Marked primer used for gene mapping
1.2.9 互补转基因材料构建 以野生型武运粳7号基因组DNA为模板,扩增包含SS2编码区及上下游序列的6 174 bp片段,纯化后用GBclonart无缝克隆试剂盒(苏州神洲基因有限公司)连接到pCAMBIA1300载体上,电击法将测序正确的质粒导入农杆菌EHA105,侵染ss2突变体的成熟胚愈伤,水稻遗传转化方法详见Chen等[17]。
1.2.10 统计学分析 用SPSS10软件的Tukey法比较分析不同样品和处理间的差异显著性,不同的字母表示在P<0.05水平下具有显著差异。
2 结果
2.1 高盐胁迫筛选获得ss2突变体
在100 mmol/L NaCl处理条件下,筛选EMS诱导的粳稻武运粳7号突变体库,鉴定出一个高盐胁迫超敏感突变材料ss2(salinity sensitive 2)。如图1-A所示,在正常培养条件下,幼苗期ss2和野生型(WT)的长势基本一致。盐胁迫对水稻苗的生长均有抑制,但抑制程度明显不同,ss2植株严重萎蔫,叶片褪绿,而WT仅表现轻微萎蔫和叶尖枯萎(图1-A)。此外,胁迫处理导致WT和ss2的地上部生长受到抑制,受盐胁迫的ss2幼苗株高和鲜重的下降幅度显著高于WT(图1-B,C)。在100 mmol/L NaCl处理下,ss2突变体的地上部鲜重只有WT的50%(图1-C)。与此同时,在正常培养环境中的ss2地上部Na+浓度和钠钾浓度比与WT无显著差异,盐胁迫下却分别高于野生型40%和45%(图1-D,E)。
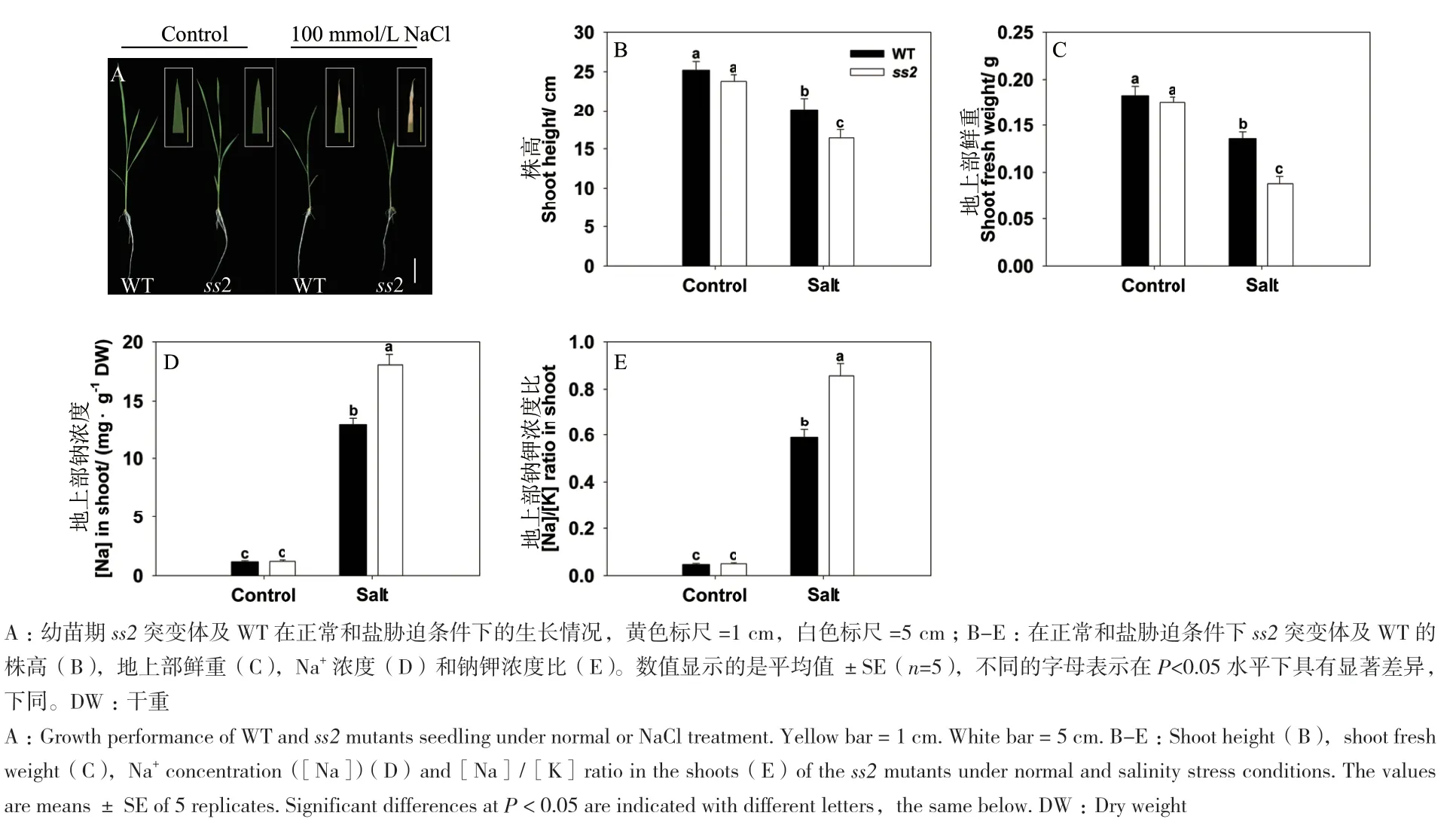
图1 正常和盐胁迫条件下SS2突变对幼苗期水稻生长的影响Fig.1 Effects of SS2 mutation on the growth performance of seedlings under normal and salinity stress
2.2 SS2突变降低分蘖期水稻对盐胁迫的耐受性
为进一步揭示SS2在水稻盐胁迫响应中的作用,将6周龄的ss2突变体和野生型(WT)在正常和含150 mmol/L NaCl的营养液中水培4 d,比较正常条件下生长的ss2和WT植株叶片,发现前者的总叶绿素含量低于后者,在NaCl处理的植株中,ss2叶绿素含量显著降低,而WT保持相对稳定(图2-A)。对非胁迫植株叶片Pn的测定也揭示了突变体与WT之间存在显著差异,在盐胁迫植株中,ss2与野生型Pn的差异被放大(图2-B)。这些结果表明,SS2突变降低分蘖期水稻植株的耐盐性。
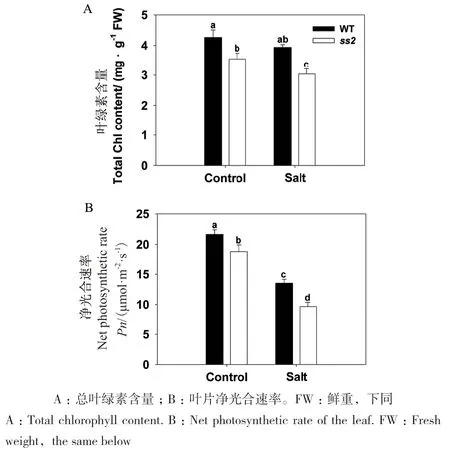
图2 分蘖期WT和ss2对盐胁迫的生理响应Fig. 2 Physiological responses of WT and ss2 to salinity stress during tillering stage
2.3 SS2突变对水稻体内糖分转运的影响
鉴于总叶绿素含量和Pn与植物体内光合同化物的生成密切相关,推测SS2通过调控糖代谢改变水稻对盐胁迫的敏感性。为了验证该假说,首先测定了源器官叶片中的蔗糖含量,发现在正常条件下,ss2的蔗糖含量比WT高15%,而在NaCl处理的植株叶片中,该值增加到24%(图3-A)。与之相反,SS2突变导致非胁迫条件下库器官根中的蔗糖含量显著降低,NaCl处理对WT根的影响相对较弱,导致受胁迫的ss2根中的蔗糖含量比WT低约16%(图3-B)。与根中蔗糖含量的趋势一致,在正常条件下,ss2植株源叶的蔗糖外运速率低于WT 23%,在盐胁迫下,该值增加到44%(图3-C),表明SS2突变显著抑制源器官中蔗糖向韧皮部的装载。

图3 盐胁迫下WT和ss2的蔗糖转运差异分析Fig. 3 Comparison of sucrose transportation between WT and ss2 in response to salinity stress
我们对WT和ss2源叶中参与糖转运的基因进行表达差异分析,在正常条件下,4个被检测的基因均下调表达(图4-A-D)。此外,盐胁迫抑制OsSUT4(Os02g0827200)、OsSWEET11(Os08g0535200)、Os-SWEET14(Os11g0508600)和 OsMT(Os04g0602400)在WT和ss2中的表达,但ss2的降幅大于WT,导致差异更加显著(图4-A-D),表明糖转运相关基因的表达量显著降低,是SS2突变抑制蔗糖从源到库转运的重要原因。
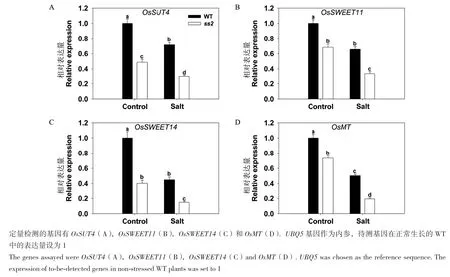
图4 SS2突变对WT和ss2源叶中糖转运相关基因表达的影响Fig.4 Effects of SS2 mutation on the expressions of genes related to sugar transport in WT and ss2 leaves
2.4 SS2基因的精细定位和互补验证
利用籼稻品种南京6号与ss2组配的F2分离群体,将目的基因初定位在第10号染色体的标记SS11和SS32之间(图5-A)。根据日本晴和9311序列差异设计InDel标记,最终将目的基因精细定位到BAC克隆OSJNBa0057L21上标记SS23和SS24之间的55 kb范围内(图5-B),在该区间内共有11个预测基因,通过测序发现ss2中 LOC_Os10g41780的第2外显子(基因编码区第259位碱基)发生了单碱基替换(C突变为T),使编码蛋白序列第87位的谷氨酰胺(Gln)突变成终止密码,从而导致翻译提前终止(图5-C)。
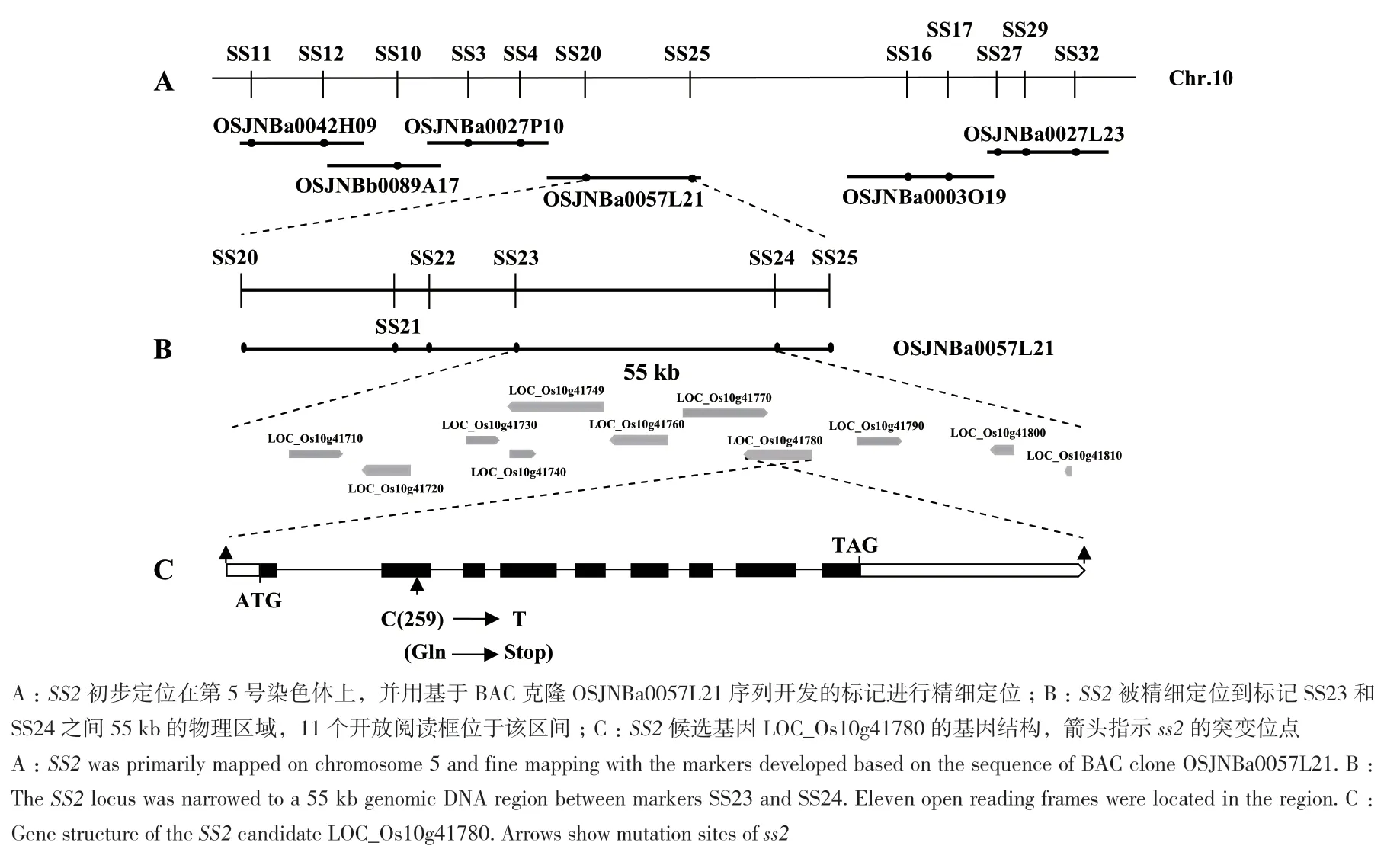
图5 SS2的图位克隆Fig.5 Map-based cloning of SS2
构建互补转基因材料(COM)用以验证ss2盐敏感性状的产生是否由候选基因的突变所引起,如图6所示,在盐胁迫条件下,转基因株系的表型、地上部和根系干重、H2O2和 MDA 含量与野生型相比均没有差异,植株的耐盐性恢复正常。
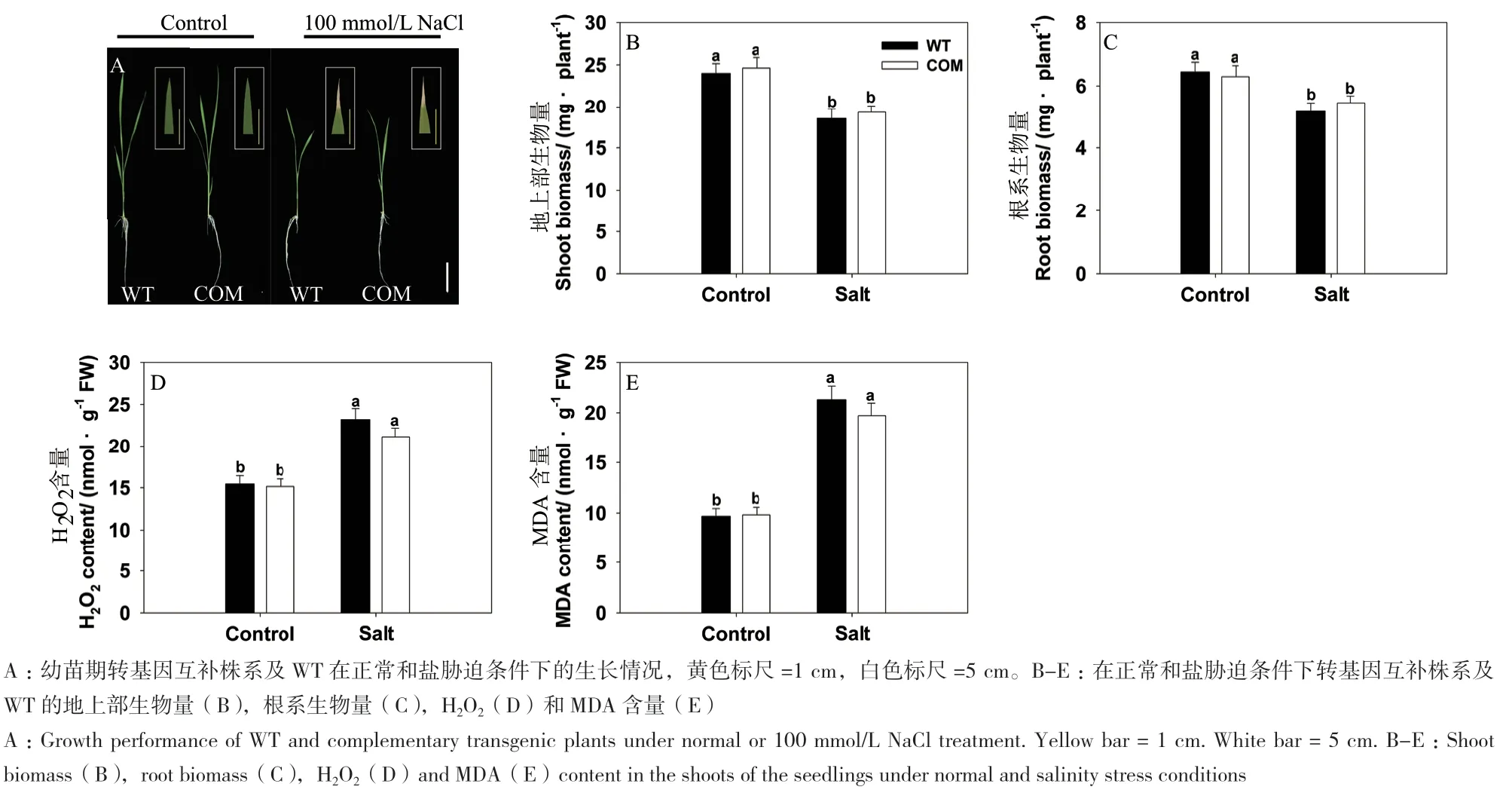
图6 盐胁迫下WT和互补转基因株系的生长差异分析Fig.6 Difference analysis in the growth performance of complementary transgenic plant compared with WT in response to salinity stress
3 讨论
通过EMS诱变、T-DNA插入等方式创制水稻突变体库,利用各种处理模拟胁迫环境对其进行筛选,获得相应敏感或抗性突变体,进而构建定位群体图位克隆到功能基因,是挖掘胁迫响应关键新基因的重要途径,研究团队已经通过该方法,成功克隆到分别参与氧化、高盐逆境响应的基因RLS1和FLN2[15-16]。本研究通过 100 mmol/L NaCl筛选 EMS诱变的武运粳7号突变体库,图位克隆到基因SS2(LOC_Os10g41780),并通过遗传互补验证其准确性,分析发现该基因与Lee等[18]报道的OsCAO1和Yang等[19]报道的PGL基因等位,前人研究发现其编码叶绿素a加氧酶,催化叶绿素b的合成,突变后叶呈淡绿色,叶绿素含量和光合速率降低,这与本研究中处于分蘖期的ss2一致但新发现SS2影响水稻的耐盐性。
随着叶绿素含量和净光合速率的下降,ss2源叶片中的蔗糖含量理论上应该低于野生型(WT),而本研究的结果却相反。我们推测这种现象与韧皮部外运速率受到限制有关,原因有以下三方面:一是,在ss2源叶片中,以每单位鲜重叶片为单位的韧皮部蔗糖外运显著减少;二是,与WT相比,ss2源叶中参与糖转运的基因表达量均显著下调;三是,ss2根系蔗糖含量明显降低。SS2突变降低水稻的耐盐性,与体内糖分转运受抑制密切相关。盐胁迫下,ss2与WT在蔗糖从源到库运输方面与正常条件相比差异更为显著,同时伴随着ss2的盐敏感表型。盐害等环境胁迫通过诱导糖的生物合成和转运基因的表达来提高糖分的积累,对增强耐盐性至关重要[20]。许多蔗糖转运蛋白基因(SUTs)参与非生物胁迫的响应[21]。在拟南芥中,AtSUC4和AtSUC9通过调节蔗糖分配和代谢参与植株的抗逆性[22-23]。在苹果中,过表达MdSUT2.2促进糖分积累,提高植株的耐盐和抗旱性[24-25]。在水稻中,OsSUT1和OsSUT2参与盐和干旱胁迫响应[26-27]。SS2突变显著抑制源叶中OsSUT4的表达,尤其在盐胁迫条件下,表明SS2可能通过调控OsSUT4介导的糖分配来影响水稻的耐盐性。此外,非生物胁迫下SWEETs转运蛋白对调控糖分的积累有重要作用[24]。DsSWEET12和DsSWEET17影响拟南芥体内的糖代谢并赋予植株多重耐逆性[28-29]。 盐 胁 迫 诱 导 OsSWEET13 和 OsSWEET15表达上调,导致韧皮部汁液中蔗糖含量升高,叶片以及根中的蔗糖分配发生改变[11]。本研究发现,OsSWEET11和OsSWEET14在受胁迫的ss2源叶中的表达量显著低于WT。鉴于SS2编码的是功能酶而非转录因子,OsSUTs和OsSWEETs等糖转运基因的表达在ss2叶片中受抑制的直接原因可能与糖稳态遭到破坏有关,这与Chen等[15]报道的osfln2敲除突变体对盐胁迫的响应相似。综上所述,SS2突变抑制盐胁迫下糖分从源叶到库根的分配,是导致ss2盐敏感的主要原因之一。
植株的活力或生长速率在一定程度上可以影响地上部的Na+浓度,从而调控水稻的耐盐性[30]。多项研究表明,盐胁迫下的生长速率可以反映不同品种的耐盐性,因为其通过稀释作用降低了离子毒害[31-32]。在本研究中,盐胁迫下苗期和分蘖期ss2地上部的生长速率均显著低于WT,可能是作为营养物质的糖分供应不足所致。因此,SS2突变通过减少蔗糖等碳水化合物的供应来抑制植株的生长,是降低ss2盐胁迫适应性的另一个原因。
SS2的等位基因PGL定位在叶绿体上[19],我们前期研究克隆的FLN2基因同样定位在叶绿体并调控水稻糖分代谢[15],两个基因之间是否有相互作用?光合同化物的生成与长距离转运之间的分子联系和反馈机制如何?过表达SS2是否可以提高水稻的耐盐性?这些问题是未来进一步研究的重点。
4 结论
NaCl筛选武运粳7号EMS突变体库,获得盐敏感突变体ss2。SS2突变抑制蔗糖从源到库的长距离运输和植株的生长,进而降低水稻的耐盐性。
