一株新的多重耐药福氏志贺菌噬菌体生物学特性及基因组分析
2022-11-05文畅刘晨卢诗韵许忠兵艾超凡廖汉鹏周顺桂
文畅 刘晨 卢诗韵 许忠兵 艾超凡 廖汉鹏 周顺桂
(福建省土壤环境健康与调控重点实验室 福建农林大学资源与环境学院,福州 350002)
抗生素在临床医学和畜禽养殖等行业中发挥重要的作用,是治疗细菌感染的有效药物。然而近些年抗生素大量滥用导致一些病原菌耐药性问题愈发严峻,严重威胁整个人类健康[1]。例如常见的福氏志贺氏菌(Shigella flexneri,S. flexneri)是一种人畜共患条件致病菌,它会引起细菌性痢疾,是志贺氏菌病的主要病因之一[2]。志贺氏菌病是世界上最重要的食源性和水源性疾病之一,志贺氏菌病患者可能会出现继发性并发症,如败血症、肺炎和溶血性尿毒症综合征[3]。虽然目前抗生素是治疗志贺菌病的有效手段,但临床出现越来越多的多重耐药志贺菌,使抗生素治疗志贺菌病受到严重威胁[4]。因此,开发治疗多重耐药S. flexneri感染的方法迫在眉睫。
噬菌体(phage)是感染细菌等原核生物的一类病毒。据估计,地球上噬菌体总量达1032个,广泛存在于养殖场、污水、土壤与海洋等自然环境[5]以及人体动物肠道中[6]。根据其生活周期不同,分为温和(溶原)噬菌体和烈性噬菌体[7];按照宿主范围不同,可分为广谱性噬菌体和特异性噬菌体[8]。由于大部分烈性噬菌体具有专一性高、裂解能力强、增殖速度快和不受细菌耐药性影响等特点,因此被视为细菌“天然杀手”[9]。早在20世纪初,噬菌体疗法就被临床应用于皮肤科、眼科、泌尿科、口腔科、耳鼻喉科和外科手术等细菌感染的治疗,然而随着抗生素发现被慢慢取代[10]。近些年随着抗生素耐药性问题加剧,噬菌体疗法又重新成为人们的研究热点。目前,国内外已逐渐将噬菌体广泛应用于人类、动物细菌性感染等疾病的治疗以及环境、食品和土壤根际等方面病原菌的清除。譬如,Law等[11]用噬菌体疗法成功治疗囊性纤维化患者耐多药铜绿假单胞菌感染;Saussereau等[12]将噬菌体疗法用于临床慢性肺部感染等治疗;Wang等[13]利用噬菌体防控土传病原青枯菌。由此可见,噬菌体疗法在耐药病原菌治疗方面有着良好的应用前景。
噬菌体疗法用于病原菌S. flexneri的感染也越来越受重视。Xu等[14]分离出潜伏期约为35 min的S.flexneri 短尾噬菌体vB_ShiP-A7,成功将小鼠肠道多重耐药S. flexneri的感染降低3-10倍;Shahin等[15]分离出一株侵染S. flexneri潜伏期为20 min的长尾烈性噬菌体vB_SflS-ISF001,可将食用鸡肉S. flexneri的感染数量降低2个数量级。虽然噬菌体疗法对动物和食品中S. flexneri感染已有初步成效,但大多S. flexneri噬菌体的宿主专一性和噬菌体抗性的出现是单一噬菌体疗法面临的重大挑战。通过使用两个或更多噬菌体的噬菌体鸡尾酒疗法,不仅可以增加宿主范围,还能降低噬菌体抗性的可能性[16]。然而,目前依然缺乏种类多样且高效稳定的多重耐药S.flexneri的噬菌体资源。
本研究从活性污泥中分离出一株多重耐药S.flexneri肌尾烈性噬菌体P003,对其形态、最佳感染复数、一步生长曲线、温度和pH稳定性等生理特性进行测定。通过全基因组测序进行生物信息学分析,从基因组水平判断其潜在功能和安全性,并明确其系统发育进化关系,为后续噬菌体疗法在多重耐药S. flexner的应用奠定理论基础。
1 材料与方法
1.1 材料
菌株及样品来源:本实验涉及的宿主菌S.flexneri B003及其噬菌体P003均由本实验室从榕北海峡环保污水处理厂的活性污泥中分离获得。用于裂解谱分析的其他15株菌株,具体为志贺菌属(Shigella)3株、埃希氏菌属(Escherichia)7株、沙雷氏菌属(Serratia)2株、肠杆菌属(Enterobacter)和克雷伯菌属(Klebsiella)各1株。其中E. coli DH5α购于生工生物工程(上海)股份有限公司,E.coli HB101由天津卫生学环境医学研究所惠赠,E.coli OP50由南京农业大学惠赠,其他菌株由本实验室保存。
培养条件:使用的培养基有LB(Luria-Bertani)液体培养基、LB固体培养基(1.5% W/V琼脂)、LB半固体培养基(0.5% W/V琼脂)。宿主菌和噬菌体均在160 r/min、37℃条件下培养。
1.2 方法
1.2.1 宿主菌分离及耐药性鉴定 用无菌接种环蘸取污泥样品稀释液,在LB固体平板上划线,过夜培养,挑单菌重复划线3次进行纯化。将菌液送至生工生物工程(上海)股份有限公司进行16S rRNA基因测序鉴定。蘸取适量菌液分别在含有不同抗生素的LB固体药板上划线,观察细菌生长情况,重复3次。抗生素选用常见的四环素(2 μg/mL)、氯霉素(16 μg/mL)、氨苄青霉素(100 μg/mL)、卡那霉素(100 μg/mL)、阿莫西林(64 μg/mL)、硫酸链霉素(30 μg/mL)、庆大霉素(10 μg/mL)、红霉素(15 μg/mL)和利福平(100 μg/mL)[17]。
1.2.2 噬菌体分离纯化及效价测定 将S. flexneri B003与污泥滤液(0.22 μm水系滤膜)混合于LB液体培养基过夜培养。取适量共培液于LB半固体培养基(约55℃)中,迅速摇匀后倒入琼脂平板上,37℃过夜培养。挑取单个形态清晰的噬菌斑与S.flexneri菌液进行增殖纯化,重复3次后即获得纯噬菌体。将共培液离心(12 000 r/min,4℃,3 min),过滤(0.22 μm),滤液梯度稀释,分别取10 μL点滴于含菌平板上过夜培养,统计最大稀释倍数下的单噬菌斑个数。噬菌体效价(PFU/mL)=噬菌斑个数×稀释倍数×100。
1.2.3 噬菌体形态学观察 取20 μL P003和S.flexneri B003的共培液滴到200目铜网上,静置5 min,用滤纸吸去多余共培液,干燥1 min。向铜网加入1滴1%的磷钨酸,室温静置10 min,置于日立 HT7700 型透射电子显微镜(transmission electron microscope,TEM)下观察P003形态。
1.2.4 噬菌体最佳感染复数及一步生长曲线测定 将S. flexneri B003培养至对数期(108CFU/mL),P003调至不同滴度(106-1010PFU/mL)。按照噬菌体感染复数(multiplicity of infection,MOI)为0.01、0.1、1、10、100的比例混合于5 mL液体LB,培养12 h,测定效价,重复3次,测得最高效价的感染复数即为最佳感染复数。在最佳感染复数条件下,S. flexneri和P003各取200 μL加入20 mL液体LB,37℃培养5 min,离心弃上清,加入适量液体LB重悬沉淀,再次离心弃上清液,重新加入20 mL液体LB,37℃振荡培养。10 min取一次样,测定噬菌体效价,重复3次。绘制噬菌体一步生长曲线,得出P003侵染宿主菌的潜伏期、裂解期和平台期。
1.2.5 噬菌体温度、pH及紫外稳定性测定 热稳定性:分别取1 mL P003于无菌离心管中,置于4、20、30、40、50、60、70和80℃恒温水浴锅孵育2 h。pH敏感性:分别取100 μL P003加入900 μL pH值为3、4、5、6、7、8、9、10的无菌液体LB,30℃水浴2 h。紫外敏感性:分别取1 mL P003均匀铺于无菌培养皿中,在距离紫外灯30 cm处静置照射0、5、10、15和20 min。通过测定P003在以上不同处理条件下的效价来反映其生物学稳定性。
1.2.6 噬菌体宿主谱测定 对包含宿主菌在内的16株菌株进行噬菌体侵染测定。取300 μL单菌菌液加入30 mL固体LB培养基(55℃),迅速摇匀,倒入培养皿,待凝固。取20 μL噬菌体悬液点滴在已凝固的含菌平板,37℃过夜培养,观察是否出现噬菌斑。每次测定重复3次。
1.2.7 噬菌体基因组测序及分析 使用λ噬菌体基因组DNA提取试剂盒(北京艾比根生物技术有限公司)提取噬菌体DNA,送至广东美格基因科技有限公司,使用Illumina HiSeq novaseq 6000平台对噬菌体基因进行测序。测序结果采用软件Soapnuke[18]进行数据质控。使用 SOAPaligner[19]、BWA[20]等软件去除宿主污染。序列通过组装软件SPAdes[21]进行拼接。使用blast软件,将获得序列与病毒数据库(NCBI)进行比对,使用BWA和samtools软件将序列与目标病毒序列进行比对,获得基因组GC含量及结构特征。采用MetaGeneMark[22]对病毒序列进行基因预测,利用预测基因的蛋白序列与UniProtKB数据库的病毒序列(ViralZone[23],reviewed proteins https://viralzone.expasy.org/)比对,获取病毒的功能注释信息。通过CGView Server绘制噬菌体基因组图谱[24];使用软件R中ggplot2和gggenes包进行基因功能注释;采用软件mauve将NCBI比对到相似度较高的噬菌体基因组共线性分析[25];使用软件MEGA 6邻接法(bootstrap设为1 000)构建噬菌体衣壳蛋白系统发育树[26]。
2 结果
2.1 宿主菌抗生素耐药性
宿主菌S. flexneri B003初步鉴定为一株潜在多重耐药病原菌,对四环素、氯霉素、氨苄青霉素、阿莫西林、硫酸链霉素、庆大霉素、红霉素和利福平8种抗生素具有耐药性(表1),表明其在环境中对人类健康存在潜在风险。
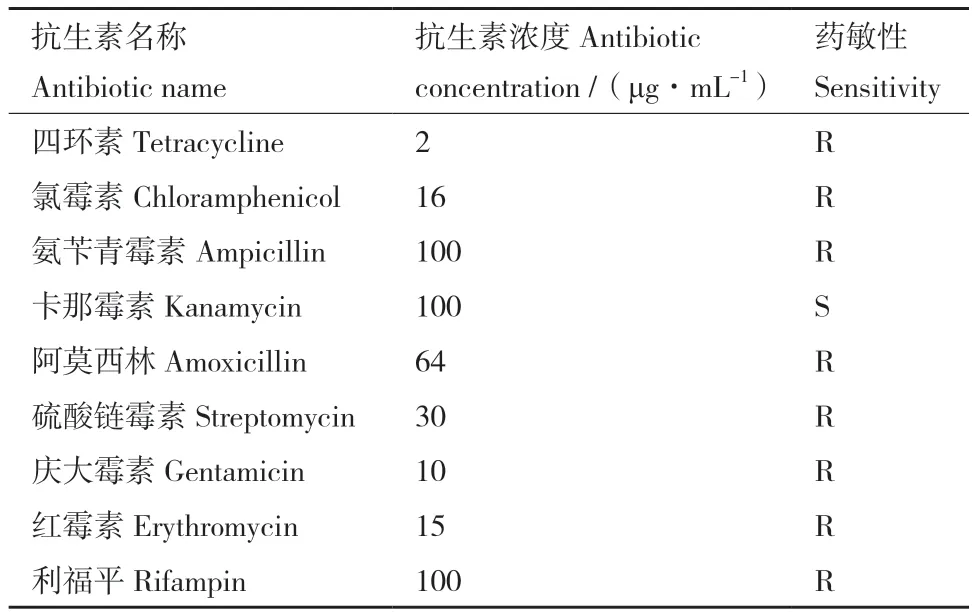
表1 宿主菌耐药性Table 1 Antibiotic sensitivity of host bacteria
2.2 噬菌体分离鉴定及形态学特征
从活性污泥中分离纯化到一株多重耐药S.flexneri噬菌体,命名为P003。经过双层平板法培养,在S. flexneri B003菌苔上出现清晰透亮且大小均匀的噬菌斑,大小1.5-2.0 mm(图1-A)。透射电镜观察,P003由典型的正二十面体头部和带收缩性尾鞘的尾部构成,头部直径80 nm±2 nm,尾部116 nm±1 nm(图1-B)。根据病毒形态学分类,初步鉴定为有尾噬菌体目(Caudovirales)、肌尾噬菌体科(Myoviridae)。
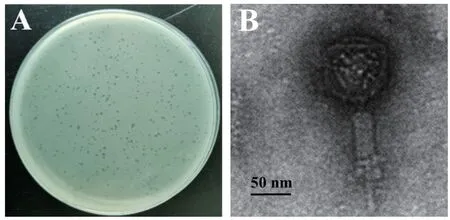
图1 噬菌体P003噬菌斑(A)及透射电镜形态(B)Fig.1 Plaque(A)and morphology by TEM(B)of phage P003
2.3 噬菌体最佳感染复数及一步生长曲线
通过测定P003在不同MOI培养下的效价分析其侵染S. flexneri B003的能力。如图2-A所示,P003的最佳MOI为10,效价可达109PFU/mL。以取样时间为横坐标,P003滴度的对数为纵坐标,绘制一步生长曲线。如图2-B所示,在0-10 min内,效价无明显变化,10-40 min内,效价急剧增加,因此P003侵染S. flexneri B003的潜伏期约为10 min,爆发期约为30 min。在侵染40 min后效价趋于稳定,P003进入裂解周期的平台期。
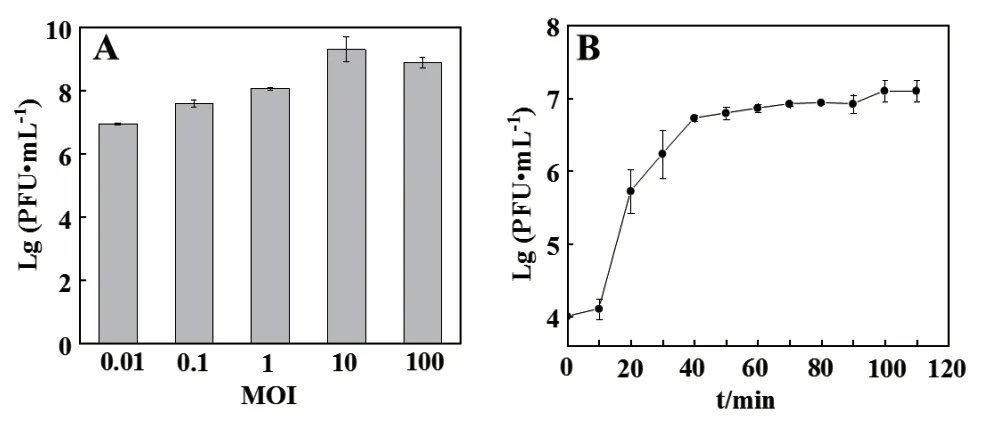
图2 噬菌体P003最佳感染复数(A)及一步生长曲线(B)Fig.2 Optimal multiplicity of infection(A)and one-step growth curve of phage P003(B)
2.4 噬菌体温度、pH及紫外稳定性
在不同条件处理后对P003进行效价测定评估其生物学稳定性。热稳定性如图3-A所示,P003在4-60℃范围内有较稳定的裂解活性,滴度约107PFU/mL。温度大于60℃时活性急剧下降,当温度达到80℃时,丧失裂解能力,表明P003对温度有一定范围的耐受性,但是高温(80℃)也能使其迅速失活。酸碱耐受性如图3-B所示,P003在pH 7时活性最高,滴度可达109PFU/mL。其效价随着酸性或碱性的增加而逐渐降低,但pH值在3-10时,P003均有一定活性,表明其对酸碱有一定范围的耐受能力,且是一株更耐酸的噬菌体。紫外耐受性如图3-C所示,随着紫外照射时间的增加,P003效价不断降低,紫外照射20 min可导致P003完全失活。
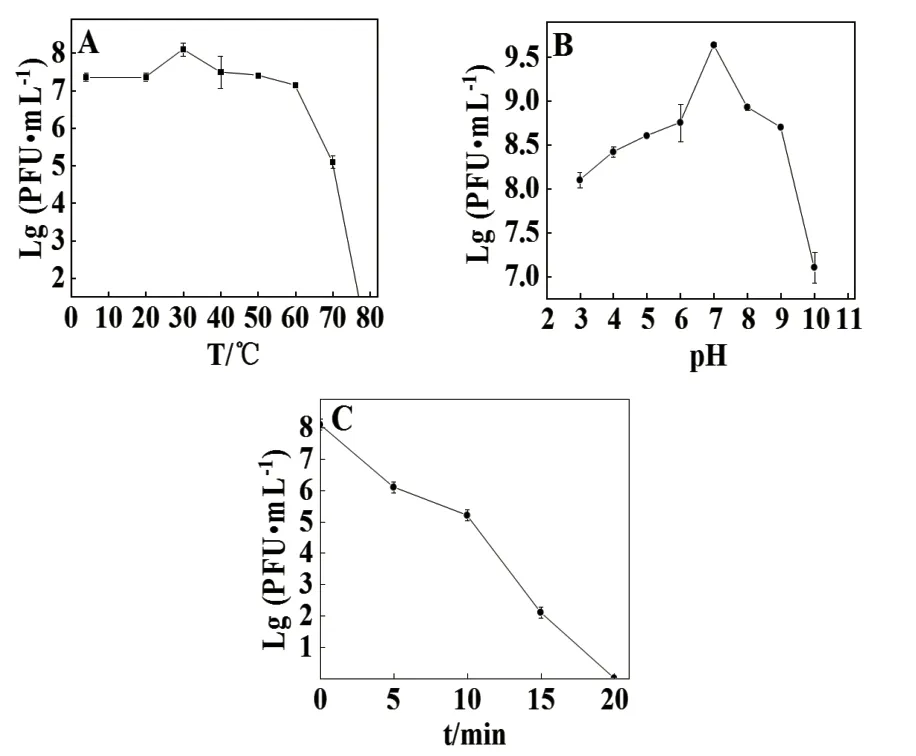
图3 噬菌体P003温度(A)、pH(B)及紫外(C)稳定性Fig. 3 Temperature (A), pH (B) and UV (C) stability of phage P003
2.5 噬菌体宿主谱
通过对16株菌株裂解谱分析,结果发现噬菌体P003仅对多重耐药S. flexneri B003有侵染裂解能力,所测试的其他福氏志贺菌、大肠杆菌和沙雷氏菌等15株菌株的平板均未出现噬菌斑(表2),表明P003是一株宿主特异性较高的噬菌体,对其他菌株无害。

表2 噬菌体P003裂解谱Table 2 Lytic range of phage P003
2.6 噬菌体全基因组分析
测序结果表明P003基因组为双链DNA,全长68 721 bp,GC含量约46.14%(图4)。使用Blast(v2.9.0+)软件将基因组序列与NCBI Refseq数据库比对,预测编码99个开放阅读框(open reading frame,ORF)。P003基因组中暂未发现已知抗生素抗性基因和毒力因子,表明了其在基因组水平上的安全性。
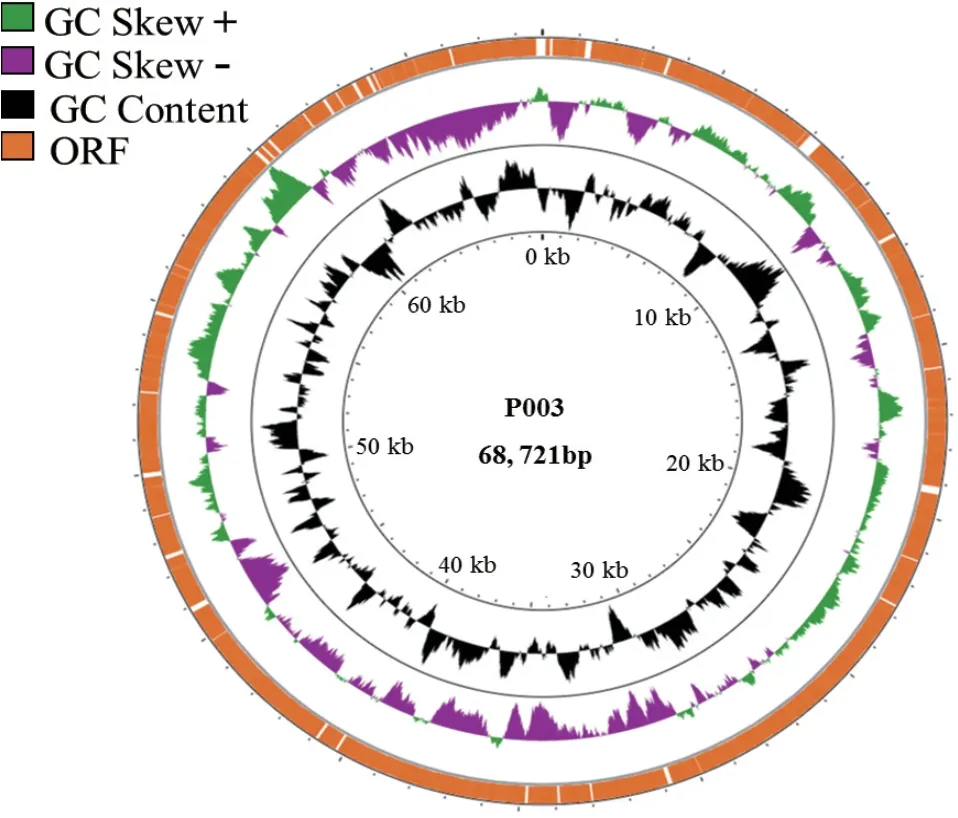
图4 噬菌体P003全基因组图谱Fig.4 Genome profile of phage P003
噬菌体P003编码的99个ORF中有13个ORF注释到已知功能基因,主要分为以下4类:DNA复制组装基因、DNA代谢功能基因、结构基因和裂解基因。其他为未表征的假定蛋白(图5)。
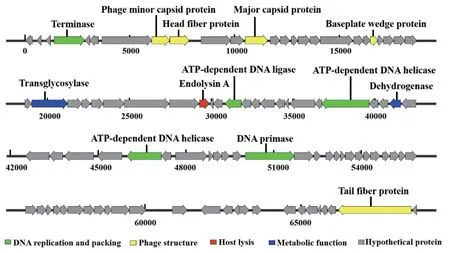
图5 噬菌体P003基因功能注释Fig. 5 Gene function annotation of phage P003
(1)噬菌体DNA复制组装基因:DNA聚合酶(ORF45)在催化合成脱氧核糖核酸中起着重要作用,参与DNA合成表达相关的还有DNA解旋酶(ORF54)、DNA连接酶(ORF37)、DNA引发酶(ORF61)、大亚基终止酶(ORF4)。
(2)噬菌体代谢功能基因:仅预测出两个已知与代谢调控相关的蛋白,分别为转糖基酶(ORF27)和脱氢还原酶(ORF48)。转糖基酶参与噬菌体DNA进入宿主细胞所必需的宿主肽聚糖消化过程,其缺失可能导致噬菌体DNA复制和宿主细胞裂解被延迟。
(3)噬菌体结构基因:分为头部蛋白和尾部蛋白。头部蛋白包括主要衣壳蛋白(ORF12)、小衣壳蛋白(ORF8)和头纤维蛋白(ORF9)。尾部蛋白包括基板楔形蛋白(ORF21)和尾纤维蛋白(ORF98),基板蛋白在噬菌体吸附中起关键作用,这是噬菌体复制周期的第一步。
(4)噬菌体裂解基因:内溶素A(ORF34)是P003基因组中唯一被注释到与裂解相关的基因。内溶素是噬菌体编码的肽聚糖水解酶,噬菌体繁殖周期结束时在宿主细胞内合成,其在裂解宿主细胞过程中起着关键作用。
将噬菌体P003全基因组与NCBI Refseq病毒数据库比对,结果发现其与5株大肠杆菌噬菌体同源性较高,覆盖率在90%以上,相似度在95%以上(表3)。选取同源性最高的3株大肠杆菌噬菌体基因组进行共线性比较,结果显示噬菌体P003局部基因与其他3株噬菌体存在差异,基因排布明显不同(图6),且不能侵染大肠杆菌,初步鉴定P003是一株新的噬菌体。
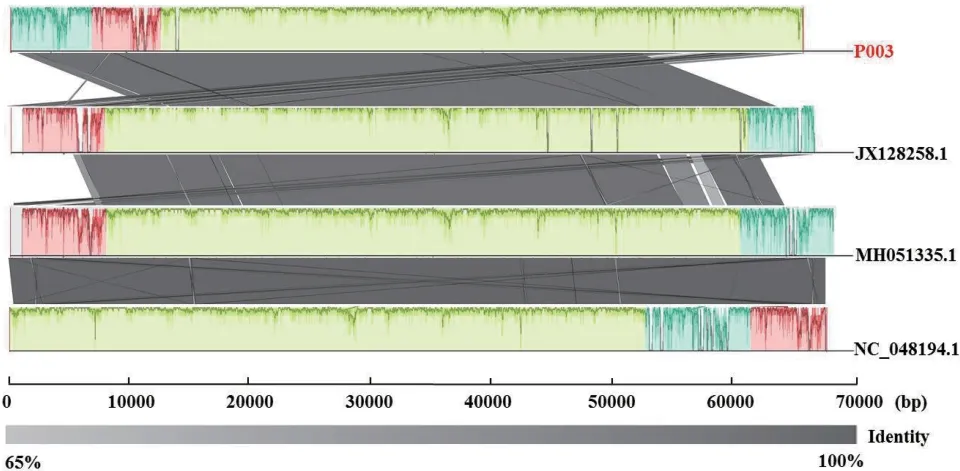
图6 噬菌体P003与3株大肠杆菌噬菌体全基因序列比对Fig. 6 Whole-gene sequence alignment of phage P003 with 3 Escherichia phages
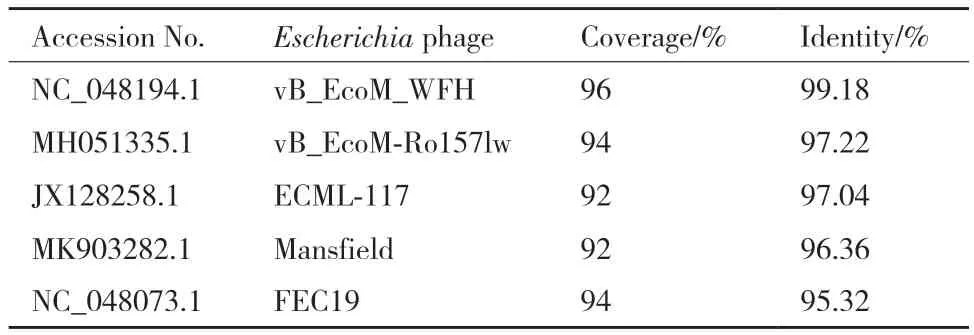
表3 噬菌体P003与数据库中病毒基因组比较分析Table 3 Comparative analysis of phage P003 with virus database based on genome
2.7 噬菌体系统发育树
为了说明噬菌体P003与其他同源噬菌体之间的系统进化关系,选取P003具有进化意义的主要衣壳蛋白序列(ORF12)和NCBI数据库比对获得的同源蛋白序列构建系统发育树(图7)。结果显示P003与大肠杆菌噬菌体ECML-117和FEC19在同一分支上,表明P003与大肠杆菌噬菌体有较高亲缘关系。

图7 基于噬菌体P003主要衣壳蛋白系统发育树Fig.7 Phylogenetic tree based on the major capsid protein of phage P003
3 讨论
近年来,抗生素大量滥用促使病原菌对抗生素产生的多重耐药性问题日益加剧,世界卫生组织已将抗生素耐药性问题列为2019年全球健康面临的十大威胁之一[27]。据估计,到2050年全球每年约有1 000万人死于抗生素耐药性引起的细菌性疾病,比癌症死亡人数多180万[28]。因此,人们正在积极探索治疗病原菌的其他方法,比如疫苗、微生态制剂、植物提取物和噬菌体等生物化学方法[29],另外还有超高温、电场和辐射杀菌等物理方法[30]。噬菌体作为地球上最丰富的微生物实体[31],大多烈性噬菌体有宿主专一性高、有较强的自我繁殖能力且对人体和动物无害等显著优势[32],成为一种理想的抗生素替代品。近年来噬菌体疗法在临床医学取得较大进展,尤其是被称为噬菌体鸡尾酒的多噬菌体疗法。譬如,Fabijan等[33]通过静脉注射作为辅助治剂的3种肌病毒科噬菌体AB-SA01治疗金黄色葡萄球菌严重感染患者,Melo等[34]研发了噬菌体混合物治疗奇异变形杆菌引起的尿路感染等,这表明噬菌体鸡尾酒疗法具有良好的安全性和令人满意的疗效。
志贺菌是人畜常见易感病原菌之一,其主要通过水源、食源和排泄物等途径感染,据报道世界上每年引起16万人死亡[35]。目前越来越多的福氏志贺菌进化出多重抗生素耐药性,这使抗生素疗法面临重大挑战。虽然噬菌体作为一种专性治疗病原菌的有效途径,但是目前仍然缺乏能高效裂解多重耐药病原菌S. flexneri的噬菌体资源,因此,不断加强噬菌体分离培养是噬菌体疗法应用的必要前提。
噬菌体分离培养需具备丰富噬菌体来源的样品以及高效富集分离的方法。温度、pH和紫外等理化条件不仅能限制细菌生存,也可通过影响噬菌体蛋白结构来决定其活性[28]。本研究从活性污泥中分离获得一株多重耐药S. flexneri噬菌体P003,在温度4-70℃、pH 4.0-10依然保持活性,高温80℃和紫外照射20 min可使其完全失活。一步生长曲线表明,P003侵染S. flexneri的潜伏期仅为10 min,相比何秀等[36]研究从养鸡场中分离出潜伏期为75 min的S. flexneri噬菌体ΦDS8,P003有更快裂解S. flexneri的优势。通过生物信息学对P003进行全基因组比对和系统发育树分析,均显示其与大肠杆菌噬菌体有较高的亲缘关系,可能由于P003宿主S. flexneri在系统发育上与大肠杆菌高度相似[15]。噬菌体P003基因排布与大肠杆菌噬菌体存在明显差异,且宿主谱测定结果显示,P003有较高的宿主特异性并不能侵染大肠杆菌,其形态与处于进化树同一分支的大肠杆菌ECML-117依然存在差异[37]。综上,P003被鉴定是一株新的烈性噬菌体,且对温度和酸碱度有较宽耐受范围。
随着噬菌体被广泛应用和研究,噬菌体的局限性和安全性也值得人们密切关注。如现在已知可培养的噬菌体较少,且专性噬菌体裂解谱过窄,只能针对某种病原菌的感染[38]。同时也应该注意,只有基因背景清晰、裂解作用强的噬菌体才能用于噬菌体疗法,溶原噬菌体可能携带抗性基因和其他毒力基因,通过转导作用加速耐药性在其他微生物间的水平传播[39]。本研究分离的P003是一株能快速侵染宿主菌且有较强裂解能力的烈性噬菌体,其基因组暂未检测到已知耐药基因和毒力因子,初步确保了基因组水平上的安全可靠性,本研究为将来利用噬菌体疗法防治多重耐药病原菌S. flexneri感染提供了新的菌种资源。
4 结论
本研究分离并鉴定了一株新的专性裂解多重耐药病原菌S. flexneri的噬菌体P003。噬菌体P003对温度和酸碱度有较宽的耐受范围,侵染迅速,裂解能力较强,基因组未发现抗生素抗性基因和毒力因子。
