非抗生素类活性物质抗幽门螺杆菌研究进展
2022-11-05刘晓黎童真艺赵亮尹丽刘晨光
刘晓黎 童真艺 赵亮 尹丽 刘晨光
(中国海洋大学海洋生命学院,青岛 266000)
幽门螺杆菌(Helicobacter pylori)是一种革兰氏阴性细菌,主要寄生在人胃(特别是幽门区域)黏膜表面,偶尔也能在肠道中检出。全球50%-70%人口是H. pylori的感染者或携带者,感染率前三的地区为中亚、非洲和南美洲,分别高达79.5%、79.1%和69.4%。在我国,H. pylori的流行率约为50%-55%[1]。
H. pylori定殖于胃黏膜下的胃上皮细胞表面及内部[2],定殖后会通过分泌毒素因子、分解尿素产生氨等途径杀伤胃部细胞获取营养并保护自身免受胃酸伤害,继而引起消化性溃疡、慢性胃炎甚至胃部恶性肿瘤等疾病,于1994年被世界卫生组织列为一类致癌物。H. pylori感染还与许多胃外疾病密切相关,如缺铁性贫血、免疫性血小板减少性紫癜和高血压等[3]。2015年发布的京都共识报告正式将H.pylori感染定义为一种传染性疾病[4],建议除特殊情况外的所有感染者接受根除治疗。
过去临床上主要通过由抗生素(阿莫西林、克拉霉素与甲硝唑中的两种)及质子泵抑制剂(proton pump inhibitor,PPI)组成的标准三联疗法根除H.pylori感染[5]。由于滥用抗生素,H. pylori对除阿莫西林外所有抗生素的耐药性均不断上升。我国H.pylori临床菌株对克拉霉素、甲硝唑与左氧氟沙星的耐药率分别为20%-50%、40%-70%及20%-50%,且多为多重耐药株[6],因此目前我国推荐临床使用由果胶铋、PPI、阿莫西林搭配呋喃唑酮构成的四联疗法作为临床一线治疗方案。
1 口服抗生素治疗的局限性
现行疗法的主要问题是根除率持续下降,根除不彻底会导致感染复发加重病人痛苦。而造成根除不彻底的主要原因包括以下3点:(1)胃部恶劣环境影响抗生素渗透;(2)H. pylori不断获得耐药性;(3)生物膜对内部细菌具有屏障作用。
如图1所示,口服抗生素进入胃部后会受到酶、酸环境的破坏并随胃的周期性排空进入肠道,仅少量抗生素能够滞留胃部并及时渗透进入胃黏液层。其中亲水性抗生素如阿莫西林难以渗透疏水的胃黏液层和H. pylori表面,因此无法进入细胞内部发挥杀菌作用[7];疏水性抗生素如克拉霉素可以克服这些障碍渗透到细菌胞内,但在胃环境溶解度低,同样难以在菌体内累积到治疗所需浓度。与此同时,治疗H. pylori感染的特效抗生素抗菌机制大多较为单一,细菌容易通过基因突变获得耐药性[8]:如特效药克拉霉素是一种大环内酯类抗生素,仅能通过与细菌23sRNA结合干扰蛋白质合成进而抑制细菌增殖。细菌通过基因突变改变自身23sRNA结构使克拉霉素失去结合位点后,就产生了对抗生素的耐药性,进而免疫该抗生素的杀伤。除基因突变外,H.pylori还通过合成外排泵蛋白、β-内酰胺酶及改变自身膜通透性等途径对甲硝唑、阿莫西林和左氧氟沙星等抗生素产生耐药性[8]。
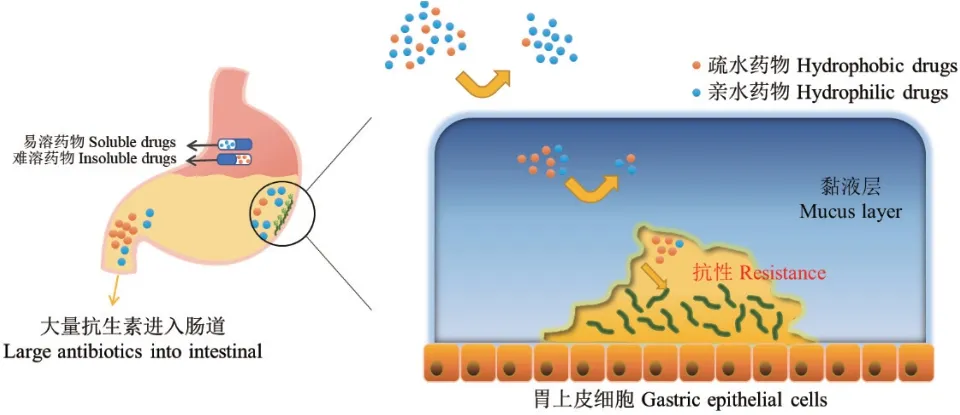
图1 抗菌药物在胃部的渗透Fig. 1 Penetration of antibacterial drugs in human stomach
此外H. pylori在生长过程中受营养匮乏、抗菌药物等生存压力影响,会聚团并嵌入自身分泌的胞外聚合物(extracellular polymeric substances,EPS)中形成生物膜[9]。与游离细菌相比,生物膜内细菌的耐药性要高10-1 000倍[10],这是由于生物膜内部高度疏水并大量带负电,仅存在少量水通道用于交换营养物质与代谢废物[11],限制药物累积的同时还会促使内部细菌转入休眠状态,从而逃避增殖抑制类抗生素的杀伤。药物治疗过后,膜内残余细菌还可从膜中脱离重新生长,造成感染复发。
最后,由于药物利用率低,现行临床疗法往往需要患者长期大量服用多种抗生素,这些抗生素在胃部被少量吸收后大量进入患者肠道杀伤正常菌群,导致患者出现恶心、呕吐、头晕、皮疹和腹泻等不良反应[12],有时甚至会诱发艰难梭菌感染等并发症[13],加重病人痛苦的同时导致患者依从性差、不按要求服药,反过来影响药物的累积导致治疗失败,形成恶性循环,给患者带来身体及经济的双重负担。
2 非抗生素类抗菌活性物质的研究进展
上述问题中,临床菌株产生耐药性是目前临床治疗所面临的最严峻的挑战,因为这直接导致现行治疗方案无效。过去解决细菌耐药性的主要手段是改进原有抗生素或发掘新抗生素,但取得的成果远无法满足临床的需求,且新抗生素同样面临细菌产生耐药性的问题。在此过程中,一些研究人员开始关注非抗生素来源的抗菌活性物质。
非抗生素类抗菌活性物质根据来源可分为天然物质与合成物质。天然物质主要包括植物天然物质、糖脂、脂肪酸和抗菌肽,这些小分子在抑制H. pylori生长的同时能够调节患处炎症反应并阻止正常细胞凋亡,因此有望取代现行疗法中的抗生素;合成物质是指针对H. pylori脲酶设计合成的一些抑制剂,能干扰H. pylori的尿素代谢,进而提高其酸敏感性并抑制其生长。此外,近年来的一些临床研究表明,益生菌作为补充治疗可提高H. pylori根除率、促进溃疡愈合并降低病人的不良反应。本文综述了以上物质在抗H. pylori方面取得的进展,以期为针对性开发新药物提供参考。
2.1 植物天然物质
从古至今,草药一直是人类抗击病原微生物的重要武器,这是由于草药中含有丰富的天然活性物质。Baker[14]指出具有抗H. pylori活性的植物天然物质主要是一些有机硫、生物碱、有机酸、萜类和类黄酮等,它们多属于疏水性药物因此具有良好的黏膜穿透性和生物膜渗透性。不同种类药物抑制H.pylori的机制区别很大,例如属于有机硫的大蒜素可损伤H. pylori细胞壁导致细胞裂解[15-16];以小檗碱及其所属的原小檗碱家族为代表的生物碱可降低感染部位炎症反应[17]、抑制 H. pylori生物膜形成[18]、抑制幽门螺杆菌脲酶活性[19]并促进溃疡处黏膜愈合[20];二氢丹参酮、橙皮苷及杨梅素等类黄酮则分别具有破坏生物膜[21]、抑制细菌毒力因子表达[22]和抑制细菌形态转变[23]等活性(表1)。此外,耐药性诱导实验还证明,这些药物诱导细菌耐药性产生的速度远低于单靶点抗生素。以上优点使得植物天然产物有望开发成抗生素的替代或辅助药物。
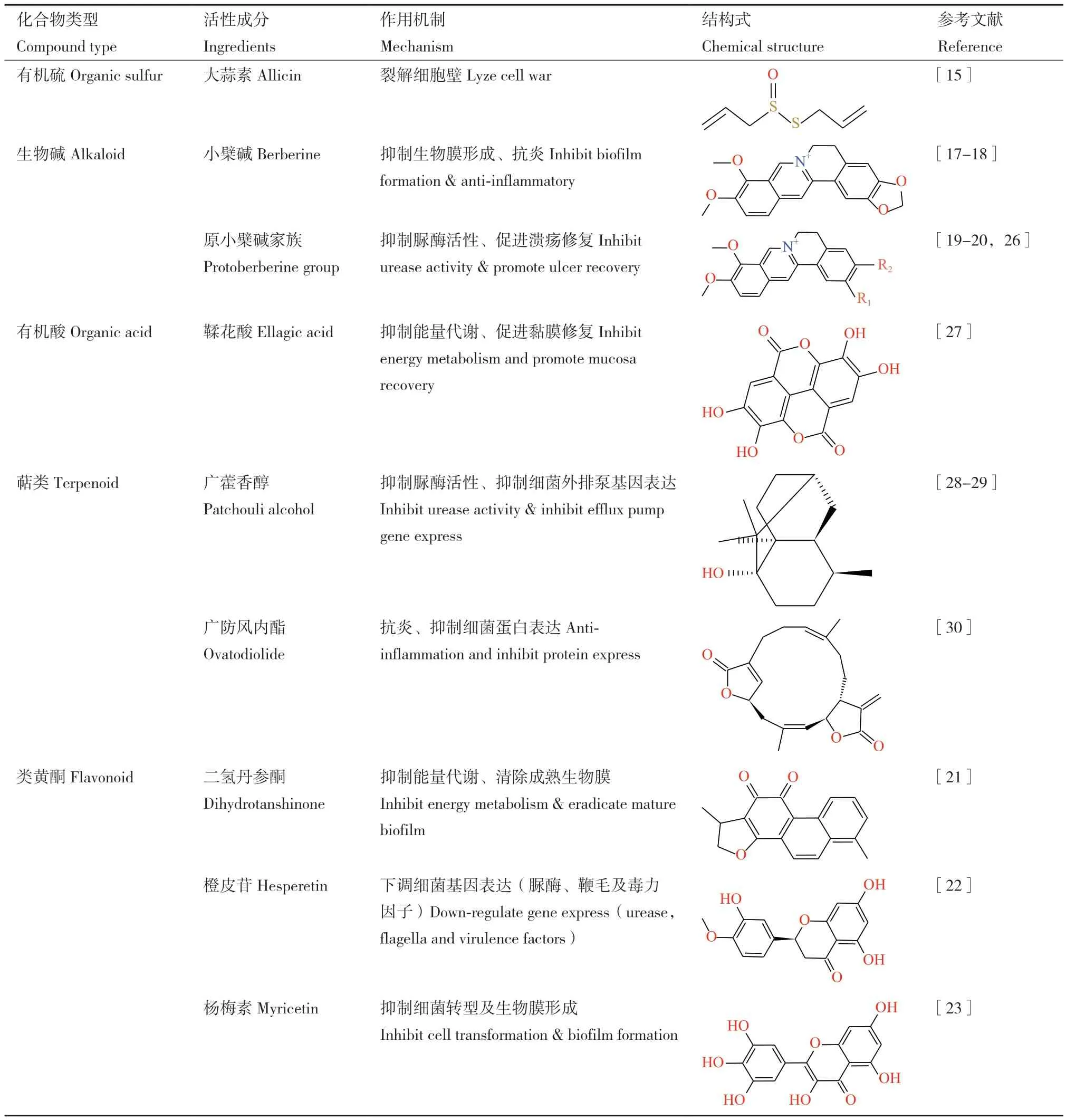
表1 抗幽门螺杆菌植物天然产物及其抑菌机制Table 1 Anti-H. pylori products from nature plants and their antibacterial mechanism
这些化合物中研究较早的如大蒜素[24]和小檗碱[25]分别是大蒜和黄连中含量最高的活性物质,分离提取工艺简单、成本较低,已实现工业化生产并在临床治疗中表现出优异的活性,作为三联疗法的补充治疗可有效提高H. pylori根除率和胃溃疡的治愈率;其他生物碱、萜类和类黄酮等则研究进度不一,有的已经完成了动物实验,有的还停留在体外实验阶段。这些物质研究起步较晚主要有两个原因:一方面,多数植物活性物质如黄连碱[19]、表小檗碱[26]等其他原小檗碱家族生物碱等不是来源草药中的主要成分,含量低且分离困难,纯品价格昂贵因此难以对其进行大规模研究;广藿香醇等虽然是草药中的主要成分,但其来源广藿香过去不是治疗胃部疾病的主要药物,近年来随研究规模扩大才被发现具有抗H. pylori活性。但可以预想的是,随科研技术发展与研究投入加大,这些活性物质也将陆续被开发为有效的抗H. pylori药物并作为补充治疗甚至是替代治疗应用于临床。
2.2 糖脂
糖脂是糖基与脂肪酸链通过酯键连接而成的两亲性化合物,是一种生物表面活性剂,具有优良的抗炎、抗氧化、抗凋亡、抗菌及抗生物膜活性。研究表明糖脂主要通过表面活性插入细胞质膜和生物膜中,改变其内部疏水作用力导致膜结构瓦解,最终诱导细胞凋亡或分散细菌生物膜[31]。但革兰氏阴性细菌对糖脂的抗性显著高于革兰氏阳性细菌,这是由于革兰氏阴性细菌具有复杂的细胞外膜,能够保护其细胞质膜免受破坏。
H. pylori属于革兰氏阴性细菌,因为过去默认糖脂不太可能具有抗H. pylori活性,这导致很长的一段时间内没有关于糖脂抑制H. pylori的研究。然而最近的一项研究中,Shen等[32]在研究鼠李糖脂及其他表面活性剂对H. pylori等病原微生物的生物膜的分散作用时意外发现,鼠李糖脂能够抑制H.pylori生长,但对同样属于革兰氏阴性细菌的大肠杆菌和铜绿假单胞杆菌则完全无抑制作用。Chen等[33]进一步探究了鼠李糖脂在对抗H. pylori时与三联疗法中药物的相互作用,发现鼠李糖脂与这些药物表现出了较强的相加作用,同时还能增强生物膜内细菌对这些药物的敏感性,说明鼠李糖脂是一种良好的药物佐剂,适合作为抗生素治疗的补充治疗。此外,该课题组后续研究发现,使用鼠李糖脂作为表面活性剂构建的纳米载体具有更高的药物搭载量、黏膜穿透能力,并在动物实验中表现出优异的抗H. pylori活性和生物膜清除能力,可有效清除胃黏液层下的H.pylori生物膜[18,34]。尽管上述研究没有解释为何同属革兰氏阴性细菌的H. pylori与大肠杆菌和铜绿假单胞杆菌对糖脂的敏感性存在差异,但其结果暗示糖脂类表面活性剂具有抗H. pylori的潜力,因此糖脂可能在未来开发抗H. pylori的纳米药物替代疗法中扮演重要角色。
2.3 多不饱和脂肪酸
多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)包括亚麻酸、亚油酸和花生四烯酸等含两个以上双键的脂肪酸,具有广谱的抗菌作用,是人类先天免疫系统中不可或缺的成分[35]。流行病学家和临床工作人员很早就发现富含PUFA的饮食可以预防胃部疾病的发生,而多种胃部疾病又与H. pylori感染密切相关,因此陆续有人研究PUFA对H. pylori的 抑 制 作 用。Khulusi等[36]、Petschow 等[37]与Bergsson等[38]先后证明了多种中、长链PUFA可在体外抑制H. pylori生长,指出PUFA的抑菌机制与糖脂类似,即通过破坏H. pylori的细胞膜,导致细胞裂解、内容物外流而诱导细胞凋亡。Correia等[39]的研究还发现,PUFA在H. pylori细胞感染模型中能够通过抗氧化活性清除氧自由基,从而下调胃部细胞的炎症因子表达。
然而脂肪酸链较长且不饱和度较高的PUFA存在黏膜穿透性差、氧化稳定性差和水溶解度低等缺点,这限制了其在体内的进一步应用。通过物理混合或共价接枝的方法将PUFA整合进纳米颗粒可有效克服这些缺点,如Obonyo等[40]将其中一种PUFA——亚麻酸制备为脂质体纳米粒,提高了其水溶解度,研究表明脂质体能够通过膜融合直接将脂肪酸递送到细菌细胞膜内,因此杀菌更迅速并能够彻底根除H. pylori在不利环境下转化成的球状休眠体。该脂质体在动物模型中表现出良好的胃滞留性与黏膜穿透性,能够有效根除黏液层下的H. pylori并降低胃部细胞的炎症因子表达量[41];将PUFA共价接枝到具有黏膜黏附和穿透性的聚合物纳米粒[42]或金属纳米粒[43]上,同样可将PUFA以共递送的形式递送到感染部位发挥杀菌效果。以上结果表明,PUFA更适合作为一种活性材料用于制备抗H. pylori的纳米药物。
2.4 抗菌肽
抗菌肽是由生物体或其某些细胞分泌的一种小于50个氨基酸长度的多肽,多带正电荷,是生物体先天免疫系统的重要组成部分,除抗菌活性外往往还具有抗炎、抗凋亡活性,其杀菌活性与抗生素水平相当但不易诱导耐药性的产生[44],因此抗菌肽是一种非常适合替代抗生素的药物。Pero等[45]和Neshani等[46]先后综述了抗菌肽在抗H. pylori方面的研究现状,指出具有抗H. pylori活性的抗菌肽多属于抗菌膜类多肽,如人体自身分泌产生的β-防御素(β-defensin),以及外源的罗非鱼鱼毒毒素(tilapia piscidins)等,主要通过自身正电荷亲和H. pylori细胞外膜中负电荷的磷酸,插入细胞外膜后折叠形成α-螺旋结构,然后自组装形成通道造成细胞外膜穿孔,进而引起细胞凋亡。
多种抗菌肽在体外实验中表现出很好的抗H.pylori活性,但在体内应用环节中则面临较大的挑战。首先,抗菌肽属于多肽/蛋白类药物,在极端pH和蛋白酶环境下不稳定[47],因此胃酸和胃蛋白酶严重限制了其应用于体内。其次,部分抗菌肽属于毒力因子因此有溶血性和毒性[48]。最近的一些研究尝试通过改造抗菌肽来克服这些缺点,如Olleik等[49]通过替换氨基酸的方式改造了一种细胞毒性低但抗菌活性较高的抗菌肽Termporin-SHa,在保留低细胞毒性的前提下提高了该抗菌肽的蛋白酶抗性及抗H.pylori活性,但其安全性和有效性还有待通过动物与临床实验进一步验证。
2.5 脲酶抑制剂
在H. pylori寄生到宿主胃黏膜下的生命过程中,尿素扮演着至关重要的角色。H. pylori分解尿素产生的氨不仅降低了胃酸对其的杀伤力,更会对胃上皮细胞产生伤害并诱导溃疡发生[50]。还有研究表明氨与质子形成的铵离子对H. pylori合成ATP至关重要[51],抑制尿素代谢可有效抑制H. pylori生长并降低其对人体毒害作用。H. pylori主要依赖自身细胞内的脲酶分解尿素,脲酶抑制剂能抑制相关代谢反应,适合替代现行疗法中所使用的质子泵抑制剂或作为辅助治疗应用于根除治疗。
过去的研究者从尿素的结构类似物中发现了多种脲酶抑制剂,如硫脲[52]、异羟肟酸[53]和磷酸酰胺[54]等,但这些药物存在酸不稳定性、致畸毒性和容易诱导耐药性等缺点,导致这些小分子难以应用于临床。植物中分离出的类黄酮、萜类等活性物质能够抑制H. pylori脲酶,与尿素类似物相比,这些天然产物具有更高的生物相容性与安全性,但对脲酶的特异性不高因此活性较差。基于这一情况,一些化学家开始尝试以植物活性物质为底物,通过半合成的方式开发同时具有高安全性和高活性的脲酶抑制剂,如Yang等[55]合成了一系列紫草醌类似物,它们能有效抑制H. pylori脲酶,在抑菌浓度下无细胞毒性,同时其抗H. pylori活性强于作为对照的抗生素甲硝唑;另一部分研究者则尝试改造尿素类似物,使其保留高脲酶抑制活性的同时变得更加安全,如Li等[56]以硫脲为底物合成了一系列同系物并成功从中筛选出一株安全且亲和力高的单体。尽管这些药物在体外实验阶段表现优异(表2),考虑到H. pylori感染的复杂性,将这些实验成果转化为临床药物还有大量工作需要开展。
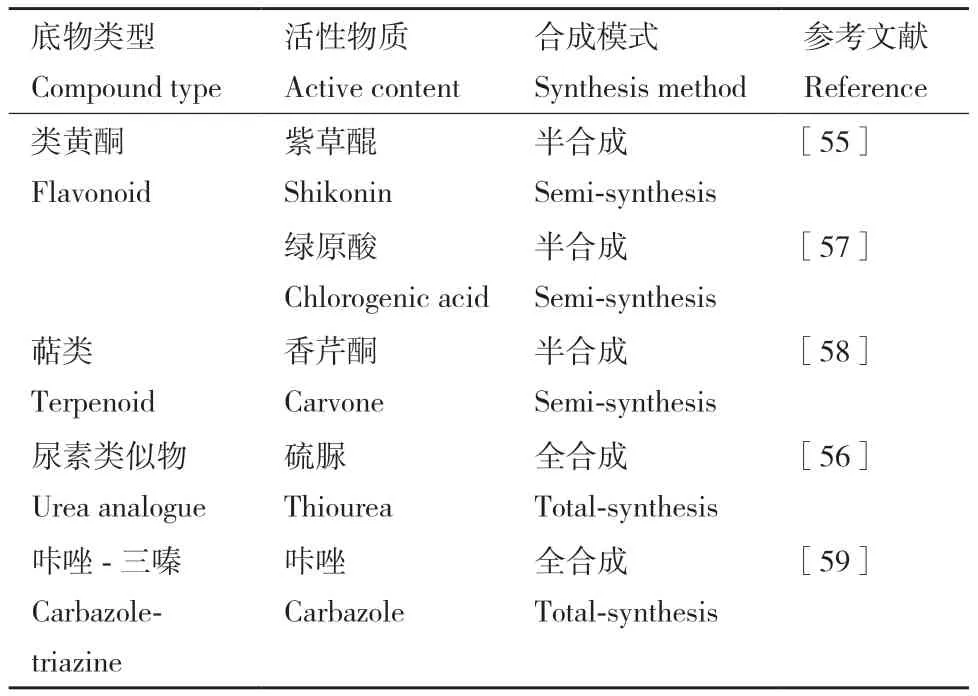
表2 新开发的脲酶抑制剂Table 2 Novel discovered urease inhibitors
2.6 益生菌及其代谢产物
益生菌是指本身属于人体正常菌群,能够调节相关消化道组织及免疫系统功能或影响该位置菌群组成,进而对人体健康产生有益作用的一类微生物[60]。一些临床研究发现,在H. pylori根除治疗过程中,为患者补充益生菌制剂可有效提高根除率并降低不良反应发生的几率[61]。进一步的研究还表明益生菌对受损黏膜的重构起到积极作用[62],回补益生菌后的肠道菌群还具有更强的毒物代谢能力和营养消化能力[63],因此益生菌制剂很适合用于治疗儿童和孕妇等低抵抗力患者[64]。
益生菌抑制H. pylori的机制较为复杂,但总体来讲包括竞争性抑制黏附[65]、分泌拮抗因子拮抗细菌毒素和炎症因子[66],以及分泌细菌素直接杀伤H.pylori[67-68]等(图 2)。
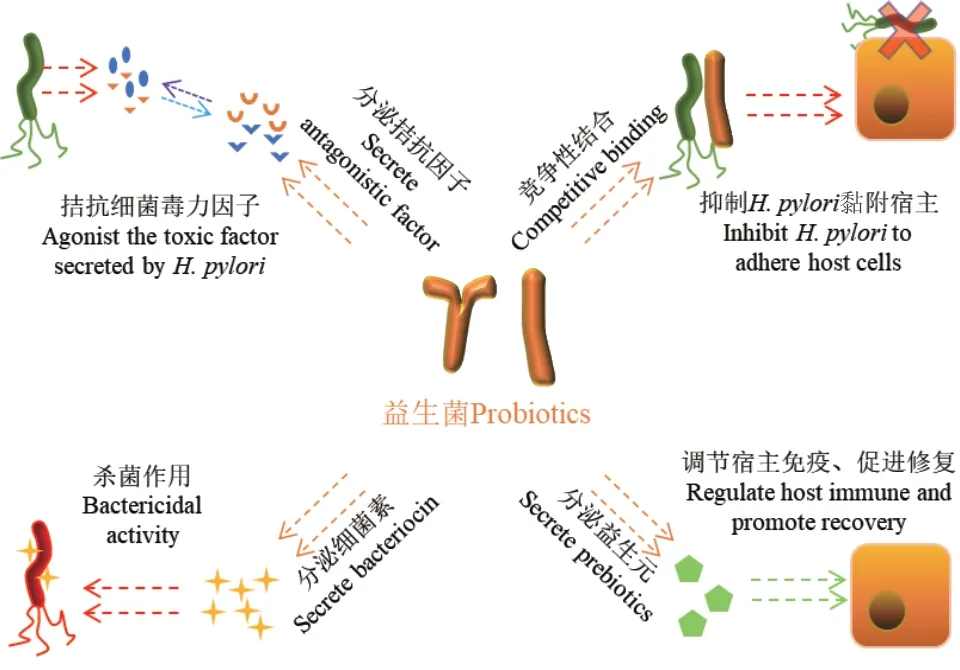
图2 益生菌对幽门螺杆菌的抑制作用Fig. 2 Mechanism of probiotics inhibiting H. pylori
但是将益生菌作为补充治疗并不总是有效的[69],因此最新的一些研究开始从分子层面深入挖掘益生菌抑制H. pylori的机制(表3),例如研究者发现益生菌分泌的胞外多糖可能是抑制H. pylori黏附和拮抗炎症因子的主要活性物质[70-71]。对于乳酸菌属的益生菌而言,研究表明其抗H. pylori活性与其产酸能力成正比[72]。此外,分子层面的研究还揭露了一种全新的抗菌机制:益生菌可以通过调节机体代谢(如降低血液中胆固醇水平,其对H. pylori的生长极为重要)的方式抑制细菌的生长并调节炎症反应[73]。这些研究将为未来更高效、更有针对性地选择治疗用菌株提供理论支撑。
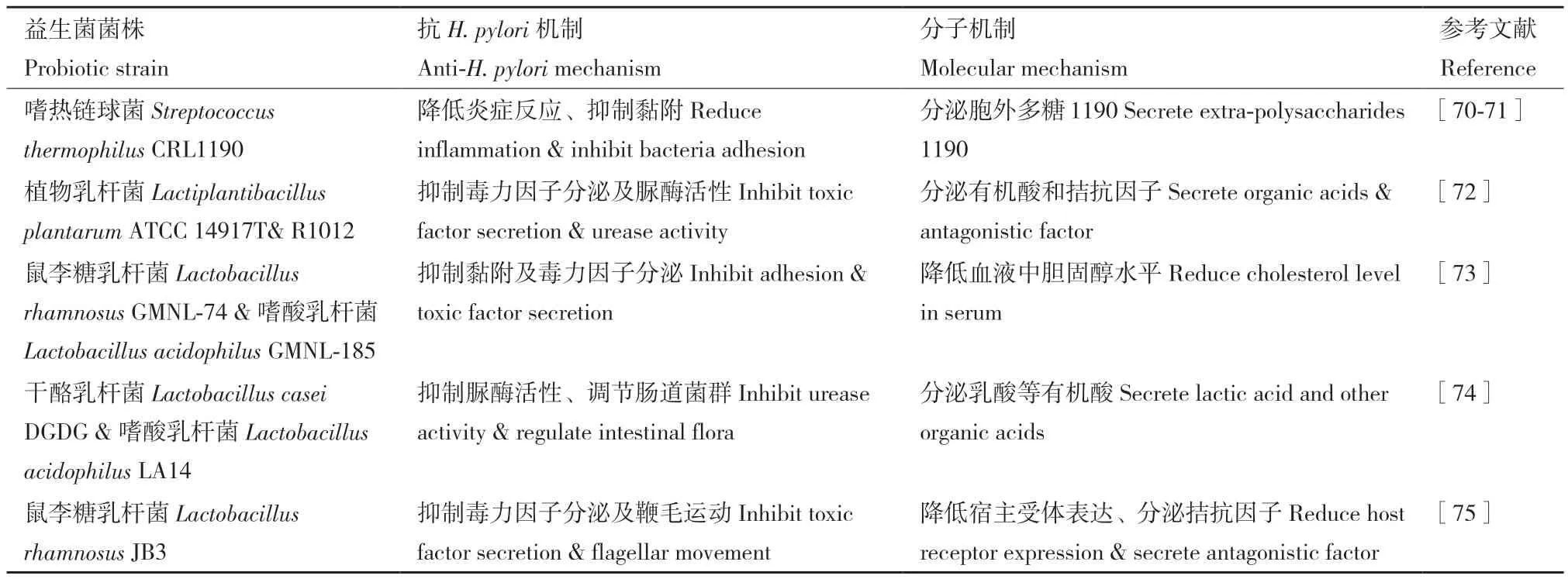
表3 不同益生菌对幽门螺杆菌的抑制作用及其机制Table 3 Inhibitory activity and mechanisms of probiotics against H. pylori
3 总结与展望
与抗生素相比,非抗生素类活性物质更难产生耐药性,具有广谱、多靶点抗菌、能够改善炎症反应和促进黏膜修复等优点,因此有望成为临床上取代抗生素的治疗手段,但其临床上的应用还面临以下挑战:(1)抑菌机制尚待阐明:糖脂与益生菌制剂已经显示出抗幽门螺杆菌的前景,但与抗生素相比其分子水平抗菌机制尚不明了,仍需通过生物化学、分子生物学及酶学等手段深入探索并阐明。(2)安全性尚需进一步评估:脲酶抑制剂和抗菌肽在体外实验中表现出良好的抗菌活性,但在临床上,生理毒性强的缺点限制了其实际应用。最新的研究中,以植物活性物质为底物半合成的脲酶抑制剂和改造后的抗菌肽表现出低的生理毒性,但其治疗效果及安全性还有待进一步通过动物与临床实验评估。(3)规模化生产技术尚待研究:一部分植物天然产物作为“中成药”在亚洲地区取得了一定的成功应用,少数研究更早的如大蒜素和小檗碱已经实现了工业化生产并作为西药上市,但由于研究起步较晚,大多数活性物质的分离纯化仍停留在实验室阶段,其临床应用还有待实现低成本规模化生产。(4)需要同纳米递药技术进行有机结合:从非抗生素类活性物质中开发新药主要可解决细菌耐药性问题,但无法解决胃部恶劣生理环境及细菌生物膜屏障造成的药物利用率低的问题。采用纳米级药物递送系统递送药物可有效提高药物利用率。尽管纳米递药系统目前还存在工艺复杂、成本高、稳定性不足和安全性缺乏研究等挑战,但其巨大前景毋庸置疑,利用搭载非抗生素类活性物质的纳米递药系统治疗H.pylori感染将成为未来的主流方案。
综上,尽管非抗生素活性物质向临床药物的转化还面临诸多挑战,在各国更加重视H. pylori感染而其耐药性问题愈发突出的当下,从非抗生素类活性物质中开发新药构建新的治疗方案将在未来临床治疗中发挥更加重要的作用。
