外源注射褪黑素对小麦抵抗叶锈菌侵染的影响
2022-11-03赵港伊史天乐吴思凡闫倩颖韩胜芳王冬梅
王 硕,赵港伊,史天乐,吴思凡,闫倩颖,韩胜芳,王冬梅
(华北作物改良与调控国家重点实验室,河北省植物生理与分子病理学重点实验室,河北农业大学 生命科学学院,河北 保定 071001)
小麦(TriticumaestivumL.)为禾本科小麦属,是我国重要的粮食作物,其易发生多种病害,从而影响产量。其中,叶锈病作为禾谷类锈病中常见的一类病害,是由小麦叶锈菌(Pucciniatriticina,Pt)侵染小麦引起的真菌性病害,叶锈病分布范围广、发生普遍,可导致小麦大幅减产,严重时甚至可达40%[1]。
当病原菌入侵植物时,寄主会通过产生过敏性反应 (Hypersensitive response,HR)来抑制病原菌在体内的生长。在不亲和组合中,小麦利用HR抵抗叶锈菌侵染,通过与叶锈菌吸器母细胞(Haustorium mother cell,HMC)接触的寄主细胞快速死亡,限制叶锈菌的繁殖和扩展[2]。这个过程与寄主体内一系列生理生化指标的变化有关,其中,活性氧(ROS)爆发作为HR的特征性反应,参与了植物抵抗病原菌侵染的早期防卫反应[3]。由于ROS过度积累会对植物细胞造成损害,抑制植物生长,所以植物需要清除过多的活性氧以维持活性氧代谢平衡。
褪黑素(N-acetyl-5-methoxytryptamine)自1995年在植物中被发现以来,已经被证实在植物中发挥多种生理作用,包括可以促进植物的生长发育,在植物中发挥抗氧化作用,提高植物的抗病能力等[4-5]。其中,褪黑素作为一种保护剂抵抗各种生物和非生物胁迫被人们大量研究[6]。褪黑素的防御机制主要归因于其维持细胞H2O2浓度保持平衡以及调节抗氧化酶活性的能力。抗氧化酶作为清除ROS的重要成员,在调节植物体内ROS浓度方面发挥关键作用[7]。植物通过抗氧化酶系统清除ROS提高细胞的抗氧化能力,从而提高植物耐胁迫能力,其变化在寄主抗病性表达中发挥着重要作用[8]。褪黑素还可以通过褪黑素受体及其下游信号转导途径发挥信号分子的作用[9]。
目前,褪黑素是否在小麦与叶锈菌互作中参与活性氧的清除尚未见报道。本研究通过对小麦叶片外源注射褪黑素后,利用DAB染色观察H2O2积累,利用Rohringer染色检测HR面积大小,通过对小麦过氧化物酶和过氧化氢酶活性的测定来探究外源注射褪黑素对小麦抗氧化能力的影响,旨在明确褪黑素在小麦与叶锈菌互作中的作用,为进一步阐明其作用机制奠定基础。
1 材料和方法
1.1 试验材料
小麦品种洛夫林10(简称L10),小麦叶锈菌生理小种260,均由河北省植物生理与分子病理学重点实验室长期繁育保存。小麦叶锈菌生理小种260与L10组成不亲和组合。L10幼苗在镝灯照射,光照强度为400 W/m2,光照周期14 h/d,昼夜温度24 ℃/20 ℃的光照培养室中培养。待幼苗第一片真叶完全展开时,以第一片叶作为试验材料,用于药物注射及接种处理。
1.2 试验方法
1.2.1 褪黑素最佳处理浓度确定 通过预备试验确定褪黑素(Melatonin,MT)最佳浓度。将试验分为对照组和试验组。当L10的第一片真叶完全展开时,将50 μmol/L甲基紫精(Methylviologen,MV)溶液注射到L10叶片上,同时将浓度分别为0,10,20,100 μmol/L的褪黑素溶液注射到L10叶片上,以单独注射甲基紫精的叶片作对照。分别于注射后8,16,24,48 h取样进行DAB染色处理,观察H2O2的含量变化,从而确定MT的最佳试验浓度,以该浓度进行后续试验。
1.2.2 H2O2的DAB染色 DAB与细胞内的H2O2在过氧化物酶作用下可生成黄褐色或者红褐色的显色物质,通过颜色深浅判断H2O2的含量多少。
本试验用最佳浓度的褪黑素注射L10叶片褪黑素处理组(Melatonin treatment group,MT组),并接种叶锈菌生理小种260。对照组(Control group,CK组)只接种叶锈菌生理小种260。每组试验设置3个重复。对各种不同处理的试验材料在接种后不同时间点12,24,48 h进行取样,参考Hans等[10]的染色方法对细胞DAB染色进行观察。
1.2.3 小麦叶片Rohringer荧光染色 将L10叶片接种叶锈菌生理小种260,取接种后24,48,72 h的叶片剪成1.5 cm长的片段,放于小瓶中,采用Rohringer[11]描述的荧光染色方法对细胞HR反应进行荧光观察和分析。
1.2.4 过氧化物酶和过氧化氢酶活性的测定 过氧化物酶(Peroxidase,POD)活性的测定采用愈创木酚法[12]。以每分钟反应体系在470 nm波长处吸光度增加1为一个酶活单位(U)。
过氧化氢酶(Catalase,CAT)活性的测定采用紫外吸收法[12]。在240 nm波长处的吸光值每分钟减少0.01为一个酶活单位(U)。
2 结果与分析
2.1 褪黑素最佳处理浓度
将50 μmol/L的MV以及10,20,100 μmol/L等不同浓度梯度的褪黑素先后分别注射小麦叶片,其中,只注射MV的叶片为对照组,其余为试验组,并于注射后8,16,24,48 h对上述各组取样,进行DAB染色,制片后分别在显微镜下观察,DAB染色结果如图1所示。

图1 不同浓度褪黑素对甲基紫精诱发产生H2O2的清除作用Fig.1 Scavenging effect of melatonin with different concentrations on H2O2 induced by methyl viologen
甲基紫精作为一种氧化剂诱发产生超氧阴离子,可以有效增加活性氧的含量,本实验室前期工作表明,50 μmol/L是最佳的甲基紫精注射浓度。注射甲基紫精后,小麦叶片的H2O2含量在16 h出现明显上升,24 h L10叶片内的H2O2含量最多,48 h H2O2的含量逐渐下降。同时发现,在经过不同浓度的褪黑素注射处理后,小麦叶片中的H2O2含量减少,表明褪黑素可以起到清除H2O2的作用。其中,10,20,100 μmol/L对H2O2的清除效果相差不大,为避免药品浓度过大伤害到植物本身及节约药品的原则,选取10 μmol/L作为后续试验的最佳作用浓度。
2.2 外源褪黑素对小麦与叶锈菌互作过程中H2O2的影响
小麦叶片先注射10 μmol/L褪黑素,后接种叶锈菌生理小种260,以此作为试验组。对照组不注射褪黑素,二者同时接种叶锈菌生理小种260,并于接种后12,24,48 h对2组叶片取样,进行DAB染色,观察H2O2的变化及分布特征。
DAB染色结果显示(图2),与对照组相比,同一时间点试验组的L10小麦叶片中的H2O2含量更少,说明外源性的褪黑素能够有效清除L10与叶锈菌生理小种260互作中产生的H2O2。

图2 外源注射褪黑素小麦叶片的DAB染色观察Fig.2 DAB staining observation of wheat leaves injected with melatonin
2.3 注射褪黑素后小麦HR细胞染色分析
HR是植物抗病性的一种典型表现,在植物对真菌、细菌、病毒等多种病原物的抗病反应中都可以观察到寄主细胞发生HR的现象。经10 μmol/L褪黑素注射处理及接种叶锈菌生理小种260后,于24,48,72 h取样,并采用Rohringer 染色,通过观察HR的产生面积以明确褪黑素是否参与小麦的抗病机制。
L10接种叶锈菌生理小种260后不同时间观察细胞发生HR的情况,发现HR细胞经染色后呈现亮黄色(图3)。Rohringer 染色结果表明,试验组与对照组的L10叶片在接菌后24 h开始出现HR,
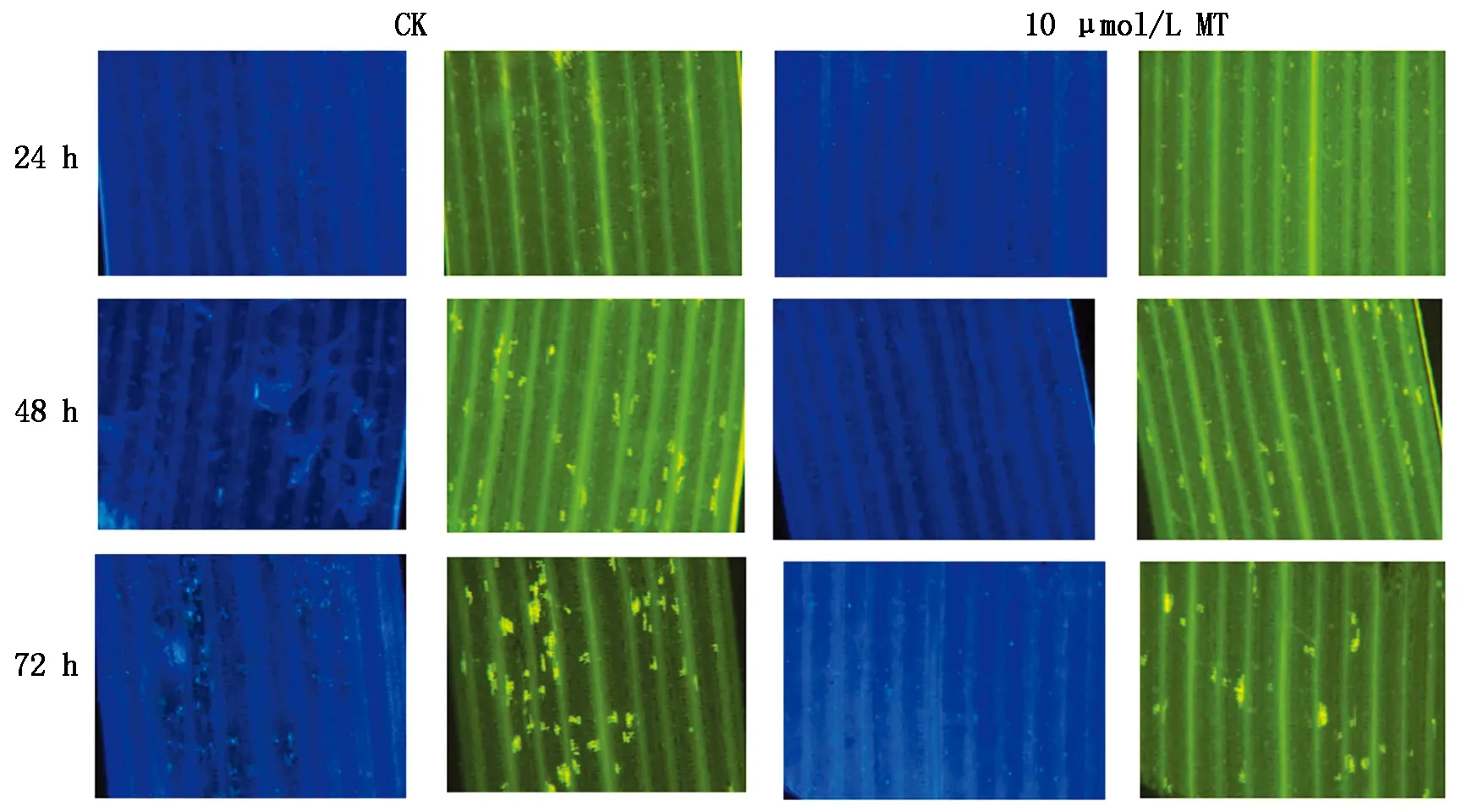
图3 外源注射褪黑素的小麦HR细胞染色观察Fig.3 Observation on HR cell staining of wheat injected with melatonin
其中试验组叶片的HR面积明显小于对照组。在L10与叶锈菌生理小种260互作后期,HR面积大量增加,在10 μmol/L褪黑素的作用下,试验组L10的HR面积小于对照组(图4),从而进一步证明外源性的褪黑素能够减小HR面积,增强小麦对叶锈菌的抗性。
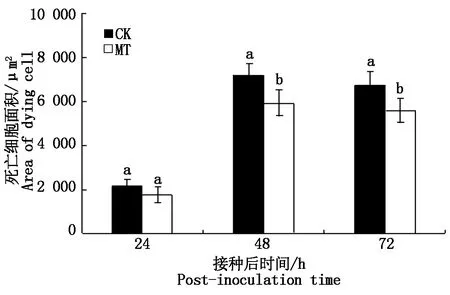
不同小写字母表示差异显著(P<0.05)。图5同。Different lowercase letters indicate significant differences(P<0.05).The same asFig.5.
2.4 外源褪黑素对小麦抗氧化酶活性的影响
过氧化物酶是植物活性氧代谢中重要的清除酶之一。接种叶锈菌后POD活性呈先上升后下降趋势(图5-A),在接种24 h达到最高峰,其中,与对照组相比,试验组POD活性显著提高,说明外源注射褪黑素处理可促进POD活性的上升,并延缓其活性的下降。图5-B显示,小麦接种叶锈菌后的8~24 h,试验组的CAT活性显著高于对照组,说明褪黑素处理促进了早期CAT活性的上升(图5-B)。通过对以上2种抗氧化酶活性的测定结果进行分析,用褪黑素处理后的酶活性会大幅提高,表明褪黑素可通过提高植物的抗氧化能力增强植物的抗逆性。
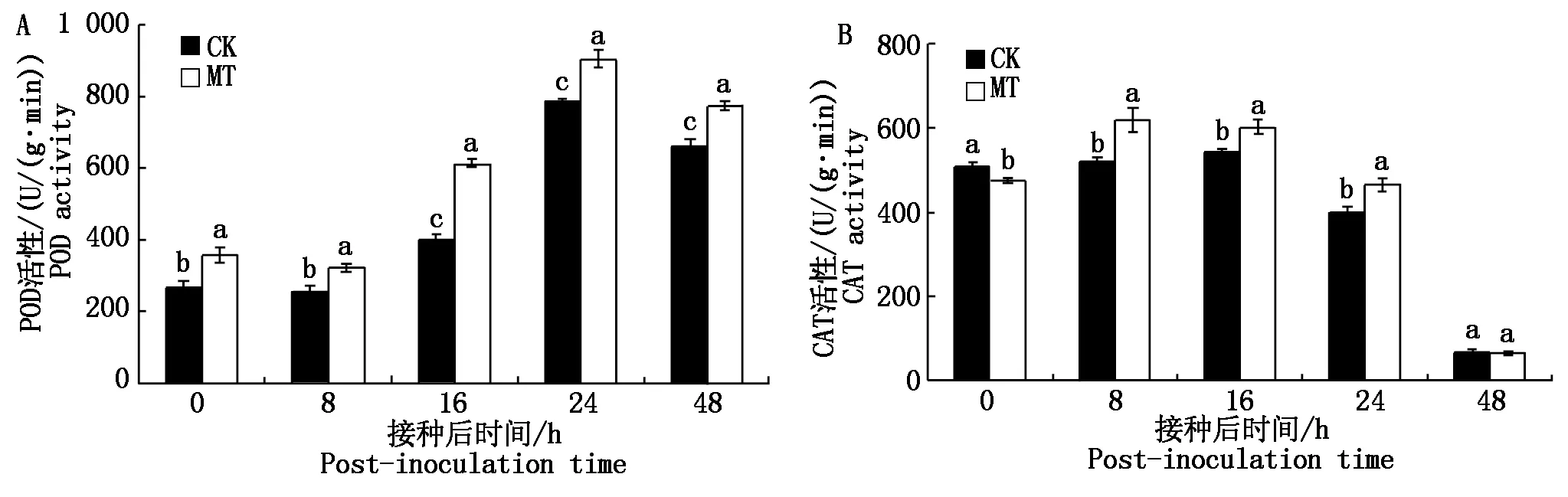
图5 注射褪黑素对小麦叶片POD(A)、CAT(B)活性的影响Fig.5 Effects of melatonin injection on POD(A)and CAT(B)activities in wheat leaves
3 结论与讨论
20世纪50年代,褪黑素(N-乙酰-5-甲氧基色胺)被首次发现在牛松果体中具有调节动物昼夜节律和季节性繁殖[13]等功能,在这之后又在其他动物、细菌、以及植物[14]中被发现。作为最近二十几年在植物中发现的一种吲哚类激素物质,褪黑素一经发现就受到了许多研究学者的关注。研究发现,褪黑素在植物抗非生物胁迫上发挥重要作用,可以提高植物抗重金属、紫外辐射、低温、干旱、盐胁迫的能力[15]。
随着研究的深入,不断有研究表明,褪黑素不仅参与植物抵抗非生物胁迫的过程,还参与植物抵抗生物胁迫,通过多种防御机制诱导植物产生防御反应。在植物-真菌相互作用体系中,外源施用0.05~0.50 mmol/L褪黑素可调节抗氧化酶[16]和植物防御相关酶的活性[17],提高植物对苹果褐斑病(一种真菌性病害)的抗性。褪黑素可以通过调节H2O2的生成和茉莉酸信号机制,在番茄果实对灰葡萄孢菌的抗性中发挥积极作用[18]。在对西瓜的白粉病研究中发现,通过改变与ETI和PAMP介导的防御相关基因的表达,褪黑素积累的增加可增强植物对叶片病原体的抗性[19]。褪黑素还可以通过清除受侵染水果中与防御相关的ROS来降低指状青霉引起的柑橘果实绿霉病的抵抗力[20]。在外源褪黑素对番茄果实采后灰霉病的研究中发现,外源褪黑素提高了硒对番茄采后灰霉病防治的效果。试验证明,外源褪黑素和硒复合诱导果实能显著抑制灰霉病的病斑扩展[21]。同样地,通过褪黑素对小豆抗锈性的研究中发现,低浓度(11.61 mg/L)褪黑素可使得小豆对锈病的抗性显著提升。在病菌入侵小豆的时期,经过褪黑素处理后的小豆,其NPR1基因表达量有明显增加。另外,在病菌扩展阶段PR基因也被发现有显著的高表达[22]。
本试验小麦与叶锈菌互作的体系中,发现在小麦抵抗叶锈菌的侵染过程中,植物体内产生的大量活性氧,可使细胞膜遭受破坏和代谢紊乱,严重时导致细胞死亡。外源注射褪黑素能够有效清除L10与叶锈菌生理小种260互作中产生的H2O2。此外,L10接种叶锈菌生理小种260后植株出现HR反应,注射褪黑素减小了HR面积,一定程度上说明褪黑素能够增强小麦对逆境胁迫时的抗性。同时,褪黑素可提高POD、CAT的活性,表明褪黑素可通过增强抗氧化酶活性发挥抗氧化作用,从而维持细胞ROS平衡,对各种胁迫进行最佳防御反应。
本试验证明了褪黑素对小麦与叶锈菌互作中产生的H2O2具有清除作用,参与小麦与叶锈菌的互作过程,对于小麦抵抗叶锈菌的胁迫研究具有积极意义。
尽管已经有不少对于褪黑激素相关防御信号网络的研究,但仍有必要对该通路中的某些上游组件进行研究。当AtPMTR1作为植物褪黑素的第一个受体在拟南芥中被发现后,这一方向研究空白开始被填补[7,23]。在叶锈菌和小麦互作的体系中,褪黑素介导的信号通路还值得进一步深入研究。
