利用转录组解析鲜食玉米闽甜6855的耐寒机制
2022-11-03林建新卢和顶陈山虎廖长见
林 静,林建新,张 扬,卢和顶,陈山虎,廖长见
(福建省农业科学院 作物研究所,福建省特色旱作物品种选育工程技术研究中心,福建 福州 350013)
鲜食玉米与普通玉米相比具有甜、糯、嫩、香等特点,营养较高富含维生素和多种微量元素,所以鲜食玉米具有很高的经济和商品价值。随着我国人民生活水平的逐步提高,市场对鲜食玉米的需求量也越来越大,然而我国对鲜食玉米品种的研发和供应仍存在很大缺口,因此,提升鲜食玉米品质,增加鲜食玉米的市场供应,对保障我国国民生活水平具有重要意义。福建省地处东南山区,可用耕地面积十分匮乏,素有“八山一水一分田”之称,开发经济价值相对较高的农作物对提升当地农民收入具有重要意义,因此,鲜食玉米成为福建省可选的特色经济作物之一。
鲜食玉米具有即食的特点,其保鲜期和上市期都很短。根据播种时期,鲜食玉米在福建省可分为春、秋两季种植,而提前上市可以显著提高入市时的销售价格。然而对于春播的鲜食玉米,种植太早苗期遇低温会导致减产和品质下降,而延后种植又会导致入市价格不理想。玉米是一个对温度非常敏感的作物[1],有研究表明,玉米适宜生长的高温在25~28 ℃,适宜的低温在5~18 ℃,高于或低于这个区间的温度其产量和品质都会受到显著影响[2]。例如通过设置不同播种期研究玉米生长发育进程发现,玉米的生长速率与温度密切相关,平均气温每升高1 ℃,出苗速率提升17%,营养生长速率提升5%;平均气温每降低0.7 ℃,玉米成熟期将延迟7 d,发生一般低温冷害,玉米单产减少8%;气温下降1 ℃,生育期延迟10 d,发生严重低温冷害,减产10%以上[3],低温胁迫还会导致玉米籽粒灌浆期缩短,从而导致空秆、秃顶及瘪粒增多等现象[4]。此外,低温还会影响细胞分化的速度,受低温影响叶片大小和数目都会显著减少,即使后期温度回升,由于叶片面积和数量不足无法支撑苗期的快速发育,也会影响玉米产量和品质[5-6]。
植物受冷害胁迫后应激反应会表现在多种形式上,例如活性氧(ROS)升高以及一些具有保护作用小分子的合成等[7]。在分子机制上普遍认为,冷害会显著影响植物的光合系统Ⅱ(PS Ⅱ)的活性,进一步影响植物的光合作用,而光合作用的减弱将会影响植物能量的合成和储备,从而降低植物对冷害的耐受性,但不同的植物对冷害的耐受性也存在显著差异[8]。在应对冷害上,植物激素和MAPK两大信号通路起着关键的调控作用,其中钙结合蛋白、蛋白激酶和蛋白磷酸酶等又是这2个通路中的一些关键因子[9-10],但对于耐冷的遗传调控机制研究相对较少。而相关耐冷机制的研究在鲜食玉米上也非常有限[1]。玉米的耐冷是一个复杂的性状,生理机制上冷害胁迫会影响玉米的一些主要农艺性状,但调控玉米主要农艺性状的主效基因却不能显著影响玉米的耐冷特性[11],暗示着玉米耐冷机制是需要多基因和信号通路协调作用,因此,单独或局部研究某个基因或调控通路很难全面解析耐冷性状的分子机制。关于玉米耐冷的多基因和网络协调调控机制的研究也在逐步开展,如Sobkowiak等[12]研究发现,对于冷害胁迫最先响应的是光合系统,随后细胞结构和发育过程的调控通路也会随之发生变化,但其具体的调控通路和关键调控基因仍不明确。
本研究以福建省农业科学院作物研究所培育的耐寒鲜食玉米品种闽甜6855为材料,利用转录组学的方法解析受冷害胁迫后,耐寒玉米品种在转录水平上的基因组表达量变化,以期从宏观的角度初步揭示玉米抗寒过程中涉及的关键调控网络和基因,为深入解析玉米抗寒的分子机制提供参考数据和理论依据。
1 材料和方法
1.1 试验材料
试验中使用材料为福建省农业科学院作物研究所自主选育的甜玉米品种闽甜6855,在以往栽培年份中表现出较好的耐寒性。
1.2 试验方法
1.2.1 样品处理 试验中使用的玉米材料釆用盆栽方式种植培养,在室外正常培养玉米至二叶一心时,选择无病、健壮、生长势均匀的幼苗置于25 ℃培养箱中预处理24 h,随后置于5 ℃低温培养箱中进行冷处理,每个处理20株,3 次生物学重复。以未进行低温处理的玉米叶片作对照,每隔24 h取样1次,冷处理最长至72 h。每次取样随机选取5株,剪取相同部位的叶片置于液氮速冻,然后保存于-80 ℃冰箱待用。
1.2.2 RNA 的提取和纯化 测序中使用的叶片总RNA利用Total Plant RNA Extraction kit(Karroten,Beijing,中国)进行提取。提取后RNA 的质量检测方法如下:电泳检测:用DEPC水配制1×TAE电泳缓冲液,制作2%琼脂糖凝胶,120 V 电泳检测,观察RNA条带是否降解;分光光度计检测:取2 μL RNA溶液,用 NanoDrop 2000核酸蛋白检测仪检测RNA 浓度及纯度,当RNA浓度 ≥300 ng/μL、 OD260/280= 2.0~2.2、OD260/230≥1.0时,表示质量合格,可以进行后续试验。
1.2.3 文库的构建、测序及差异分析 转录组文库的构建由北京诺禾致源生物科技有限公司进行流程化的制备,合格后在Nova-seq 6000测序仪上进行双末端测序。对下机的 raw reads利用 fastp[13]进行质控,过滤低质量数据得到。将得到的 Clean Date 使用 TopHat version 2.0.10 与玉米参考基因组B73比对,进行基因表达量的计算。获得基因的 FPKM 值,利用 edgeR的方法寻找差异表达基因(Differentially expressed genes,DEGs)。在筛选差异表达基因时,以P<0.05 且 Fold Change≥2 作为差异标准。
1.2.4 主成分(PCA)和KEGG注释分析 样品间主成分(PCA)分析和KEGG注释分析均在基迪奥云分析平台(https://www.omicshare.com/tools/Home/Soft/diffanalysis)进行,分析使用的注释文件在https://phytozome-next.jgi.doe.gov/网站下载。韦恩分析和表达聚类分析根据响应基因的FPKM值,利用TBtools进行分析绘制。
2 结果与分析
2.1 不同处理样本间的主成分分析(PCA)
为了明确耐寒鲜食玉米闽甜6855在不同耐冷处理时长后转录组样本间的重复性及整体变化趋势,以12个转录组样本所有注释基因的FPKM值为参数进行样本间的主成分分析(PCA),结果显示(图1),横坐标和纵坐标分别可以解释整体样本变化的57.5%和28.5%,可解释总体变异率为86.0%,且样本重复间呈现显著聚集趋势,说明样本间重复性较好,可以用于后续差异分析。结果还显示,CK(即0 h)时间点的样本与24,48,72 h点样品距离较远,而CK之外的样品间相对距离较近,表明闽甜6855受冷害胁迫后前期响应比较迅速,但随着耐冷时间的变化,基因表达也存在变化,但变化趋势逐渐减少。

图1 低温处理样品表达量的PCA分析Fig.1 PCA analysis of expression levels for samples treated with low temperature
2.2 不同处理样本间的基因表达差异分析
为了进一步明确闽甜6855受冷害胁迫后在转录水平上基因表达量的变化,对不同时间点的基因表达量进行差异分析,结果显示(图2),整体上闽甜6855在低温处理前后差异基因为4 000~7 000个,而不同时长低温处理样本间差异基因较少,为100~2 000个,表明低温是引起基因差异主要因素,且对低温胁迫的响应主要在前期。不同时间点对比结果显示(图2),与处理前CK相比,闽甜6855受冷害处理后24 h点分别有1 952,1 882个基因上调和下调;处理48 h后,上调和下调基因增多,分别达到3 543,3 265个;而在处理72 h后,上调基因变少,下调基因增多,分别为2 178,4 913个。但从整体上分析,随着处理时间变长,整体差异基因呈现增多的趋势。此外。处理24,48,72 h后样品之间相比,差异基因显著减少。尤其是处理48,72 h,上调和下调基因分别仅为10,103个。结果表明,闽甜6855的多数差异基因在冷害处理前期即具有显著响应,处理后期新增响应基因数目显著减少。而处理48,72 h后,样品间差异基因几乎没有了,表明低温是造成差异的主要因素,而低温处理时长是次要因素,此外闽甜6855对冷害胁迫的响应在48 h内基本完成,暗示着快速应对冷害胁迫可能是闽甜6855能够耐寒的基本特性之一。
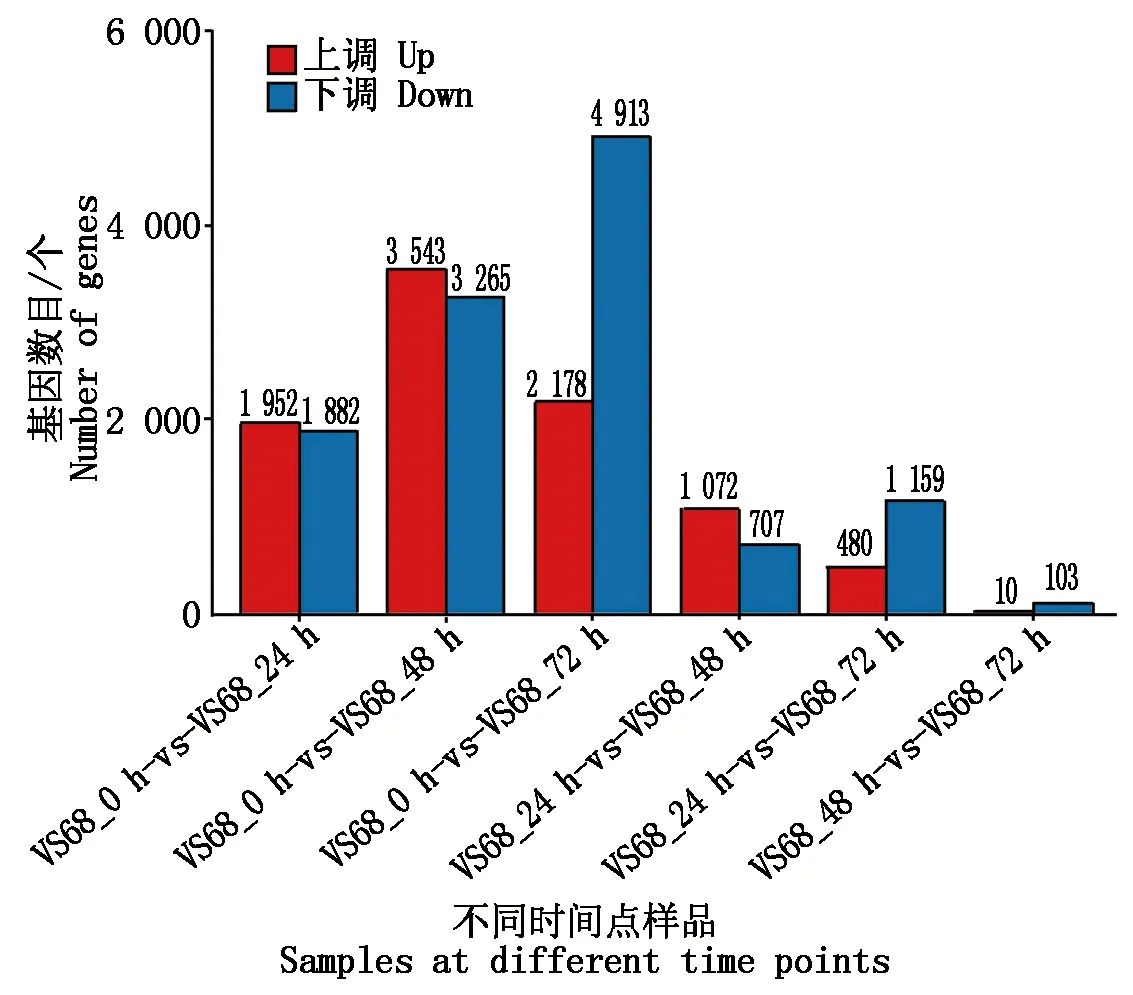
图2 低温处理后不同时间点样品表达量差异分析Fig.2 Difference analysis of expression in samples at different time points after low temperature treatment
进一步分析差异基因在不同处理样本间的变化,对不同样本间的差异基因进行韦恩分析,结果显示(图3),处理24 h的上调和下调的基因与处理48,72 h的差异基因相比具有显著差异,其中24 h样本中上调和下调的1 952,1 882个差异基因中,分别有1 925,1 851个为特异表达,仅在24 h样品中上调和下调表达,仅有27,31个基因也在其他时间点样本中上调表达和下调表达;与此不同,48,72 h样本中,共同上调和下调的基因分别为2 827,1 882个,占各自样本差异基因总数的50%以上,甚至90%左右。结果表明,闽甜6855在受冷害胁迫后不同阶段的响应基因存在着显著不同,尤其前期响应比较特异,后期响应存在一定共性。
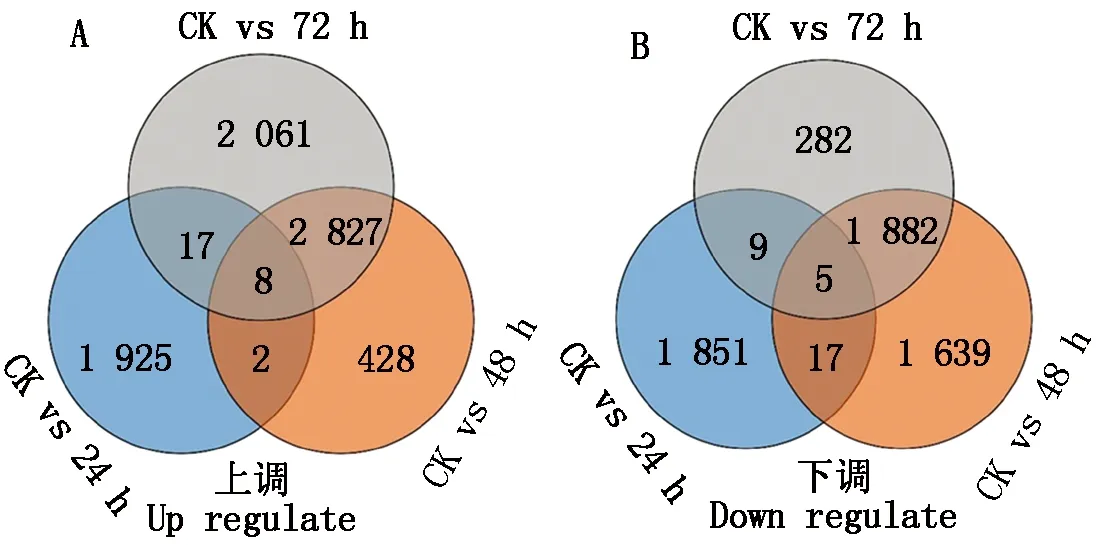
图3 低温处理后不同时间点样品表达量差异Veen图Fig.3 Veen plot of differences in expression levels of samples at different time points after low temperature treatment
2.3 参与抗寒胁迫基因KEGG通路分析
为了深入探究闽甜6855中参与抗寒胁迫的调控通路,对不同时间点响应进行KEGG通路注释分析,结果显示(图4),在冷害处理24,48 h后,绝大多数的差异基因参与了代谢途径(Metabolic pathways)和次生代谢产物的合成途径(Biosynthesis of secondary metabolites),处理24(48)h分别有483(798),268(442)个差异基因参与了2种途径。但在处理72 h后,参与2种代谢通路的响应基因几乎消失。表明闽甜6855中抗寒需要的一些代谢物主要在72 h之前完成合成,并且不需要持续合成。植物激素信号转导(Plant hormone signal transduction)和MAPK是与抗病虫及抗逆胁迫紧密相关的2个信号通路,本结果还显示,在冷害处理的不同时间点分别有40,66和67个差异基因参与了MAPK信号调控途径;分别有55,91,102个差异基因参与了植物激素信号转导信号调控途径,差异基因有增多的趋势,表明抗寒胁迫过程中这2个信号通路积极响应。此外,结果还显示,在低温处理后24,48 h,分别有54,74个基因参与了植物病原菌互作(Plant-pathogen interaction)调控通路,推测除MAPK和植物激素信号转导调控途径外,在抗病虫和抗逆境胁迫的通路上也存在着重叠或共有调控途径。

A、B、C分别代表低温处理24,48,72 h的样品差异基因的KEGG分析;q value即q值,是对p值的校正。A, B, and C. The KEGG analysis of differential genes in samples treated with low temperature for 24, 48, and 72 h, respectively; q value is the correction of the p value.
2.4 参与抗寒胁迫MAPK信号通路的变化分析
为了深入了解闽甜6855的耐寒分子机制 ,对MAPK信号通路上的调控基因进行进一步分析,结果显示(图5),受冷害处理后MAPK信号通路上的大部分基因发生了显著的变化。在处理24,48,72 h后,MAPK信号通路上分别有10,23,44个基因下调,分别有30,43,33个基因上调。从不同时间点上分析,冷害处理24,48 h后,在MAPK信号通路的多数节点上均出现了显著上调,结果表明,闽甜6855在受冷害48 h内即出现显著响应,随后开始逐渐降低。此外,从数量上分析,处理72 h比24 h上调基因数目要多,分别为33,30个,但上调基因的类型要显著少于24 h,表明24 h对冷害的响应更为广泛。试验结果还显示,在与冷害直接相关的途径上,MKK1、MKK2和MKK4/6家族一些差异基因在受冷害处理后均出现了显著上调或下调,说明这些基因在应对冷害胁迫中均起到了积极的响应。

图5 冷害胁迫后MAPK信号通路上基因表达变化Fig.5 Expression variation of MAPK signaling pathway in cold stress treatment
2.5 参与抗寒胁迫植物激素信号转导信号通路的变化分析
为了探究植物激素信号转导信号通路参与抗寒胁迫的关键基因,对3个时间点该信号通路上的基因变化趋势进行分析,结果显示(图6),在处理24,48,72 h后,植物激素信号转导信号通路上分别有20,34,69个基因下调,分别有35,57,33个基因上调。与MAPK信号通路变化相比,不同时间点间的基因表达变化差异相对较少,一些关键调控基因例如ARF、A-ARR、JAZ及PP2C在不同时间点均有显著上调表达,这类基因主要参与植物细胞增大、细胞分化、茎的生长或胁迫响应等过程,表明这类基因可能随着温度的降低持续表达,以维持植物在低温下的正常生长和发育。

图6 冷害胁迫后植物激素信号转导网络通路上基因表达变化Fig.6 Expression variation of plant hormone signal transduction signaling pathway in cold stress treatment
2.6 冷害胁迫对昼夜节律信号通路(Circadian rhythm-plant)基因的影响
为了进一步明确冷害胁迫的广泛影响,对受胁迫后调控昼夜节律信号通路上的差异基因进行分析,结果显示(图7),该信号通路上共有37个基因发生了显著变化。从初始表达总量上分析,3个家族的4个差异基因GI(Zm00001d008826和Zm00001d039589),CRY1(Zm00001d003477)和PRR7(Zm00001d047761)在冷胁迫处理前初始表达量相对较高,FPKM值在78.42~243.32,但受胁迫后4个基因均出现了显著降低,FPKM值下降到16.83~117.40;与此相反,6个家族的7个差异基因PRR5(Zm00001d021291)、CHS(Zm00001d052673)、HY5(Zm00001d015743和Zm00001d039658)、LHY(Zm00001d049543)、PIF3(Zm00001d024783)和TOC1(Zm00001d017241)在冷害处理后前初始表达量相对较低,FPKM值在1.69~24.92,受冷害胁迫后基因表达量显著上调,FPKM值最高值均超过了50。结果暗示着11个基因在植物受胁迫后调节昼夜节律信号通路变化中起主要作用。除此之外,还有9个基因冷害处理前初始表达量FPKM值在18.85~33.19,冷害胁迫72 h后出现显著降低,表达量FPKM值在1.79~9.05,说明这些基因在调控昼夜节律信号通路变化中也起着重要的作用。

图7 昼夜节律信号通路基因的差异分析Fig.7 Differential analysis of genes in circadian rhythm-plant signaling pathway
3 结论与讨论
3.1 耐冷鲜食玉米闽甜6855的推广前景
福建省地处东南山区,可用耕地面积少,机械化程度低,人工成本高,因此适宜开展一些高附加值的农业经济。随着人们对鲜食玉米需求的逐渐增加,其经济价值越来越高,然而我国鲜食玉米整个种业现状有待进一步发展,主要不足有两点:良种推广滞后和配套的产业化程度不高[14]。目前,显示玉米产业主要集中在南方,以春玉米为主。但由于鲜食玉米上市期非常短,容易形成扎堆上市,从而导致货丰价廉的现象[15]。春播鲜食玉米面临一大问题即苗期低温胁迫,尤其是倒春寒引起的大降温容易导致鲜食玉米的大面积减产或品质下降,因此,农民在种植过程中为了避免类似灾害发生,多数农民会选择在清明天气维稳后开始播种。闽甜6855是福建省农业科学院作物研究所培育的甜玉米品种,于2016年5月通过福建省农作物品种审定委员会审定(品种审定号:闽审玉2016003)。在前期福建和广西等田间试验中发现,闽甜6855播种期可提前至3月中下旬,且苗期如果遭遇一般年份的冻害不会造成显著的减产或品质下降,呈现较好的抗寒特性。因此,在推广应用的过程中可以适当强调其抗寒特性,推荐提前播种达到提前收获提前上市的目的,避开上市高峰期,提高入市价格。但在推广的过程中也应继续关注其耐冷的生物学特性,研发配套的栽培技术。总之,抗寒品种闽甜6855的推广有利于完善鲜食玉米的产业化结构,提升整个产业的经济效益。
3.2 耐寒研究采样时期和处理温度的选择
本研究采用的主要技术手段是转录组分析,而对于转录组研究来说,正确处理对试验至关重要。发育时期、处理温度、处理时间等均是本研究中考虑的重点。低温是影响鲜食玉米的重要气候条件,春玉米苗期又非常容易遭受骤冷降温的胁迫,从而严重影响发芽率和后期长势,而鲜食玉米与普通玉米相比受影响更大[16]。玉米受冷害胁迫后首先表现在膜上,膜系统结构被破坏后,细胞质膜透性增强,电解质外渗,叶片就会出现萎蔫等不可逆的胁迫症状[17]。基于以上研究背景,本试验选择玉米苗期进行后续研究分析。此外,在选择温度和处理时长上,在前期通过设置不同温度的梯度对闽甜6855及其亲本进行冷害处理,当温度降低至5 ℃,处理到72 h后,闽甜6855表现出比双亲优良的抗寒性,双亲均出现了不同程度的萎蔫,说明冷害处理72 h后,其细胞膜结构已经被破坏。相比之下,闽甜6855则无显著影响。因此,本研究的转录组选择时期主要是苗期,温度设置为5 ℃,处理最长时间为72 h,以此来保证获得的转录组数据能够真实反映冷害胁迫后转录层面的变化趋势。
3.3 冷害胁迫与植物-病原互作通路变化
植物抗逆境胁迫是一个复杂的过程,其中逆境胁迫又可以分为生物和非生物逆境胁迫。生物逆境胁迫又包含病毒、细菌和真菌等胁迫,非生物主要包括干旱、盐、冷、高温等环境胁迫。在应对逆境胁迫的过程中MAKP和植物激素信号转导信号通路起着重要的作用,在本研究中也发现,冷害胁迫后,这2个信号通路均富集了大量差异基因。但在植物-病原互作通路上也富集了相对较多的差异基因。通过分析参与这3种信号通路的差异基因发现,存在着相同的调控基因。例如,钙调蛋白磷酸酶(Caldneurin)是依赖Ca2+/钙调素调节的丝氨酸/苏氨酸蛋白磷酸酶,在MAKP和植物激素信号转导通路中起关键调控作用。而在植物-病原互作通路中也存在此类基因的参与,而本研究中的植物-病原互作通路上也发现了此类结构基因显著富集。除此之外,类似WRKY、PR1等基因在3种信号调控通路中也广泛存在并显著富集,暗示着植物在抗生物和非生物胁迫过程中,存在着相似或相通的调控通路,这对植物应对外界环境胁迫具有重要的意义。
3.4 冷害胁迫与植物昼夜节律变化
玉米是典型的积温作物,温度能够显著影响玉米的生长发育进程[18]。昼夜节律是调节植物发育的一个重要信号通路,昼夜节律控制植物多种生命活动,如胚轴伸长、叶片发育及开花期等[19]。植物响应低温途径的核心是CBF蛋白,CBF蛋白通过转录激活COR基因,从而促进初级和次级代谢产物积累,增加与抗冻相关蛋白的合成来提高植物的低温耐受力[20],研究发现,CBF同时受低温诱导和生物钟控制,它在白天被诱导表达,夜晚则几乎没有表达,暗示着生物钟对植物寒冷胁迫应答至关重要[19,21]。其中一些生物钟基因也被证实与CBF存在调控作用。例如,CCA1/LHY可以直接和CBF启动子结合,正调控该基因的表达[22],PRR5/7/9是CBF的负调控因子[23],TOC1和EC复合物同样通过和启动子结合来抑制CBF3表达,这一调控也影响CBF1和CBF2的表达[24]。本研究结果也显示,昼夜节律通路上的基因发生了显著变化,包括已明确与冷害胁迫相关的LHY、PRR及TOC等家族的基因,这些结果暗示着闽甜6855在应对冷害胁迫的过程中可能是通过昼夜节律通路调控抗寒信号CBF蛋白的表达,从而促进一些与抗寒相关的蛋白合成。而结果还显示,在冷害处理24,48 h后,代谢途径和次生代谢产物的合成途径富集了大量差异基因,这可能与CBF核心蛋白的调控相关,并且这种蛋白合成在非常短的时间(72 h内)内完成,因此可以快速使其适应低温的环境。
本研究利用转录组学对耐寒鲜食玉米品种闽甜6855在受低温胁迫后转录水平的变化进行分析,结果表明,闽甜6855受冷害胁迫后前期响应比较迅速,基本在48 h内即可完成转录水平的调控。受冷害胁迫后,主要抗性信号通路植物激素信号转导、MAPK和植物病原互作等通路都会积极响应,此外,昼夜节律也出现了积极响应,表明昼夜节律对甜玉米抗寒具有重要作用。
