茯砖茶中冠突散囊菌的分离鉴定及富硒菌株筛选
2022-11-03程梁静一美王周利袁亚宏岳田利
刘 程梁静一美王周利袁亚宏岳田利
(1.西北农林科技大学食品科学与工程学院,陕西杨陵 712100;2.农业农村部农产品质量安全风险评估实验室(杨凌),陕西杨陵 712100;3.西北大学食品科学与工程学院,西安 710069)
茯砖茶属于六大茶类中的黑茶,它生产工艺复杂、品质独特[1],具有调节肠道菌群、降低血脂、抗氧化、消炎等功效[2]。冠突散囊菌(Eurotium cristatum)是茯砖茶在一定的温度、湿度条件下,通过“发花”过程生长得到的益生菌体[3],也被称为“金花菌”[4]。1990年,齐祖同等[5]对湖南茯砖茶中的“金花菌”进行分离培养,观察到菌体表面具有冠状突起,将其定义为冠突散囊菌。陈云兰[6]将形态学鉴定与酯酶同工酶电泳相结合,分离鉴定多地茯砖茶中的“金花菌”,结果显示它是由冠突散囊菌和谢瓦氏曲霉菌组成。由于散囊菌属真菌存在很高的同源性,目前普遍接受的分类为真菌门、子囊菌纲、真子囊菌亚纲、曲霉目、曲霉科、散子囊菌属、冠突散囊菌,无性型为针刺曲霉[7]。
硒(Selenium)是哺乳动物必需的微量营养素,在自然界以有机和无机形式存在[8]。无机硒包括单质硒、亚硒酸盐和硒酸盐等,具有较大的毒性。有机硒包括硒代氨基酸、硒蛋白、硒多糖等,研究已经证实,有机硒的毒性低且生物利用度高[9-10]。硒在生物体的能量代谢和基因表达中起着重要的作用[11],具有抗氧化、保护心血管、预防癌症等功能[12-13],而硒摄入不足可能会引发克山病、甲状腺肿等疾病。世界卫生组织已确定饮食中硒的最佳摄入量为50μg/d,开发低毒性和高生物利用度的硒补充剂尤为重要[14-16]。酵母、细菌、真菌等可以通过自身生理代谢实现无机硒到有机硒的转化[17],微生物富硒能力的大小可以通过生物量、硒形态等多种指标判定[18]。利用生物对无机硒进行转化,是生产有机硒补充剂的一种安全有效的方法,已成为当前重要的研究方向[19]。
本研究从陕西茯砖茶中分离冠突散囊菌,并利用形态学与分子生物学对其进行鉴定,根据微生物的富硒特性对冠突散囊菌富硒菌株进行筛选,并对菌体硒形态进行分析,旨在为冠突散囊菌的利用及硒补充剂的开发提供理论依据。
1 材料与方法
1.1 材料
经典1368茯茶(1 000 g)、手筑茯砖茶(1 000 g)、贡金茯茶(200 g)、贡福尊品(200 g)、茯茶柱(200 g)、吼秦腔(200 g),购于咸阳泾渭茯茶有限公司;泾茯源花开月圆泾渭茯砖茶(1 000 g),购于陕西泾阳百富茯砖茶有限公司;泾阳茯茶1368(450 g),购于陕西古渡茯砖茶有限公司。所购茯砖茶均金花茂盛、品质优良者。
1.2 主要试剂
葡萄糖、琼脂、硝酸、高氯酸、盐酸、过氧化氢、氢氧化钠、戊二醛、磷酸铵、亚硒酸钠等,购自西安化学试剂厂,均为分析纯。植物基因组DNA 提取试剂盒,购自天根生化科技(北京)有限公司。蛋白酶XIV、脂肪酶VII,购自美国Sigma-Aldrich公司。硒代蛋氨酸(Se Met)、硒代胱氨酸(SeCys2)、甲基硒代半胱氨酸(MeSeCys)、硒酸根(Se(IV))、亚硒酸根(Se(VI)),购自中国计量科学研究院。
1.3 主要仪器与设备
超净工作台(YT-CJ-2ND),北京亚泰科隆仪器技术有限公司;恒温培养箱(ZXSD-A1160),上海智诚分析仪器制造有限公司;恒温培养振荡器(ZWY-240),上海智城分析仪器制造有限公司;高速冷冻离心机(HC-3018R),安徽中科中佳科学仪器有限公司;光学显微镜(Ni-U),日本尼康株式会社;扫描电子显微镜(S-3400N),日本株式会社日立制作所;PCR 仪(CFX CONNCT),美国Bio-Rad公司;电泳仪(JY600C),北京市六一仪器厂;凝胶成像仪(Gel Doc XR+),美国Bio-Rad公司;氢化物发生—原子荧光光谱仪(AFS-9300),江苏艾塔科学仪器有限公司;液相色谱仪(ICS-600),赛默飞世尔科技公司;电感耦合等离子体质谱仪(NexION 2000),珀金埃尔默仪器有限公司。
1.4 试验方法
1.4.1 培养基制备 马铃薯葡萄糖琼脂(PDA)培养基:取去皮马铃薯200 g,切片后置于1 000 m L蒸馏水中煮沸20 min,过滤后加入葡萄糖20 g、琼脂20 g并再次煮沸,加蒸馏水定容至1 000 m L,121 ℃灭菌20 min。马铃薯葡萄糖(PDB)培养基:除不加入琼脂外,其他步骤与PDA 培养基制备方法相同。
1.4.2 冠突散囊菌的分离纯化 称取茯砖茶样品25 g,粉碎后混悬于225 m L 无菌生理盐水(0.85%),在28 ℃恒温水浴箱中以200 r/min振荡40 min,洗脱茶叶上附着的菌体[20]。将去除茶叶的洗脱液进行梯度稀释,取10-3、10-4、10-5、10-6梯度稀释液涂布PDA 培养基。置于28 ℃恒温培养箱中避光培养,适时对长势良好的菌落进行划线分离,将得到的纯化菌株接种至PDA斜面培养基于4 ℃保存。
1.4.3 形态学特征观察 将纯化菌株接种于PDA 培养基,于28 ℃恒温避光培养21 d,观察菌落的生长状况并根据《中国真菌志》对其种属进行初步判断[21]。培养5~7 d时通过显微镜与扫描电镜进行形态学观察。
显微镜观察:通过直接制片与形态观察相结合的方式进行光学显微镜观察[22]。制备PDA 平板培养基时,以45°斜插入4片无菌盖玻片,接种后置于28℃的恒温培养箱中培养,待菌丝延伸至盖玻片上时,用镊子将盖玻片夹出,盖到滴有一滴无菌水的载玻片上,在显微镜下观察。
扫描电镜观察:纯化菌株在PDA 培养基上生长7 d,用无菌刀片切取5 mm×5 mm 且长有菌落的培养基薄片,置于2.5%戊二醛常温浸渍过夜。用0.1 mol/L PBS缓冲液(p H 7.2)浸洗3次,每次10 min。然后用30%、50%、70%、80%、90%、100%乙醇逐级脱水,每级脱水2 次,每次10 min[23]。脱水后的样品通过超临界CO2真空干燥,喷金后通过扫描电镜观察。
1.4.4 分子生物学鉴定 收集PDA 培养基上纯化菌落的菌丝体,经液氮研磨后利用植物基因组DNA 提取试剂盒提取DNA。采用真菌核糖体基因通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')进行PCR 扩增[18]。PCR 扩增反应体系:上游、下游引物各1μL(5.65 nmo L,稀释100倍),模板DNA 2μL,premixTaq10μL,加dd H2O 至20μL。扩增条件:95℃预变性5 min,95℃变性30 s,55℃退火30 s,72℃延伸1 min,34次循环,72 ℃延伸10 min[24]。PCR 扩增产物通过凝胶电泳进行检测,将条带单一且明亮的PCR 扩增产物送至上海生物工程股份有限公司进行测序。将测序结果提交至NCBI数据库,通过核酸BLAST 进行比对,对测序菌株进行属种归类,筛选出冠突散囊菌。
1.4.5 孢子悬浮液制备 冠突散囊菌于PDA培养基活化3次,在28 ℃下恒温培养5~7 d,用无菌生理盐水将孢子洗脱至无菌离心管中,通过血球计数板调整孢子浓度为107cfu/m L 并于4 ℃保存。
1.4.6 生长特性研究 以1%的接种量将孢子悬浮液接种于PDB 培养基中,于28 ℃、130 r/min振荡培养10 d。每隔12 h取出3瓶培养液并收集菌丝体,于65 ℃烘干至恒质量,即为菌体生物量[25]。绘制菌体生物量关于培养时间的曲线,即为冠突散囊菌在该条件下的生长曲线。
1.4.7 耐硒菌株筛选 不同菌株对无机硒的耐受能力不同,在环境硒质量浓度相同的情况下,根据菌体红硒现象出现的程度,筛选耐硒能力强的菌株。配制硒质量浓度为0、30、60、90、120 μg/m L的PDA 培养基,分别取32株冠突散囊菌孢子悬液100μL涂布于平板,每个质量浓度设置3个平行,于28 ℃下避光培养9 d,每天观察菌落生长状况,筛选耐硒性能优良的菌株。
1.4.8 富硒菌株筛选 配制硒质量浓度为30 μg/m L的PDB培养基,以1%的接种量分别接种初筛得到的耐硒菌株的孢子悬液,于28 ℃、130 r/min振荡培养7 d。加硒组和对照组均设置3个平行。通过测定菌体生物量、总硒含量筛选富硒能力强的菌株。
1.4.9 菌体生物量的测定 将培养7 d的冠突散囊菌培养液转移至离心管中,在8 000 r/min离心10 min,弃去上清液,向沉淀中加入30 m L无菌水,震荡清洗后再次离心,重复清洗3次。将菌体沉淀转移至10 m L无菌离心管中,冷冻干燥24 h,称重得菌体生物量[26]。
1.4.10 菌体总硒含量的测定 通过氢化物发生原子荧光光谱法(HG-AFS)测定总硒含量[27]。
样品消化:称取冠突散囊菌冻干菌体0.500 g于250 m L 锥形瓶中,依次加入9 m L 硝酸和1 m L高氯酸并充分混合。将锥形瓶置于200 ℃加热板加热,至混合物变为澄清透明并有白烟出现。待混合物冷却后加入5 m L盐酸(6 mol/L),混匀后继续加热,直到混合物再次澄清透明。冷却后转移至10 m L容量瓶中用蒸馏水定容。
标准曲线绘制:分别配制硒质量浓度为0、10、20、30、40、50μg/L 的硒标准溶液,充分混匀后测定其荧光强度。以硒质量浓度为横坐标,荧光强度为纵坐标,绘制标准曲线。
硒含量测定及计算:硒含量通过氢化物原子荧光仪测定,运行条件如表1所示。对样品和空白溶液进行测定,与标准系列溶液比较定量,每个样品平行测定3次。硒含量按照以下公式计算:

表1 HG-AFS运行参数Table 1 Operating conditions of HG-AFS
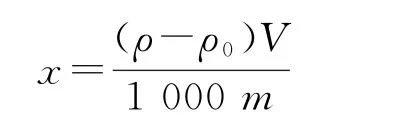
其中,x为硒含量(μg/g);ρ为样品溶液中硒的质量浓度(mg/m L);ρ0为空白溶液中硒的质量浓度(mg/m L);V为消化液总体积(m L);m为样品的质量(g);1 000为换算系数。
1.4.11 菌体硒形态的测定 菌体硒形态的提取:称取0.200 g冠突散囊菌冻干菌体粉末于离心管中,加入20 mg蛋白酶XIV、20 mg脂肪酶VII、6 m L无菌超纯水。将混合物置于磁力搅拌器上,以400 r/min速度在37 ℃避光孵育36 h。在8 000 r/min 离心5 min,收集上清液并通过0.45μm 无菌滤膜过滤,测定前置于-20 ℃保存。
LC-ICP/MS测定硒形态:通过液相色谱—电感耦合等离子体质谱(LC-ICP/MS)测定菌体硒形态及其含量。LC 系统使用PRP-X100阴离子交换柱(250 mm×4.1 mm×10μm)对硒形态进行分离。流动相为40 mmol/L磷酸铵(p H 6.0),流速为1.0 m L/min,进样量为50μL,运行时间为25 min。ICP-MS系统用于硒形态的分析和定量,选择78Se 和82Se 作为监测同位素。ICP-MS的运行条件如表2 所示。硒形态鉴定标准物质为:Se Met、SeCys2、MeSeCys、Se(IV)、Se(VI),分别配制质量浓度为0、20、40、60、80、100μg/m L的标准物质系列溶液。通过LC-ICP/MS对标准系列溶液进行测定,确定各硒标准物质保留时间,并绘制标准工作曲线。
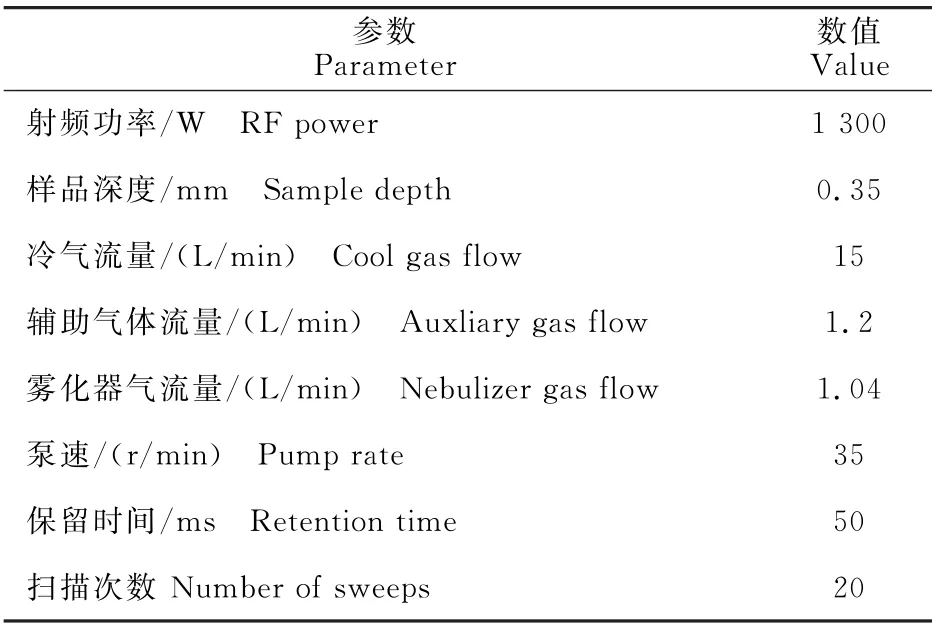
表2 ICP-MS运行参数Table 2 Operating conditions of ICP-MS
2 结果与分析
2.1 菌落形态特征
如图1所示,生长4 d的菌落(图1-a,1-f)直径约15~20 mm,可观察到黄白色菌丝和黄色闭囊壳。菌落生长7 d(图1-b,1-g)时,直径达30~35 mm,整体呈较规则圆形,中心部位稍厚且有小突起;颜色由边缘的浅黄色逐渐加深至中心的浅褐色。菌落生长10 d(图1-c,1-h)时,直径达到40~45 mm,菌落上布满黄色闭囊壳,部分黄色菌丝已衰老,变为褐色;菌落中心已近橄榄褐色,且有透明黄色液滴渗出。菌落生长14 d(图1-d,1-i)时为直径50~55 mm 的较规则圆形;此时菌落已老化,产生大量闭囊壳;菌落边缘变成铁锈色,培养基被色素染为褐色。菌落生长21 d(图1-e,1-j)时,直径达到65~70 mm,菌落几乎变成深橄榄色,反面呈黑褐色,菌落中心渗出黑色浓稠的液滴。
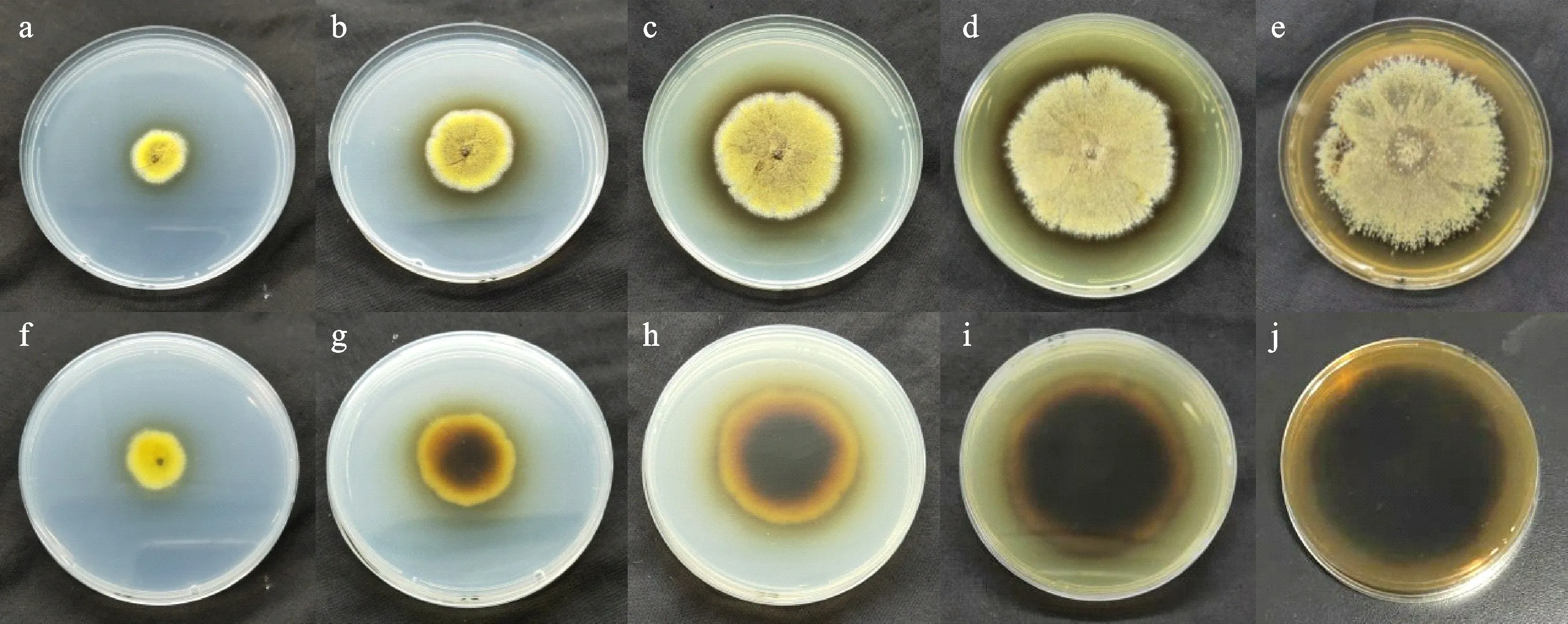
图1 冠突散囊菌在PDA平板培养基生长状况Fig.1 Growth status of Eurotium cristatum on PDA plate medium
菌落颜色随着培养时间延长而逐渐加深,因为在菌落生长过程中,其形态结构和色素分泌出现于不同阶段。浅色菌丝和少量黄色闭囊壳产生于培养初期,使菌落呈淡黄色;大量黄色闭囊壳产生于中期,使菌落呈黄色;黑褐色色素分泌于后期,且此时菌落开始老化,菌落颜色进一步加深而呈褐色。
2.2 菌体显微特征
在显微镜下对冠突散囊菌进行观察,可看到冠突散囊菌存在有性生殖(子囊孢子)和无性生殖(分生孢子)两种生殖方式。如图2所示,视野内可观察到具有不对称分枝的菌丝(图2-a),以及大量球形或近球形的子囊果(黄色闭囊壳)。子囊果成熟后发生无规则破裂释放出包含子囊孢子的子囊(图2-b,2-c)。培养中后期可观察到分生孢子结构(图2-d),未成熟分生孢子呈球形,孢子梗较光滑,具有烧瓶形或球形的顶囊。分生孢子从顶端以出芽的形式发育至成熟,并串生在孢子梗顶部。

图2 冠突散囊菌显微形态特征Fig.2 Microscopic morphological characteristics of Eurotium cristatum
2.3 菌体扫描电镜特征
如图3所示,扫描电镜下可以观察到冠突散囊菌茂盛的菌丝(图3-a),菌丝为具有分枝的管状,中间有隔膜。子囊果缠绕在菌丝中(图3-b),直径为70~100μm,含有大量子囊。子囊为椭球形或近球形,直径为10~25μm,包裹着8个子囊孢子。子囊孢子为(3~5)μm×(5~8)μm,呈双凸镜形,“赤道”部分绕有两圈纵向的“冠状”凸起(图3-c)。“冠状”凸起为冠突散囊菌的特征结构,是判断其属种的重要依据。分生孢子头成熟后呈较疏松的扫帚状(图3-d),分生孢子为(3.0~4.0)μm×(4.0~5.0)μm,大部分为椭球形,外壁粗糙且生有小刺。无性孢子形成结构被认为是曲霉家族的独特特征[28]。

图3 冠突散囊菌扫描电镜形态Fig.3 Scanning electron microscopy morphological characteristics of Eurotium cristatum
2.4 分子生物学鉴定结果
从茯砖茶中共分离、纯化得到54株菌株,部分优势菌株的ITS序列PCR 扩增产物的电泳分析如图4所示,2至15号泳道条带所对应的基因片段长度约为500~750 bp,且呈现单一明亮状态,表明所对应DNA 纯度高。将测得的基因序列在NCBI数据库进行同源序列比对,以ITS序列同源性>99%为标准进行属种归类。54株菌株序列比对结果如表3所示,SXFCA.1、SXFCB.7等32株菌与模式冠突散囊菌的相似度达到99%以上,其中SXFCC.12、SXFCF.23、SXFCF.25、SXFCH.32达到100%,表明这32株菌与冠突散囊菌有很高的同源性。结合形态学的鉴定结果,可将32株菌株判定为冠突散囊菌。

表3 茯砖茶分离菌株的测序结果Table 3 Sequencing results of strains isolated from Fucha tea

图4 茯砖茶部分优势菌株的ITS序列PCR 扩增产物凝胶电泳图像Fig.4 Gel electrophoresis images of PCR amplification products of ITSsequences of dominant strains from Fucha tea
2.5 冠突散囊菌生长特性曲线
通过液体培养绘制的冠突散囊菌生长曲线如图5所示。冠突散囊菌短时间内便适应了生长环境,培养24 h时生物量开始增加。由于培养基为冠突散囊菌的生长提供充足的营养物质,极大地促进了菌体生长[25]。在培养前132 h,菌丝体生物量呈稳定增加趋势,在培养132 h~156 h 阶段,菌丝体生长速率出现大幅提升,菌丝体生物量在156 h时达到最大值184.33 mg/100 m L,说明此时冠突散囊菌处于生长对数期且活力最旺盛。此后,菌丝体生物量出现缓慢下降并逐渐平稳的趋势,这是因为菌丝体的持续生长繁殖使培养基体系内菌体相对密度增加,导致菌体生长空间变小,也可能是由于长时间半封闭培养使菌丝体发生轻微自溶[29]。
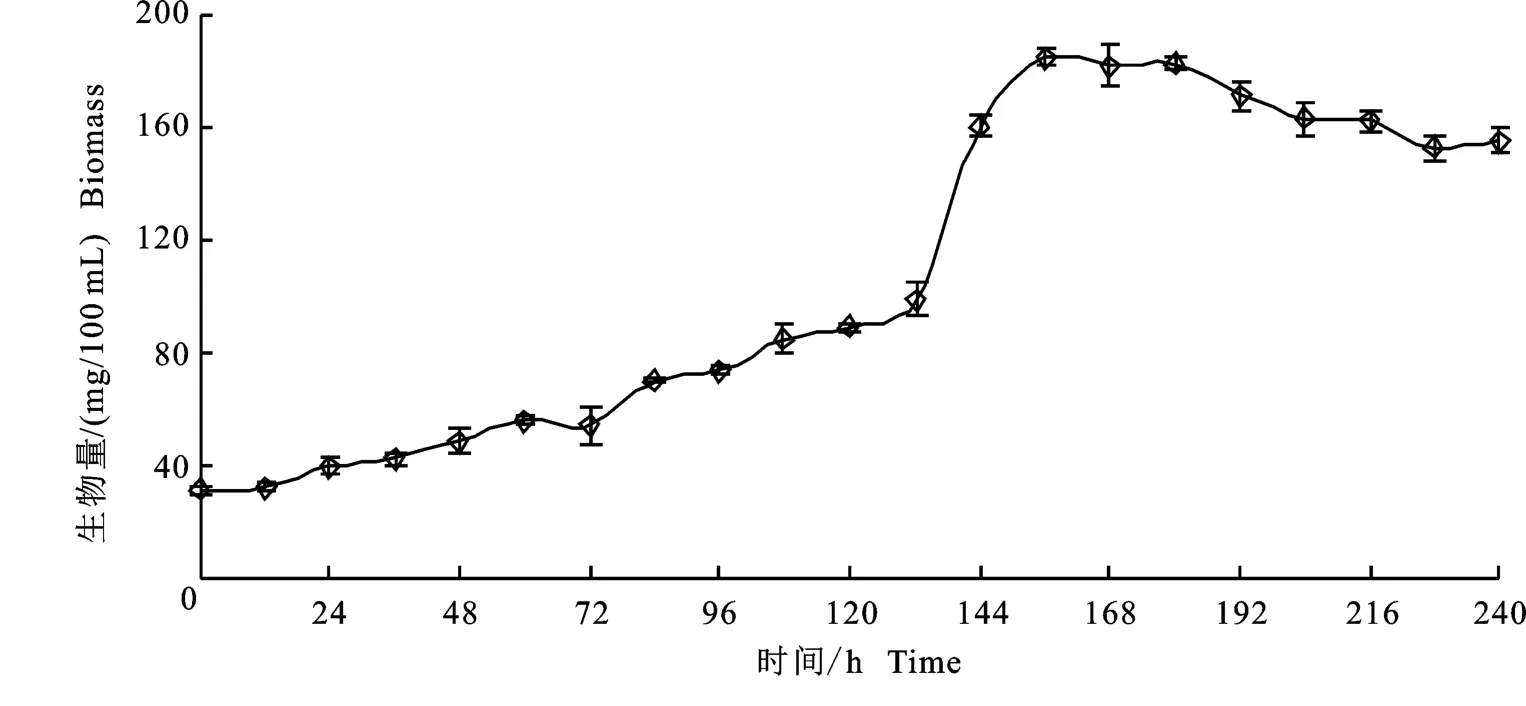
图5 冠突散囊菌生长特性曲线Fig.5 Growth characteristic curve of Eurotium cristatum
2.6 耐硒菌株筛选结果
当微生物生长环境中的无机硒浓度较高时,它不仅会在胞内转化成有机硒,而且有一部分会被还原成单质硒[30],使菌体在外观上呈红色。32株冠突散囊菌在含硒培养基上生长情况如表4所示。在硒质量浓度为30μg/m L 时,菌落数量多且直径大,与正常生长的菌落相比颜色没有明显变化,且菌落在此浓度下生长最快。为了提高有机硒的转化率,减少单质硒的累积[31],选择冠突散囊菌生长的适宜硒质量浓度为30μg/m L。当硒质量浓度为60μg/m L时,菌落颜色明显变红,说明硒单质在细胞内的累积增多[18]。当硒质量浓度达到120μg/m L时,大部分菌株已停止生长或长出零星的红色或橙红色菌落。部分菌株可以生长出颜色较浅的菌落,分别为菌株SXFCB.7、SXFCC.1、SXFCC.8、SXFCC.10、SXFCD.7、SXFCD.8、SXFCE.7、SXFCG.3,表明这8株菌有很强的耐硒性能,可进一步探究它们的富硒能力。
2.7 富硒菌株筛选结果
PDB培养筛选富硒菌株结果如图6所示,不同菌株受硒的影响有明显差别。菌株SXFCC.1与SXFCD.8 的生物量分别为(27.48±1.31)mg/100 m L和(28.92±0.94)mg/100 m L,均超过25 mg/100 m L,说明这两株菌在硒环境中能保持较好的活力,硒对其生长产生的抑制作用小。SXFCC.8和SXFCD.8富硒量分别为(604.98±16.93)μg/g和(628.38±20.96)μg/g,说明这两株菌的富硒能力很强,对硒的利用和转化率高,但是菌株SXFCC.8的生物量较低,说明硒对其生长的抑制作用较强。综合考量得出菌株SXFCD.8能够在保持较高生物量的基础上实现最大的富硒量,是一株富硒能力较强的优势菌株。

图6 8株富硒冠突散囊菌生物量及总硒含量Fig.6 Biomass and total selenium content of 8 selenium-enriched Eurotium cristatum
为进一步探究菌株SXFCD.8的有机硒转化能力,通过LC-ICP/MS 对其菌体硒形态进行测定。如图7-b所示,菌株SXFCD.8硒形态色谱图中共检出6个清晰的峰,代表至少存在6种硒形态。通过与硒标准物质保留时间(图7-a)比对可知,峰1为SeCys2,峰2 为MeSeCys,峰4 为Se(IV),峰5为Se Met。根据硒标准物质曲线计算出的硒形态浓度如表5所示。浓度最高的硒形态为Se Met,达到(338.03±3.78)μg/g,占总硒含量的53.79%。其次为SeCys2,含量为(183.30±2.43)μg/g,占总硒含量的29.17%。MeSeCys是含量最低的有机硒形态,为(17.58±3.24)μg/g,仅占总硒含量的2.80%。作为原始硒源的Se(IV),在菌体内的含量为(44.07±0.84)μg/g,仅占总硒含量的7.01%。Se(VI)未在菌体中检测到。硒形态测定结果表明,菌株SXFCD.8能够将环境中的无机硒吸收并转化为有机硒,且主要以硒代氨基酸形式存在,进一步说明冠突散囊菌具有作为有机硒来源的巨大潜力。
表5 冠突散囊菌中硒形态及总硒含量(±s)Table 5 Se species contents and TSC of proteins isolated from Eurotium cristatum

表5 冠突散囊菌中硒形态及总硒含量(±s)Table 5 Se species contents and TSC of proteins isolated from Eurotium cristatum
注:ND.未检出。Note:ND.Not detected.
硒形态Selenium species项目Item 硒代胱氨酸SeCyS2甲基硒代半胱氨酸MeSeCyS硒代蛋氨酸Se Met硒(Ⅳ)Se(Ⅳ)硒(Ⅵ)Se(Ⅵ)有机硒Organic selenium总硒Total selenium含量/(μg/g)Content 183.30±2.43 17.58±3.24 338.03±3.78 44.07±0.84 ND 538.91±4.59 628.38±7.96占总硒比例/%Percentage of total selenium 29.17 2.80 53.79 7.01 0 85.76

图7 硒标准物质(a)和冠突散囊菌硒形态(b)的LC-ICP/MS色谱图Fig.7 LC-ICP/MS chromatogram of(a)selenium standards and(b)selenium species of Eurotium cristatum
3 讨论
对冠突散囊菌的命名和分类的研究自其被发现就开始了,早期的研究多以形态学鉴定为主,温琼英[32]通过扫描电镜观察到“金花菌”菌体表面具有冠状突起,其子囊孢子表面比较粗糙而分生孢子具有小刺,与齐祖同[5]的研究结果相符。虽然形态学观察在菌株鉴定中起到重要作用,但是由于菌落形态具有不稳定性,因而需要采用多种鉴定手段以确证鉴定结果。本研究将传统的形态学观察与分子生物学鉴定相结合,从陕西茯砖茶中鉴定出32株冠突散囊菌。从测序结果可以看到每个菌株在ITS保守区域中有各自的碱基变化,表明冠突散囊菌中存在遗传多样性[33]。从茯砖茶中分离的菌株除了冠突散囊菌外,其他菌株分别与阿姆斯特丹散囊菌、谢瓦散囊菌、赤散囊菌等有较高的相似性,说明茯砖茶中的“金花菌”是一个菌种组成复杂的体系。胡治远等[34]鉴定了湖南地区茯砖茶中的“金花菌”,结果表明“金花菌”包括冠突散囊菌、谢瓦散囊菌、蜡叶散囊菌等多种散囊菌。尽管ITS 区域可用于散囊菌的分类鉴定,但在反映种间的遗传多样性方面仍有欠缺。如果要得到种水平的相关信息,则应利用分辨能力更高、更精准的基因进行鉴定,或进行基因系统发育分析[35]。
目前,关于冠突散囊菌功能和应用的研究较少,至于其富硒能力的研究更是鲜有报道,本研究关于陕西茯砖茶中的冠突散囊菌富硒菌株的报道为首次。在菌株筛选过程中发现,硒对所有菌株的生长都造成不同程度的影响,且质量浓度越高对菌体生长抑制越明显。另外,不同冠突散囊菌在含硒PDA 培养基上的菌落生长情况有显著差异,如在大部分菌株可以耐受的30μg/m L 的硒环境中,菌株SXFCA.6和SXFCA.8几乎没有菌落产生,而在硒质量浓度高达120μg/m L的环境中,菌株SXFCC.1、SXFCD.8等仍可以产生大量菌落,且红硒现象并不严重,这说明不同菌株对硒的耐受和转化能力存在差异性。目前关于微生物硒转化的机理并未明确,对富硒酵母富硒机理的研究表明[36],菌株富硒能力的差异可能与其自身的代谢系统有关,因为该系统对硒和硫元素的识别能力在微生物富硒过程中起决定性作用。也有研究表明由于不同微生物含有的酶类不同,氧化还原反应的胞内环境也不尽相同,从而影响了富硒能力[37]。
对菌株SXFCD.8 硒形态的研究表明,冠突散囊菌具有转化有机硒的能力。在其转化得到的有机硒中,Se Met的含量最高,这与之前的报道相一致,表明Se Met是富硒微生物中有机硒的主要种类[27,38],这也被认为是富硒微生物“有机”的标志[39]。SeCys2 占冠突散囊菌总硒含量的29.17%,而在富硒酵母中约为10%~15%[40],这一差异可能与蛋白质中Met、Cys2和Cys的比例有关[41]。3种有机硒的总含量达到92.44%,表明冠突散囊菌中的硒物质具有较高的生物利用度,更易于被生物吸收[42]。值得注意的是,所鉴定的4种硒形态总含量为(582.99±2.78)μg/g,低于HG-AFS检测到的总硒含量,这可能是由于冠突散囊菌酶解不足所致[43]。除了这4种可以通过标准物质确定的硒形态外,在图7-b中还观察到两个未确定的峰。在没有标准物质的情况下,可以利用ESI-Orbitrap MS进行鉴定。硒氨基酸的多样性是微生物具有强大富硒能力的重要基础,对冠突散囊菌硒形态的分析表明,冠突散囊菌具有较强的有机硒转化能力,有望被开发为一种有机硒补充剂。
4 结论
本研究通过形态学和分子生物学手段相结合的方式,从陕西茯砖茶中分离并鉴定到32株冠突散囊菌,并通过硒胁迫筛选得到8株耐硒菌株,其中菌株SXFCD.8在硒质量浓度为30μg/m L 的培养环境下,生物量为(28.92±0.94)mg/100 m L,富硒量达到(628.38±20.96)μg/g,是具有较强富硒能力的优势菌株。通过LC-ICP/MS在SXFCD.8菌体内共检测到6种硒形态,其中Se-Met、SeCys2、MeSeCys、Se(IV)与标准物质相匹配,说明冠突散囊菌具有较强的有机硒转化能力。
本研究首次报道了陕西茯砖茶中冠突散囊菌富硒菌株,丰富了富硒微生物的种类,为微生物硒补充剂的研究提供了参考,并对硒缺乏现象的改善具有重要意义。
