冷冻大熊猫初乳XO 和PAO 活性测定及其与牛、羊乳的比较
2022-11-03付尚辰雷颖虎赵鹏鹏张丹辉沈洁娜刘永峰
付尚辰雷颖虎赵鹏鹏张丹辉沈洁娜刘永峰
(1.陕西师范大学食品工程与营养科学学院,西安 710100;2.秦岭大熊猫研究中心(陕西省珍稀野生动物救护基地),西安 710032)
母乳是哺乳动物幼崽的理想食物,它含有多种酶,其中一部分与乳腺中乳汁分泌有关,一部分与新生幼崽对母乳中蛋白质、脂肪或碳水化合物等营养物质的消化吸收有关,还有少部分参与新生幼崽免疫系统的形成[1-2]。黄嘌呤氧化酶(xanthine oxidase,XO)和多胺氧化酶(polyamine oxidase,PAO)是母乳中两类重要的氧化还原酶,在新生幼崽肠道中发挥一定的抗菌免疫作用[3-4]。XO 在乳中主要存在于乳脂球膜中,可以氧化黄嘌呤或次黄嘌呤,产生尿酸以及能杀死微生物的活性氧[5]。Ozturk 等[6]通过模拟口腔环境检测牛乳中XO 的抗菌活性,发现牛乳中的XO 可通过氧化次黄嘌呤和(或)黄嘌呤产生H2O2,有效抑制几种革兰氏阴性和阳性细菌病原体的生长。此外,乳汁是新生幼崽外源性多胺的第一来源,其中PAO 是调节机体多胺代谢的重要氧化还原酶之一,它可以催化精胺和亚精胺氧化脱氨,产生腐胺、氨和H2O2,参与新生儿肠道成熟过程[7-8]。Bjelakovic等[9]通过测定人乳多胺代谢过程中的PAO 和二胺氧化酶活性,发现人乳中PAO 的活性产物可能具有潜在的抗菌作用,从而对婴儿具有一定的保护作用。
新生大熊猫幼崽体质量约为100 g,生长发育水平很低且高度依赖初乳[10]。Griffiths等[11]通过蛋白质组学和代谢组学研究表明,大熊猫乳的初乳期约为30 d。初乳对大熊猫新生幼崽的存活具有决定性作用,没有吃到初乳的幼崽均会死亡[12],1 m L大熊猫初乳可能挽救1只熊猫幼崽;并且大熊猫幼崽在断乳后抵抗力明显减弱,极易感染胃肠道和呼吸道相关疾病[13]。目前,大熊猫乳汁与新生幼崽免疫系统之间的关系已经受到研究人员的关注。王成东等[14]发现大熊猫初乳中免疫球蛋白主要为Ig A,其含量低于人乳,高于牛羊乳。Ma等[15]发现母乳能促进大熊猫幼崽对母体miRNA 的摄入,可调节幼崽产后免疫和发育。另外,随着大熊猫人工繁殖技术的日益成熟,大熊猫产双胞胎的概率也随之提高,其产后泌乳量难以同时满足两只幼崽成长的需要[16],且绝大多数大熊猫在初乳期结束后会敏感易怒、极易伤人,因此大熊猫常乳难以采集,饲养人员通常会将大熊猫初乳冷冻保存,用于大熊猫产后缺乳、产多胎等情况的应急。截止目前,珍贵的大熊猫初乳中具有抗菌免疫作用的XO 和PAO 两类氧化还原酶的活性研究尚无报道,因此本研究围绕此问题开展试验,以利于大熊猫初乳免疫作用的明晰。
综上,乳中XO 和PAO 与新生幼崽良好肠道环境的形成和免疫系统的构建密切相关。本研究采用冷冻牛、羊乳和新鲜牛、羊乳建立XO 和PAO 活性的Amplex Red荧光法检测方法,再检测冷冻大熊猫初乳中XO 和PAO 活性,并与新鲜和冷冻牛、羊乳中XO、PAO 活性进行对比,以期为大熊猫乳汁中XO 和PAO 活性及其协同抗菌免疫机制的明晰奠定理论基础,对人工大熊猫育幼具有重要意义。
1 材料与方法
1.1 材料
1.1.1 乳样及来源 大熊猫初乳采集于陕西省林业科学院秦岭大熊猫繁育研究中心(陕西,楼观台)饲养的一只产后17 d的健康大熊猫,用干冰带回实验室储存于-80 ℃冰箱,备用;牛、山羊乳采集于陕西省西安市长安区奶牛和奶山羊养殖大户,新鲜乳样品采集后用低温冰盒快速带回放入普通冰箱冷藏室,备用。冷冻乳样品储存于-80 ℃超低温冰箱,备用。
1.1.2 主要试剂及仪器 体积分数30% H2O2、次黄嘌呤、精胺、辣根过氧化物酶(HRP)、10-乙酰基-3,7-二羟基吩嗪(ADHP,AR)、二甲基亚砜、0.1 mol/L磷酸盐缓冲盐水(PBS,p H=7),所有试剂均为分析纯;200μL 黑色96孔酶标板购于西安晶博有限公司;多功能酶标仪(Synergy H1,Gene Company Limited,美国)、普通冰箱(578WPU9C,美菱,合肥)、超低温冷冻冰箱(LOW-HL388,美菱,合肥)。
1.2 方法
1.2.1 样品处理 取10μL乳样与990μL去离子水充分震荡混合,配置1%乳样;取50μL、40 μL、25μL、13μL、5μL 1%乳样分别与450μL、534μL、475μL、507μL、495μL 去离子水混合,配置0.10%、0.075%、0.05%、0.025%、0.01%的梯度稀释乳样。
1.2.2 H2O2标曲绘制 参照Zou等[17-18]方法并进行适当改进。用30%的H2O2溶液与去离子水混合分别配置浓度为1、2、4、6、8μmol/L 的H2O2工作液,现配现用。将976 μL 100 mmol/L PBS(p H=7)、4μL 200 U/m L HRP和20μL 10 mmol/L ADHP 混合均匀配置“H2O2反应混合物”工作液。分别将50μL 不同浓度的H2O2工作液与50μL“H2O2反应混合物”工作液添加到96孔不透明微量滴定板的每个孔中,使用多功能酶标仪37 ℃温育3 min后(发射波长590 nm,激发波长544 nm)进行吸光度测定。
以H2O2的浓度(x)为横坐标、吸光度(y)为纵坐标进行线性回归分析并建立标准曲线,线性回归方程为y=61 717x-3 140,R2=0.995 7。
1.2.3 XO 活性检测 根据Zou等[17]的试验结果选取最佳XO 反应条件。将956 μL 100 mmol/L PBS(p H=7)、20μL 10 mmol/L次黄嘌呤、4μL 200 U/m L HRP 和20μL 10 mmol/L ADHP混合均匀配置“XO 检测混合物”工作液。将936μL 100 mmol/L PBS(p H=7)、40μL 去离子水、4 μL 200 U/m L HRP 和20 μL 10 mmol/L ADHP混合均匀配置“XO 空白混合物”工作液。分别将50μL 乳汁稀释样品加入96孔不透明微量滴定板中,再添加50μL 的“XO 检测混合物”(XO 空白混合物),乳中所含的XO 与“XO 检测混合物”中的次黄嘌呤发生氧化反应产生H2O2。使用多功能酶标仪在37 ℃恒温(发射波长590 nm,激发波长544 nm)条件下,对反应体系内H2O2与ADHP 氧化结合后生成的荧光间苯二酚进行吸光度测定,每90 s读取1 次读数,持续监测30 min。根据公式计算不同种类乳汁样品中XO 活性:
酶活力(U/L)=K1/K2×稀释倍数
其中K1表示乳汁样品吸光度值相对于时间的斜率(减去空白的斜率后),K2表示H2O2吸光值相对于H2O2浓度的斜率,U 为本试验条件(以次黄嘌呤作为底物)下每分钟释放1μmol H2O2所需XO 的量。
1.2.4 PAO 活性检测 根据Zou等[17]的试验结果选取最佳PAO 反应条件。将936μL 100 mmol/L PBS(p H=7)、40μL 10 mmol/L精胺、4 μL 200 U/m L HRP和20μL 10 mmol/L ADHP混合均匀配置“PAO 检测混合物”工作液。将936μL 100 mmol/L PBS(p H=7)、40μL去离子水、4μL 200 U/m L HRP 和20μL 10 mmol/L ADHP混合均匀配置“PAO 空白混合物”工作液。分别将50μL 乳汁稀释样品加入96孔不透明侧微量滴定板的每个孔中,再向孔中添加50μL的“PAO 检测混合物”(PAO 空白混合物),乳中所含的PAO 与“PAO 检测混合物”中的精胺发生氧化反应产生H2O2。PAO 活性检测与计算同上述XO 活性检测。U 为本试验条件(以精胺为底物)下每分钟释放1μmol H2O2所需PAO 的量。
1.3 数据处理
试验设置3个重复,每个样品平行测定3次。采用Excel 2013进行数据整理和吸光度值初步分析,结果以“平均数±标准差”的形式表示,采用GraphPad Prism 6.0对数据进行显著性检验。
2 结果与分析
2.1 牛、羊鲜乳和冷冻乳中XO 和PAO 的活性
2.1.1 XO 活性 为探究Amplex Red荧光法对微量乳中XO 活性检测的适用性以及冻藏对乳中XO 活性的影响,使用Amplex Red荧光法检测不同浓度鲜牛、羊乳和冷冻牛、羊乳中XO 活性,结果如图1所示。XO 活性在5个不同浓度乳样中均保持稳定状态,各组之间无显著性差异(P>0.05)。不同浓度鲜牛乳、鲜羊乳、冷冻牛乳、冷冻羊乳中XO 活性分别为2.1~2.5 U/L、0.31~0.36 U/L、0.76~0.88 U/L、0.1~0.13 U/L;鲜乳中XO 活性均极显著高于冷冻乳(P<0.01),牛乳中该酶活性均极显著高于羊乳(P<0.01),牛、羊乳中XO 活性总体差异未受到冻藏处理的影响。

图1 鲜乳与冷冻乳的XO 活性Fig.1 XO activities of fresh and frozen milk
2.1.2 牛、羊鲜乳和冷冻乳的PAO 活性 不同浓度鲜乳、冷冻乳中PAO 活性如图2 所示。PAO 活性在5个不同浓度乳样中保持稳定状态,各组之间无显著性差异(P>0.05)。不同浓度鲜牛乳、鲜羊乳、冷冻牛乳、冷冻羊乳中PAO 活性分别为0.31~0.34 U/L、0.16~0.18 U/L、0.1~0.12 U/L、0.053~0.06 U/L。鲜乳中PAO 活性均极显著高于冷冻乳(P<0.01),牛乳中该酶活性均极显著高于羊乳(P<0.01),牛、羊乳中PAO活性总体差异未受到冻藏处理的影响。
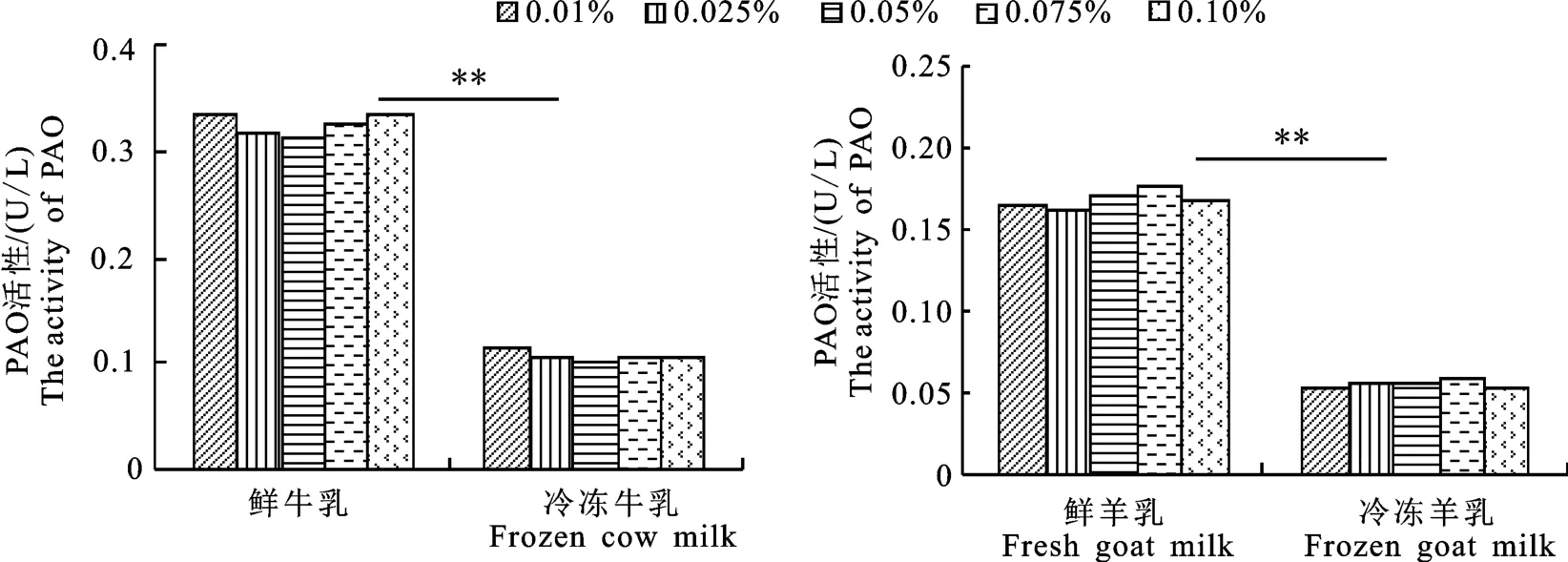
图2 鲜乳与冷冻乳的PAO 活性Fig.2 PAO activities of fresh and frozen milk
2.1.3 乳中XO 与PAO 活性测定方法评价Amplex Red 荧光法测定结果(“2.1.1”和“2.1.2”)表明,牛、羊鲜乳和冷冻乳中XO 和PAO 活性在不同稀释倍数(1 000~10 000)下,各组之间均无显著性差异(P>0.05)。可见,Amplex Red荧光检测法不仅实现了微量乳汁的XO和PAO 活性检测,且能稳定反应不同物种乳汁的XO 和PAO 活性及其差异,可以采用此方法进行大熊猫初乳中酶活性的测定。
2.2 冷冻大熊猫初乳中XO 和PAO 活性
使用Amplex Red荧光法检测5个不同浓度冷冻大熊猫初乳中XO 和PAO 活性,结果如图3所示。不同浓度冷冻大熊猫初乳中XO 活性为0.59~0.65 U/L,各组之间XO 活性无显著差异(P>0.05);不同浓度冷冻大熊猫初乳PAO 活性为0.023~0.029 U/L,各组之间也无显著性差异(P>0.05)。

图3 冷冻大熊猫初乳中XO 和PAO 活性Fig.3 XO activities and PAO activities in frozen giant panda colostrum
2.3 牛、羊乳与冷冻大熊猫初乳中XO 和PAO活性比较
将冷冻大熊猫初乳与牛羊鲜乳、冷冻乳中的XO 活性对比,结果如表1 所示。0.05% 和0.10%浓度的冷冻牛乳中XO 活性是冷冻大熊猫初乳的1.3~1.4 倍,显著高于冷冻大熊猫初乳(P<0.05),而0.01%、0.025%和0.075%浓度的冷冻牛乳中该酶活性与冷冻大熊猫初乳相比均无显著差异(P>0.05),但其酶活性均比相应浓度冷冻大熊猫初乳高5%~32%;不同浓度鲜牛乳中XO 活性为冷冻熊猫初乳的3.4~4.3 倍。不同浓度的冷冻大熊猫初乳中XO 活性均高于羊乳,为鲜羊乳的1.7~2.0倍、冷冻羊乳的4.6~5.5倍。3 种乳中XO 活性总体趋势为牛乳>大熊猫初乳>羊乳。

表1 牛、羊乳与冷冻大熊猫初乳中XO 活性Table 1 Comparison of XO activities in cow milk,goat milk and frozen giant panda colostrum U/L
将冷冻大熊猫初乳与牛羊鲜乳、冷冻乳中的PAO 活性对比,结果如表2所示。不同浓度牛乳中PAO 活性均显著高于冷冻大熊猫初乳(P<0.05),鲜牛乳是冷冻大熊猫初乳的11.1~14.5倍,冷冻牛乳是冷冻大熊猫初乳的3.7~4.5倍。鲜羊乳中PAO 活性均显著高于冷冻大熊猫初乳(P<0.05),是冷冻大熊猫初乳的5.6~7.2倍;0.025%、0.05%、0.075%和0.10%浓度的冷冻羊乳中该酶活性显著高于冷冻大熊猫初乳(P<0.05),是冷冻大熊猫初乳的1.9~2.3 倍,其中0.01%浓度的冷冻羊乳虽与冷冻大熊猫初乳相比均无显著差异(P>0.05),但该浓度下该酶活性比相应浓度冷冻大熊猫乳高92%。3 种乳中PAO 活性总体趋势为牛乳>羊乳>大熊猫初乳。
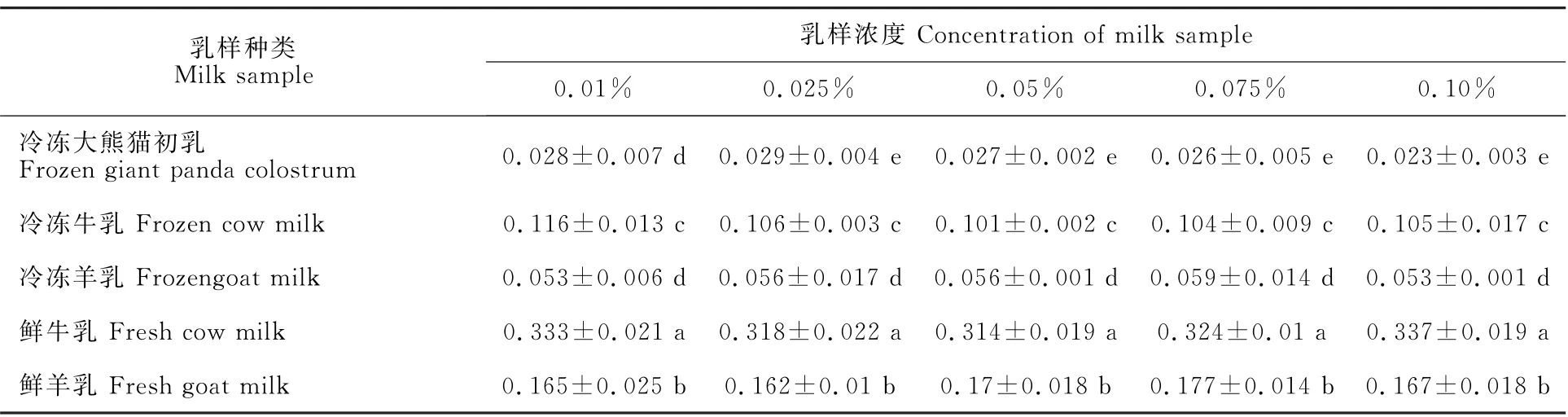
表2 牛、羊乳与冷冻大熊猫初乳中PAO 活性Table 2 Comparison of PAO activities in cow milk,goat milk and frozen giant panda colostrum U/L
3 讨论
XO 是乳汁中产生H2O2的主要酶类,PAO通过氧化精胺以补充乳汁中的H2O2含量[5,7]。Amplex Red荧光检测法通常用于测量生物样品中极低浓度的H2O2,具有稳定性好、荧光强度高等优点[19-20]。同时有研究证明XO 或PAO 氧化产生的H2O2与HRP催化的ADHP氧化结合后产生高荧光物质间苯二酚,通过对其荧光强度检测可实现4×105倍稀释乳中XO 和PAO 活性的测量[17,21],因此Amplex Red荧光法为测定大熊猫乳中XO 和PAO 活性提供了可能。在此基础上,本研究通过测定牛、羊乳中XO 和PAO 活性,进一步证实Amplex Red荧光法在乳中适用性,并创新地应用在冷冻大熊猫初乳中XO 和PAO 活性的检测。
此外,XO 和PAO 是乳汁中两种重要活性成分,在有氧条件下参与黄嘌呤(次黄嘌呤)与精胺(亚精胺)的代谢,其代谢过程中产生的活性氧、氨基醛类以及H2O2具潜在的抗菌作用。研究发现XO 和PAO 产生的H2O2存在进一步被乳中乳过氧化物酶(lactoperoxidase,LPO)系统催化的可能,可通过LPO-H2O2-SCN-体系生成具有抗菌活性的次硫氰酸盐(OSCN-),反应机制如图4所示[6,17-18,22-23]。OSCN-对革兰氏阳性和阴性菌有抑制作用,因此乳中XO 和PAO 可以通过该协同作用达到降低乳腺炎的发生,调节新生幼崽肠道环境的作用。
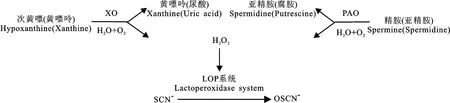
图4 乳中XO、PAO 和LPO 系统的拟协同反应机制Fig.4 Simulated synergistic reaction mechanism of XO,PAO and LPO system in milk
本研究测定的牛、羊乳中PAO 活性与Zou等[17]和Morgan等[24]的测定结果相似,但XO 活性与尿酸盐吸光度法测定的酶活性相比较低,这可能归因于哺乳期、饲料和季节变化等各种因素[9,25]。从总体趋势来看,牛乳中XO 和PAO 活性均高于羊乳,这与Zou等[17]和Atmani等[26]的研究结果一致;且牛、羊乳中XO 和PAO 活性在不同稀释倍数下,各组之间均无显著性差异,说明Amplex Red荧光法效果良好,能准确反映牛、羊乳中XO 和PAO 活性及其差异,进一步证实该方法对微量乳中XO 和PAO 活性测定的适用性。
新生大熊猫幼崽免疫力极低,大熊猫初乳在幼崽免疫系统发育过程中起重要的调节作用[15]。因此,本研究应用该方法对十分珍贵的大熊猫初乳进行XO 和PAO 活性检测,其XO 活性为0.59~0.65 U/L,PAO 活性为0.023~0.029 U/L,这为后续大熊猫初乳中XO 和PAO 活性的研究提供参考。此外,大熊猫初乳中XO 活性略低于牛乳,但高于羊乳;PAO 活性比牛、羊乳低;且大熊猫初乳中XO 活性高于PAO 活性,大熊猫乳汁中XO、PAO 和LPO 系统的协同抗菌机制可能以XO 为主。乳中较低的PAO 活性可能与大熊猫特殊的进食模式和消化系统有关,牛、羊幼崽在出生3~4月时会发育出一个瘤胃,用于消化食物中的纤维物质,而大熊猫幼崽直至成年都不能发育出瘤胃[27-29]。大熊猫具有典型的肉食性动物的肠道结构,但成年大熊猫的饮食模式以竹子(>90%)等高纤维食物为主,其必须依靠肠道微生物来消化纤维素,因此大熊猫幼崽肠道微生物的形成在其生长发育中十分重要[29]。大熊猫幼崽的断奶时间通常在1岁以后,由此猜测,虽然大熊猫乳中PAO 活性较低,但大熊猫乳可通过XO、PAO 和LPO 系统长期的协同抗菌机制(LPO-H2O2-SCN--OSCN-)来实现对大熊猫幼崽肠道微生物的调节,进而促进大熊猫幼崽先天免疫系统的形成。
4 结论
本研究采用高灵敏度的Amplex Red荧光法对冷冻大熊猫初乳中XO 和PAO 活性进行检测,并与牛羊鲜乳、冷冻乳进行对比,发现大熊猫初乳中XO 活性低于牛乳但高于羊乳,PAO 活性低于牛、羊乳。通过对乳中XO、PAO 和LPO 系统的协同抗菌机制分析,认为大熊猫初乳在新生幼崽肠道微生物和先天免疫系统形成过程中发挥作用的以XO 为主。本文首次探究了大熊猫初乳中XO 和PAO 活性,并对其相关的抗菌协同作用进行初步分析,为进一步探究大熊猫乳与幼崽免疫形成的关系提供了理论参考。
