抗氧化转录因子Nrf2与Rad51相互作用降低BLM对细胞DNA的损伤
2022-11-01徐倩倩张沛誉
徐倩倩,张沛誉,陈 妮
据最新的全球癌症统计报告,肺癌是最常见的恶性肿瘤之一,仅2020年就有新增肺癌病例220万例(占总病例的11.6%),死亡180万例,占人类所有癌症死亡人数的近五分之一,肺癌的低治愈率是当前面临的重大难题[1]。据研究肿瘤细胞对博莱霉素(bleomycin,BLM)耐药性的产生是导致治疗失败的重要原因[2-4],肿瘤细胞对BLM的耐药主要表现在DNA损伤修复能力的增加。BLM被发现能诱导肿瘤细胞株G2/M期阻滞[5],而这可能与细胞在G2/M检查点对DNA损伤的应答有关。另有研究表明,在BLM作用下肿瘤细胞内的抗氧化水平升高[6],这也可能是细胞产生抗性的另一大因素。
核因子E2相关因子2(nuclear factor erythroid related factor 2,Nrf2)是抗氧化应激反应的关键调节因子,在许多肿瘤中发现Nrf2通路的过度活化与肿瘤治疗过程中的放化疗抵抗有关[7]。目前Nrf2在放化疗抵抗中的相关研究主要聚焦在氧化应激方面,而在参与DNA损伤应答方面的研究仍较少。该研究中,以人肺癌细胞系A549和H1299为对象,探究抗氧化转录因子Nrf2对BLM诱导的DNA损伤水平及DNA损伤修复的影响。
1 材料与方法
1.1 实验材料BLM、白藜芦醇(resveratrol,Res)、N-乙酰基-L-半胱氨酸(N-Acetyl-L-cysteine,NAC)均购自美国Sigma-Aldrich公司;NRF2慢病毒颗粒、聚凝胺溶液(polybrene)、质粒转染培养基均购自上海吉玛基因公司;细胞松弛素B(cytochalasins B,CB)、吖啶橙粉末、嘌呤霉素(puromycin)购自广州索莱宝生物科技有限公司;其他实验室常规试剂均购自国药集团。γ-H2AX兔单克隆抗体、Nrf2兔单克隆抗体购自美国CST公司;Rad51单克隆抗体购自英国Abcam公司;β-actin兔单克隆抗体购自北京中杉金桥生物技术有限公司;LaminB单克隆抗体购自武汉三鹰生物技术有限公司。四季青胎牛血清购自湖州市天杭生物科技股份有限公司;细胞胰酶消化液、青链霉素溶液均来自上海碧云天生物科技有限公司。免疫共沉淀试剂盒购自美国Thermo公司;DCFH-DA试剂盒、细胞核蛋白提取试剂盒、细胞胰酶消化液、青霉素-链霉素双抗均来自上海碧云天生物科技有限公司;全自动凝胶成像系统GenoSens S2 system购自上海勤翔科学仪器有限公司;细胞培养箱购自美国Thermo公司。
1.2 细胞培养人肺癌细胞株A549和H1299购自中国科学院细胞库,由实验室传代保种;利用质粒瞬时转染技术构建Nrf2敲低的细胞株(si-Nrf2)及其对照细胞株(si-NC);利用慢病毒稳定转染技术构建Nrf2敲低的细胞株(sh-Nrf2)及其对照细胞株(sh-NC)。用含10%胎牛血清、1%青链霉素的DMEM高糖培养基培养。在细胞置于37 ℃、5% CO2培养箱中培养,细胞量较少时(小于30%),隔天换液。细胞转染时采用不含血清和双抗的DMEM高糖培养基培养。
1.3 活性氧(reactive oxygen species,ROS) 检测将处于对数期的细胞用胰酶消化计数,种25万细胞到每个皿中,分为对照组、 BLM 组、NAC组及NAC+BLM 组。待细胞贴壁后,首先用1 mmol/L NAC处理NAC组及NAC+BLM 组30 min,然后再用5 μg/ml BLM处理BLM 组和NAC+BLM 组1 h。细胞完成培养后弃培养基,待反应完成后,用灭菌PBS轻柔洗涤3次后用锡箔纸包裹完全避光,放置倒置荧光显微镜下调整合适视野并观察荧光强度。使用ZEN.2011数字成像软件拍摄,各组随机选取5个视野进行荧光统计。使用软件Image J 进行分析处理,IBM SPSS Statistics 20统计分析荧光强度,使用GraphPad Prism 8绘制荧光强度分析统计图。
1.4 免疫印迹进行蛋白表达的检测将生长至对数期的对照组、BLM组、NAC+BLM组、Res+BLM组的A549和H1299正常细胞,质粒瞬时转染A549和H1299细胞组:对照组、si-NC+BLM组、si-Nrf2+BLM组,慢病毒稳定转染A549细胞组:sh-NC组、sh-NC+BLM组、sh-Nrf2组、sh-Nrf2+BLM组进行提取蛋白操作;细胞长满后用蛋白裂解液进行裂解,并收集全细胞蛋白用BCA蛋白测定试剂盒进行蛋白定量,上样后于SDS-PAGE上进行蛋白条带的分离,转膜,封闭,分别加入β-actin、Nrf2、γ-H2AX、Rad51(1 ∶1 000)抗体,4 ℃孵育过夜。经过3次洗膜,再加入相应的二抗(1 ∶2 000),洗膜3次后最后用凝胶成像仪获取蛋白条带。蛋白条带灰度值采用Image J软件分析,以β-actin为内参,目的蛋白条带的灰度值进行归一化处理。
1.5 微核形成实验将正常A549和H1299细胞分为对照组、BLM组及Res+BLM 组,质粒瞬时转染的A549和H1299细胞分为对照组和BLM组,细胞最佳状态进行实验,吸去含有BLM、Res的细胞培养基,加入新鲜完全培养基,放入细胞培养箱中1 h待细胞状态稳定后,计数后取含10 000~20 000个细胞的细胞悬液加入6孔板中(每组设3个复孔),待细胞贴壁后加入终浓度2.5 μg/ml的CB,继续培养2个细胞周期(32~36 h)后固定、染色,使用Partical Count3-2软件计数每1 000个双核细胞数中的微核细胞数。使用IBM SPSS Statistics 20统计分析,使用GraphPad Prism 8绘制微核数统计图。
1.6细胞转染① siRNA瞬时转染siRNA步骤按照转染要求进行,按照质粒与转染试剂1 ∶5的比例,对生长对数期细胞处于50%左右汇合度时进行细胞转染操作,通过荧光可初步鉴定转染效率。②shRNA构建Nrf2低表达稳定细胞株,根据预实验获知转染的病毒原液与培养基比例为1 ∶50,对生长对数期细胞处于50%左右汇合度时进行慢病毒转染操作,按照试剂说明书进行,转染 24~48 h后镜下观察状态,吸去病毒感染液,加入培养基(未加双抗)继续培养;待细胞状态稳定后,开始向培养基(加双抗和血清)中加入终浓度为1.5 μg/ml的嘌呤霉素筛选获得Nrf2低表达的稳转细胞系。
1.7 免疫共沉淀取生长状态好的A549慢病毒稳转的细胞, 进行BLM处理后,按照免疫共沉淀试剂盒操作,先行弱裂解液裂解,离心取上清液,新制备的裂解液在4 ℃下与蛋白A/G琼脂糖珠孵育30~60 min进行预清洗。含有蛋白质复合物的上清液被分离与抗Nrf2单抗或抗Rad51单抗一起孵育4 ℃过夜,然后加入Protein A/G琼脂糖凝珠,4 ℃置于摇床温和摇动4 h后,离心并用PBS洗涤分离的琼脂糖凝珠,通过Western blot进行蛋白条带的分离,并使用抗Nrf2或Rad51抗体进行蛋白分析。
1.8 统计学处理使用SPSS 24.0软件进行分析,多组间比较采用方差分析,两组间比较采用t检验。各组实验重复3次以上,P<0.05为差异有统计学意义。
2 结果
2.1 细胞内Nrf2在BLM作用下的活化DCFH-DA检测显示,BLM组与对照组相比细胞内产生的ROS的荧光强度明显上升(P<0.01);NAC组与对照组相比细胞内产生的ROS荧光强度略有下降(P<0.05);NAC+BLM组与BLM组相比细胞内产生的ROS荧光强度下降显著(P<0.01),见图1A。本研究首先观察了在NAC和BLM作用下Nrf2在A549和H1299细胞核内的蛋白表达变化,Western blot结果表明,BLM刺激后核内Nrf2蛋白表达上调(P<0.01),NAC的加入能有效抑制(P<0.01)Nrf2的核内累积,见图1B。以上结果表明,BLM引起的氧化应激能够使细胞内的Nrf2产生功能活化。

图1 细胞内Nrf2在BLM作用下的活化A:5 μg/ml BLM作用后A549和H1299肺癌细胞内ROS的荧光活性 ×200;B:抗氧化转录因子Nrf2在A549和H1299肺癌细胞核内的蛋白表达;与对照组比较:*P<0.05,**P<0.01;与BLM组比较:##P<0.01;与NAC组比较:&&P<0.01
2.2 刺激Nrf2的表达降低BLM诱导的细胞DNA损伤程度Western blot结果显示,与对照组相比,BLM组细胞Nrf2蛋白的表达上调(P<0.01);与BLM组相比,Res+BLM组细胞Nrf2的蛋白表达上调(P<0.01)。γ-H2AX蛋白表达结果显示,与对照组相比,BLM组细胞γ-H2AX蛋白表达水平上调(P<0.01),然而Res+BLM组的γ-H2AX蛋白表达水平比BLM组下调(P<0.01),见图2A。微核结果显示, 与对照组相比,BLM组细胞微核率升高(P<0.01);与BLM组相比,Res+BLM组微核率下降(P<0.01),其中A549细胞微核发生率下降10%,而H1299细胞微核发生率下降了40%左右。见图2 B。两种实验结果均显示,Nrf2的表达上调可以降低BLM诱导的细胞DNA损伤。
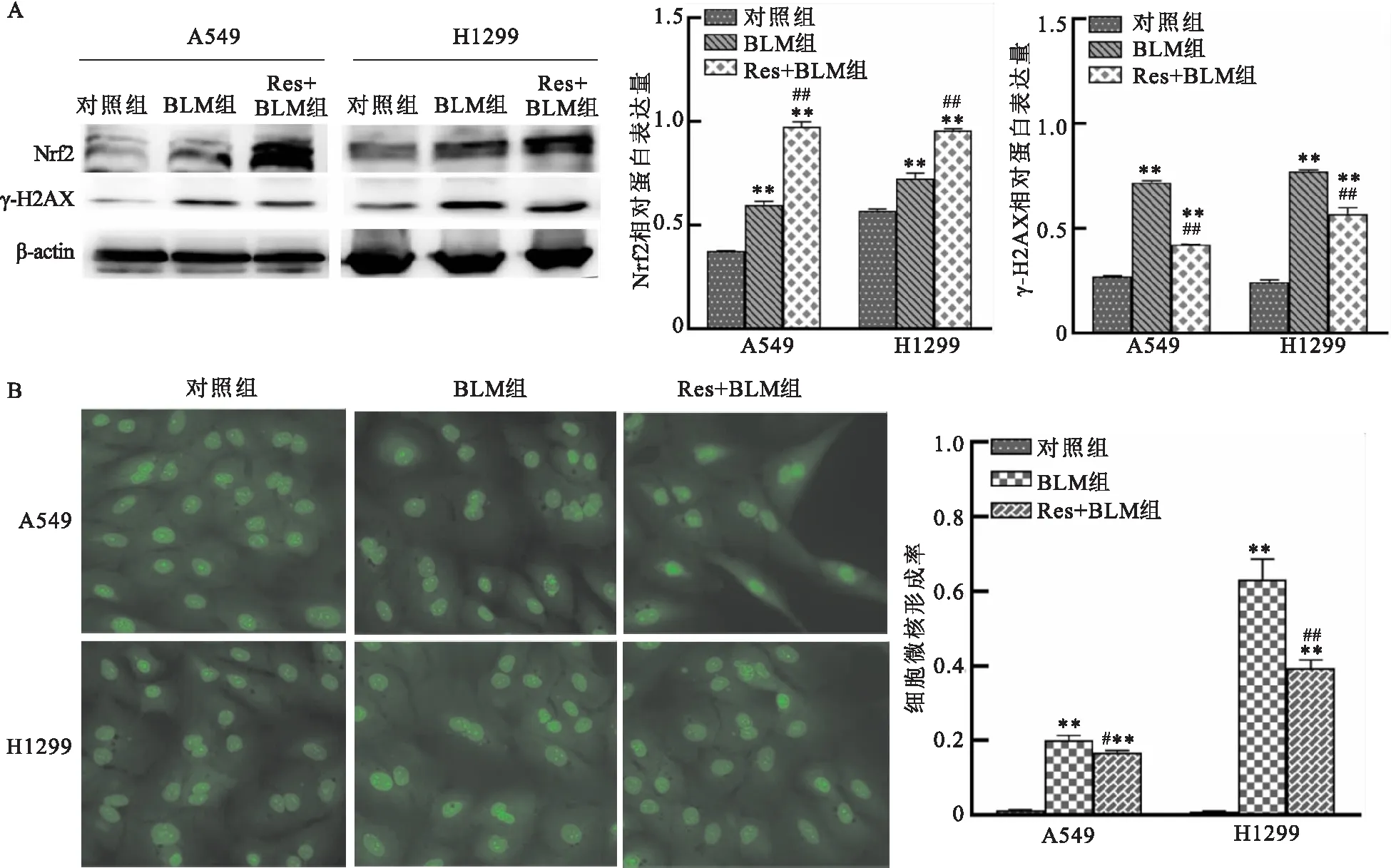
图2 刺激Nrf2的表达降低BLM引起的细胞DNA损伤A:10 μmol/L Res作用24 h 后经5 μg/ml BLM处理,抗氧化转录因子Nrf2和DNA损伤标志蛋白γ-H2AX在 A549和H1299肺癌细胞内的蛋白表达;B:10 μmol/L Res作用24 h后经5 μg/ml BLM处理,A549和H1299肺癌细胞的微核形成率 ×200;与对照组比较:**P<0.01;与BLM组比较:#P<0.05,##P<0.01
2.3 抑制Nrf2的表达增强BLM对肿瘤细胞DNA的损伤siRNA对Nrf2的表达进行干扰实验显示,与对照组相比,BLM能够引起si-NC组细胞的Nrf2表达上调(P<0.01),但BLM不能引起si-Nrf2细胞内Nrf2蛋白表达上调。与si-NC+BLM组相比,si-Nrf2+BLM组细胞的γ-H2AX蛋白水平的表达有了进一步的增强(P<0.01),见图3A。微核试验结果显示,在si-NC细胞中,BLM处理组细胞微核率高于对照组(P<0.01);si-Nrf2细胞的BLM组相较于si-NC细胞BLM组的细胞微核率有了更为显著的上升(P<0.05),见图3B。
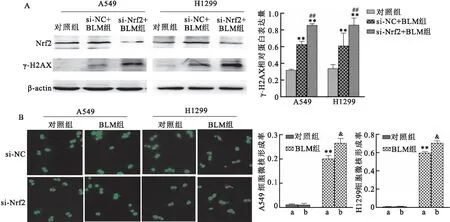
图3 干扰Nrf2的表达增强BLM引起的细胞DNA损伤A:5 μg/ml BLM作用后A549和H1299肺癌细胞内Nrf2和γ-H2AX的蛋白表达;B:10 μmol/L Res作用24 h 后经5 μg/ml BLM处理,A549和H1299肺癌的细胞微核形成情况 ×200;a:si-NC细胞;b:si-Nrf2细胞;与对照组比较:**P<0.01;与si-NC+BLM组比较:##P<0.01;与si-NC细胞的BLM 组比较:&P<0.05
2.4 Nrf2与Rad51相互作用对BLM引起的细胞DNA损伤的影响实验中构建了Nrf2低表达稳转细胞系。Western blot 结果显示,与sh-NC 组比较,sh-NC+Res组的细胞Nrf2蛋白表达水平上调(P<0.01);与sh-Nrf2 组比较,sh-Nrf2+Res组的细胞Nrf2蛋白表达水平上调(P<0.01),见图4A。 Western blot实验显示,在sh-Nrf2细胞中,Rad51表达随着Nrf2表达的抑制而同步下调(P<0.01),见图4B。免疫共沉淀实验的Western blot结果显示,Nrf2与Rad51存在相互作用:A549细胞经过BLM处理后,用IP抗体为Nrf2蛋白时,Western blot结果可以检测到Rad51蛋白的表达;同样在IP抗体为Rad51蛋白时,在最终Western blot实验中可以检测到Nrf2蛋白的表达。在BLM作用下,细胞内蛋白Nrf2通过与蛋白Rad51相互作用调控Rad51的表达,见图4C。

图4 Nrf2与Rad51相互作用降低BLM引起的细胞DNA损伤A:10 μmol/L Res 作用后A549肺癌细胞内Nrf2蛋白的表达;B:A549肺癌细胞内Nrf2和Rad51蛋白的表达;C:免疫共沉淀;a:sh-NC 组;b:sh-NC+Res 组;c:sh-Nrf2 组;d:sh-Nrf2+Res 组;与sh-NC组比较:**P<0.01;与sh-Nrf2组比较:##P<0.01
3 讨论
BLM是一种具有糖肽结构的抗癌药物,因不产生骨髓抑制,在临床上广泛应用于生殖细胞癌、淋巴癌、肺癌的治疗。BLM主要通过诱导DSBs促使肿瘤细胞凋亡而达到治疗疗效。γ-H2AX对DSBs快速敏感的反应使其被认为是DSBs早期检测的金标准。在DSB发生后,组蛋白H2AX第139位丝氨酸被磷酸化而富集到DNA断裂处,传导损伤修复信号,招募DNA损伤修复蛋白如BRCA1、Rad51、Rad50等对损伤处进行修复。故对肿瘤细胞在BLM作用后细胞内DNA的损伤及其修复机制进行探究有助于揭示肿瘤细胞耐药性的产生机制。
BLM对细胞损伤方式与辐射类似,BLM可作用于肿瘤细胞后可通过直接与DNA链的结合引起不依赖ROS的链的断裂,但同时,BLM主要通过提高细胞内ROS的产生导致细胞DNA的氧化损伤。早期研究[8]认为,BLM的抗性产生是细胞内BLM水解酶上调造成的,该酶能够水解BLM上的一个肽结构而降低BLM的活性。然而,研究[9]表明,这一机制并不是普遍存在于所有BLM抗性的细胞中。近年来,更多的关于BLM耐药的机制被提出,其中抗氧化应激机制就是其中的一种。Nrf2是对抗细胞氧化应激的一种重要转录因子,广泛存在于各种细胞及机体中。Nrf2的缺陷或调节异常可直接降低细胞应对氧化应激的敏感性[10]。该研究显示,细胞在BLM作用后,细胞内的ROS 在短期内迅速累积,通过蛋白表达检测显示,两种细胞在5 μg/ml BLM作用下,细胞核内Nrf2蛋白表达水平显著增加,暗示细胞内Nrf2转录功能的活化。用Nrf2表达刺激剂人为刺激细胞Nrf2蛋白的表达水平,显著缓解了细胞在BLM作用后的DNA损伤程度。用Nrf2的siRNA干扰Nrf2的基因表达后,细胞DNA的损伤显著增加,结果提示,Nrf2功能的活化直接降低了肿瘤细胞DNA的损伤程度,这可能就是BLM抗药性产生的一大原因。
根据先前的报告,细胞在BLM作用后,细胞处于G2/M期[11],这提示肿瘤细胞在BLM作用后DNA损伤修复机制的活化。且在辐射作用下,肿瘤细胞内DNA损伤修复相关蛋白53BP1以Nrf2依赖的方式活化,通过敲低方法抑制Nrf2时,在A549细胞中观察到辐射诱导的53BP1 foci形成显着减少[12]。这些结果表明,同源重组修复核心蛋白Rad51确实可能与Nrf2的表达相关。该研究结果显示,当Nrf2表达被抑制时,Rad51蛋白的表达水平也出现了相应的下降,表明,在BLM诱导的细胞DNA损伤修复中,Rad51的表达受Nrf2的影响。且蛋白相互作用结果显示,两者存在直接相互作用。因此猜测Nrf2不仅仅通过抗氧化途径保护细胞DNA损伤,同时还可以直接通过调控Rad51 来启动DNA损伤修复,从而降低了肿瘤细胞在BLM作用下的DNA损伤程度。当然,Nrf2与Rad51具体作用方式还有待进一步的实验研究。
综上所述,该实验提示Nrf2在肿瘤细胞对BLM抗性中存在着重要的作用,不仅仅是因为其强大的抗氧化功能,细胞内的Nrf2还可通过与Rad51相互作用调控Rad51蛋白表达水平,最终影响DNA的损伤修复。该研究为揭示Nrf2在BLM耐药中的潜在机制提供了新的思路。
