芪玉三龙汤通过PD-1信号通路增强Th1免疫反应抑制肺癌转移
2022-11-01焦安男李泽庚
焦安男,吴 欢,朱 洁,张 梅,李 平,李泽庚,陈 杨
在全球恶性肿瘤发病率和病死率的排名中,肺癌均居于首位[1],其中约85%是非小细胞肺癌(non-small cell lung cancer,NSCLC)[2],它的产生变化与肿瘤微环境改变及机体免疫系统失去平衡有紧密联系。近几年,免疫疾病的医治与调节发展迅速,在NSCLC的治疗中,程序性死亡蛋白-1(programmed death protein-1, PD-1)及其配体PD-L1抑制剂等的应用取得了良好的效果。中医药辅助治疗肺癌的效果已在多项研究中得到验证[3],芪玉三龙汤(Qiyu Sanlong Decoction,QYSLD)处方来源基于长期临床实践,前期研究[4-5]结果显示QYSLD可以抑制肺癌增殖。为进一步明确QYSLD抑制肺癌转移的作用,该研究构建了Lewis肺癌细胞株(lewis lung cancer cell line,LLC)细胞皮下移植瘤小鼠模型,从QYSLD通过介导PD-1信号通路,增强Th1免疫反应,调节肿瘤免疫微环境的角度探讨其对肺癌转移影响。
1 材料与方法
1.1 实验材料
1.1.1实验癌株 LLC购自南京科白生物,用改良的RPMI-1640的培养基,其中包含10%胎牛血清、100 U青霉素、100 μg链霉素,在37 ℃含5% CO2的培养箱中常规培养。传代一次的时间为2~3 d,开始用于实验的细胞状态为对数生长期。
1.1.2实验动物 体质量(20±2)g的无菌级雄性C57BL/6小鼠(批准号:AHUCM-mouse-2019013)72只,鼠龄8周,购自常州卡文斯实验动物有限公司,合格证号:SCXK(苏)2011-0003,饲养于安徽医科大学动物中心动物房。
1.1.3实验药物 QYSLD草药(30 g黄芪、10 g玉竹、6 g壁虎、6 g地龙、20 g龙葵、20 g白花蛇舌草、20 g薏苡仁、6 g泽漆、10 g莪术及10 g贝母)购自安徽中医药大学第一附属医院中药房,将其放1.34 L蒸馏水(1/10,W/V)中进行1 h的浸泡处理,武火煮沸30 min,文火60 min。用两个70 μm白色细胞滤网上下叠加将提取液过滤,残渣浸泡于1.07 L蒸馏水中,煮沸40 min。再通过两个70 μm白色细胞滤网上下叠加再次过滤。在50 ℃真空中将两种提取液混合浓缩至浓度为4.0 g/ml,制得QYSLD悬浮液。放置于4 ℃冰箱储存,一周内使用。用0.9%氯化钠溶液将注射用顺铂(Cisplatin,DDP)稀释至0.367 mg/ml。
1.1.4实验试剂 DMEM高糖细菌液、标准胎牛血清FBS、磷酸盐缓冲液PBS(美国HyClone公司);RPMI-1640培养基(美国Invitrogen公司);NH4Cl/Tris红细胞裂解液(上海哈灵生物有限公司);胰酶细胞消化液、青链霉素溶液(上海Beyotime公司);CCK-8试剂盒、BD CBA小鼠炎症试剂盒(上海碧云天生物技术有限公司);皮尔斯低密度脂蛋白细胞毒性检测试剂盒(美国Pierce Biotechnology公司);CD3、CD4、CD8、CD44抗体、PD1抗体(德国Merck公司);Annexin V-PE试剂(德国Calbiochem公司);荧光素FITC、荧光素PE-Cy5(美国Pierce公司);丝裂霉素C(瑞士Roche公司)。
1.1.5实验仪器 培养瓶、6孔板、96孔培养板(美国Corning公司);CKX41型倒置显微镜(日本OLYMPUS公司);MCO-175型CO2细胞培养箱(日本Sanyo公司);LD4-8型台式低速离心机(北京医用离心机厂);70 μm尼龙细胞过滤器(上海碧云天生物技术有限公司);FACSCalibur 流式细胞仪(美国BD公司);小鼠CD4+、CD8+T淋巴细胞浓缩装置(美国bd-bioscience公司)。
1.2 实验方法
1.2.1构建小鼠皮下移植瘤模型 将LLC细胞(对数生长期)用胰酶消化液消化离心(1 800 r/min×5 min)收集,再用无血清DMEM培养基重悬使其浓度为1×107个/ml,吸取0.2 ml细胞悬液,皮下注射入小鼠右前肢,构建小鼠皮下移植瘤模型[6],观察30 min,小鼠与之前比较无异常,说明接种成功。
1.2.2分组及给药 模型建立10 d 后,皮下肉眼看到及摸到3~5 mm3的小圆状硬物,待触及的硬物长到1 cm3左右以后,将每组中随机一只小鼠的移植瘤取出进行病理检测是否均为癌细胞,以此来判断建模是否成功。设置对照(Control)组、顺铂(DDP)组、芪玉三龙汤(QYSLD)组和联合(DDP+QYSLD)组,18只/组。
小鼠的顺铂给药剂量=7.34 mg/[kg·(0.2 ml/10 g)]=0.367 mg/ml[5],小鼠的腹腔注射体积为0.2 ml/10 g,但反复注射顺铂会造成小鼠肾功能不全,所以注射药量减半,即小鼠的腹腔注射体积为0.2 ml/20 g。临床上,成人的QYSLD给药量为134 g/60 kg=A。QYSLD小鼠给药剂量设为B=9.01(小鼠和人的等效剂量折算系数)×A=20.12 g/kg(与1倍的成人临床用药相当),小鼠给药体积为0.2 ml/10 g。所以,QYSLD小鼠给药剂量为1.006 g/ml(与1倍的成人临床用药相当),其4倍即4.024 g/ml。预实验结果为高剂量与中剂量效果相当,即与2倍的成人临床用药相当,因此正式实验采用2倍给药,即40.24 g/kg,为方便给药计算,采用40 g/kg。
实验分组给药如下:① 对照组:每日按照0.1 ml/10 g 0.9%氯化钠溶液灌胃,每日1次;② 顺铂组:第1、3、5日腹腔注射0.2 ml DDP溶液;③ QYSLD组:40 g/(kg·d)中药药液灌胃,每日1次;④ 联合(DDP+QYSLD)组:40 g/(kg·d)中药药液灌胃,每日1次,同时0.2 ml DDP溶液每2 d注射1次。
1.2.3观察记录小鼠一般状态 每天观察记录各组小鼠的精神活力、进食、体质量、毛发变化、大小便等各项生长情况。
1.2.4绘制肿瘤生长曲线 第1天开始每隔3 d测量1次其皮下肿瘤的长径(a)和短径(b)测量小鼠皮下肿瘤的长径(a)和短径(b),计算肿瘤体积(V),公式为:V(cm3) = ab2/2。
1.2.5标本收集与准备 21 d连续给药,在给药的第7、14和21天每组随机选取6只小鼠处死,解剖小鼠,取出脾脏,分离脾淋巴细胞,检测并分析肿瘤抗原特异性T细胞表面PD-1表达水平及肿瘤特异性Th1细胞反应。给药21 d后,将两侧肺脏从处死的小鼠胸腔中完整取出,利用解剖显微镜观察统计肺表面转移瘤结节数量。
1.2.6制备小鼠脾脏CD4+和CD8+T细胞 在给药的第7、14和21天处死小鼠,分离脾脏,使用2.5 ml注射器柱塞通过70 μm尼龙细胞过滤器制备脾脏单细胞悬浮液,用NH4Cl/Tris溶液溶解红细胞后,分别用小鼠CD4+T、CD8+T淋巴细胞浓缩装置分离CD4+和CD8+T细胞,纯度大于95%。
1.2.7ELISA法检测小鼠肿瘤抗原特异性Th1细胞反应 将骨髓细胞(bone marrow-derived dendritic cell,BMDC)从C57BL/6小鼠股骨和胫骨取出,用含2 mmol的谷氨酰胺、100 U/ml青霉素、10%胎牛血清、100 μg/ml链霉素和20 ng/ml GM-SF的RPMI-1640培养基中培养,培养基每隔3 d更换1次。培养8 d后,将BMDC与LLC细胞裂解物(10 mg/ml)共培养16 h,加入50 μg/ml丝裂霉素C作用30 min。将接种LLC细胞21 d小鼠的脾脏淋巴细胞(1×106个/ml)与BMDC(5×105个/ml)共培养60 h,细胞增殖情况通过CCK-8试剂盒进行检测。收集上述共培养后的细胞上清液,采用BD CBA小鼠炎症试剂盒应用ELISA法检测细胞培养上清液中IFN-γ和TNF-α水平。按照50 ∶1的比例将上述与BMDC共培养后的小鼠脾脏淋巴细胞与LLC细胞接种于96孔细胞培养板中,所处的培养环境设置为37 ℃、5% CO2,进行24 h的细胞培养。为了检测对LLC细胞的杀伤效应,应用ELISA法通过皮尔斯低密度脂蛋白细胞毒性检测试剂盒检测细胞培养上清液中乳酸脱氢酶(lactic dehydrogenase,LDH)水平。
1.2.8流式细胞术检测小鼠PD-1细胞及记忆性CD4+T细胞凋亡情况 按照上述时间和方法处死小鼠获得单个脾细胞,用CD16/CD32将脾细胞放在冰上孵育10 min封闭Fc非特异结合位点。将处理后的脾细胞分别与荧光素PE标记的PD-1抗体及FITC标记的CD3、CD4、CD8抗体在冰上孵育20 min后检测确定记忆T细胞中PD-1的阳性比例;将脾细胞与荧光素FITC标记的抗CD44抗体和荧光素PE-Cy5标记的抗CD4抗体,再进行Annexin V-PE凋亡染色试剂盒进行染色来检测记忆性CD4+T细胞的凋亡情况。将CD4+T细胞内的Foxp3用荧光素FITC染色,通过BD FACS Calibur流氏细胞仪将所有染色后的细胞上机检测,使用CELLQuest软件进行分析。
1.3 统计学处理采用SPSS 19.0统计软件进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 QYSLD对小鼠一般情况的影响小鼠给药第5天开始,DDP组小鼠精神活力最差,进食减少,毛发枯燥,动作迟缓,反应力降低,聚集性强,体质量降低量大,大小便量减少;Control组小鼠第7天开始精神活力一般,毛发略枯,饮食和大小便均良好;QYSLD组及联合组小鼠精神活力尚可,状态相较DDP组优,饮食良好,体质量降低不明显,毛发状态尚好。其中,小鼠的生长情况,QYSLD组最好,联合组次之,均明显优于DDP组。
2.2 QYSLD对小鼠肿瘤生长的抑制作用观察肿瘤生长曲线可知,Control组与QYSLD组曲线变化相近,DDP组与联合组曲线变化几乎一致(图1)。从肿瘤生长曲线可知,Control组与QYSLD组曲线变化相近,DDP组与联合组曲线变化几乎一致(图1)。将四个组别进行两因素析因设计的方差分析,得出QYSLD抑制肿瘤体积与质量效果不明显,差异无统计学意义,而DDP可以抑制肿瘤体积与质量,差异有统计学意义(P<0.01),联合组差异无统计学意义。结果显示,QYSLD可以平和地抑制肺癌移植瘤,尚且不能得出其与DDP联合使用有显著提高疗效的作用。

图1 肿瘤生长曲线
2.3 QYSLD对小鼠CD4+T细胞免疫反应上调作用将BMDC用特异性LCC抗原刺激,与小鼠脾淋巴细胞共培养,为评价CD4+T细胞的功能,观察细胞培养上清液中IFN-γ和TNF-α的水平及细胞增殖情况,结果显示,联合组小鼠T细胞增殖能力最强,IFN-γ和TNF-α的分泌水平最高,QYSLD组次之,对照组和顺铂组较低,差异有统计学意义(P<0.01)。CD4+调节性T细胞的功能通过流式细胞术分析CD4+CD25+Foxp3+调节性T细胞(Treg)数目来观察,结果显示,Control组小鼠中CD4+CD25+Foxp3+调节性T细胞数目显著增加,QYSLD组CD4+CD25+Foxp3+调节性T细胞数目略增加,DDP组增加幅度比QYSLD组大,联合组略减少,上述结果表明QYSLD和DDP联合使用能够上调肺癌荷瘤小鼠CD4+T细胞免疫反应。见图2。

图2 QYSLD对肺癌荷瘤小鼠CD4+T细胞免疫反应的影响A:细胞培养上清液中TNF-α的分泌水平;B:细胞培养上清液中IFN-γ的分泌水平;C:T淋巴细胞自身增殖能力变化程度;D:随着治疗时间的增加CD4+CD25+Foxp3+调节性T细胞数目的变化情况;E:不同组CD4+CD25+Foxp3+调节性T细胞数目在不同时间点的变化情况;与Control组比较:**P<0.01;与QYSLD组比较:##P<0.01
2.4 QYSLD对小鼠CD8+T细胞特异性杀肿瘤细胞效应的影响小鼠脾淋巴细胞用抗原递呈激活后,将其与LLC细胞共培养24 h后,随着接种LLC细胞时间的延长,细胞培养上清液中LDH的含量逐渐增多,杀细胞效应逐渐增强。CD8+T细胞特异性杀肿瘤细胞效应在同一时间点QYSLD组和联合治疗组两组小鼠均高于Control组(P<0.001)。结果表明QYSLD能够上调肺癌荷瘤小鼠CD8+T细胞特异性杀肿瘤细胞效应。见图3。
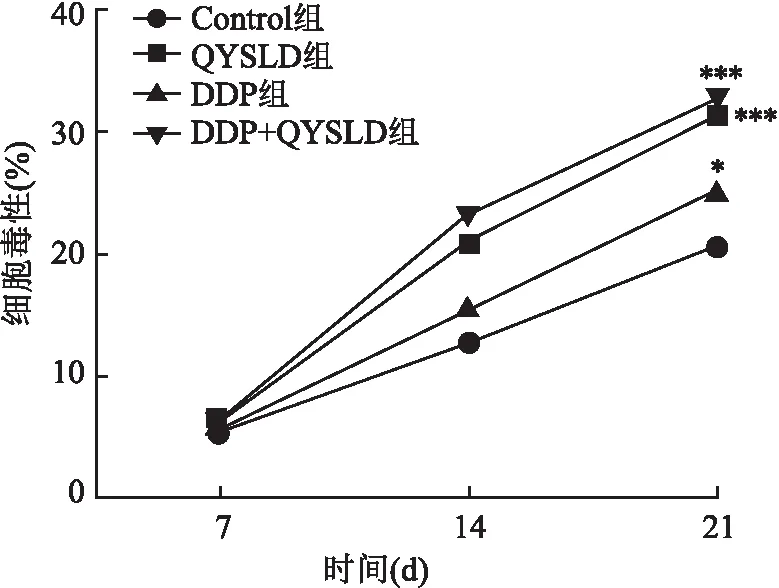
图3 QYSLD对肺癌转移小鼠CD8+T细胞特异性杀肿瘤细胞效应上调作用与Control组比较:*P<0.05,***P<0.001
2.5 QYSLD对小鼠T细胞中PD-1阳性细胞的比例的影响21 d给药后,流式细胞术检测小鼠脾脏T细胞中PD-1阳性细胞的比例显示,在对照组和顺铂组小鼠中PD-1阳性细胞的比例高于其他组(P<0.001)。结果表明QYSLD可能通过下调PD-1信号途径抑制肺癌的增殖。见图4。

图4 QYSLD对肺癌荷瘤小鼠T细胞中PD-1阳性细胞的比例的下调作用A:CD3+ T细胞中PD-1阳性细胞的比例;B:CD3+ CD4+T细胞中PD-1阳性细胞的比例;C:CD3+ CD8+T细胞中PD-1阳性细胞的比例;D:流式细胞术检测试验21 d之后各个组小鼠T细胞中PD-1阳性细胞的百分比;与Control组比较:***P<0.001
2.6 QYSLD对小鼠CD4+记忆性T细胞中凋亡细胞比例的下调作用连续21 d给药后,用流式细胞术检测肺癌荷瘤小鼠脾细胞中CD4+细胞凋亡状况,得出DDP组和Control组小鼠的CD4+细胞的凋亡比例显著高于QYSLD组和联合组(P<0.001)。以上表明QYSLD可能通过减少PD-1信号途径降低记忆性T细胞凋亡比例,增强机体免疫功能,阻止肺癌的转移。见图5。

图5 QYSLD抑制肺癌荷瘤小鼠CD4+记忆性T细胞凋亡A:不同治疗组小鼠CD44high CD4+T细胞的凋亡水平;B:不同治疗组小鼠CD44high CD4+T细胞的凋亡情况;与Control组比较:***P<0.001
2.7 QYSLD对小鼠肿瘤细胞肺转移的抑制作用连续21 d给药后处死小鼠,打开胸腔完整取出肺脏,利用解剖显微镜观察统计肺表面转移瘤结节数量,结果显示,与Control组相比,联合组小鼠肺转移瘤结节最少,DDP组次之(P< 0.001),QYSLD组也明显减少(P<0.001)。这表明QYSLD能够抑制小鼠肿瘤细胞肺转移。见图6。

图6 QYSLD能够抑制肺癌荷瘤小鼠肿瘤细胞肺转移A:不同组治疗后小鼠肺表面转移结节图片;B:各组小鼠肺表面转移结节数目比较;C:各组小鼠肺表面转移结节体积比较;与Control组比较:***P<0.001
3 讨论
近年来,在癌症治疗的各种措施中,其中免疫治疗备受关注,尤其是免疫检查点分子PD-1及其配体PD-L1的发现已成为肿瘤免疫治疗中里程碑式的标志。多项研究[7]揭示PD-1/PD-L1信号通路与肺癌相关,临床应用PD-1/PD-L1抑制剂治疗肺癌,取得了持久有效的药物反应和令人满意的治疗效果。
机体免疫功能与中医的“正气”有着紧密联系,从现代免疫学角度阐述免疫治疗与中医“扶正消积”治法的关系研究已然越来越活跃[8]。国家级名老中医韩明向教授遵循肺癌中医学病机“整体正虚、局部积聚”,提出治疗肺癌采用“益气养阴、解毒消积、化痰祛瘀”的“扶正消积”方法,根据病机治法产生了治疗肺癌的有效验方QYSLD,此方后由安徽中医药大学李泽庚教授带领的研究团队不断进行多次基础研究并更新改良而最终形成。
Th细胞是T细胞亚群,在机体免疫中有重要功能,是机体内一类重要的免疫调节细胞,根据分泌出的细胞因子的不同主要将Th细胞分为Th1细胞与Th2细胞两种。Th1细胞可以促进细胞免疫[9],Th2细胞参与体液免疫应答以及抗体的生成[10]。生理状态下,二者相对平衡,这是机体维持正常免疫功能重要条件之一,二者平衡失调,则机体免疫应答功能降低,进而使肿瘤免疫逃逸。
T细胞由多个免疫检查点共同调控激活,而PD-1是其应答途径中的一员,PD-1是由PD-1基因编码的Ⅰ型跨膜糖蛋白,共有PD-L1和PD-L2 两个配体,其中PD-L1是其主要配体[11]。PD-L1由于肿瘤细胞及其微环境的促进作用而过表达,PD-1/PD-L1信号通路进而激活,从而宿主的免疫反应被限制,适宜肿瘤生长的微环境也就形成,机体不能够约束肿瘤细胞,致使其免疫逃逸[12]。PD-1/PD-L1抑制剂可以抑制PD-1/PD-L1信号通路,进而调节肿瘤生存环境,恢复T细胞对肿瘤的监视和杀伤作用,提高了内源性抗肿瘤的免疫应答功能[13],最终发挥抗肿瘤作用。
