宫颈癌细胞过表达酪氨酸激酶受体1对其肿瘤相关内皮细胞恶性生物学行为的影响
2022-11-01孙倩玉
孙倩玉,韦 艳,白 瑞,杨 萍
宫颈癌居全球女性常见恶性肿瘤第四位,居女性癌症死亡原因的第四位[1]。据统计,我国2020年宫颈癌新发病例达11万,已成为第二位宫颈癌负担国[2]。在肿瘤微环境中,肿瘤相关内皮细胞(tumor related endothelial cells, TRECs)受肿瘤细胞直接或间接影响生成新生血管,为肿瘤恶性进展提供条件[3-4]。血管生成素(angiopoietin,Ang)/酪氨酸激酶受体(tyrosine kinase receptor,Tie)通路参与血管新生机制[5-6],Tie-1为此通路重要成员。课题组前期研究[7]表明,Tie-1在部分宫颈癌细胞(cervical cancer cells, CCCs)中高表达与患者不良预后有关;但Tie-1在TRECs中表达情况及其是否与患者预后有相关性尚不明确。该研究进一步扩大样本量以探究CCCs与其TRECs中Tie-1表达的相关性,并通过细胞共培养法探究过表达Tie-1的宫颈癌细胞对其TRECs生物学行为的影响,为宫颈癌抗肿瘤血管生成治疗提供新思路。
1 材料与方法
1.1 材料
1.1.1病例资料 选择2008年11月—2019年12月在石河子大学第一附属医院妇科经病理学检查确诊为宫颈癌的96例患者为研究对象,年龄为35~83(53.16±11.36)岁,术前均未接受过放化疗。收集患者年龄、FIGO分期(2018年版)、肿瘤直径、分化程度、宫颈肌层浸润深度、肿瘤类型、淋巴脉管间隙浸润、淋巴结转移等临床病理资料,按照不同病理特征分组(见表1)。对患者行术后随访,记录患者无瘤生存时间(progression-free survival,PFS)和总生存时间(overall survival,OS)。无瘤生存时间是指从手术日至有证据标明肿瘤复发之日或末次随访日期的时间;总生存时间是指手术日至死亡日或末次随访日期的时间。
1.1.2试剂与材料 Tie-1过表达慢病毒购自上海和元生物技术有限公司(货号:H17481);Tie-1及β-actin抗体购自英国Abcam公司;DMEM培养基(货号:C11995500BT)、胎牛血清(货号:10099141)、Hyclone胰酶(货号:25200-056)等购自德国Gibco公司;细胞共培养Transwell小室(货号:3413)、细胞侵袭迁移Transwell小室(货号:3422)、Matrigel基质胶(货号:354234)购自美国康宁公司。
1.1.3细胞 人宫颈癌HeLa细胞(货号:XF0314)、人脐静脉内皮细胞HUVEC(货号:XF1122)购自上海复祥生物科技有限公司。所有细胞均用含10%胎牛血清的DMEM完全培养基于37 ℃、5% CO2培养箱中培养。
1.2 方法
1.2.1免疫组化 采用免疫组化染色检测96例宫颈癌患者石蜡组织切片中CCCs及TRECs Tie-1的表达,实验步骤参考文献[7],Tie-1抗体工作过浓度为1 ∶500。Tie-1在CCCs及TRECs中的表达均为胞质内棕黄色颗粒,呈全或无染色,且染色均匀。随机选取3个视野,根据CCCs或TRECs细胞染色的强度分别评分:无染色记为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。染色评分小于2分为低表达,≥2分为高表达。
1.2.2细胞转染 本实验按照慢病毒转染说明书所示操作步骤进行。将宫颈癌HeLa细胞接种于6孔板中,待细胞汇合度约60%时加入含过表达Tie-1基因序列(Tie1-Overexpression, Tie1OE)或空载体基因序列(natural control, NC)的慢病毒,12 h后更换新鲜的完全培养基,24 h后更换含嘌呤霉素(2 μg/ml)的完全培养基连续筛选7 d。用Western blot法检测过表达Tie-1的HeLa细胞(HeLa-Tie1-Overexpression,HeLa-Tie1OE)及空转染对照组HeLa细胞(HeLa-Natural control,HeLa-NC)Tie-1蛋白表达水平。
1.2.3细胞共培养实验 本实验采用膜孔径为0.4 μm的Transwell小室构建细胞共培养模型,于上室接种HeLa-Tie1OE或HeLa-NC细胞,下室接种HUVEC细胞,细胞数均为2×104个,在含10%胎牛血清的DMEM培养基中共培养。48 h后移除上室,下室中的HUVECs即为宫颈癌TRECs[8],根据共培养时上室的HeLa细胞不同,将共培养后获得的TRECs分别记为HUVECs+HeLa-Tie1OE、HUVECs+HeLa-NC,以单独培养的HUVECs原株作为空白对照组。Western blot检测不同共培养体系下获得的TRECs细胞Tie-1蛋白表达水平。
1.2.4Western blot实验 实验步骤参考文献[9]。用细胞裂解液于冰上提取细胞总蛋白,取等质量蛋白行凝胶电泳,将目的蛋白转至PVDF膜上,用5%脱脂牛奶封闭1.5 h,将膜置于含β-actin(1 ∶1 000)或Tie-1(1 ∶1 000)的一抗反应液中4 ℃孵育过夜,TBST洗膜后用相应二抗(1 ∶10 000)孵育1.5 h,再次洗膜后用ECL化学发光液显影,通过分析条带灰度值计算相应蛋白表达水平。
1.2.5细胞划痕实验 将共培养体系中获得的2种TRECs(HUVECs+HeLa-Tie1OE、 HUVECs+HeLa-NC)及HUVECs,分别以5×105个细胞/孔接种于6孔板中,每孔加入2 ml完全培养基培养,待细胞汇合度近100%时进行划痕处理并换为无血清DMEM培养基培养。分别于划痕后0、12、24 h用显微镜定点观察并拍照。Image J软件分析图片中划痕剩余面积,计算细胞迁移面积并进行统计分析。
1.2.6细胞侵袭实验 实验前将Matrigel基质胶于4 ℃冰箱中解冻,将基质胶按1 ∶4用DMEM稀释,在Transwell上室中加入50 μl稀释后的基质胶,放入37 ℃培养箱中30 min至胶凝。用DMEM分别将HUVECs+HeLa-Tie1OE、HUVECs+HeLa-NC及HUVECs细胞的浓度调整为15×104个/ml,于上室加入200 μl细胞悬液,下室加入800 μl含20%胎牛血清的DMEM,于37 ℃、5% CO2培养箱中培养。48 h后取出上室,用棉签擦去上层基质胶和未穿过膜的细胞,将小室置于4%多聚甲醛固定15 min,结晶紫染色30 min后PBS洗3次。于200倍镜下随机选取4个视野拍照,计算穿过小室的细胞数。
1.2.7细胞迁移实验 与细胞侵袭实验步骤基本相同,其中Transwell小室上室不加基质胶,且细胞接种后于培养箱培养24 h后取出行固定、染色、拍照、计数。
1.2.8小管生成试验 将基质胶按1 ∶5用DMEM稀释,在96孔板中每孔加入50 μl稀释后的基质胶,放入37 ℃培养箱中至基质胶凝固,分别将HUVECs+HeLa-Tie1OE、HUVECs+HeLa-NC、HUVECs用DMEM调整细胞浓度为1×105个/ml,每孔接种100 μl。接种9 h后于200倍镜下选取4个视野拍照并对每组细胞所形成的血管节点进行计数。
2 结果
2.1 Tie-1在CCCs和TRECs的表达免疫组化结果显示,Tie-1在96例宫颈癌患者癌组织中CCCs及TRECs的高表达率分别为51.0%(49/96)和 53.1%(51/96)。相关性分析结果显示,Tie-1在宫颈癌患者癌组织中CCCs的表达与其在TRECs中的表达呈正相关(r=0.709,P<0.001)。见图1。

图1 Tie-1在宫颈癌组织中CCCs及TRECs的表达强度呈正相关 IHC ×400A、 B:宫颈鳞癌;C、D:宫颈腺癌;黑箭头:CCCs;红箭头:TRECs
2.2 Tie-1在宫颈癌患者组织中TRECs的表达与患者临床病理特征的相关性Tie-1在FIGO(2018)分期为ⅠB2-ⅡA2期、肿瘤直径≥4 cm、腺癌、中低分化、宫颈肌层浸润深度≥1/2全层的宫颈癌TRECs中的高表达率分别高于ⅠA1-ⅠB1、肿瘤直径<4 cm、鳞癌、高分化、宫颈肌层浸润深度<1/2全层宫颈癌患者,差异均有统计学意义(P<0.05),见表1。

表1 Tie-1在宫颈癌TRECs中的表达与患者临床病理特征的关系[n(%)]
2.3 Tie-1在宫颈癌TRECs中的表达及与患者预后的关系对96例宫颈癌患者进行随访,失访7例,中位随访时间为48(22~123)个月,其中24例复发,19例死亡。Kaplan-Meier生存分析显示, 89例患者中TRECs Tie-1高表达者5年累积PFS[63.0%(29/46)]及OS[67.4% (31/46)]均低于TRECs Tie-1低表达者的PFS[83.7%(36/43)]及OS[90.7%(39/43)],差异有统计学意义(PPFS=0.019,POS=0.005),见图2A、B。

图2 TRECs中Tie-1的不同表达的宫颈癌患者PFS(A)和OS(B)对应的生存曲线图与Tie-1低表达组比较:*P<0.05,**P<0.01
2.4 HUVECs与过表达Tie-1的宫颈癌细胞共培养后其 Tie-1表达情况用慢病毒转染法构建Tie-1过表达的HeLa细胞,结果显示,与HeLa-NC组及HeLa组相比,HeLa-Tie1OE组细胞Tie-1的表达水平明显升高,差异有统计学意义(F=50.78,P<0.001),如图3A、B;HeLa细胞Tie-1过表达成功后,将HeLa-Tie1OE、HeLa-NC细胞细胞分别与HUVECs共培养,结果显示,相较于HUVECs+HeLa-NC共培养获得的TRECs或HUVEC原株细胞,HUVECs+HeLa-Tie1OE共培养获得的TRECs其Tie-1的表达水平升高(F=3.867,P=0.018),图3C、D。
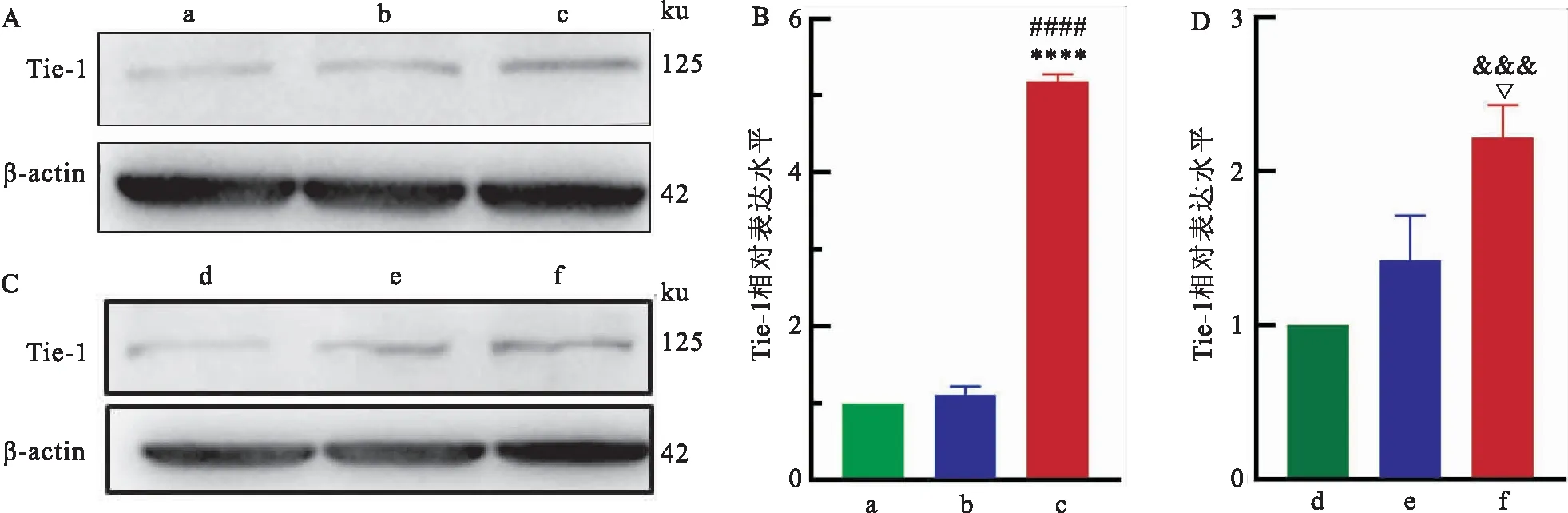
图3 HUVECs与过表达Tie-1的HeLa细胞共培养后TRECs Tie-1表达情况A、B:Western blot检测各转染组HeLa细胞Tie-1表达情况灰带图及图灰度值统计分析图;C、D:Western blot检测共培养体系下各组TRECs的Tie-1的表达情况灰带图及图灰度值统计分析图;a: HeLa组;b: HeLa-NC组;c: HeLa-Tie1OE组;d: HUVECs组;e: HUVECs+HeLa-NC组;f: HUVECs+HeLa-Tie1OE组;与HeLa组比较:####P<0.000 1;与HeLa-NC组比较:****P<0.000 1;与HUVECs组比较:&&&P<0.001;与HUVECs+HeLa-NC组比较:▽P<0.05
2.5 过表达Tie-1的宫颈癌HeLa细胞对其TRECs侵袭和迁移能力的影响细胞划痕实验显示,与HUVECs及HUVECs+HeLa-NC共培养获得的TRECs相比,HUVECs+HeLa-Tie1OE共培养获得的TRECs在第12、24小时迁移距离均增加,差异有统计学意义(F12 h=8.916,P<0.001,F24 h=13.068,P<0.001),见图4A、B。Transwell侵袭及迁移实验显示,与HUVECs及HUVECs+HeLa-NC共培养获得的TRECs相比,HUVECs+HeLa-Tie1OE共培养获得的TRECs穿过小室的细胞数更多,差异有统计学意义(F迁移=124.1,P<0.000 1;F侵袭=17.90,P<0.001),见图4C、D。

图4 过表达Tie-1的宫颈癌HeLa对其TRECs侵袭和迁移能力的影响A:细胞划痕实验白光图 ×100;B:细胞划痕实验统计分析折线图;C:Transwell细胞侵袭和迁移实验白光图 结晶紫染色 ×200;D、E:Transwell细胞迁移和侵袭实验统计分析柱状图;a: HUVECs组; b: HUVECs+HeLa-NC组; c: HUVECs+HeLa-Tie1OE组;与HUVECs组比较:#P<0.05,###P<0.001,####P<0.000 1;与HUVECs+HeLa-NC组比较:**P<0.01,***P<0.001,****P<0.000 1
2.6 宫颈癌HeLa细胞Tie-1过表达对其TRECs小管生成能力的影响体外小管生成试验显示,与HUVECs原株细胞及HUVECs+HeLa-NC共培养获得的TRECs相比,HUVECs+HeLa-Tie1OE共培养获得的TRECs生成血管节点数更多,差异有统计学意义(F=10.86,P=0.001 2),见图5A、B。

图5 过表达Tie-1的宫颈癌HeLa细胞对其TRECs小管生成能力的影响 A:小管生成试验白光图 ×200; B:小管结点生成数量统计分析图;a: HUVECs组; b: HUVECs+HeLa-NC组;c: HUVECs+HeLa-Tie1OE组;与HUVECs组比较:##P<0.01;与HUVECs+HeLa-NC组比较:**P<0.01
3 讨论
近年来我国宫颈癌发病率和病死率逐年增高[10],早期宫颈癌患者尚能得到有效治疗,但晚期宫颈癌患者常因缺乏有效治疗手段预后较差。目前抗肿瘤血管生成已成为难治性宫颈癌的治疗手段之一,其中抗血管内皮生长因子类药物被广泛应用,但此类药物存在多种副作用,治疗效果也因人而异[11]。研究[5]表明,除常见的血管内皮生长因子外,Tie-1所在的Ang/Tie通路也参与肿瘤血管生成过程。目前,Tie-1在多种肿瘤中被发现呈高表达,其在肿瘤生长和进展中的作用已成为研究热点,但在宫颈癌中的研究报道尚少。
Tie-1在一些肿瘤的癌细胞或TRECs中高表达并提示患者不良预后[5,7,12]。有研究[5]表明,Tie-1在胃腺癌细胞高表达与患者的生存率呈负相关,并且在结直肠腺癌中的表达与肿瘤组织学分级、肿瘤浸润深度、Duke分类和淋巴浸润存在显著相关性。在卵巢癌中,Tie-1在癌细胞中高表达不仅提示患者预后差,还与顺铂耐药性有关[12]。前期,该课题组[7]研究表明Tie-1在宫颈癌上皮细胞中高表达与患者不良预后有关。另外,Tie-1在浸润性导管性乳腺癌的TRECs中高表达并且其高表达与患者癌细胞淋巴结转移相关[5]。在具有转移潜能的黑色素瘤细胞中Tie-1高表达,并且在黑色素瘤转移瘤中的微血管中检测到Tie-1 mRNA表达呈强阳性[13]。该研究表明,在宫颈癌组织TRECs中Tie-1的高表达与患者临床分期、肿瘤直径、分化程度、肿瘤类型等病理特征相关,并且与患者不良预后有关。有研究[14]表明,若没有新生血管生成,肿瘤生长会受到抑制;该研究显示,当肿瘤直径分界分别为4 cm(P<0.001)时差异有显著统计学意义(表1),提示宫颈癌组织TRECs中Tie-1的高表达与肿瘤大小密切相关。另外,局部晚期宫颈癌肿瘤直径通常大于4 cm,提示Tie-1在局部晚期宫颈癌TRECs中高表达可能与宫颈癌进展有关。
Tie-1对肿瘤血管生成及成熟具有重要作用[6,15]。在小鼠实验模型中,Tie-1缺陷的小鼠虽然没有明显的血管生成障碍,但是它们的血管系统不能成熟,胚胎在妊娠后期即死亡[15]。另外,在小鼠原发性肿瘤生长期间,内皮细胞中Tie-1缺失会导致肿瘤微血管密度降低、血管生成减少和血管正常化增强使肿瘤内坏死逐渐增加[6]。在Ang/Tie通路中,Tie-1能与Tie-2结合形成多聚体,稳定Tie-2磷酸化信号,正向调控Ang/Tie-2信号传导,促进内皮细胞的存活和迁移,在肿瘤微环境中,内皮细胞侵袭迁移能力提高可促进血管的新生[15]。本研究显示,Tie-1在宫颈癌组织中CCCs和TRECs中的表达呈正相关,并通过体外共培养实验验证了这一结果;其次,TRECs中Tie-1表达升高促进了其侵袭、迁移及小管生成能力。以上说明宫颈癌细胞可能通过某种方式影响了其TRECs中Tie-1表达并促进了TRECs形成新生血管,其具体机制仍需要进一步探究。
综上所述,该研究表明,Tie-1在子宫颈CCCs与TRECs的表达呈正相关,且TRECs中Tie-1的高表达与患者肿瘤临床分期、肿瘤直径、癌组织浸润深度、分化程度、肿瘤类型相关,与患者5年累积PFS及OS呈负相关,提示宫颈癌TRECs中Tie-1高表达患者生存时间相对较短,预后较差。此外,细胞实验表明,HUVECs与过表达Tie-1的HeLa细胞共培养后获得的TRECs其Tie-1表达水平升高,且此细胞的侵袭、迁移和小管生成能力增强。因此,Tie-1在宫颈癌TRECs中的高表达有望作为潜在的宫颈癌血管标志物来预测患者预后,并可能成为优于VEGF的宫颈癌抗肿瘤血管生成治疗靶点。
