2-BFI对氟化钠致SH-SY5Y细胞损伤的保护作用
2022-11-01张才溢耿德勤
徐 婉,张才溢,闫 微,耿德勤
地方性氟中毒(以下简称“地氟病”)是以氟骨症、氟斑牙为主要特征的一种慢性全身性疾病[1]。有研究[2]表明,过量氟暴露会导致中枢神经系统结构受损和功能障碍。唑啉化合物2-(2-苯并呋喃基)-2-咪唑啉[2-(2-benzofuranyl) 2-imidazoline, 2-BFI]是咪唑啉2受体的选择性配体,在中枢神经系统线粒体膜上强烈表达,有研究[3]表明2-BFI对神经系统具有保护作用。但是2-BFI对地氟病的神经毒性是否具有保护作用,还有待进一步研究。该实验通过应用SH-SY5Y细胞建立地氟病模型,观察细胞凋亡及对线粒体功能的变化,探究2-BFI对氟中毒的保护作用。
1 材料与方法
1.1 主要仪器与试剂NaF购自上海阿拉丁试剂有限公司;2-BFI购自英国TOCRIS生物科技公司;DMEM高糖培养基、胎牛血清、0.25%胰蛋白酶购自美国Gibco公司;青链霉素溶液、CCK-8试剂盒、TRIzol购自徐州Vicmed公司;多功能酶标仪购自美国BioTek公司;倒置荧光显微镜购自日本Olympus公司;cleaved caspase-3、Tubulin抗体购自美国CST公司;Bcl-2、Bax抗体购自沈阳万类生物科技有限公司;SDS-PAGE凝胶快速配制试剂盒、BCA蛋白检测试剂盒、RIPA裂解液、增强型ATP检测试剂盒、线粒体红色荧光探针(Mito-tracker red CMXRos,TMRM)试剂盒(C1049B)购自上海碧云天生物技术公司;奥德赛激光成像系统购自美国LI-COR公司;Tunnel试剂盒(货号:MA0224)购自大连美仑生物公司;透射电子显微镜购自上海NULL公司。
精密称取NaF粉末41.99 mg,加入50 ml PBS缓冲液混匀至完全溶解,配制成20 mmol/L的储存液;在1 mg 2-BFI粉末中加入4.49 ml PBS缓冲液混匀至完全溶解,配制成1 mmol/L的母液,0.22 μm无菌过滤器过滤后于-20 ℃保存,按需要浓度培养基稀释后使用。
1.2 细胞培养与分组SH-SY5Y细胞购自中国科学院上海细胞库;SH-SY5Y细胞在DMEM高糖培养基(含10%胎牛血清和1%青链霉素)中,于37 ℃、5% CO2培养箱中培养。分组方法:① NaF筛选实验分组,将细胞随机分为对照组(不做处理)和实验组(加入浓度为0.5、1.0、1.5、2.0、4.0 mmol/L的NaF培养24 h)[4];② 2-BFI筛选实验分组,将细胞分为对照组(不做处理)、损伤组(仅NaF)、2-BFI组(NaF和浓度为2.5、5.0、10.0、20.0、40.0 μmol/L的2-BFI培养24 h)[5];③ 药物浓度筛选之后将SH-SY5Y细胞随机分为对照组(不做处理)、NaF组、NaF + 2-BFI组,处理24 h。
1.3 CCK-8法检测细胞活性将细胞按分组加入不同药物作用24 h后,加入CCK-8试剂10 μl,37 ℃孵育2 h,用酶标仪测量450 nm波长处吸光度(A)值。设置不含任何药物和细胞的等体积的培养液为空白孔。细胞存活率=(A实验孔-A空白孔)/(A对照孔-A空白孔)×100%。
1.4 ATP浓度测定吸除培养基,每孔加入200 μl裂解液,4 ℃、 12 000 r/min离心5 min,取上清液测定浓度:加100 μl ATP检测工作液到检测孔内,室温放置3 min,以消耗本底ATP。在检测孔内加入20 μl样品或标准品,迅速混匀,用荧光酶标仪进行测定,根据标准曲线计算出样品中ATP的浓度[6]。
1.5 线粒体膜电位检测应用TMRM染色检测线粒体膜电位。取出孔板,吸除细胞培养液,加入PBS洗涤1次,加入2 μl TMRM染色液和198 μl PBS,轻轻混匀。37 ℃孵育15 min后,移液器吸弃TMRM工作液,加入37 ℃预热的新鲜细胞培养液。用倒置荧光显微镜观察、拍照。
1.6 透射电子显微镜将药物处理好的细胞胰酶消化离心,收集细胞,用2.5%戊二醛固定、脱水、包埋、固化,将制备好的样本进行超薄切片,用3%醋酸铀-枸橼酸铅双重染色,然后用透射电镜进行观察、拍照。
1.7 TUNEL染色法用PBS洗涤细胞孔板后,加入组织固定液于室温下固定30 min,通透5 min,加入50 μl TUNEL检测液,使检测液均匀覆盖在样本上,37 ℃避光孵育60 min,DAPI染色液室温孵育5 min。荧光显微镜下观察细胞染色结果,显示红色荧光的细胞为凋亡细胞。细胞凋亡率=凋亡细胞数/细胞总数×100%。
1.8 蛋白质印迹法每个大皿加入150 μl细胞裂解液(RIPA ∶PMSF=100 ∶1),裂解完全后置于提前预冷至4 ℃的离心机中,12 000 r/min转速下离心20 min。通过BCA法测定蛋白浓度,配平后煮沸使蛋白充分变性。15% SDS-PAGE电泳分离蛋白,湿转至NC膜,5%脱脂牛奶封闭2 h,加入一抗于4 ℃冰箱孵育过夜,二抗室温孵育2 h后使用奥德赛系统扫描条带,用Image J软件分析图像,以目的蛋白与内参蛋白的吸光度比值作为结果进行统计分析。
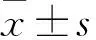
2 结果
2.1 NaF对SH-SY5Y细胞活性的抑制作用CCK-8结果显示,SH-SY5Y细胞的生长受到不同浓度的NaF的抑制,且细胞存活率随NaF浓度的升高呈下降趋势。与对照组相比,NaF 1.5 mmol/L组(F=12.89,P<0.05)、NaF 4.0 mmol/L组(F=12.89,P<0.001)细胞存活率下降,差异有统计学意义。以上提示NaF 1.5 mmol/L时开始出现明显抑制作用,当NaF浓度为4.0 mmol/L时,细胞抑制作用过度。当NaF质量浓度太低时,不能有效抑制细胞增殖,而NaF浓度过高则会引起细胞死亡过量,因此本实验选用2.0 mmol/L处理24 h作为后续研究的最佳浓度。见图1。

图1 NaF对细胞增殖的影响与对照组比较:*P<0.05,**P<0.01,***P<0.001
2.2 2-BFI对SH-SY5Y细胞增殖的影响用2.0 mmol/L NaF处理24 h后再加入不同浓度的2-BFI处理24 h。CCK-8结果显示,当2-BFI浓度在2.5 μmol/L到10 μmol/L之间,细胞活性随药物浓度的升高而升高。与NaF组相比,2-BFI浓度为10 μmol/L时细胞存活率最高为99.16%(F=21.18,P<0.001),差异有统计学意义;当2-BFI浓度大于10 μmol/L时,细胞存活率随2-BFI浓度升高反而下降,2-BFI浓度为40 μmol/L时,细胞存活率与10 μmol/L组相比,差异有统计学意义(F=21.18,P<0.01)。见图2。以上说明2-BFI发挥保护作用存在一个最佳浓度范围,浓度过高对细胞会产生损伤作用。因此,2-BFI最佳作用浓度为10 μmol/L。
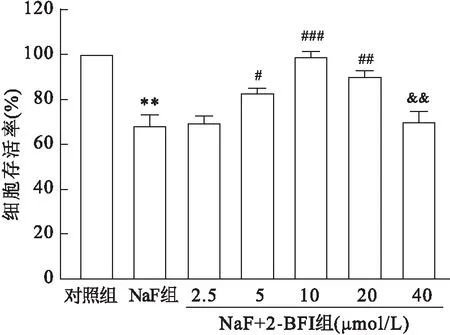
图2 2-BFI对细胞增殖的影响与对照组比较:**P<0.01;与NaF组比较:#P<0.05,##P<0.01,###P<0.001;与NaF+2-BFI 10 μmol/L组比较:&&P<0.01
2.3 2-BFI对SH-SY5Y细胞线粒体形态的影响通过电镜观察可知,对照组SH-SY5Y细胞线粒体呈椭圆形,线粒体嵴清晰,结构完整;NaF组线粒体出现不同程度结构缺失,线粒体肿胀,结构松散,甚至部分呈空泡状,形态延长,出现丝状和管状线粒体;2-BFI组大部分线粒体结构正常,有部分嵴模糊,但基本具有完整结构。见图3。

图3 2-BFI对线粒体形态的影响 ×25 000A:对照组;B:NaF组;C:2-BFI组
2.4 2-BFI对线粒体功能的影响与对照组比较,NaF组ATP水平下降(F=1 155,P<0.001);与NaF组比较,NaF+2-BFI组SH-SY5Y细胞的ATP水平升高(F=1 155,P<0.001。见图4。与对照组相比,NaF组TMRM荧光强度降低(F=15.61,P<0.01);与NaF组比较,NaF+2-BFI组TMRM的荧光信号升高(F=15.61,P<0.01)。见图5。以上结果提示2-BFI可以改善NaF引发的线粒体膜电位(Δψm)的降低情况。
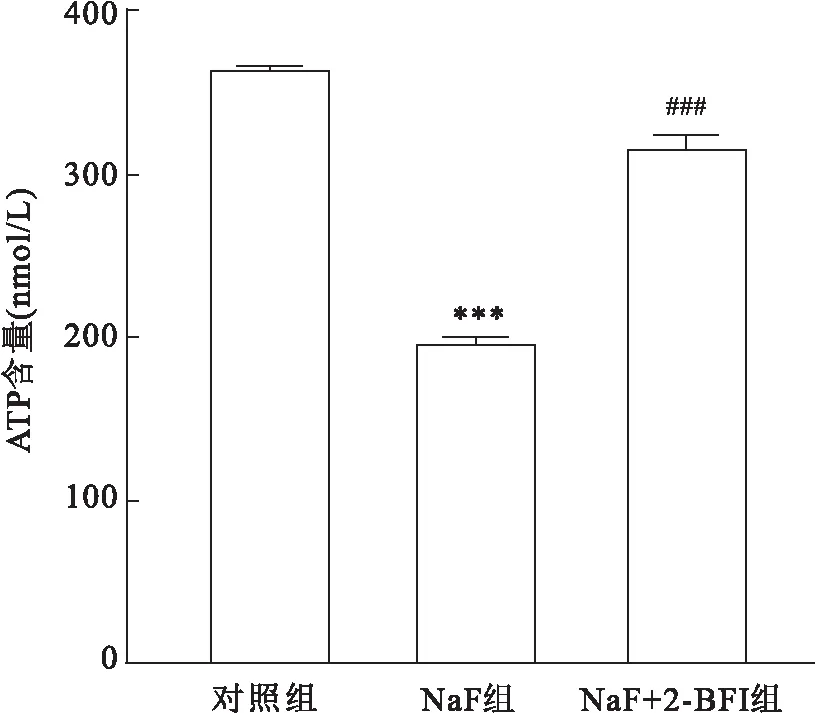
图4 2-BFI 对ATP水平的影响与对照组比较:***P<0.001;与NaF组比较:###P<0.001
图5 2-BFI 对线粒体膜电位的影响 TMRM染色 ×20A:对照组;B:NaF组;C:NaF+2-BFI组;D:各组荧光强度统计;与对照组比较:**P<0.01;与NaF组比较:##P<0.01
2.5 2-BFI对细胞凋亡的影响TUNEL染色结果显示,与对照组比较,NaF组阳性细胞数量增多,凋亡率升高(F=15.61,P<0.01);与NaF组比较,NaF+2-BFI组凋亡率下降(F=15.61,P<0.05)。见图6。提示2-BFI可以缓解NaF引发的细胞凋亡。

图6 2-BFI对氟中毒细胞凋亡率的影响 TUNEL荧光染色 ×20A:对照组;B:NaF组;C:NaF+2-BFI组;D:凋亡率统计;与对照组比较:**P<0.01;与NaF组比较:#P<0.05
与对照组比较,NaF组的促凋亡蛋白cleaved caspase-3、Bax含量升高(F=73.76,P<0.001;F=17.73,P<0.01),抑制凋亡的Bcl-2含量降低(F=39.33,P<0.01)。见图7。与NaF组相比,2-BFI组的cleaved caspase-3、Bax蛋白含量降低(F=73.76,P<0.01;F=17.73,P<0.05),Bcl-2蛋白含量有所升高(F=39.33,P<0.01)。
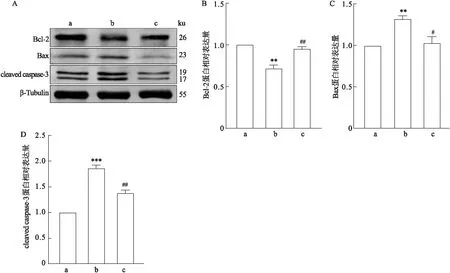
图7 2-BFI对氟中毒细胞cleaved caspase-3、Bax和Bcl-2蛋白的影响a: cleaved caspase-3、Bax和Bcl-2蛋白条带图;B-D:条带定量分析统计图;a:对照组;b:NaF组;c:NaF+2-BFI组;与对照组比较:**P<0.01,***P<0.001;与NaF组比较:#P<0.05,##P<0.01
3 讨论
氟是自然界分布广泛的元素之一,由于氟化物高度可溶,可通过饮用、食物等介质进入人体,当人体过量摄入氟后,氟化物可以从胃肠吸收进入血液,然后再通过扩散透过生物膜如血脑屏障,从而对中枢神经系统产生影响[7]。据报道,产前暴露于氟的小鼠大脑中的氟含量比未暴露的动物高1.5倍[8];长期接触氟化物后,工人出现了嗜睡、记忆力减退和注意力障碍等神经精神症状[9]。本研究显示,随着氟化钠浓度的升高,SH-SY5Y细胞增殖受到抑制,细胞存活率不断下降,表明过量的氟会对神经系统产生毒性作用。
2-BFI分子量小,极易透过血脑屏障。2-BFI在小胶质细胞中通过抗脂质氧化作用,稳定线粒体膜电位,减少凋亡蛋白释放,抑制细胞凋亡,对神经损伤产生保护作用[10]。本实验结果显示,应用2-BFI处理NaF损伤的SH-SY5Y细胞,可显著提高细胞存活率,表明2-BFI在地方性氟中毒中有神经保护作用。
线粒体是真核生物进行氧化代谢的重要的细胞器,且一直处在分裂和融合的过程中,线粒体的形态在线粒体正常功能维持过程中起着非常重要的作用[11]。由于大脑需要消耗大量的能量执行功能活动,然而大脑糖酵解能力不足,所以几乎全部依靠线粒体经氧化磷酸化过程产生的ATP来供能,且氟化物易在神经系统积聚,所以神经细胞的线粒体更容易受到氟化物的作用而受到损伤[12]。本研究结果表明,氟化钠作用于SH-SY5Y细胞后,线粒体功能障碍。2-BFI处理24 h之后,有效提高ATP生产量,稳定线粒体膜电位,表明在细胞氟中毒实验中,2-BFI可以通过稳定持线粒体形态和功能发挥神经保护作用。
细胞凋亡是细胞程序性死亡的一种形式,它会对各种不同的毒性刺激做出反应[13]。为了进一步检测2-BFI在细胞凋亡中是否发挥作用,该研究通过TUNEL染色法检测了细胞凋亡率,同时检测了凋亡通路相关蛋白cleaved caspase-3、Bax、Bcl-2。研究结果显示,2-BFI可降低SH-SY5Y细胞凋亡率,降低Bax和cleaved caspase-3蛋白表达,升高Bcl-2蛋白水平,提示2-BFI的氟中毒神经保护可能与抑制线粒体凋亡途径激活有关。
