吡仑帕奈调控MAPK信号通路抗偏头痛作用及其机制
2022-11-01翟庆龄谢丹娜王凯新王雪贞陈金波董晓梦
翟庆龄,谢丹娜,王凯新,王雪贞,陈金波,董晓梦
偏头痛是世界上最常见的神经系统疾病之一,许多信号传导通路参与偏头痛发病机制,如丝裂原活化蛋白激酶通路(mitogen actived protein kinase, MAPK)通路、一氧化氮(nitric oxide, NO)/可溶性鸟苷酸环化酶(soluble guanylate cyclase,sGC)/环磷酸鸟苷(cyclic guanosinemonophosphate, cGMP)通路等。垂体腺苷酸环化酶激活肽(pituitary adenylate-cyclase-activating polypeptide,PACAP)已经被证明是脑循环中作用强大的舒张因子,是偏头痛关键生物学标志物[1]。吡仑帕奈是一种高度选择性、非竞争性的α-氨基-3-羟基-5-甲基-4-异恶唑-丙酸(amino-3-hydroxy-5-methyl-4-isoxazole-propionatereceptor,AMPA)受体拮抗剂,最开始被用作治疗癫痫[2],基于癫痫与偏头痛共同的病理生理特征,可能具有治疗偏头痛的作用。该研究应用腹腔注射硝酸甘油建立大鼠偏头痛模型,研究吡仑帕奈对偏头痛大鼠的影响,同时检测三叉神经节(trigeminal ganglion,TG)中PACAP及MAPK信号通路相关蛋白的表达,以探讨吡仑帕奈的抗偏头痛作用及其机制,为抗偏头痛药物的研发提供理论基础。
1 材料与方法
1.1 实验动物及分组清洁级6周龄成年雄性SD大鼠40只,体质量180~220 g,购自济南朋悦实验动物繁育有限公司,许可证号:SCXK(鲁)2019-0003。饲养环境温度控制在21~22 ℃,保持12 h/12 h明暗间隔的人工昼夜节律,自由摄食和饮水。对实验动物进行的所有研究行为均严格遵照国际疼痛学会(International Association for the Study of Pain,IASP)的相关动物保护及使用规定。大鼠采用随机数字表法分为:空白组、硝酸甘油(nitroglycerin, NTG)组、吡仑帕奈50 μg/kg+NTG预防组、吡仑帕奈100 μg/kg+NTG预防组,每组10只。
1.2 方法
1.2.1偏头痛大鼠模型建立 采用Pradhan改良的方法进行造模,即每隔1 d给予NTG组、吡仑帕奈50 μg/kg+NTG预防组、吡仑帕奈100 μg/kg+NTG预防组腹腔注射稀释后的硝酸甘油注射液(NTG 10 mg/kg),空白组腹腔注射等量生理盐水;共注射5次,即在第1、3、5、7、9天时完成各组注射。
1.2.2预防组给药 造模前30 min吡仑帕奈50 μg/kg+NTG预防组、吡仑帕奈100 μg/kg+NTG预防组分别给予腹腔注射吡仑帕奈50、100 μg/kg,吡仑帕奈浓度设置参考Hara et al[3]的研究。实验流程设计示意图见图1。

图1 研究的实验设计
1.2.3眶周痛觉阈值测定 实验在药物注射后1 h进行。研究人员用手约束每只老鼠,防止它们逃离。用von Frey纤维丝悬于大鼠一侧眶周皮肤上,相互垂直,从最小强度0.08 g开始刺激眶周皮肤,逐步增加至最大强度300 g。以纤维丝弯曲90°为标准,并在刺激部位停留2 s,刺激5次为1循环,每次刺激之前间隔3 s。若在5次刺激中有3次及以上出现大鼠用前爪拨开纤维丝、发动攻击或缩头缩爪等行为表现,则判定该大鼠出现痛觉超敏,并记录此时刺激强度(g)为疼痛阈值。若刺激强度达到300 g,但仍未出现上述痛觉超敏表现,则将300 g记为其痛阈值。实验表明,出现痛觉超敏的大鼠,其疼痛阈值多在20 g以下。
1.2.4爬笼及梳理面部行为测试 头部梳理行为为大鼠用前爪或后爪清洁双侧头部或面部。爬笼次数与梳头时间的增加被认为是自发性面部疼痛的一个指标。用摄像机记录并计算各组大鼠梳理面部的时间及爬笼子的次数。在腹腔注射NTG后30 min,将动物置于树脂玻璃箱中,首先适应15 min,然后在箱前30 cm处放置摄像机,记录20 min。
1.2.5畏光行为测试 偏头痛的另一个特征是畏光,并且暴露在光线下会增加偏头痛的严重程度。实验第9天给药后1 h进行畏光行为测试。明暗箱是一个80 cm×40 cm×35 cm的树脂玻璃箱,被隔间分隔成两个区域。在明暗箱里,隔间用白纸包裹,没有盖子,使用800流明LED灯照明。而另一个隔间用黑纸包裹,并盖上盖子。箱子中间有一个12 cm×12 cm的通道,大鼠可以自由穿梭。通过摄像装置观察并记录10 min内首次进入明室的潜伏时间、在明箱的活动时间及穿梭次数。实验过程中保持外界环境安静,每次放入大鼠前要清理粪便并喷洒酒精去除异味,以便进行下一组测试,确保每次检测结果的准确性。
1.2.6净体质量增长量和净食物消耗量测量 在每次注射药物之前称量大鼠的体质量和食物,计算出体质量和净食物消耗量。
1.2.7免疫荧光染色 在第9天完成行为测定后用10%的水合氯醛深麻醉大鼠,用0.1 mol/L PBS溶液心脏灌流,再用4%多聚甲醛固定,取空白组及NTG组大鼠TG,经30%蔗糖水脱水后行冰冻切片,切片厚度为40 μm。经封闭液室温封闭1 h后,一抗PACAP(美国Santa公司提供,货号:sc-166180)、二抗Alexa fluor488驴抗鼠(1 ∶400)室温孵育4 h,封片剂封片并用共聚焦显微镜观察TG染色效果并拍照。
1.2.8Western blot实验 同1.2.7项深麻醉大鼠,置于冰上取各组TG放入灭菌EP管中加入裂解液及相应的磷酸酶抑制剂,使用匀浆器将组织磨成匀浆状态,4 ℃、1 500 r/min离心10 min。采用BCA法检测上清液中的蛋白浓度。加入上样缓冲液和裂解液将蛋白样品的浓度配平,100 ℃加热5 min使蛋白变性,分装后保存于-80 ℃冰箱备用。配置SDS-PAGE胶,加入蛋白质样本电泳后转移到PVDF膜。将膜浸泡在封闭缓冲液置于摇床温柔摇晃2 h;在4 ℃条件下,分别用一抗如下:PACAP抗体(购自英国Abcam公司,批号:ab181205);phospho-ERK1/2 (Thr202/Tyr204) 抗体 (批号:#4370)、ERK1/2抗体(批号:#9102)、phospho-JNK抗体(批号:#9251)、JNK抗体(批号:#9252)、phospho-p38MAPK抗体(批号:#9215)、p38MAPK抗体(批号:#8690)和内参GAPDH抗体(批号:#51332)均购自美国Cell Signaling Technology公司。将一抗置于摇床孵育过夜;TBST清洗3次,每次10 min;二抗孵育,按说明书稀释相应二抗,室温孵育置于摇床温柔摇晃2 h;TBST清洗3次,每次15 min;Western blot条带经Photoshopcs6.0软件进行灰度扫描分析。
1.2.9RT-PCR实验 用RNA提取试剂盒将组织裂解稀释提取总RNA,反转录为cDNA,于-20 ℃保存。设计PACAP引物,用GAPDH作为内参。PACAP上游引物:5′-ACTCACCTTTGGTCAATCCC-3′,下游引物:5′-TGATCCCAGGGAAGCTGAGT-3′;GAPDH上游引物:5′-CATGTGTAGCGGAGCAAGGTT-3′,下游引物:5′-TGATCCCAGGGAAGCTGAGT-3′。PCR扩增,反应体系20 μl,2× AceQ qPCR Green Master Mix (High ROX Premixed)10 μl、Primer 10.4 μl、Primer 20.4 μl、TemplatecDNA 1 μl、ddH2O 8.2 μl。反应条件:95 ℃预变性5 min,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸60 s,循环40次。采用2-ΔΔCt法计算基因相对表达量。
1.2.10ELISA实验 同1.2.7项麻醉大鼠,各组大鼠经颈静脉取血1.5 ml,血液静置后放入离心机中4 ℃、4 000 r/min离心5 min后取血清,使用ELISA试剂盒检测PACAP浓度,严格按照说明书进行。

2 结果
2.1 吡仑帕奈对NTG诱导的畏光、偏头痛样疼痛、眶周痛觉阈值减低的影响与空白组相比,NTG组在明室中的时间缩短且重新进入明室的潜伏期更长,在明暗箱间穿梭次数也更少(P<0.000 1);吡仑帕奈预处理组不仅增加了大鼠在明室停留时间(图2A)(F=62.62,P<0.000 1),而且还缩短了重新进入明室的潜伏期(图2B)(F=147.10,P<0.000 1),增加了穿梭次数(图2C)(F=15.03,P<0.000 1)。在观察大鼠头部梳理和爬笼行为时,如图2D所示,第1次和第2次给药后,NTG组的头部梳理时间长于空白组(P<0.05),而吡仑帕奈100 μg/kg+NTG预防组的大鼠头部梳理时间比NTG组短(P<0.05);随着注射次数增多,与NTG组相比,吡仑帕奈100 μg/kg+NTG预防组头部梳理时间有差异(给药因素,F=36.51,P<0.000 1;时间因素,F=0.09,P=0.96; 双因素,F=0.36,P=0.97)。如图2E所示, NTG增加了爬笼时间,吡仑帕奈50 μg/kg +NTG预防组和吡仑帕奈100 μg/kg+NTG预防组减弱了NTG诱导的爬笼次数增加(给药因素,F=29.37,P<0.000 1;时间因素,F=1.40,P=0.24;双因素,F=0.67,P=0.78)。第1天四组之间的眶周疼痛阈值没有显著差异(图2F)。从第2次给药开始,NTG组与空白组之间存在差异,NTG组阈值降低(P<0.05)。NTG组的阈值从第3次到第4次给药呈现出进一步降低的趋势(P<0.01)。第2次给药后,吡仑帕奈50 μg/kg+NTG预防组和100 μg/kg+NTG预防组的眶周疼痛阈值高于NTG组(P<0.05)。给药3次后,NTG组的阈值低于50 μg/kg和100 μg/kg吡仑帕奈+NTG组(图2F)(给药因素F=23.28,P<0.000 1; 时间因素,F=4.40,P<0.001;双因素,F=0.96,P=0.49)。注射5次给药后,各组大鼠代谢情况并没有显著差异,大鼠体质量差异、食物消耗差异无统计学意义。体质量测量(图2G):(给药因素,F=3.20,P=0.04;时间因素,F=34.27,P<0.000 1;双因素,F=0.64,P=0.81);净食物消耗量(图2H):(给药因素,F=4.79,P=0.01;时间因素,F=6.31,P<0.001;双因素,F=1.40,P=0.17)。各组行为学数据见表1、2。
表1 各组不同时间行为学测定
表2 各组明暗箱实验测定

图2 吡仑帕奈对NTG诱导的畏光、偏头痛样疼痛、眶周痛觉阈值减低的影响低A:明室停留时间;B:重新进入明室的潜伏时间;C:穿梭次数;D:梳理头部行为;E:爬笼行为;F:眶周痛觉阈值;G:体质量;H:净食物消耗量;a:空白组(n=8);b:NTG组(n=10);c:吡仑帕奈50 μg/kg+NTG预防组(n=7);d:吡仑帕奈100 μg/kg+NTG预防组(n=10);与空白组比较:*P<0.05,**P<0.01,***P<0.001,****P<0.000 1;与NTG组比较:#P<0.05,##P<0.01,###P<0.001,####P<0.000 1
2.2 吡仑帕奈对NTG诱导的PACAP水平升高的影响免疫荧光实验显示,与空白组相比,NTG组大鼠TG中PACAP水平表达升高(图3A、B);Western blot结果显示,与空白组相比,NTG组中的PACAP蛋白表达升高,吡仑帕奈50 μg/kg+NTG预防组、吡仑帕奈100 μg/kg+NTG预防组PACAP蛋白的表达降低(F=25.06,P<0.000 1)。RT-qPCR分析显示,与空白组相比,NTG组中PACAP mRNA的表达升高(F=25.06,P<0.000 1)。吡仑帕奈50 μg/kg+NTG 预防组和吡仑帕奈100 μg/kg+NTG预防组降低PACAP的表达。ELISA结果与Western bolt和RT-qPCR的结果相似,与NTG组相比,吡仑帕奈100 μg/kg+NTG下调PACAP的水平但结果无统计学差异(W=4.218,P=0.88)。 见图3D。

图3 吡仑帕奈对NTG诱导的PACAP水平升高的影响a:空白组TG PACAP免疫荧光图 ×40;B: NTG组TG PACAP免疫荧光图 ×40;C:PACAP蛋白检测Western blot图;D:PACAP表达水平统计图;a:空白组(n=4);b:NTG组(n=6);c:吡仑帕奈50 μg/kg+NTG预防组(n=6);d:吡仑帕奈100 μg/kg+NTG预防组(n=6);与空白组比较:**P<0.01,****P<0.000 1;与NTG组比较:#P<0.05,##P<0.01,###P<0.001,####P<0.000 1
2.3 吡仑帕奈调控MAPK信号通路对偏头痛大鼠的影响Western blot实验结果如图4所示,与空白组相比,NTG组p-JNK、p-ERK和p-p38MAPK蛋白表达升高;而吡仑帕奈100 μg/kg+NTG预防组p-JNK(F=22.76,P<0.000 1)、p-ERK(F=11.06,P<0.001)和p-p38MAPK(F=10.49,P<0.001)蛋白表达降低(图4B),差异有统计学意义;而注射NTG后各组JNK、ERK和p38MAPK蛋白表达差异无统计学意义(图4C)。这些结果表明,NTG可以促进MAPK通路信号传导以促进偏头痛的病理生理过程,但吡仑帕奈100 μg/kg可以抑制MAPK通路缓解偏头痛。
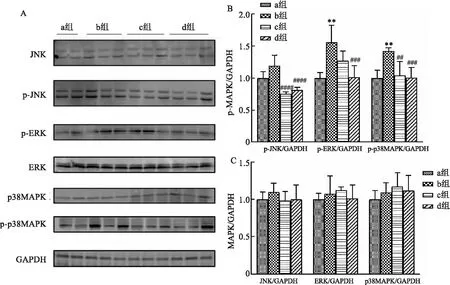
图4 吡仑帕奈调控MAPK信号通路对偏头痛大鼠的影响a: MAPK、p-MAPK蛋白检测的Western blot图;B:p-MAPK蛋白水平统计图;C: MAPK蛋白水平统计图;a:空白组(n=4);b:NTG组(n=6);c:吡仑帕奈50 μg/kg+NTG预防组(n=6);d:吡仑帕奈100 μg/kg+NTG预防组(n=6);与空白组比较:**P<0.01;与NTG组相比较:##P<0.01,###P<0.001,####P<0.000 1
3 讨论
偏头痛为一种常见疾病,偏头痛动物模型提示该疾病共同之处是存在关键信号通路的失调。本研究使用NTG诱导的偏头痛大鼠模型进一步验证偏头痛发病机制中的MAPK信号传导通路,探讨吡仑帕奈调控MAPK信号通路对偏头痛大鼠的影响,并且首次提出吡仑帕奈可能通过调控此通路发挥缓解偏头痛作用。
吡仑帕奈是高度选择性的突触后膜神经元离子AMPA受体拮抗剂,通过与AMPA受体非竞争性结合,阻止Na+、K+单价阳离子进出细胞,无法引起突触后膜去极化,因此兴奋性突触后电位无法诱发,从而抑制兴奋性突触传递。有研究[4]证明NTG诱导AMPA受体亚基GluAlSer831位点磷酸化是偏头痛模型小鼠痛觉敏化的关键机制;通过上调钙通透型AMPA受体进一步促进痛觉敏化发生。因此,AMPA受体很可能在偏头痛发生机制——痛觉敏化中起重要作用。偏头痛与癫痫同为发作性疾病,其病理生理、治疗方法有相似之处。因此,推断作为抗癫痫药物上市的AMPA受体抑制剂吡仑帕奈可能具有抗偏头痛的作用。
NTG是一种NO供体,可以在一定条件下激活鸟苷酸环化酶模拟细胞内NO的效应[5]。NO是调节脑血流量及动脉直径的重要调节因子,参与偏头痛的急性发作;NO还可以促进皮层扩散性抑制(cortical spreading depression,CSD)的发生,而CSD目前被广泛认为是偏头痛先兆发作的潜在机制[6]。全身注射NTG还会引发健康人的即刻头痛和偏头痛易感患者的偏头痛发作[7]。本研究通过建立NTG偏头痛大鼠模型,观察大鼠挠头、爬笼行为、测定眶周痛觉阈值、计算畏光行为时间,模拟偏头痛发作的临床表现和特征。从行为学角度表明吡仑帕奈具有缓解偏头痛症状的作用。原发性头痛、特别是偏头痛,与饮食障碍有双向关系,有研究表明,88%的女性偏头痛患者有节食经历,59%会暴食、26%会催吐[8];饮食失调患者中74%患有偏头痛[9]。因此本实验初步探索了偏头痛大鼠的饮食障碍与体质量增减情况,然而本实验中,5次注射NTG后NTG组大鼠与空白组、吡仑帕奈预防组大鼠的食欲减退程度才有显著差异,其原因可能是大鼠的饮食失调需要更长的时间来观察。
PACAP在偏头痛中的标志性作用已被越来越多的者证实。偏头痛学早在2009年,Schytz et al[1]首次证明静脉输入PACAP38会引发偏头痛样发作,所有的健康受试者和超过90%的偏头痛患者在输注PACAP后诱发偏头痛发作。Körtési et al[10]发现口面注射弗氏完全佐剂可激活大鼠三叉神经血管系统,导致三叉神经脊束尾核大量降钙素基因相关肽和PACAP38释放。Syed et al[11]的一项离体研究使用PAC1拮抗剂逆转了PACAP38诱导的大鼠脑膜中动脉管舒张。在本实验,与空白组相比,NTG诱导的偏头痛大鼠TG组织和血液中的PACAP表达上调,而吡仑帕奈预处理可降低NTG诱导的大鼠TG组织和血液中的PACAP表达。这些结果表明吡仑帕奈治疗偏头痛作用可能是通过减少偏头痛标志性物质PACAP表达实现的。
MAPK信号在偏头痛发病机制中的作用已经在NTG诱导的动物模型中得到印证[12]。Lai et al[13]认为钩藤碱的抗偏头痛作用是通过抑制由NTG激活MAPK/核因子-kB(NF-kB)完成。这些研究均表明,MAPK通路在偏头痛的发生和维持中有着密切的关系。本实验中NTG诱导的偏头痛模型大鼠TG组织中p-JNK、p-ERK和p-p38MAPK蛋白表达升高,进一步验证了MAPK信号通路在偏头痛发病机制中的重要作用;吡仑帕奈预处理组大鼠TG组织中p-JNK、p-ERK和p-p38MAPK蛋白表达降低,提示吡仑帕奈可能通过调控MAPK信号通路达到缓解偏头痛的效果。
综上所述,抗癫痫药物吡仑帕奈有缓解偏头痛的潜力。基于NTG诱导的偏头痛大鼠模型,本实验预给药吡仑帕奈可以缓解偏头痛症状,并且进一步验证MAPK通路参与了偏头痛的发病机制过程,吡仑帕奈可能通过调控MAPK通路缓解偏头痛,并为偏头痛治疗药物的研发提供验依据。
