柚皮素通过增强NRF-2/HO-1信号活性减轻实验性妊娠高血压模型大鼠的肾损伤
2022-10-31刘雨汤容王晓霜
刘雨,汤容,王晓霜
(1重庆市中医院产科,重庆 400021;2电子科技大学医学院附属妇女儿童医院/成都市妇女儿童中心医院产科,成都 610073)
妊娠高血压综合征(pregnancy-induced hypertension syndrome,PIH)是产科常见病,约占所有孕产妇的7.9%[1]。在妊娠期发生的高血压(49.2%)和产后出血(13.8%)是导致妊娠相关肾损伤的主要因素,且由PIH诱发的孕产妇肾损伤也是加剧妊娠不良结局甚至导致孕产妇和围产期婴儿死亡的促进因素之一[2,3]。而PIH诱发的肾损伤的原因复杂,机制并不清楚,尚缺乏特异性治疗这种疾病的药物。因此,对PIH相关肾损伤药物的研发显得尤为重要。
柚皮素(naringenin, Nar)是一种具有抗炎和抗氧化作用的黄酮类化合物[4]。研究表明,在糖尿病肾病和单侧输尿管梗阻大鼠模型中,Nar具有肾保护作用[5,6]。另外,Nar可减轻炎症性疼痛和神经性疼痛[7]。这些研究表明,Nar具有抗炎、抗氧化、镇痛和肾保护作用。然而,Nar在PIH中是否具有肾脏保护作用及其机制尚不清楚。因此,本研究重点观察Nar在PIH大鼠模型对肾脏的影响及其机制。
材料与方法
1 实验动物
10~11周龄清洁级Wistar大鼠(40只雌性,20只雄性)购自北京维通利华实验动物技术有限公司。将大鼠饲养在温度(23±2)°C和湿度(55±5)%可控的清洁级动物房中饲养,大鼠可自由进食和饮水。
2 主要试剂
N-硝基-L-精氨酸甲酯(NG-nitro-L-arginine methyl ester,L-NAME)和Nar(纯 度>98%,北京百灵威科技有限公司);大鼠尿白蛋白和肌酐ELISA试剂盒(北京冬歌生物科技有限公司);丙二醛(malondialdehyde,MDA)、过氧化氢酶(catalase,CAT)和还原型谷胱甘肽(Glutathione,GSH)测定试剂盒(南京建成生物工程研究所);HE、PAS和Masson染色试剂盒(北京索莱宝科技有限公司);TUNEL检测试剂盒(江苏凯基生物技术股份有限公司);兔源抗体:剪切的半胱氨酸天冬氨酸蛋白酶-3(Cleaved cysteine aspartate protease-3,Cleaved Caspase-3)、血红素氧合酶1(heme oxygenase 1,HO-1)、B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)和核因子E2相关因子2(nuclear factor E2-related factor 2,NRF-2)(万类生物科技有限公司);SP试剂盒(北京中杉金桥生物技术有限公司)。
3 动物模型构建与分组处理
用阴道涂片检测雌性大鼠的动情周期,并将发情期雌性大鼠与雄性大鼠按2:1合笼交配,选32只交配成功(存在阴道塞且阴道涂片镜检有精子,并计为妊娠第0 d)的雌性大鼠随机分为空白对照组、Nar对照组、PIH组和PIH+Nar组,每组8只大鼠。按照文献[8]描述的方法,从妊娠的第8 d开始每天腹腔注射50 mg/kg L-NAME至妊娠第20 d,以诱导实验性妊娠性高血压模型以模拟PIH。PIH组和PIH+Nar组按照上述方法构建PIH,且Nar对照组和PIH+Nar组大鼠在妊娠第8—20 d每天口服200 mg/kg Nar,而空白对照组和PIH组在同时间点口服等体积安慰剂。
4 血压监测
在妊娠第1、8、12、14、16、18和20 d,使用大鼠尾动脉血压测量仪测量大鼠的收缩压(systolic blood pressure,SBP)。
5 尿白蛋白排泄率的测定
在妊娠第20 d,用代谢笼收集大鼠的24 h尿液,然后用ELISA试剂盒检测尿液中白蛋白的含量,根据公式计算尿白蛋白排泄率:尿白蛋白排泄率=白蛋白含量(mg/mL)×尿液体积(mL)/24 h。
6 肌酐清除率的测定
在妊娠第20 d,收集尾静脉血,并分离血清。用ELISA试剂盒分别检测尿液和血清中肌酐的含量,然后根据公式计算肌酐清除率:肌酐清除率= [尿肌酐含量(μmol/L)× 24 h尿液体积(mL)]/{血清肌酐含量(μmol/L)× [1000/体重(g)] ×(1/1440)}。
7 肾组织病理学分析
在妊娠第21 d,麻醉、处死大鼠,收集肾组织并行石蜡包埋,5 μm厚度切片,经脱蜡、复水后分别行HE、PAS和Masson染色,并在光学显微镜下对肾脏组织学评分、肾小球硬化指数和肾小管间质纤维化水平进行分析。每个HE染色切片随机选4个视野,按照文献[9]方法进行肾脏组织学评分。每个PAS染色切片随机选10个肾小球进行评分分析,视野中出现伴随透明物质和/或基质增加的肾小球毛细血管簇的塌陷和/或闭塞则认定为肾小球硬化;肾小球硬化的严重程度从0到3分级:0,无病变;1,轻度;2,中度; 3,严重。肾小管间质纤维化由半定量法评价,每个Masson染色肾切片随机选4个视野,检查评估区域内的纤维化(蓝色染色),等级分为:0,无纤维化;1,轻度;2,中度;3,严重。
8 肾组织TUNEL染色
取肾切片经脱蜡至水后,浸泡于pH6.0的柠檬酸缓冲液中,微波中高火5 min,再自然晾凉。蛋白酶 K工作液37 ℃反应30 min,3% H2O2孵育10 min,PBS漂洗切片2次,生物素标记的TdT酶反应液37 ℃反应30 min,浸入PBS漂洗3次后以辣根过氧化物酶-链霉亲和素工作液37 ℃反应30 min,PBS漂洗3次,DAB工作液室温显色2 min,苏木素复染20 s,显微镜下观察并拍照,用Image J软件计数每个视野下的TUNEL阳性细胞。
9 肾组织免疫组织化学染色
取肾切片脱蜡至水、抗原修复和阻断内源性过氧化物酶(步骤同TUNEL染色)后,用10%正常山羊血清室温封闭20 min,1:200的Cleaved Caspase-3、HO-1、Bcl-2、Bax和NRF-2一抗37 ℃孵育60 min,PBS漂洗3次,1:100稀释的生物素标记山羊抗兔IgG聚合物室温孵育15 min,PBS漂洗3次,1:100稀释的辣根酶标记的链霉卵白素工作液室温孵育15 min,PBS漂洗3次,DAB显色液室温孵育5 min,苏木素复染20s ,显微镜下观察并拍照。用Image J软件对每个视野下的Cleaved caspase-3、Bcl-2和Bax阳性细胞计数以及测量HO-1和NRF-2积分光密度(integrated optical density,IOD)值。
10 肾组织氧化应激指标检测
每只大鼠分别取0.1 g肾组织匀浆后按照试剂盒说明书分别检测匀浆液中MDA、CAT和GSH含量,最后将匀浆液中上述指标的含量按照肾组织质量转化为单位(g)组织中MDA、CAT和GSH的含量。
11 统计学分析
计量资料均用平均值±标准差表示,用SPSS 20.0软件进行统计学分析各组之间的差异。析因设计数据资料采用析因设计方差分析,重复测量数据资料采用重复测量方差分析。P<0.05被认为差异具有统计学意义。
结果
1 柚皮素对PIH大鼠收缩压无影响
在妊娠第1和第8 d,各组大鼠的SBP无明显差异;在第12—20 d,空白对照组与Nar对照组大鼠的SBP无明显差异;与空白对照组比较,PIH组大鼠的SBP明显升高;与PIH组比较,PIH+Nar组大鼠的SBP无明显差异(图1)。
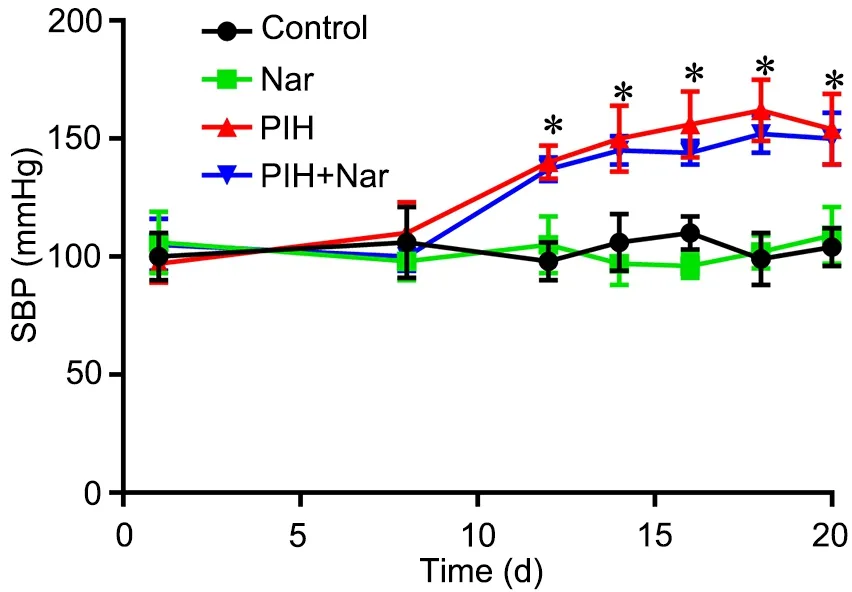
图1 柚皮素对PIH大鼠收缩压的影响。与对照组比较,*P<0.05; n=8Fig. 1 The effect of naringenin on the systolic blood pressure of the PIH rats. *P<0.05, compared with control group; n=8
2 柚皮素抑制PIH大鼠尿白蛋白排泄率的增加和肌酐清除率的降低
空白对照组和Nar对照组大鼠的尿白蛋白排泄率和肌酐清除率均无明显差异;与空白对照组比较,PIH组大鼠的尿白蛋白排泄率明显增加,肌酐清除率明显降低;与PIH组比较,PIH+Nar组大鼠的尿白蛋白排泄率明显降低,肌酐清除率明显增加;与空白对照组和Nar对照比较,PIH+Nar组大鼠的尿白蛋白排泄率仍较高,但肌酐清除率与此俩组相比无明显差异(图2)。
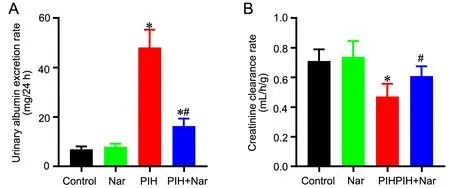
图2 柚皮素对PIH大鼠尿白蛋白排泄率(A)和肌酐清除率(B)的影响。与对照组比较,*P<0.05;与PIH组比较,#P<0.05;n=8Fig. 2 The effect of naringenin on the urinary albumin excretion rate (A) and creatinine clearance (B) of the PIH rats. *P<0.05, compared with control group; #P<0.05, compared with PIH group; n=8
3 柚皮素减轻PIH大鼠肾病理学变化
HE染色显示:空白对照组和Nar对照组肾小管正常;PIH组可见部分肾小管管腔扩张,肾小管上皮细胞变性,肾间质可见少量炎性细胞侵润;PIH+Nar组肾小管形态改变减轻(图3A上)。PAS染色显示:空白对照组和Nar对照组肾小球结构清晰,PIH组肾小球水肿、糖原沉积和存在节段性肾小球硬化,PIH+Nar组肾小球病理学改变则明显减轻(图3A中)。Masson染色显示:空白对照组和Nar对照组肾小管结构清晰,PIH大鼠肾小管间质存在明显的胶原纤维沉积,PIH+Nar组肾小管间质的胶原纤维沉积则明显减轻(图3A下)。定量分析显示(图3C—D):空白对照组肾组织评分、肾小球硬化指数和肾间质纤维化指数与Nar对照组无明显差异;PIH组肾组织评分、肾小球硬化指数和肾间质纤维化指数高于空白对照组;PIH+Nar组肾组织评分、肾小球硬化指数和肾间质纤维化指数均较与PIH组比较明显降低,但仍高于空白对照组和Nar对照组。
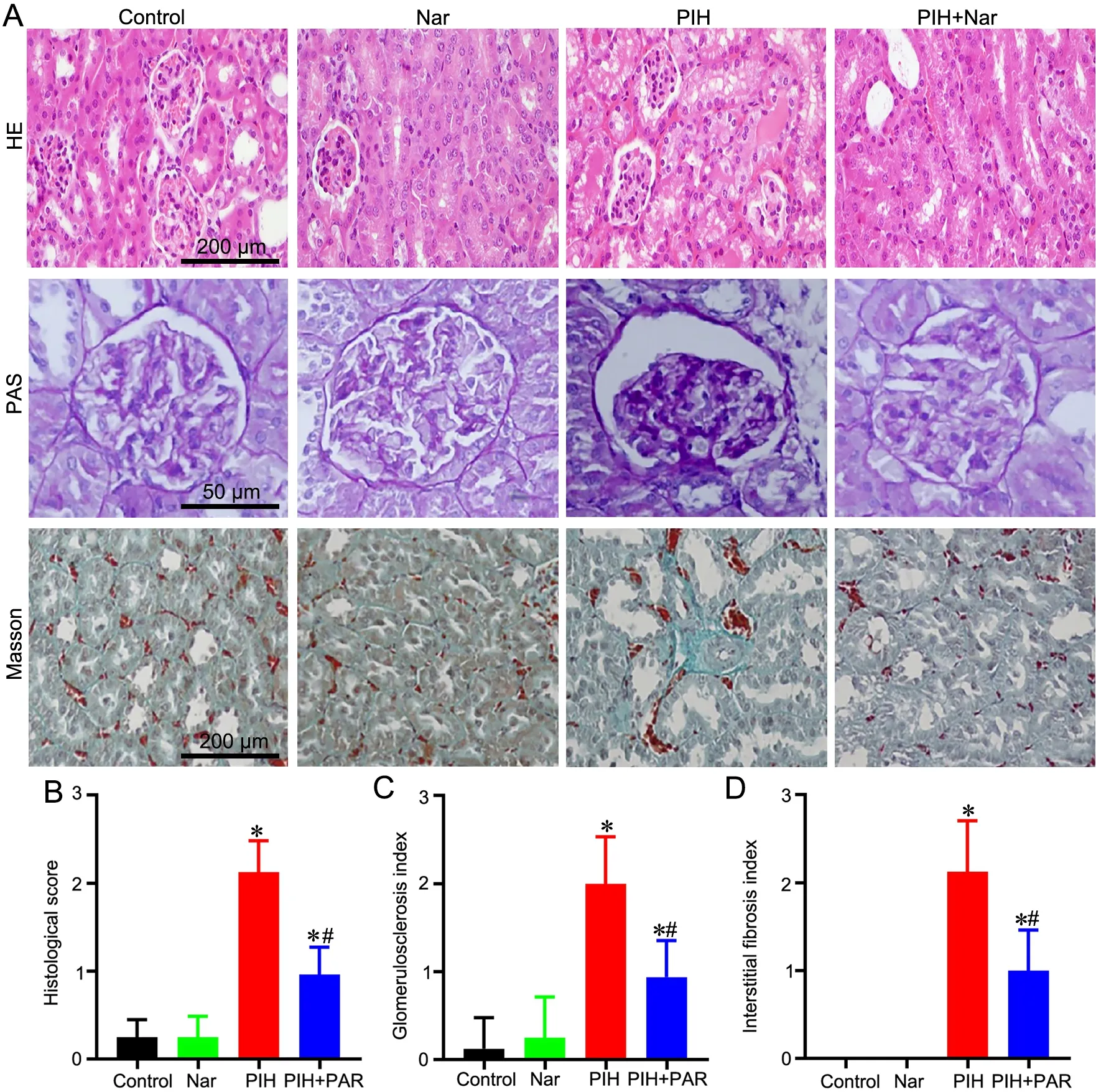
图3 柚皮素对PIH大鼠肾组织病理学变化的影响。A,肾组织病理学的HE(上)、PAS(中)和Masson(下)染色检测;B,组织学评分;C,肾小球硬化定量分析D,肾间质纤维化定量分析;与对照组比较,*P<0.05;与PIH组比较,#P<0.05;n=8Fig. 3 Effect of Naringenin on the pathological changes of renal tissues of the PIH rats. A, detection for the pathological changes of the renal tissue of the PIH rats by HE (upper), PAS (middle) and Masson (lower) staining; B, histological scoring; C, quantitative analysis of glomerulosclerosis; D, quantitative analysis of renal interstitial fibrosis; *P<0.05, compared with control group; #P<0.05, compared with PIH group; n=8
4 柚皮素减轻PIH大鼠肾小管上皮细胞凋亡
TUNEL染色结果(图4A、B)显示:空白对照组TUNEL染色阳性细胞数与Nar对照组无明显差异;与空白对照组比较,PIH组TUNEL染色阳性细胞数明显增多,且主要定位于肾小管上皮细胞;PIH+Nar组TUNEL染色阳性细胞数较与PIH组明显减少,但仍高于空白对照组和Nar对照组。免疫组织化学染色表明:与空白对照组比较,PIH组Cleaved caspase-3和Bax染色阳性细胞数均明显增多,Bcl-2染色阳性细胞数明显减少,且均主要定位于肾小管上皮细胞;与PIH组比较,PIH+Nar组Cleaved caspase-3和Bax染色阳性细胞数均明显减少,Bcl-2染色阳性细胞数明显增多;PIH+Nar组Cleaved caspase-3和Bax染色阳性细胞数仍高于空白对照组和Nar对照组,而Bcl-2染色阳性细胞数仍低于空白对照组和Nar对照组。上述结果说明,PIH能诱导肾脏中肾小管上皮细胞凋亡,而Nar治疗则能抑制PIH诱导的肾小管上皮细胞凋亡。
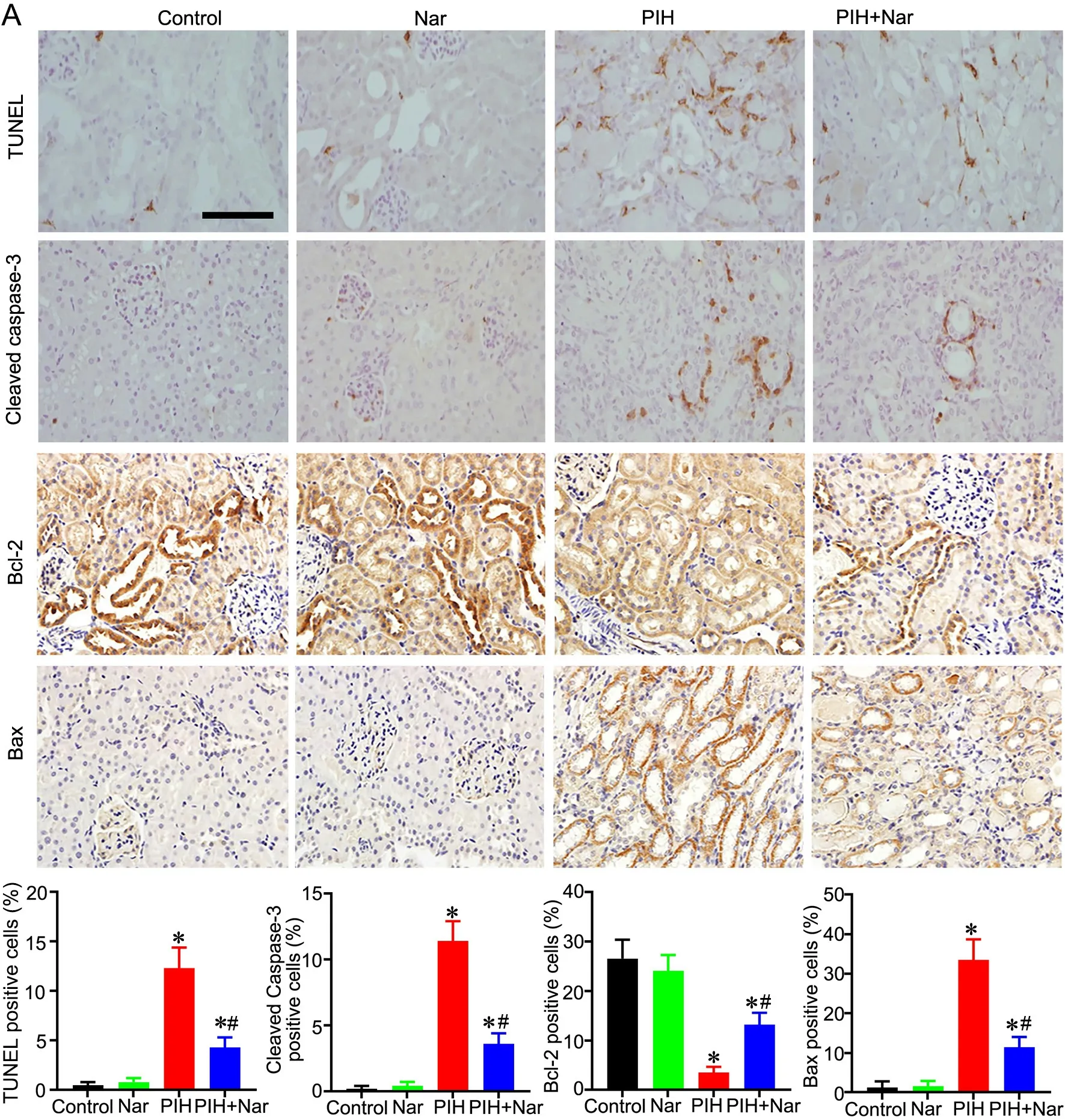
图4 柚皮素对PIH大鼠肾小管上皮细胞凋亡的影响。A,代表性的TUNEL染色与Caspase-3、Bcl-2和Bax免疫组织化学染色图像(比例尺,100 μm);B—E,TUNEL(B)以及Cleaved caspase-3(C)、Bcl-2(D)和Bax(E)阳性染色细胞的定量统计分析。与对照组比较,*P<0.05;与PIH组比较,#P<0.05;n=8Fig. 4 The effect of naringenin on apoptosis of renal tubular epithelial cells in the PIH rats. A, representative images of TUNEL staining, and immunohistochemical staining of Cleaved Caspase-3, Bcl-2 and Bax (scale bar, 100 μm); B to E, quantitative analysis of TUNEL-positive (B), Caspase-3-positive (C), Bcl-2-positive (D) and Bax-positive cells (E). *P<0.05 compared with control group; #P<0.05 compared with PIH group; n=8
5 柚皮素降低PIH大鼠肾内氧化应激水平
空白对照组和Nar对照组的MDA、CAT和GSH含量均无明显差异;与空白对照组比较,PIH组MDA含量明显升高,CAT和GSH含量明显降低;与PIH组比较,PIH+Nar组MDA明显降低,CAT和GSH含量明显增加;PIH+Nar组MDA含量仍高于空白对照组和Nar对照组,而CAT和GSH含量与空白对照组和Nar对照组均无明显差异(图5)。

图5 柚皮素对PIH大鼠肾组织内氧化应激的影响。A,MDA 水平的定量统计分析;B,CAT水平的定量统计分析;C,GSH水平的定量统计分析;与对照组比较,*P<0.05;与PIH组比较,#P<0.05;n=8Fig. 5 Effect of naringenin on oxidative stress in the PIH rat renal tissues. A, quantitative analysis of MDA contents; B, quantitative analysis of CAT; quantitative analysis of GSH; *P<0.05 compared with control group; #P<0.05 compared with PIH group; n=8
6 柚皮素对PIH大鼠肾组织中NRF-2/HO-1信号活性的影响
免疫组织化学染色显示:空白对照组和Nar对照组肾组织中NRF-2和HO-1免疫反应性均无明显差异;与空白对照组比较,PIH组肾组织中NRF-2和HO-1免疫反应性均明显升高;与PIH组比较,PIH+Nar组肾组织中NRF-2和HO-1免疫反应性均进一步增强,提示Nar治疗能增强PIH大鼠肾组织中NRF-2/HO-1信号活性。
讨论
PIH能累及多种器官,其中肾脏是最先累及且易受损的靶器官之一[10]。一旦发生肾损伤,则会直接导致体液和代谢失调,进而加重PIH和肾损伤的病情程度,严重者甚至出现肾衰竭[11,12]。因此,加强对PIH患者的肾保护意识具有重大的积极意义。本研究显示,Nar虽不能降低PIH大鼠的收缩压,但能降低尿白蛋白排泄和提高肌酐清除率并改善肾病理学改变,提示Nar在PIH中具有肾保护作用。
PIH能导致肾脏发生氧化应激和炎症,继而损害肾实质[13]。本研究显示,Nar则能抑制PIH大鼠肾组织肾小管上皮细胞凋亡,进一步证实了Nar在PIH中的肾保护作用。肾脏易受氧化应激的影响,这也被认为是不同高血压动物模型中肾损伤进展的促动因素[14]。因此,为了确定Nar对PIH大鼠肾脏氧化应激的影响,我们评估了氧化应激的标志物MDA、CAT和GSH。MDA是评估脂质过氧化和蛋白质氧化或氧化裂解并反映组织过氧化损伤程度的重要标志物,CAT和GSH是主要的抗氧化酶[15]。本研究显示,在Nar治疗的PIH大鼠肾组织中检测到MDA含量回跌以及CAT和GSH含量回升,提示Nar在PIH大鼠的肾损伤中发挥抗氧化剂作用。
本研究对Nar在PIH大鼠肾脏中的抗氧化应激的作用机制进行了进一步探索。NRF-2/HO-1信号是机体主要的维持氧化/还原平衡的系统之一。已有研究[16,17]表明,当肾脏受到外界氧化损伤刺激时,肾脏中NRF-2会发生活化,进而通过上调HO-1和醌氧化还原酶1的表达来调节下游的抗氧化酶(如CAT和GSH等)的表达;且进一步通过增强NRF-2/HO-1活性则能通过上调抗氧化酶表达来增强氧自由基的清除来减轻肾组织的氧化损伤。本研究显示,在Nar治疗的PIH大鼠肾组织中检测到NRF-2和HO-1表达大幅度增加,表明Nar能增强PIH大鼠肾组织中NRF-2/HO-1的活性。而NRF-2/HO-1信号在Nar对PIH大鼠肾保护作用中发挥的作用程度以及是否还有其他信号参与,目前并不清楚,仍有待进一步研究。
总之,本研究的发现表明,Nar可改善PIH大鼠的蛋白尿和肾损伤,其潜在机制至少部分是通过缓解氧化应激来实现的。另外,Nar的毒副作用小,提示其在将来的PIH治疗中可能具有一定的应用潜力。

图6 柚皮素对PIH大鼠肾组织中NRF-2/HO-1信号活性的影响的免疫组织化学检测。A,代表性的NRF-2和HO-1免疫组织化学染色图像(比例尺,100 μm);B和C,NRF-2(B)和HO-1(C)免疫反应性的定量统计分析。与对照组比较,*P<0.05;与PIH组比较,#P<0.05;n=8Fig. 6 Immunohistochemical examination for the effect of naringenin on NRF-2/HO-1 signal activity in renal tissues of PIH rats. A, representative images of NRF-2 and HO-1 immunohistochemical staining (scale bar, 100 μm); B and C, quantitative analysis of the immunoreactivities of NRF-2 (B) and HO-1 (C); *P<0.05 compared with control group; #P<0.05 compared with PIH group; n=8
