敲低GLI3抑制胃癌细胞增殖、迁移和侵袭和下调促上皮间质转化相关蛋白水平
2022-10-31袁博常占国马磊
袁博,常占国,马磊
(南阳市第一人民医院肿瘤1血液科,2肿瘤科,南阳 473000)
胃癌(gastric cancer, GC)是世界上第3大常见的癌症相关死亡原因[1]。在过去的几十年中GC的治疗取到了很大的进步,但目前GC患者的5年生存率依然很低[2]。导致GC预后不良的原因在很大程度上与癌细胞增殖与转移导致的GC复发有关[3]。过去虽然已经对影响胃癌细胞增殖与转移的靶点进行了大量研究,但依然众多靶点未被发现。GLI家族锌指蛋白3(GLI family zinc finger 3, GLI3)是GLI家族主要成员之一,也被报道在结直肠癌、宫颈癌、乳腺癌和前列腺癌等多种实体癌类型中显著上调,并能促进癌进展与转移[4-7],而GLI3在胃癌中的具体作用和机制仍不清楚。本研究旨在评估GLI3在胃癌的作用并分析其相关的机制。
材料和方法
1 临床标本和细胞系
从南阳市第一人民医院获得经肿瘤切除术的1~3期胃癌患者(共24例)的胃癌和以及癌旁非肿瘤组织标本。本方案均经本院伦理委员会审查批准并征得患者的书面知情同意。正常胃黏膜细胞株(GES-1)以及胃癌细胞株(MKN-45、MGC-803、SGC-790和AGS)细胞购自武汉普诺赛生命科技有限公司,并保持培养在补充有10%胎牛血清(FBS,美国Invitrogen公司)和1%青霉素/链霉素(Invitrogen)的DMEM(美国sigma公司)正常生长培养基中,在37 ℃的5%CO2孵育箱中培养。
2 免疫组织化学染色
将胃癌及癌旁组织用4%多聚甲醛固定过夜,然后将组织用石蜡包埋并用HS-S7220-B病理切片机(沈阳恒松科技有限公司)切成4 μm切片。按照ABC法检测试剂盒(PK-4001,北京中山金桥生物科技有限公司)操作步骤,对组织切片依次进行脱蜡、水化、抗原修复、阻断内源性过氧化物酶和血清封闭后,滴加兔抗GLI3单克隆抗体(1:200;南京Bioworld公司)37 ℃下孵育1 h,PBS洗3次,滴加100 μL生物素-山羊抗兔IgG工作液室温孵育30 min,PBS洗3次,滴加100 μL辣根过氧化物酶-链霉卵白素工作液室温孵育室温孵育30 min,PBS洗3次, 0.1% DAB/0.03%H2O2显色5 min,苏木素染色液孵育20 s。在IMM 5000光学显微镜[迈格仪器(苏州)有限公司]下分析阳性染色情况。
3 shRNA转染
GLI3短发夹RNA(shRNA)(GLI3-1 shRNA和GLI3-2 shRNA)及对照shRNA(sh-Con)质粒购自美国Santa Cruz公司。取SGC-790和AGS细胞至含10% FBS和无抗生素的DMEM培养基中,生长至70%汇合时,更换shRNA转染培养基(Santa Cruz)孵育6 h,然后用shRNA转染试剂(Santa Cruz)分别将GLI3-1 shRNA、GLI3-2 shRNA或sh-Con质粒转入上述俩种细胞中,并培养48 h,收集细胞用Western blot鉴定转染效率后,用于后续研究。
4 细胞增殖检测
用细胞计数试剂盒-8(CCK-8)和EdU荧光染色细胞增殖试剂盒[均亚科因(武汉)生物技术有限公司]评估细胞增殖。CCK-8法:分别将各细胞按5×103个/孔接种在96孔板中,培养0~74 h,每孔加入10 μL CCK-8试剂溶液并37 ℃孵育1 h,FlexA-200酶标仪(杭州奥盛仪器有限公司)读取450 nm波长的光密度(OD)值。EdU荧光染色:分别将各细胞按5×103个/孔接种在96孔板中,加入10 μmol/L EdU试剂37 ℃孵育2 h,PBS洗2次,4%多聚甲醛固定10 min,DAPI染核。MF-53N荧光显微镜(广州明美光电技术有限公司)拍摄荧光图像,并计数EdU阳性细胞。
5 细胞迁移和侵袭测定
用Transwell小室法评估细胞的迁移和侵袭能力。迁移测定:24孔板的每孔中加入700 μL补充有10% FBS的DMEM培养基,分别将各细胞按1×104个/孔(100 μL无血清但含3% BSA的DMEM培养基)接种在小室的聚碳酸酯膜上,然后将小室镶套放在24孔板中,37 ℃孵育24 h。擦除膜上侧面细胞,并将膜下侧细胞用0.5%结晶紫染色20 min,光学显微镜下随机选4个视野计数细胞。侵袭测定需采用基底膜包被小室的聚碳酸酯膜,其余步骤同迁移测定方法。
6 免疫荧光测定
将各细胞铺板到载玻片,37 ℃过夜培养粘附后,去除培养基,用兔抗β-连环蛋白(β-catenin)单克隆抗体(1:200;南京Bioworld公司)在4 ℃过夜孵育细胞。PBS洗涤后,用IFKine™ Green-驴抗兔IgG[1:500;亚科因(武汉))物技术有限公司]室温孵育1 h,PBS洗涤后,DAPI染核,在Airyscan 2激光扫描共聚焦显微镜(卡尔蔡司)下观察。
7 蛋白质印迹分析
收集细胞并在冰上用RIPA(武汉博士德生物工程有限公司)裂解并提取蛋白。用BCA蛋白浓度测定试剂盒(武汉博士德生物工程有限公司)对蛋白定量后,每个样品取20 μg蛋白用WB-600Auto全自动蛋白印迹处理系统(广州博鹭腾生物科技有限公司)进行蛋白电泳和转膜。用5%BSA封膜后,分别加入1:2000稀释的兔抗β-catenin、N-钙粘蛋白(N-cadherin)、E-钙粘蛋白(E-cadherin)和GAPDH一抗(均购自南京Bioworld公司)室温孵育2 h。洗涤膜后,加辣根过氧化物酶-IPKine小鼠抗兔IgG轻链二抗[1:2000;亚科因(武汉)生物技术有限公司]室温温育1 h。通过ECL增强化学发光[SuperLumia HRP底物ECL Plus超敏试剂盒,亚科因(武汉)生物技术有限公司]显影,用GelView6000 ProⅡ多功能图像工作站(广州博鹭腾生物科技有限公司)采集图像,并用光密度法对标记蛋白条带定量。
8 统计分析
用GraphPad Prism 9.0软件进行统计学分析,结果表示为平均值±标准差。 采用方差分析各组的差异,用Tukey法对各组均数进行多重比较。P值小于0.05被定义为具有统计学意义。
结果
1 GLI3在胃癌组织和胃癌细胞中高表达
免疫组织化学染色检测GLI3在正常胃粘膜组织和不同分期的胃癌组织中的表达显示,GLI3表达在癌旁组织的正常胃粘膜中呈阴性,在胃癌组织中呈阳性且而随着分期的增加而增强(图1A)。在不同的胃癌细胞系中,与正常胃粘膜细胞GES-1相比,胃癌细胞系中GLI3的表达水平均增高(图1B)。上述数据证明,GLI3在胃癌组织和胃癌细胞系中表达上升。
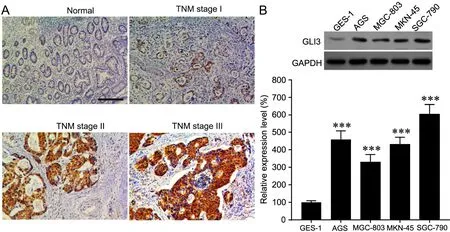
图1 GLI3在胃癌组织和胃癌细胞系中的表达。A,免疫组织化学染色法显示GLI3在癌旁正常组织、TNM 1-3期胃癌组织中表达的代表性图像;比例尺,200 μm。B,正常人胃粘膜细胞和不同胃癌细胞系中GLI3表达的代表性Western blot检测结果和统计学分析;与正常人胃粘膜细胞(GES-1)比较:***P<0.001;n=4Fig. 1. Expression of GLI3 in gastric cancer tissues and cell lines. A, representative immumohistochemical staining images showing the expression and distribution of GLI3 in para-cancer normal tissue, TNM Stage 1-3 gastric cancer tissue; scale bar, 200 μm. B, representative Western blot detection results and statistical analysis for the expression levels of GLI3 in normal human gastric mucosa cells and different gastric cancer cell lines; compared with normal human gastric mucosa cells (GES-1): ***P<0.001; n=4
2 敲低GLI3抑制胃癌细胞增殖
CCK-8法和EdU染色法检测显示:有效敲低GLI3表达(图2A)后,SGC-790和AGS细胞的活力(图2B)和增殖能力(图2C)均明显降低。
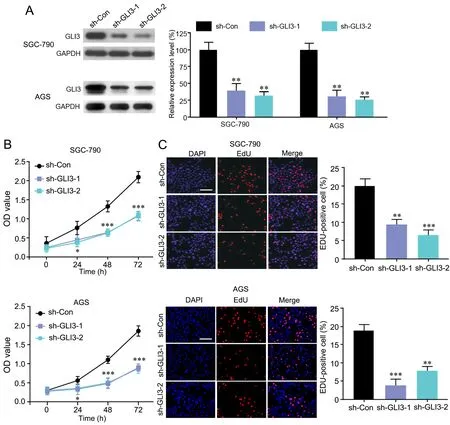
图2 敲低GLI3对胃癌细胞增殖的影响。A,GLI3 shRNA沉默SGC-790和AGS细胞中GLI3表达效率的Western blot检测与统计学分析;与对照shRNA比较:**P<0.01, n=4。B,敲低GLI3对SGC-790(上)和AGS(下)细胞活力影响的CCK-8法检测和统计学分析;与对照shRNA比较:*P<0.05,***P<0.001,n=4。C,敲低GLI3对SGC-790(上)和AGS(下)增殖影响的EdU染色检测和统计学分析;比例尺,100 μm;与对照shRNA比较:**P<0.01, ***P<0.001;n=4Fig. 2 Effect of knocking-down GLI3 on the proliferation of gastric cancer cells. A, Western blot detection and statistical analysis for the efficiency of Gli3 shRNA silencing Gli3 expression in SGC-790 and AGS cells; compared with the control shRNA: **P<0.01, n=4. B, CCK-8 assay and statistical analysis for the effect of knocking-down GLI3 on cell viability of SGC-790 (upper) and AGS (lower) cells; compared with the control shRNA: *P<0.05, ***P<0.001, n=4. C, EdU staining examination and statistical analysis for the effect of knocking-down GLI3 on proliferation of SGC-790 (upper) and AGS (lower) cells; scale bar, 100 μm; compared with the control shRNA: **P<0.01, ***P<0.001; n=4
3 敲低GLI3抑制胃癌细胞的迁移和侵袭
Transwell检 测 显 示:敲 低GLI3表 达 后, SGC-790和AGS细胞的迁移(图3A)和侵袭(图3B)均明显降低。
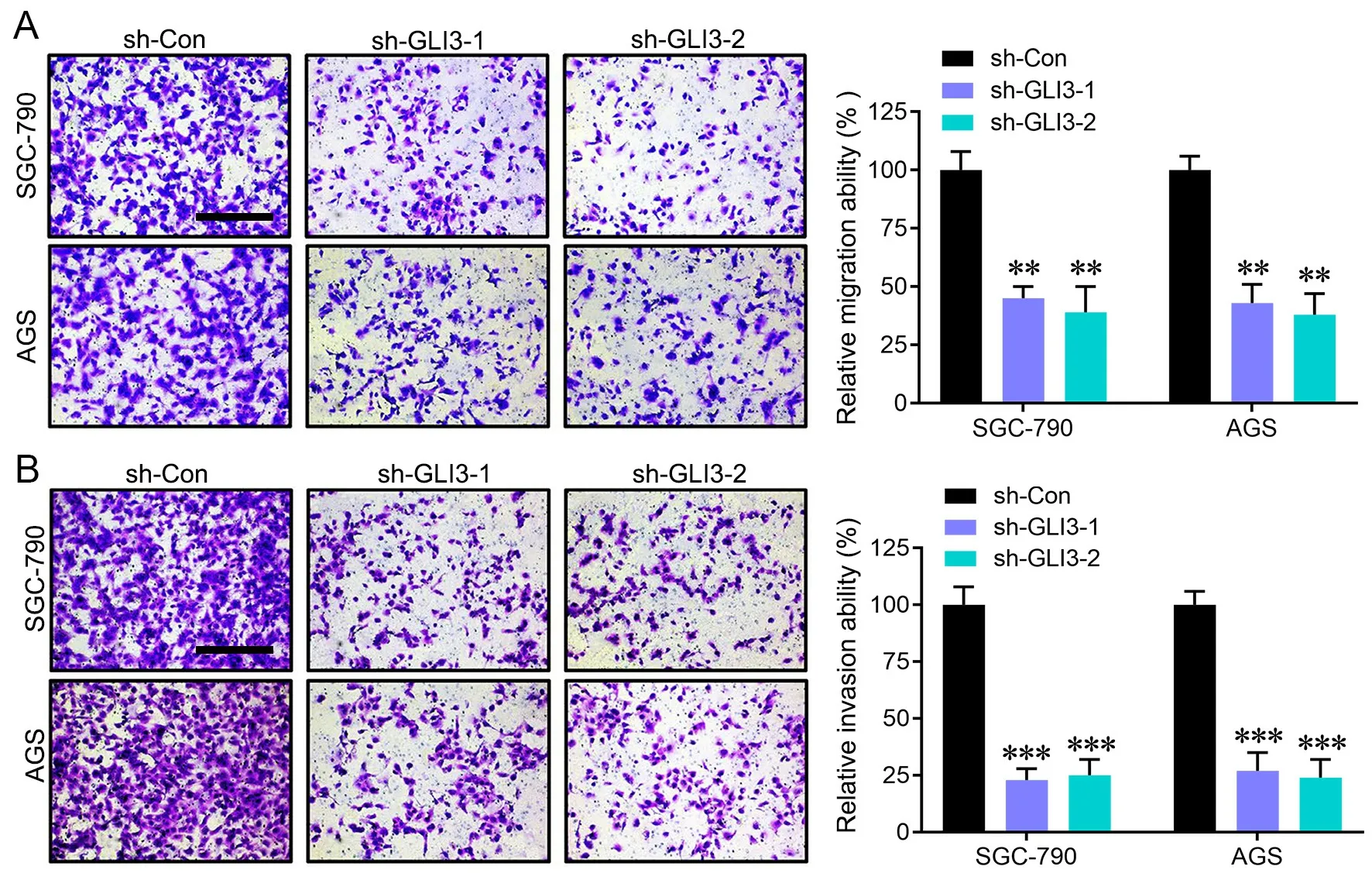
图3 敲低GLI3对胃癌细胞迁移和侵袭的影响。A,敲低GLI3对SGC-790和AGS细胞迁移影响的Transwell法检测和统计学分析;B,敲低GLI3对SGC-790和AGS侵袭影响的Transwell法检测和统计学分析;比例尺,100 μm;与对照shRNA比较:**P<0.01, ***P<0.001;n=4Fig. 3 Effect of knocking-down GLI3 on the migration and invasion of gastric cancer cells. A, Transwell examination and statistical analysis for the effect of knocking-down GLI3 on migration of SGC-790 and AGS cells; B, Transwell assay and statistical analysis for the effect of knocking-down GLI3 on invasion of SGC-790 and AGS cells; scale bar, 100 μm; compared with the control shRNA: **P<0.01, ***P<0.001; n=4
4 敲低GLI3降低胃癌细胞β-catenin和N-cadherin水平增加E-cadherin水平
免疫荧光染色显示:在对照SGC-790和AGS细胞中,β-catenin在细胞核和细胞质中均强表达,而用GLI3 shRNA沉默GLI3表达后,细胞核和细胞质中β-catenin表达均明显减弱,特别是细胞核中几乎不表达(图4A)。Western blot检测表明,沉默GLI3显著降低SGC-790和AGS细胞中β-catenin和N-cadherin水平,增加E-cadherin水平(图4B)。
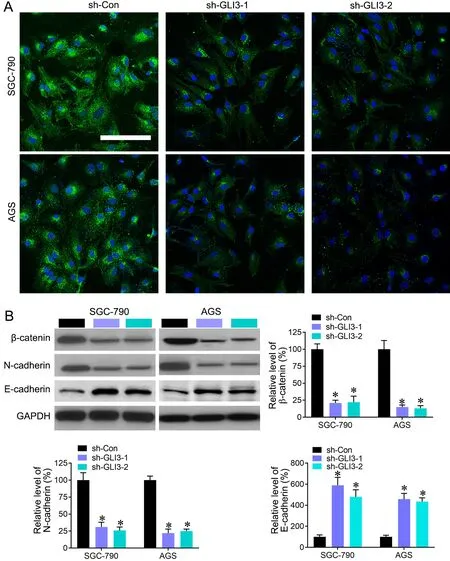
图4 . 敲低GLI3对胃癌细胞β-catenin、N-cadherin和E-cadherin水平的影响。A,沉默GLI3表达对SGC-790和AGS细胞内β-catenin表达影响的免疫荧光观察;比例尺,20 μm。B,沉默GLI3表达对SGC-790和AGS细胞内β-catenin、N-cadherin和E-cadherin水平影响的Western blot法检测和统计学分析;与对照shRNA比较:***P<0.001;n=4Fig. 4 Effect of knocking-down GLI3 on the levels of β-catenin, N-cadherin and E-cadherin in the gastric cancer cells. A, immunofluorescent observation on the effect of silencing GLI3 expression on the expression of β-catenin in SGC-790 and AGS cells; scale bar, 20 μm. B, Western blot assay and statistical analysis for the effect of silencing GLI3 expression on the levels of β-catenin, N-cadherin and E-cadherin in SGC-790 and AGS cells; compared with the control shRNA, ***P<0.001; n=4
讨论
发掘能影响胃癌增殖与转移的新靶点并阐明其影响胃癌转移的分子机制,可能为胃癌患者的个体化治疗提供新的见解[3,8]。众多报道[4-7]显示,GLI3在恶性实体肿瘤中能发挥促癌作用,而其在胃癌中的作用尚不清楚。本研究显示,GLI3表达随胃癌进展而递增,敲低GLI3能抑制胃癌细胞增殖、迁移与侵袭,表明GLI3可能是胃癌的一个有前途的生物标志物。
癌细胞转移是一个复杂的过程,涉及癌细胞招募内皮细胞并形成肿瘤微血管、癌细胞通过上皮间质转化(epithelial-mesenchymal transition,EMT)获得间质特性,使它们能够进入血流并侵入人体的其他器官[9]。越来越多的研究表明EMT在包括胃癌在内的多种恶性肿瘤的转移中起着重要作用[10-11],并且EMT还能在癌症侵袭转移的过程中能促进恶性肿瘤进展[12]。研究[13-14]显示,抑制EMT能抑制胃癌细胞的迁移与侵袭。E-cadherin和N-cadherin是EMT进程的重要的上皮表面标记分子,E-cadherin表达降低和N-cadherin表达增加往往代表着EMT启动,同时经常伴随着肿瘤细胞迁移与侵袭的增强[10-14]。本研究结果显示,在胃癌细胞中敲低GLI3能上调E-cadherin和下调N-cadherin,提示敲低GLI3能抑制胃癌细胞EMT。此外结合前面结果,敲低GLI3能发挥对胃癌细胞增殖、迁移与侵袭的抑制作用,进一步提示敲低GLI3抑制胃癌细胞侵袭与迁移可能与其抑制EMT有关。此外,本研究还发现敲低GLI3能降低β-catenin表达丰度。β-catenin是一个多功能蛋白,其能直接与E-cadherin形成复合物,也能通过转录因子、基质金属蛋白酶等间接与E-cadherin形成复合物,进而促进胃癌细胞EMT;而β-catenin表达降低的作用相反[15-17]。β-catenin还能与下游分子细胞周期蛋白D结合促进细胞增殖,而下调β-catenin则抑制胃癌细胞增殖[18]。以上结果显示,敲低GLI3对胃癌细胞增殖、侵袭与迁移的抑制作用可能与其抑制EMT与β-catenin表达有关。
