水系钠离子电池正极材料及电解液研究进展
2022-10-29鲁明峻吕奕菊
鲁明峻,吕奕菊,李 伟,刘 峥
(桂林理工大学化学与生物工程学院,电磁化学功能物质广西区重点实验室,广西桂林 541004)
当今科技飞速发展,人类对能源需求量日益增加。化石燃料依旧是火力发电的主力军,使用化石燃料会导致大量碳排放,这成为温室效应的主要因素。为了保护环境,清洁能源技术得到快速发展,大规模储能成为发电侧最主要配置。电化学储能技术因其安全性高、经济效益好而被广泛应用。锂离子电池因其优越的电化学性能而被广泛使用,已用作新能源汽车的动力电源,也用于手机和笔记本电脑的电源。
锂离子电池广泛应用也将面临锂资源短缺的问题[1],据调查,全球锂资源约为3 950 万吨,其中有商业开采价值的仅为1 351.9 万吨。以目前产业发展对锂需求量估算,探明的锂资源可用上百年。但是,储能行业在迅猛发展,锂的需求量也会成几何倍数暴涨,假设以后锂需求量维持在70 万吨/年,那么全球锂资源20 年内会被耗尽。
储能行业的主力军铅酸电池,因环境保护面临“退役”问题。在锂资源不足前提下,资源充沛的钠离子电池则迎来发展机遇。目前,碳酸锂价格大约40 万元/吨,碳酸钠价格约0.2 万元/吨。钠离子电池作为锂离子电池和铅酸电池替代品极具成本优势。
锂离子电池使用有机电解液,热累积或者外界碰撞容易导致电池安全问题,严重的会起火爆炸。钠离子电池使用水系电解液,电解液离子导电率高,且没有有机电解液的易燃易爆特点[2]。
文章对水系钠离子电池正极材料和电解液做综述性介绍,结合课题组研究工作探讨钠离子电池技术发展趋势。
1 水系钠离子电池研究现状
20 世纪80 年代前后,钠离子电池和锂离子电池一起,被作为未来储能的支撑技术,锂和钠资源对比数据见表1。在科学家们近半个世纪努力开发后,锂离子电池实现了商业化。钠离子电池研究被搁置,这主要原因在于钠离子质量偏重,半径比锂离子要大,在充放电循环时,钠离子在电极材料中脱嵌相对困难和缓慢,嵌入过程中迫使晶体无法保持原有结构,破坏材料稳定性。
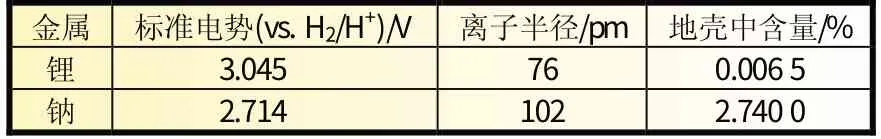
表1 锂和钠资源对比
钠离子电池电极材料研究不能照搬锂离子电池研究方法,需要寻找新型结构的正极材料,使用水系电解液,构建适宜钠离子脱嵌与嵌入的专属通道[3-6]。
1.1 聚阴离子化合物正极材料
“聚阴离子”化合物,其结构为开放式骨架结构,结构多样;其热力学和化学性能稳定,具有强烈阴离子诱导作用,是长循环寿命、优良高倍率性能和高安全性的理想正极材料[7]。
1.1.1 NASICON 型
NASICON 类化合物因其较高的结构稳定性、相对较大的离子通道和钠位可接近性较好而引起了广泛关注[8-9]。在具有NASICON 结构的钒基和钛基插入物插入主体中时,V4+/V3+和Ti4+/Ti3+的氧化还原过程发生在水的电化学稳定窗口内[10]。因此,NASICON 型NaTi2(PO4)3和Na3V2(PO4)3作为水系钠离子电池(ASIB)电极材料得到了深入研究。
NaTi2(PO4)3在水系电解液稳定性窗口的下端具有氧化还原活性,能够提高能量密度[11]。SHEN 等[12]使用NVTP@C 同时作为正极和负极组装对称ASIB 全电池。双功能NVTP@C电极的CV 曲线见图1(a),在0.53、0.42 V 处为一对正极氧化还原峰,-0.73、-0.66 V 处为一对负极氧化还原峰。图1(b)显示了对称ASIB 的CV 曲线,在1.17、1.08 V 处一对氧化还原峰是由于双功能的NVTP@C 电极中V4+/V3+和Ti4+/Ti3+的氧化/还原电对之间的电位差所产生的。如图1(c)所示,对称ASIB 在0.5C下的初始充电容量为79.6 mAh/g(理论值62 mAh/g),初始放电容量为48.8 mAh/g。充电容量异常高,归因于初始充电过程中存在不可逆水分解反应,此过程库仑效率低至61.3%。全电池在连续循环中表现出稳定的可逆容量和相对较高的库仑效率(约90%)。图1(d)展示了电池循环时的倍率容量,当放电电流从0.5C增加到15C,它仍然实现了85.2%的容量保持率,并且在15C时库仑效率接近100%。
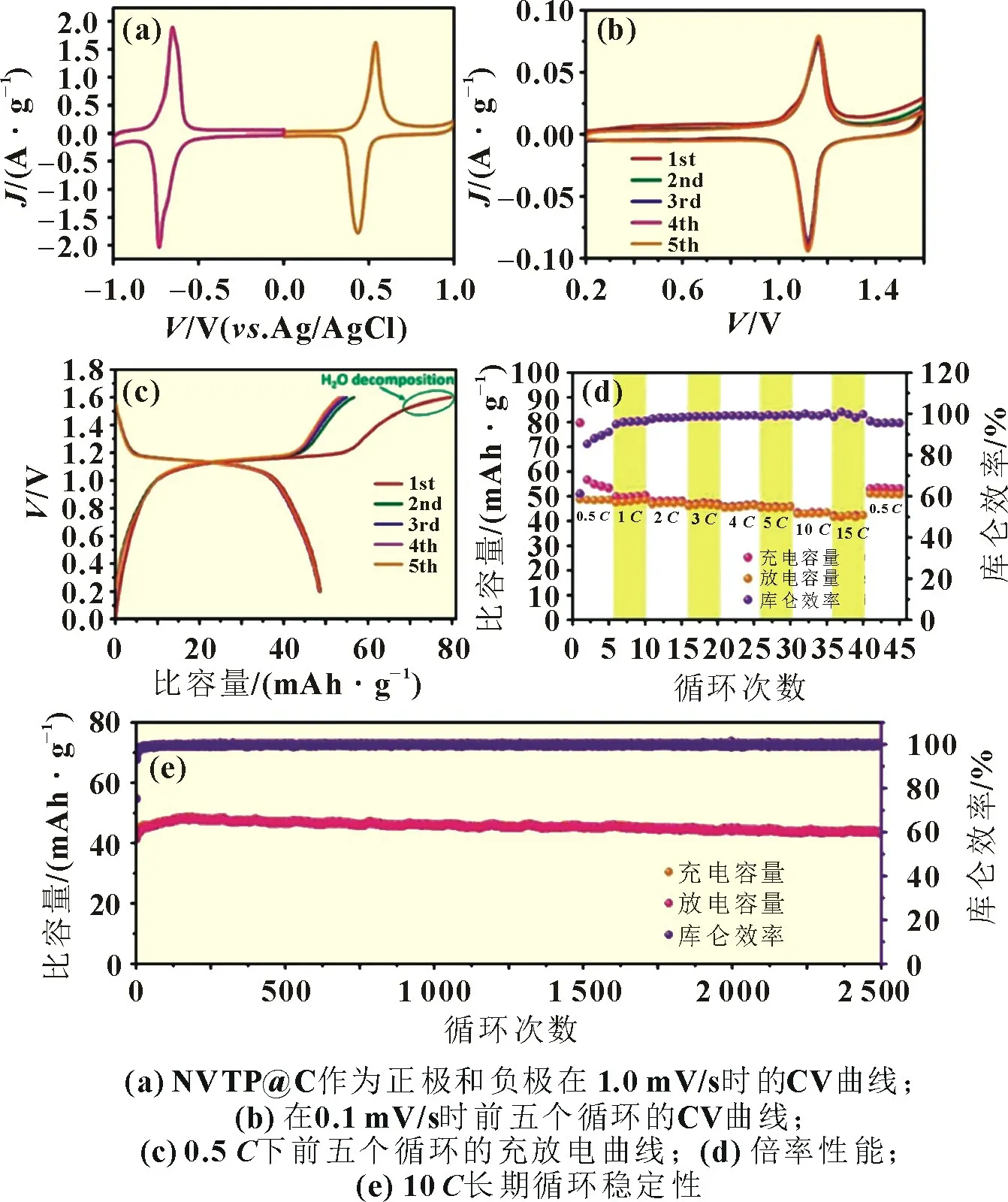
图1 基于NVTP@C电极的对称ASIB电化学性能[12]
1.1.2 磷酸盐类
众所周知,许多钒化合物受钒溶解的影响,导致ASIB 较大不可逆容量和较差循环稳定性。GOODENOUGH 及其同事[13]使用NASICON 结构的Na3MnTi(PO4)3开发了一种对称水系钠离子电池,在低浓度下表现出Ti4+/Ti3+和Mn3+/Mn2+氧化还原电对,NASICON 型Na3MnTi(PO4)3形成了基于MnO6或TiO6八面体的三维骨架,与PO4四面体共享其所有角,与NASICON 型Na2VTi(PO4)3(NVTP)对称非水系钠离子电池一样,同样具有出色的倍率性能和循环稳定性。此外,NVTP 电极还用于对称的水系钠离子电池,在传统的1 mol/L Na2SO4水系电解液中的输出电压约为1.2 V[14]。
YU 等[15]使用了溶胶-凝胶法制备碳包覆的Na3V2(PO4)3纳米复合材料。Na3V2(PO4)3/C 作为正极材料,10C、15C、20C放电比容量分别为94.5、90.5 和71.7 mAh/g,表现出优异的电化学性能,这是因为Na3V2(PO4)3纳米粒子和碳层所形成的独特核壳结构极大地改善了材料电子导电性。SONG 等[16]使用NASICON 型Na3V2(PO4)3作为正极材料,使用1 mol/L Li2SO4、Na2SO4和K2SO4电解质溶液,对该电极进行研究发现电化学离子交换过程将橄榄石LiFePO4转化为NaFePO4,使得它在Na+基电解质中出现了最佳性能。在1 mol/L Li2SO4水系电解液的初始脱锂过程中,初始脱锂容量为134.9 mAh/g,电压平台为0.25 V(vs.Ag/AgCl),见图2(a)。在1 mol/L Na2SO4电解质水溶液中进行电极的钠化过程,并确定了122.6 mAh/g 的钠化容量,电极电位稳定在-0.15 V。在钠化后,XRD图与NaFePO4的图非常吻合[17-18],见图2(b)。这些发现表明橄榄石LiFePO4的晶体结构通过FePO4中间体能成功转化为NaFePO4。
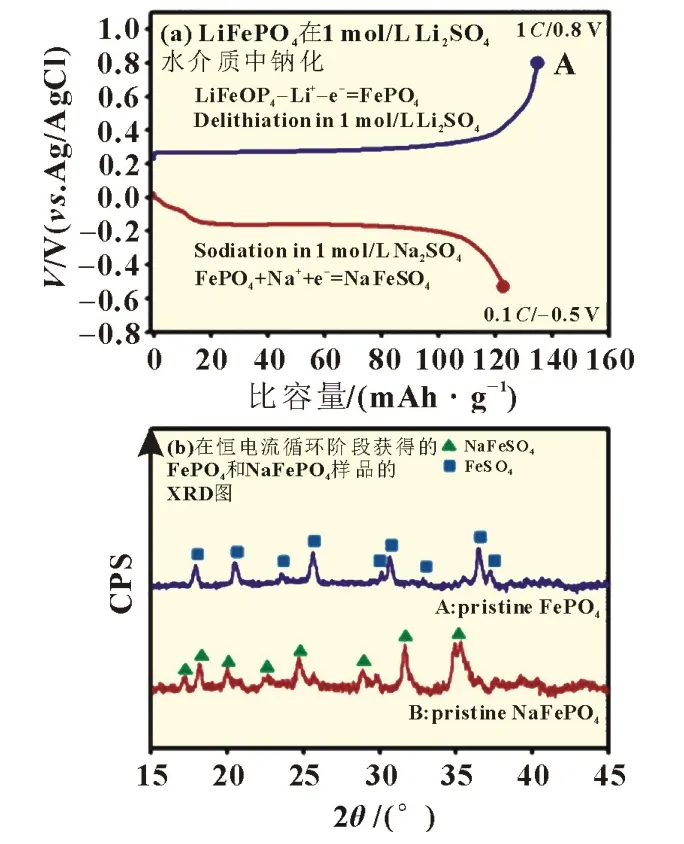
图2 电解质溶液中钠化和XRD图[18]
1.1.3 氟化磷酸盐类
GUO 等[19]的研究结果表明,Na2FePO4F 具有高平均工作电位,水系环境下具备高稳定性和较高的理论容量,因此成为ASIB 正极理想的候选材料。SHARAMA 等[20]研究结果中,Na2FePO4F 在17 mol/L NaClO4“盐包水”电解液中,可逆容量为85 mAh/g,在100 次循环后没有显著的容量损失。
具有Na+超离子导体结构的Na3V2(PO4)2F3被认为是具有巨大潜力的钠离子电池正极材料,但水系电解质下它较窄的电化学稳定性窗口(1.23 V)限制了电池本身的能量输出。LIU等[21]设计并合成了Na3V2(PO4)2F3-SWCNT 复合材料作为ASIB的正极材料,NaTi2(PO4)3-MWCNT 作为负极材料组成可充电钠离子电池,该电池可以提供150 Wh/kg 的高能量密度,通过使用高浓度电解质17 mol/L NaClO4,电压高达2.0 V。
1.1.4 焦磷酸盐
混合聚阴离子材料Na4Fe3(PO4)2(P2O7)结合了NaFePO4和Na2FeP2O7在容量、稳定性和成本方面的优势。前人通过可扩展的喷雾干燥路线合成了碳包覆的空心球结构Na4Fe3(PO4)2(P2O7)粉末。最佳样品可以在0.2C下提供107.7 mAh/g 的高放电容量。它在10C时提供88 mAh/g 的容量,1 500 次循环后的容量保持率为92%[22]。
FERNÄNDEZ-ROPERO 等[23]研究表明Na4-δFe3(PO4)2P2O7在水系电解液中以1C倍率提供84 mAh/g 的可逆容量,平均电位为3.0 V (vs.Na+/Na)。尽管在水系电解液中工作需要使用较窄的电压窗口(3.4~2.5 Vvs.Na+/Na),但材料在水系电解液中表现出的低过电位(0.07 V),从而可以让材料在水系电解液中拥有和在有机电解液中相同的容量。经测试,在1 mol/L Na2SO4水系电解液条件下,Na4‑δFe3(PO4)2P2O7在30 次循环后保留了80%的初始容量,在50 次循环后保留了74%,比有机电解液电池中观察到的容量保持率低(有机电解液50 次循环后为90%),也低于Na2FeP2O7(300 次循环后86%)[24]和NaFePO4(30次循环后90%)[25]。但Na4-δFe3(PO4)2P2O7测得的过电位显示其结构更易插入阳离子,在水系电解液中有接近100%库仑效率。
笔者认为聚阴离子化合物具有优异的电化学性能,如工作电压高、循环稳定性好,电极反应容易进行,是有前途的ASIB 正极材料[25]。该材料具有强聚阴离子共价键的稳定和坚固的框架,赋予了电极可长期循环性和改进的安全特性。从微观结构看,相交的骨架有许多大的空隙,使得钠离子扩散变得更加容易。
聚阴离子材料的合成方法很多,如球磨、喷雾干燥、溶胶-凝胶反应、静电纺丝、水热反应等。相较于ASIB 其它种类的正极材料而言,聚阴离子化合物的钠储存机制主要归因于与层状金属氧化物相比具有较少相变的插入反应,以及在富钠相和贫钠相之间建立明确的边界,这便让Na+从负极脱嵌到正极嵌入的这个过程更加容易[26]。
1.2 过渡金属氧化物正极材料
1.2.1 MnO2
MnO2的晶胞是由六个氧原子包围锰原子形成的八面体,隧道晶体结构通过共享顶点位置和边缘形成。通过控制合成方法,可以得到不同的MnO2隧道晶体结构。二氧化锰的几种典型晶型,如α-MnO2、β-MnO2、γ-MnO2、ε-MnO2、λ-MnO2和δ-MnO2,是最受研究者关注的水系电解液中储存钠离子的材料。
NOOKALA 等[27]使用无定形MnO2制造初级Na/MnO2电池。与水系可充电锂离子电池类似,研究人员尝试使用MnO2作为正极材料[28]。使用金属氧化物作为电极材料的电极通常具有电容行为,在其表面上经历法拉第吸附和解吸过程,不是钠离子提取/插入反应。此前,ATHOUËL 等[29]报道了水钠锰矿型δ-MnO2结构材料,它是一种二维层状结构材料,在0.5 mol/L Na2SO4电解液中,以2 mV/s 扫描速率进行了50 次伏安循环后,提供了145 F/g 的稳定电容容量,见图3(a)。最近,WHITACRE等[30]发现立方尖晶石λ-MnO2在Na2SO4水系电解液中具有优异的储能性能,图3(b)描述了λ-MnO2在1 mol/L Na2SO4电解液中可以实现约80 mAh/g 的放电容量,超过之前描述的正交Na4Mn9O18材料。使用λ-MnO2正极和活性炭(AC)负极制作薄型纽扣电池,在5 000 次循环,实现了70%理论容量,没有容量损失,数据见图3(c)。数据表明立方尖晶石λ-MnO2可以在中性Na2SO4电解液中有效发挥作用。SHAN等[31]首次报道了一种基于表面羟基化Mn5O8电极的高倍率高电压水系钠离子全电池,测试数据见图3(d)。Mn5O8纳米颗粒展示出了较宽的电位窗口(-1.7~0.8 V),且析氧过电位为0.63 V,析氢过电位为0.64 V。在0.1 mol/L Na2SO4电解质溶液中,显示出缓慢的析氧和析氢反应,在水系钠离子半电池中产生稳定的2.5 V 电位窗口。图3(e)显示了Mn5O8电极在5~50 A/g的不同电流密度下的放电容量。在5 A/g 下获得了116 mAh/g的容量,在50 A/g 下保持了高达20 mAh/g 的容量。图3(f)显示了在20 A/g 下测量的Mn5O8全电池更好的循环稳定性。Mn5O8电池表现出优异的库仑效率(接近100%)和能量效率(接近85%),在25 000 次循环后,电极容量为61 mAh/g。通过Mn2+/Mn4+氧化还原对的双电子电荷转移,为Na+通过Mn5O8的层内/层间空隙传输提供了简便的途径。

图3 过渡金属氧化物作为正极材料时电化学性能
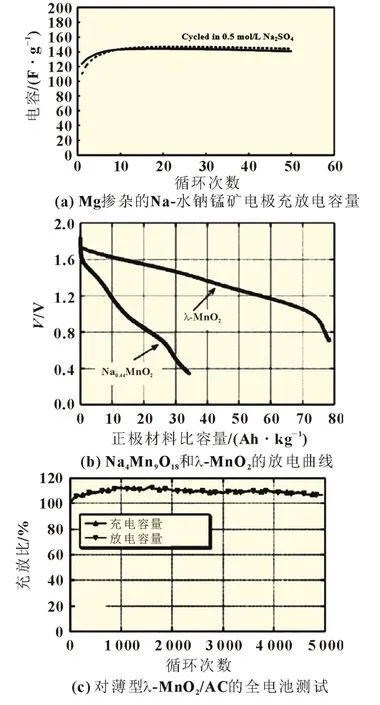
1.2.2 NaxMnO2
NaxMnO2是一种钠基过渡金属氧化物,NaxMO2(M=Co,Mn,Fe,Cr,Ni 等),是一种对ASIB 有吸引力的金属氧化物。在各种NaxMO2化合物中,不同的晶体结构和性质取决于钠的比例。Na0.44MnO2也称为Na4Mn9O18,有三维相互连接的S 形Na 隧道在ASIB[30,32-34]中被广泛研究。在过去的几年里,WHITACRE 等[35]已经证明了在隧道结构的钠锰基氧化物Na0.44MnO2(NMO)上形成了多相行为-离子提取/插入过程。尽管Na0.44MnO2材料C/5 下只能提供约35 mAh/g 的比容量,但在18C下循环,可保持20 mAh/g 的比容量。优异的循环性能证实该材料有望用作ASIB 正极材料。
SAUVAGE 等[36]通过严格控制合成条件,获得单相Na0.44MnO2,弄清了钠插入/脱嵌过程的复杂性。NaxMnO2材料,在0.18<x<0.64 组成范围内,在2.0~3.8 V(vs.Na+/Na)之间有六个不同的双相现象。KIM 等[37]也研究了Na0.44MnO2的钠离子嵌入和脱嵌行为,研究了Na0.44MnO2在水性体系和非水性体系中倍率性能,数据表明在水性体系内该材料具有更好倍率能力。
笔者认为过渡金属氧化物在作为ASIB 的正极材料时,具有高容量、高稳定性,氧化还原电位可调,这使它在ASIB 领域备受关注。但其在水系电解液中,这类材料也面临着多项挑战,当务之急就是解决电极材料在水系电解质中的溶解、与电解液的副反应和低电子电导率的问题。
1.3 普鲁士蓝类似物正极材料
普鲁士蓝类似物(PBAs)具有AxP[R(CN)6]1-y·nH2O 组分的通用化学式,A为碱或碱离子,P和R为过渡金属。它具有开放的三维框架,可实现快速离子扩散,有卓越循环稳定性。现已被报道为ASIB 合适电极材料[38]。K0.6Ni1.2Fe(CN)6·3.6 H2O 和Na1.4Cu1.3Fe(CN)6·8 H2O 在水系电解液中有特别良好的表现[39-40]。
YUAN 等[41]通过简便途径制备纳米级六氰基铁酸镍与碳纳米管复合材料NiHCF@CNTs(简称NC)并应用于ASIB 中。在ASIB 中,NC 在0.1 A/g 下提供54.1 mAh/g 的放电容量。在10 A/g 下,进行10 000 次循环,容量保持率为80%。在10 A/g的超高电流密度下,容量为47.9 mAh/g。
SHEN 等[42]借助于螯合剂和表面活性剂,通过简便的共沉淀法合成了高度稳定的单斜晶系富集六氰合铁酸镍(II)纳米晶(m-NiHCF)。它具有70.1 mAh/g 的比容量,并在8 000 次循环后容量保持率为97.1%。即使在2 000 mA/g 的电流密度下,其也能提供53.2 mAh/g 的容量。
WANG 等[43]利用六氰基铁酸铜(CuHCF)和六氰合铁酸铁(FeHCF)良好分离的氧化还原反应,以及两种电极材料良好的循环稳定性和倍率性能,以中性NaNO3溶液作为电解质,构建了全普鲁士蓝基水系钠离子电池。该电池具有0.70 V 的工作电位和27 Wh/kg 的能量密度。比容量为50 mAh/g,并且具有良好的倍率性能,在5C下250 次循环后容量保持率约为86%。从图4(a)中可以看出,FeHCF|NaNO3(aq)|CuHCF 电池的可逆容量为50 mAh/g(基于正极材料的质量计算)和27 Wh/kg的功率密度。图4(b)显示了全电池在300 mA/g 时的循环性能。图4(c)为倍率性能。

图4 FeHCF|NaNO3(aq)|CuHCF全电池[43]
笔者认为普鲁士蓝及其类似物拥有大间隙位置的刚性开放性框架和高理论比容量,从而使其在ASIB 正极材料中有一定的竞争优势,但报道的普鲁士蓝比容量却远低于理论值。以普鲁士蓝作为正极的二次钠离子电池的库仑效率低、循环稳定性差等这些问题都是当前普鲁士蓝及其类似物所面临的最大难题。针对以上问题,目前研究人员已经提出了多种解决方法。YUO 等[44]采用单一铁源作为前驱体,控制Na0.61Fe[Fe(CN)6]0.94(HQ-NaFe)纳米立方体缓慢的生成,从而获得具有少量空位、低含水量的高质量普鲁士蓝晶体。YOU等[45]合成了PB/CNT 复合材料,从而使CNT 纤维穿过立方PB颗粒的方式来填充PB 框架中的大量空位,且使其具有良好的结构稳定性。
2 水系钠离子电池电解液研究现状
电解质溶液作为电极之间的离子传输媒介,提供了一个离子通道来支持电流。传统水系电解液是通过将盐溶解到适当的溶剂中来制备的。与非水系电解液相比,水是一种有吸引力的替代品,因为它不仅安全,而且是一种具有高离子电导率的优良溶剂。
2.1 Na2?SO4?电解液
Na2SO4很早便被应用于ASIB 的水系电解液研究中,直到近些年来各种各样的水系电解质层出不穷,但Na2SO4仍借助着价格低廉,获取方式容易的特点,依旧被研究人员所青睐。WANG 等[14]就是使用1 mol/L 的Na2SO4溶液来完成ASIB 电池和三电极的测试,它在不同倍率下库仑效率保持在100%左右。即使在10C下,电极也表现出47 mAh/g 的可逆容量。WU 等[46]也同样使用1 mol/L Na2SO4溶液,通过CV 测试,发现Na-CuHCF 电极在Na2SO4水系电解液中拥有优越的循环稳定性,经过1 000 次循环后仍有90%的容量保持率。
2.2 NaNO3电解液
相比于Na2SO4,NaNO3的获取会比前者稍微困难一些,且价格也较Na2SO4略贵,但是其在水溶液中的溶解度比硫酸钠高。这是NaNO3作为ASIB 水系电解质的优势所在。MENTUS 等[47]使用NaFe0.95V0.05PO4/C 作正极,带状Na1.2V3O8作负极,饱和的NaNO3溶液作为电解质溶液,组成的水系电池,经过恒电流测试,显示出长寿命性能,1 000 次充放电后容量仅衰减10%。RAKOČEVIĆ 等[48]在900 ℃下合成的Na0.44MnO2,使用饱和NaNO3水溶液作为水系电解液,该材料制成ASIB,初始放电容量为46 mAh/g,10 次循环后容量增加到119 mAh/g,有高达96%的库仑效率。
2.3 NaClO4电解液
在水系钠离子电池的研究中,研究人员使用最多的电解液还是NaClO4[49-50],饱和的NaClO4水溶液浓度要远超过前两者,大量实验数据表明,与低浓度盐溶液相比,更高浓度盐溶液有着更利于拓宽电化学窗口的变化趋势。
NAKAMOTO 等[5]使用17 mol/L NaClO4水溶液,配置全电池,电极第二个充放电平台可以高达2~2.6 V,此时电化学窗口为0.5~2.6 V,在后续测试中发现,充电电压可以超过2.6 V,接近2.8 V。此电压已远高于以Na2SO4或NaNO3水溶液作为电解质溶液的电池充电电压。
2.4 其他种类电解液
目前,用于ASIB 水系电解质溶液的物质还有很多。如浓度相对较低的CH3COONa 溶液[51-52]、NaCl 溶液[53],SUO 等[54]报道一类新的含四乙基铵(TEA+)惰性阳离子的水系电解质溶液,它具有31 mol/kg 的超高浓度,即“盐包水”。应用该溶液,拓宽了ASIB 电化学窗口至3.3 V,“盐包水”体系还有效抑制了过渡金属在正极的溶解,确保在循环的过程中Na 在正、负极为单层插入。
在寻找新的超浓缩水性电解质时,需考虑以下标准[55-57]:(1)高溶解度,导致阳离子与水比值大于0.3,以消除游离水;(2)广泛的适用性和较低的低成本;(3)具备将阳离子-阴离子-水分子溶剂化结构转变为离子聚集结构的能力。
表2 中列出硫酸盐、硝酸盐和高氯酸盐基钠盐的相关数据,这三种钠盐常用做ASIB 的水系电解液。无机盐阴离子破坏本体水结构的相对能力自强至弱分别为ClO4-、NO3-、SO42-。ClO4-盐极易破坏水结构,可以通过离子聚集来改变溶剂化结构。当在水中的溶解度达到极限时,高氯酸基钠盐具有能够与水分子形成复杂的离子网络能力,从而来破坏它们的氢键网络[58,59]。
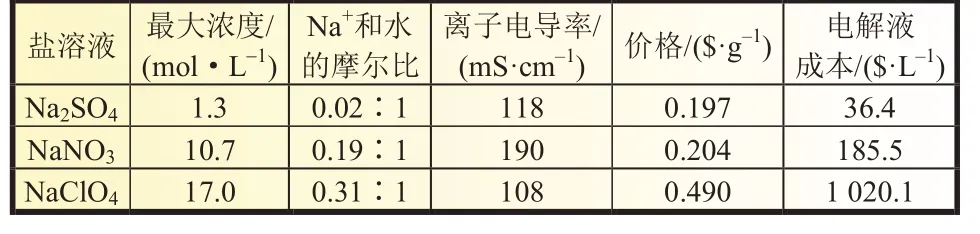
表2 钠基水系电解液[59]
3 未来挑战与展望
与现有大型储能技术相比,水系钠离子电池具有高安全、低成本、环保、可持续等优点。在储能技术的发展过程中,除了面临挑战外,也有许多发展机遇。
在电极材料方面,关键是开发和优化高性能的电极材料,组装成电压大于1.2 V、系统能量密度超过150 Wh/kg 的全电池,提高ASIB 在大规模储能中的竞争力。ASIB 虽然已被开发为传统有机钠离子电池的有前途的替代品,但仍有许多科学和技术问题尚未解决,阻碍其大规模应用。
以往的研究工作大多采用高浓度氟化盐,造成经济和环境问题,阻碍了水系电池实际应用。同样,高浓度氯化钠溶液可能会增加爆炸风险。
总之,ASIB 设计需要充分解决性能、成本、环境友好性和安全性之间的矛盾。另外,为了控制成本和延长电池使用寿命,需要进一步开发和改进制造技术,这也是电池市场化和长远发展的关键。
