微滤-超滤联用技术优化牛初乳乳清中IgG富集工艺
2022-10-27陈文璐刘妍妍耿思缘
陈文璐,刘妍妍, ,邓 凯,耿思缘
(1.黑龙江八一农垦大学食品学院,黑龙江大庆 163319;2.黑龙江惠丰乳品有限公司,黑龙江大庆 163316;3.大连产品质量检验检测研究所有限公司,辽宁大连 116000)
牛初乳是指健康母牛分娩后7 d内特别是3 d内分泌的乳汁,其蛋白质、脂肪、无机盐、维生素等含量明显高于常乳,且营养价值高出普通牛乳几倍到几十倍,对人类更有意义的是它含有大量的免疫因子(主要为IgG)和生长因子等活性成分,对提高人体免疫力、预防疾病具有独特的作用,因而被誉为“21世纪的保健食品”。目前,我国1~3 d牛初乳年产量约为20.2万吨,除哺喂犊牛外,约1/2可供加工利用。但由于牛初乳中干物质含量高,黏度较大,有苦味甚至有异臭味,加热易变性凝固等因素严重影响牛初乳产品发展,目前我国只停留在牛初乳的简单处理上,生产企业的规模较小,产品种类单一,另外,直接进行低温喷雾干燥和冷冻干燥生产初乳粉,生产成本较高,而且产品中活性成分IgG的含量较低。因此如何改善牛初乳企业的生产现状,降低生产成本,提高牛初乳产品中的IgG含量,是实现大规模工业化生产亟须解决的问题。
膜分离技术是一种新型的非热绿色环保技术,可最大限度地保留乳品的营养价值,尤其是对于热不稳定的营养物质,比如免疫因子、维生素等物质。现已应用到乳品行业的膜分离技术有微滤(MF)、超滤(UF)、纳滤(NF)、反渗透(RO)和电渗析(ED)等,可部分取代传统过滤、吸附、重结晶、浓缩、蒸馏、杀菌等工艺。有研究表明,通过微滤技术可去除乳清中的脂肪和细菌,得到蛋白含量达90%以上的分离乳清蛋白,刘飞云等使用膜孔径1.2 μm的陶瓷膜,在压力为0.12 MPa,温度为50 ℃的条件下,细菌的除菌率达到99%以上,芽孢的去除率达到95%以上。刘爱国等用盐析-超滤的方法提取纯化牛血清中的免疫球蛋白,得率为9.378 mg/mL,回收率为91%。罗磊采用截留分子量为100 kDa的聚醚砜膜提取猪血中IgG,纯度为68.2%,活性为87.6%,根据工艺的不同可将膜进行组合以获得最大成效。
针对国内牛初乳资源利用率低、产品种类单一,功效不稳定等问题。本研究拟以脱脂牛初乳乳清为原料,采取微滤-超滤联用技术对牛初乳乳清中的IgG进行富集,从而开发出具有免疫调节功能的富集IgG牛初乳乳清产品,可直接饮用或添加到其他液态奶产品中,进而开发出新型功能性产品,促进牛初乳功能液态奶产业的发展。
1 材料与方法
1.1 材料与仪器
牛初乳 黑龙江省完达山乳业有限公司;凝乳酶(酶活力为10 万U/g) 生化试剂,深圳市富晟生物科技有限公司;牛免疫球蛋白(IgG)酶联免疫试剂盒 上海分细生物科技有限公司;pH7.2磷酸盐缓冲液、平板计数琼脂(PCA) 杭州微生物试剂有限公司;氢氧化钠、浓硫酸、硫酸铜、硫酸钾、三聚磷酸钠、冰乙酸、乙酸钠、无水乙醚等均为国产分析纯。
实验室膜分离装置 吉林海普科技发展有限公司;JY2502 电子天平 郑州南北仪器设备有限公司;HH-6 数显恒温搅拌水浴锅 金坛市城东新瑞仪器厂;TD5A-WS 离心机 长沙湘仪离心机仪器有限公司;Sunrise 酶标仪 奥地利TECAN公司;SHP-250生化培养箱 上海森信试验仪器有限公司;LDZM-802KCS 立式压力蒸汽灭菌器 上海申安医疗器械厂;DL-CL-2ND 超净工作台 苏州安泰空气技术有限公司;K9840 自动凯式定氮仪 奥豪斯仪器(常州)有限公司;WH-2涡旋混合器 金坛市美特仪器制造公司;DGG-9140A电热鼓风干燥箱 上海森信公司。
1.2 实验方法
1.2.1 牛初乳乳清的制备 采集新鲜的牛初乳经纱布过滤,去除所含的细胞组织和采集过程中掺入的杂质,然后在4 ℃,4000 r/min条件下离心20 min,去除上层分离出来的脂肪层,再经纱布过滤得到脱脂牛初乳。
向脱脂后的牛初乳中添加3‰的凝乳酶后迅速搅匀,在34 ℃的水浴锅中进行恒温凝乳,待其全部凝结并有轻微的乳清析出时凝乳结束,冷却搅拌均匀后,在4 ℃,4000 r/min条件下离心30 min,将离心后用纱布过滤,得到牛初乳乳清。
1.2.2 膜的清洗 膜处理前对管路和膜组件用去离子水清洗30 min,再用70~75 ℃去离子水杀菌20 min,然后开始试验。试验完成后用去离子水清洗30 min,再采用1% NaOH溶液在50 ℃下反向清洗30 min,用以清洗膜中截留的蛋白,最后使用去离子水清洗至中性。
1.2.3 牛初乳乳清微滤除菌的工艺优化 回收1.2.1处理得到的牛初乳乳清,经0.2 μm孔径的陶瓷膜(膜面积0.07 m)过滤,截留乳清中的细菌。
1.2.3.1 不同微滤压力对微滤除菌效果的影响 选取微滤压力 0.05、0.10、0.15、0.20、0.25 MPa,在料液温度30 ℃的操作条件下,对牛初乳乳清进行除菌,将过滤后回收的截留液用去离子水稀释到原来体积,再次过滤,提升透过液蛋白含量。收集微滤的透过液,以菌落总数、IgG保留率和膜通量为指标,确定最佳的微滤压力。
1.2.3.2 不同料液温度对微滤除菌效果的影响 选取料液温度20、25、30、35、40 ℃,在微滤压力0.15 MPa的操作条件下,对牛初乳乳清进行除菌,将过滤后回收的截留液用去离子水稀释到原来体积,再次过滤,提升透过液蛋白含量。收集微滤的透过液,以菌落总数、IgG保留率和膜通量为指标,确定最佳的料液温度。
1.2.4 超滤富集IgG的单因素优化 回收1.2.3微滤得到的牛初乳乳清溶液,选用100 kDa孔径的卷式聚醚砜膜(膜面积0.32 m)。
1.2.4.1 不同超滤压力对超滤浓缩效果的影响 选取超滤压力 0.075、0.100、0.125、0.150、0.175 MPa,在料液温度30 ℃,浓缩5倍,3次稀释浓缩的操作条件下,对牛初乳乳清溶液进行超滤浓缩,收集超滤的截留液和透过液,以IgG浓缩率和膜通量为指标,确定最佳的超滤压力。
1.2.4.2 不同料液温度对超滤浓缩效果的影响 选取料液温度 20、25、30、35、40 ℃,在压力 0.1 MPa,浓缩5倍,3次稀释浓缩的操作条件下,对牛初乳乳清溶液进行超滤浓缩,收集超滤的截留液和透过液,以IgG浓缩率和膜通量为指标,确定最佳的料液温度。
1.2.4.3 不同浓缩倍数对超滤浓缩效果的影响 选取浓缩倍数 4、5、6、7、8倍,在压力 0.1 MPa,料液温度30 ℃,3次稀释浓缩的操作条件下,对牛初乳乳清溶液进行超滤浓缩,收集超滤的截留液和透过液,以IgG浓缩率和膜通量为指标,确定最佳的浓缩倍数。
1.2.4.4 不同稀释次数对超滤浓缩效果的影响 选取稀释次数 1、2、3、4、5次,在压力 0.1 MPa,料液温度30 ℃,浓缩5倍的操作条件下,对牛初乳乳清溶液进行超滤浓缩,收集超滤的截留液和透过液,以IgG浓缩率和膜通量为指标,确定最佳的稀释次数。
1.2.5 超滤富集IgG的响应面优化 在单因素实验结果的基础上,选取超滤压力、浓缩倍数、稀释次数为因素,根据Box-Behnken设计实验原理进行响应面法优化,通过分析和建立数学模型来确定超滤富集IgG的最佳工艺参数,响应面试验设计如表1所示。

表1 响应面试验设计因素与水平Table 1 Factors and levels of response surface experiment
1.2.6 检测分析方法
1.2.6.1 菌落总数的测定 参照食品安全国家标准GB 4789.2-2016中的平板计数法进行测定。
1.2.6.2 酶联免疫吸附法测定IgG活性和含量 采用牛免疫球蛋白(IgG)酶联免疫分析试剂盒,其步骤参考试剂盒说明书进行。
IgG活性线性回归得标准曲线为:y=243.8082x-0.5984(y:吸光度;x:IgG 标准品的活性为横坐标(IU/L))=0.9976。根据标准曲线计算IgG活性。
IgG含量线性回归得标准曲线为:y=0.0172x+0.0032(y:吸光度;x:IgG 标准品的浓度为横坐标(μg/mL))=0.9972。根据标准曲线计算IgG保留率和IgG浓缩率,分别按公式(1)和(2)计算。
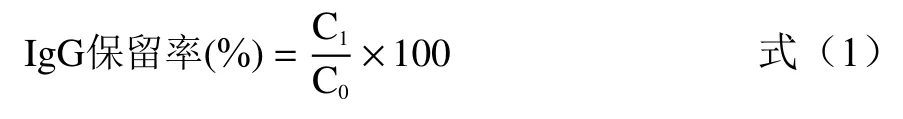
式中:C:微滤后 IgG 浓度,μg/mL;C:初始IgG 浓度,μg/mL。
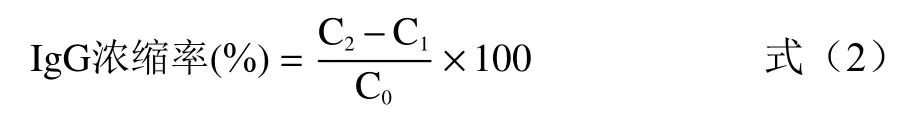
式中:C:浓缩后 IgG 浓度,μg/mL;C:微滤后IgG 浓度,μg/mL;C:初始 IgG 浓度,μg/mL。
1.2.6.3 膜通量的测定 一定的操作压力下,计算单位时间内通过单位膜表面的流体体积,膜通量的计算公式如下。

式中:J:通量,L/m·h;V:过滤液体积,L;A:面积,m;t:过滤时间,h。
1.2.6.4 蛋白质含量的测定 参照食品安全国家标准GB 5009.5-2016中的凯氏定氮法进行测定。
1.2.6.5 脂肪含量的测定 参照食品安全国家标准GB 5009.6-2016中的索氏抽提法进行测定。
1.3 数据处理
试验所得数据利用SPSS 18.0软件进行单因素方差分析,采用 Origin Pro 8.5 进行绘图,采用 Design-Expert 10.0.1 软件进行试验设计及分析。试验数据均为三次平行试验的均值。
2 结果分析
2.1 微滤除菌工艺参数结果与分析
2.1.1 微滤压力对透过液除菌效果、IgG保留率以及膜通量的影响 由图1可知,随着微滤压力的增加,菌落总数对数值呈下降趋势,除菌率>99.9%,微滤透过液中IgG保留率先上升后急剧下降,膜通量先上升再下降后上升,这可能是因为压力在0.05~0.2 MPa时,随压力增大牛初乳乳清对沉积层的剪切力增大,从而膜通量相应增大,但当压力继续增大时,吸附和沉积物的沉降速率增大,并且大于牛初乳乳清膜面的剪切力,滤孔的有效孔径缩小,造成膜孔堵塞和膜面浓差极化,膜通量降低,并进一步导致蛋白颗粒的截留。当压力增大至最大0.25 MPa时,微滤透过液中IgG保留率较低,说明微滤膜表面可快速形成滤饼层阻止IgG分子的渗透,然而微滤(压力0.25 MPa)过程中水分子的有效推动力大于沉积层的阻力,进而导致通量反而上升。因此,综合考虑微滤压力对除菌效果、IgG保留率以及膜通量的影响,确定微滤压力为0.20 MPa。
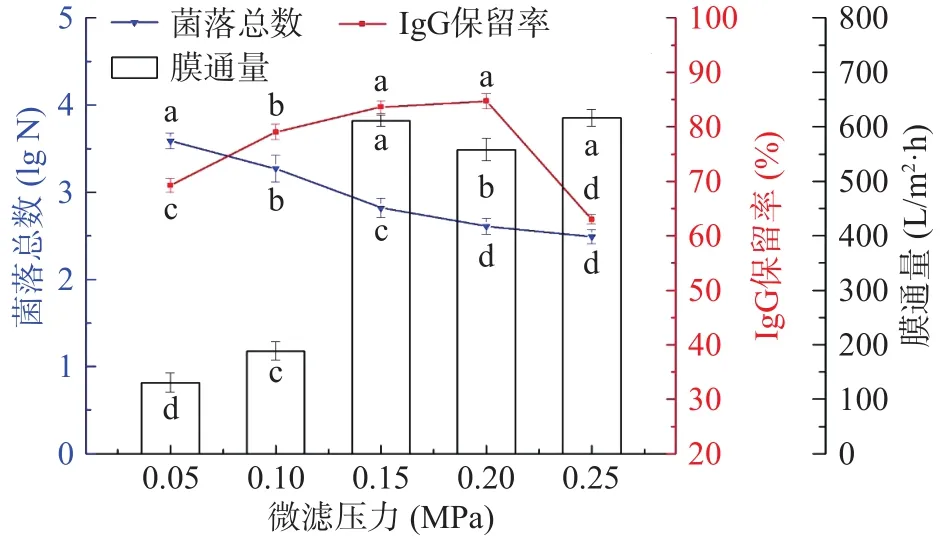
图1 微滤压力对菌落总数、IgG保留率和膜通量的影响Fig.1 Effect of microfiltration pressure on total bacterial count,IgG retention rate and membrane flux
2.1.2 料液温度对透过液除菌效果、IgG保留率以及膜通量的影响 由图2可知,随着微滤系统料液温度的上升,菌落总数对数值在逐渐降低,而IgG保留率和膜通量随着温度的升高呈先上升后下降的趋势,主要是因为温度较低牛初乳乳清的粘度较大,蛋白颗粒堵塞微滤膜,使滤孔的有效孔径缩小,导致膜通量降低,并进一步导致蛋白颗粒的截留。随着温度的上升,分子扩散系数增大,牛初乳乳清粘度降低,组分溶解度增大,因此膜通量提高,蛋白截留率降低,IgG保留率升高,当温度达到35 ℃时,乳清中蛋白质易发生聚集,导致膜表面蛋白浓度过高而造成大量蛋白吸附在膜表面,导致膜通量和IgG保留率降低。因此,综合考虑料液温度对除菌效果,IgG保留率以及膜通量的影响,确定微滤料液温度为30 ℃。

图2 料液温度对菌落总数、IgG保留率和膜通量的影响Fig.2 Effect of feed liquid temperature on total bacterial count,IgG retention rate and membrane flux
2.2 超滤富集IgG的单因素实验结果与分析
2.2.1 超滤压力对截留液IgG浓缩率及膜通量的影响 由图3可知,IgG浓缩率和膜通量随着超滤压力的增加呈现上升趋势,当超滤压力为0.150 MPa时,此时IgG浓缩率和膜通量均达到最高,分别为44.79%、190.54 L/m·h,随着操作压力的继续增加,IgG浓缩率和膜通量呈现下降的趋势。这是因为压力在0.075~0.150 MPa时,随着超滤压力的增加,膜系统中的推动力也不断增加,从而提高了IgG浓缩率和膜通量。但当压力增加到一定程度,牛初乳乳清在系统中聚集于膜表面,高浓度的蛋白形成结缔组织吸附于膜表面,形成凝胶层,阻塞膜孔,导致IgG浓缩率和膜通量降低。因此,综合考虑超滤压力对IgG浓缩率和膜通量的影响,确定超滤压力为0.150 MPa。

图3 超滤压力对IgG浓缩率和膜通量的影响Fig.3 Effect of ultrafiltration pressure on IgG concentration rate and membrane flux
2.2.2 料液温度对截留液IgG浓缩率及膜通量的影响 由图4可知,随着超滤系统料液温度的升高,IgG浓缩率随之增大,当温度达到35 ℃时,IgG浓缩率达到最大值为37.6%,随着温度的持续升高,IgG浓缩率随即下降,而膜通量也在35 ℃时达到最高,随着温度持续升高,膜通量呈缓慢下降趋势。可能是因为随着温度的升高,牛初乳乳清粘度降低,提高了料液在膜组件中的流动性,减少污染物在超滤膜表面的吸附,进而使得IgG浓缩率和膜通量增大,当温度等于或高于35 ℃时,可能是因为膜污染而导致膜通量和IgG浓缩率降低。因此,综合考虑超滤料液温度对IgG浓缩率和膜通量的影响,确定超滤料液温度为35 ℃。

图4 料液温度对IgG浓缩率和膜通量的影响Fig.4 Effect of feed liquid temperature on IgG concentration rate and membrane flux
2.2.3 浓缩倍数对截留液IgG浓缩率及膜通量的影响 由图5可知,随着浓缩倍数的增加,膜通量呈线性下降,而IgG浓缩率呈先上升后下降的趋势,当浓缩倍数达到6时,IgG浓缩率达到最大值为42.2%。随着浓缩倍数的增加,截留液中固形物含量增加,膜表面浓差极化严重,部分膜孔堵塞,造成膜污染,从而导致膜通量降低,浓缩倍数低于6倍时,IgG分子被有效截留,当浓缩倍数继续增大,IgG分子在水力作用下透过超滤膜,进而导致IgG浓缩率降低。因此,综合考虑超滤浓缩倍数对IgG浓缩率和膜通量的影响,确定浓缩倍数为6倍。
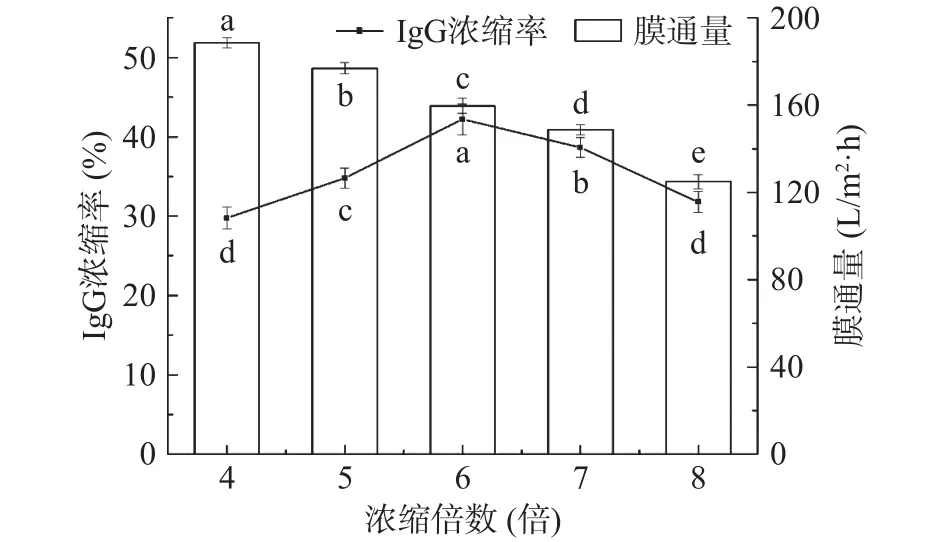
图5 浓缩倍数对IgG浓缩率和膜通量的影响Fig.5 Effect of concentration times on IgG concentration rate and membrane flux
2.2.4 稀释次数对截留液IgG浓缩率及膜通量的影响 由图6可知,随着稀释次数的增加,IgG浓缩率和膜通量均呈现先上升后下降的趋势,当稀释次数为4次时,IgG浓缩率和膜通量均达到最高,分别为42.59%、179.02 L/m·h,当透过液加水补充至原体积继续超滤后,透过液中IgG逐渐被浓缩使得浓缩率增大,而稀释次数越多,料液浓度较低,进而促进了水分子的扩散即膜通量上升。当稀释次数继续增大,膜通量和IgG浓缩率降低,这可能是由于随着透过液稀释次数的增加,料液中更多的大分子溶质吸附聚集在膜表面,导致传质阻力变大以及膜的污染现象加重,出现浓差极化现象,进而使得IgG浓缩率和膜通量降低。因此,综合考虑超滤稀释次数对IgG浓缩率和膜通量的影响,确定稀释次数为4次。

图6 稀释次数对IgG浓缩率和膜通量的影响Fig.6 Effect of dilution times on IgG concentration rate and membrane flux
2.3 超滤富集IgG的响应面试验
在单因素实验基础上以压力、浓缩倍数、稀释次数为自变量,以IgG浓缩率和膜通量为响应值,响应面试验结果如表2所示。
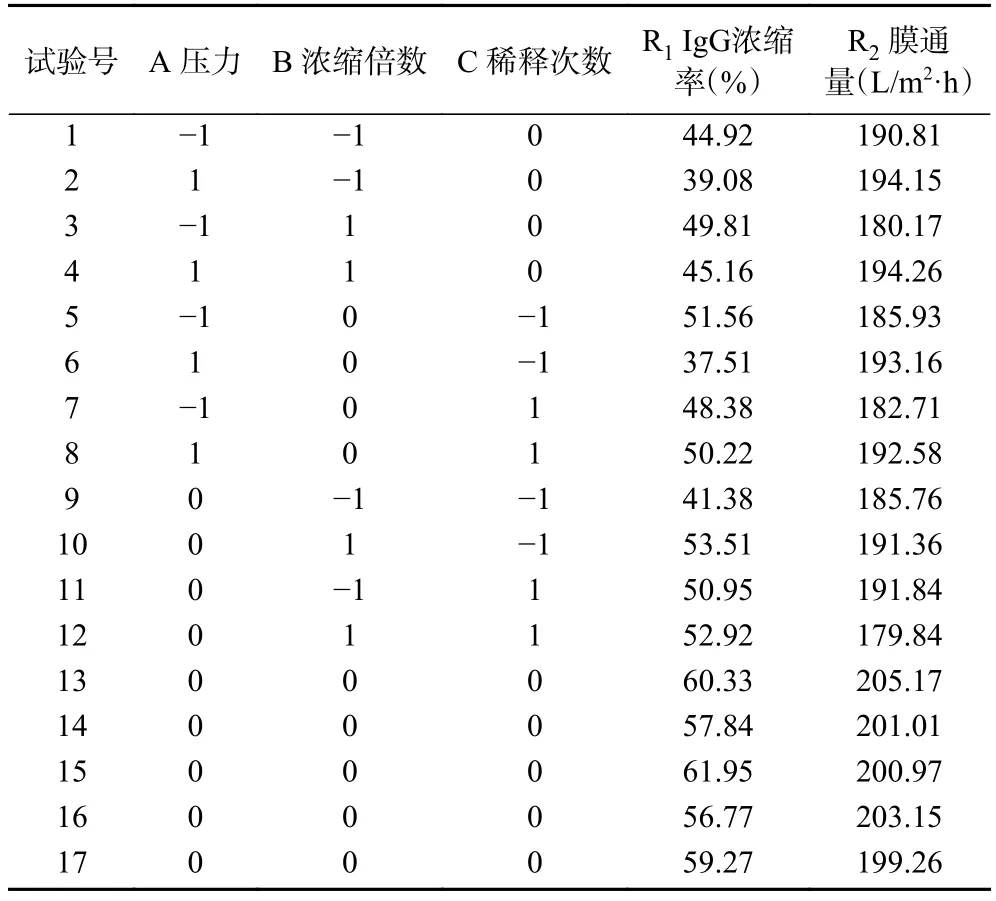
表2 响应面试验设计及结果Table 2 Experimental design and results for response surface experiment
2.3.1 响应面回归模型的建立与方差分析 利用Design-Expert软件对试验数据进行多元回归拟合,得到回归方程:R=59.23-2.84A+3.13B+2.31C+0.30 AB+3.97AC-2.54BC-8.63A-5.86B-3.68C;
R=201.91+4.32A-2.12B-1.15C+2.69AB+0.66 AC-4.40BC-5.33A-6.73B-7.98C。
方差分析结果见表3、表4。
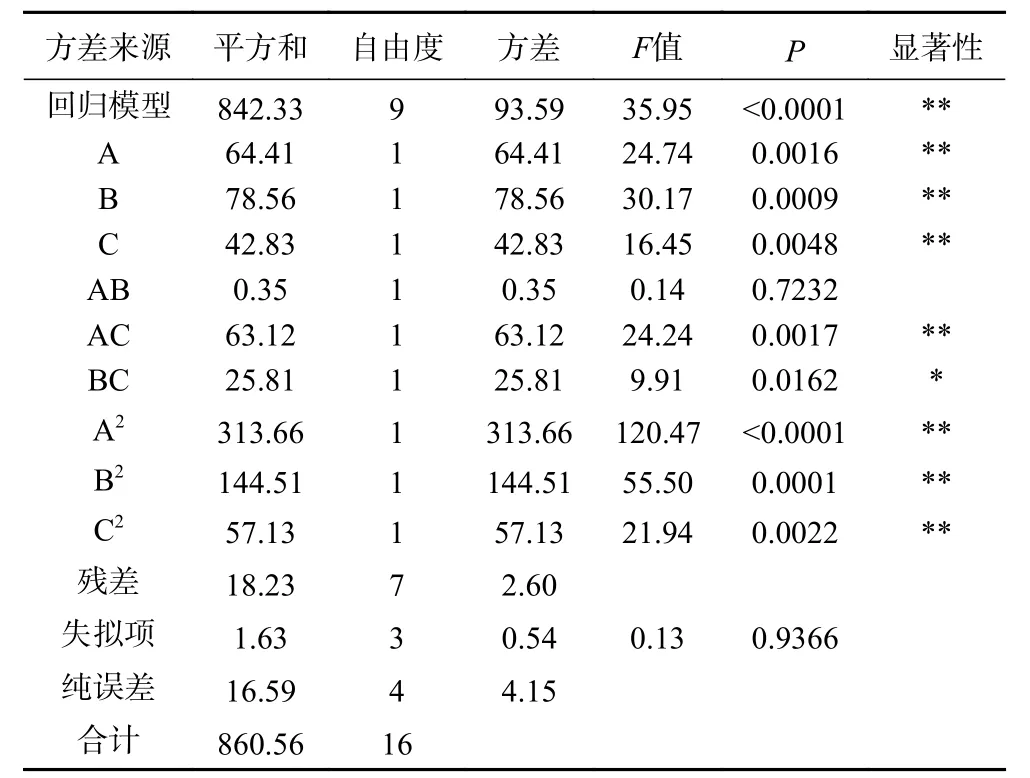
表3 IgG浓缩率回归模型方差分析Table 3 Analysis of variance of IgG concentration rate regression model
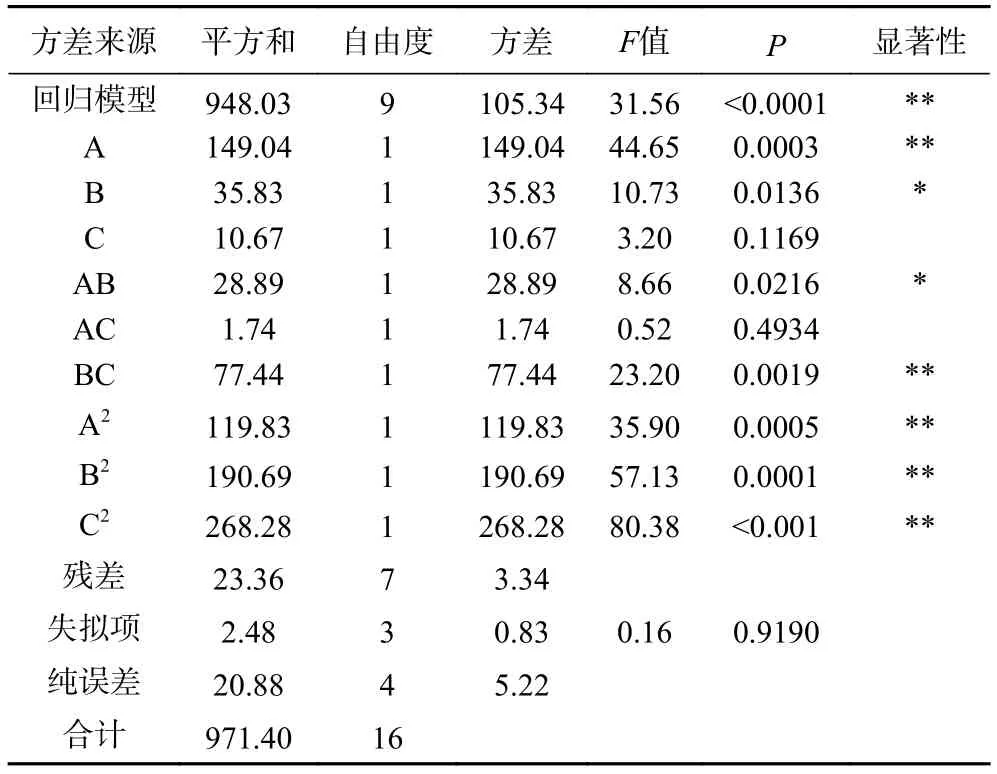
表4 膜通量回归模型方差分析Table 4 Analysis of variance of membrane flux regression model
由表3可知,IgG浓缩率的回归模型<0.0001,表明回归模型高度显著,失拟项>0.05,失拟项不显著,说明该模型具有统计学意义。观察各因素的值可以得出,因素A、B、C、AC、A、B、C对 IgG浓缩率影响极显著(<0.01);交互项BC对IgG浓缩率影响显著(<0.05);其他变量的影响均不显著(>0.05);说明单因素作用和交互作用对IgG浓缩率均有显著的影响。此模型的决定系数=0.9788,=0.9516,表明此模型拟合度良好,因此可用该模型来分析和预测微滤-超滤联用技术富集牛初乳乳清中IgG的工艺条件。
由表4可知,膜通量的回归模型<0.0001,说明回归模型差异极显著,失拟项>0.05,失拟项不显著,说明该模型具有统计学意义。观察各因素的值可以得出,因素A、BC、A、B、C对膜通量影响极显著(<0.01);交互项 B、AB对膜通量影响显著(<0.05);其他变量的影响均不显著(>0.05);说明单因素作用和交互作用对膜通量均有显著的影响。此模型的决定系数=0.9759,=0.9450,表明此模型拟合度良好,因此可用该模型来分析和预测微滤-超滤联用技术富集牛初乳乳清中IgG的工艺条件。
2.3.2 响应面分析 响应面图形可通过二维空间和三维空间直观地反映各因素及其交互作用对响应值的影响。由多元回归方程所作的响应曲面等高线图和3D图,如图7、8所示。
响应面坡度和凹凸程度能够反映各因素对超滤富集IgG的影响大小,三维响应面坡度陡峭和曲率越大则说明两个因素的交互作用影响显著,反之响应曲面的曲线越平坦,则说明两个因素的交互作用影响较小,等高线为椭圆形表示两个因素交互作用显著,等高线为圆形则说明交互作用不显著。由图7可知,三个响应曲面陡峭、曲率相对比较大,在因素水平范围内压力、浓缩倍数和稀释次数对IgG浓缩率均有显著影响,且压力和稀释次数的交互作用大于浓缩倍数与稀释次数和压力与浓缩倍数的交互作用,试验结果与方差分析一致。由图8可知,压力与浓缩倍数,浓缩倍数与稀释次数的等高线图趋于椭圆,响应面图的曲面较陡,交互作用明显。压力与稀释次数的等高线图趋于圆形,响应面图曲面较平缓,交互作用较小。比较3组图可知,压力对膜通量的影响最为显著,曲面较陡。
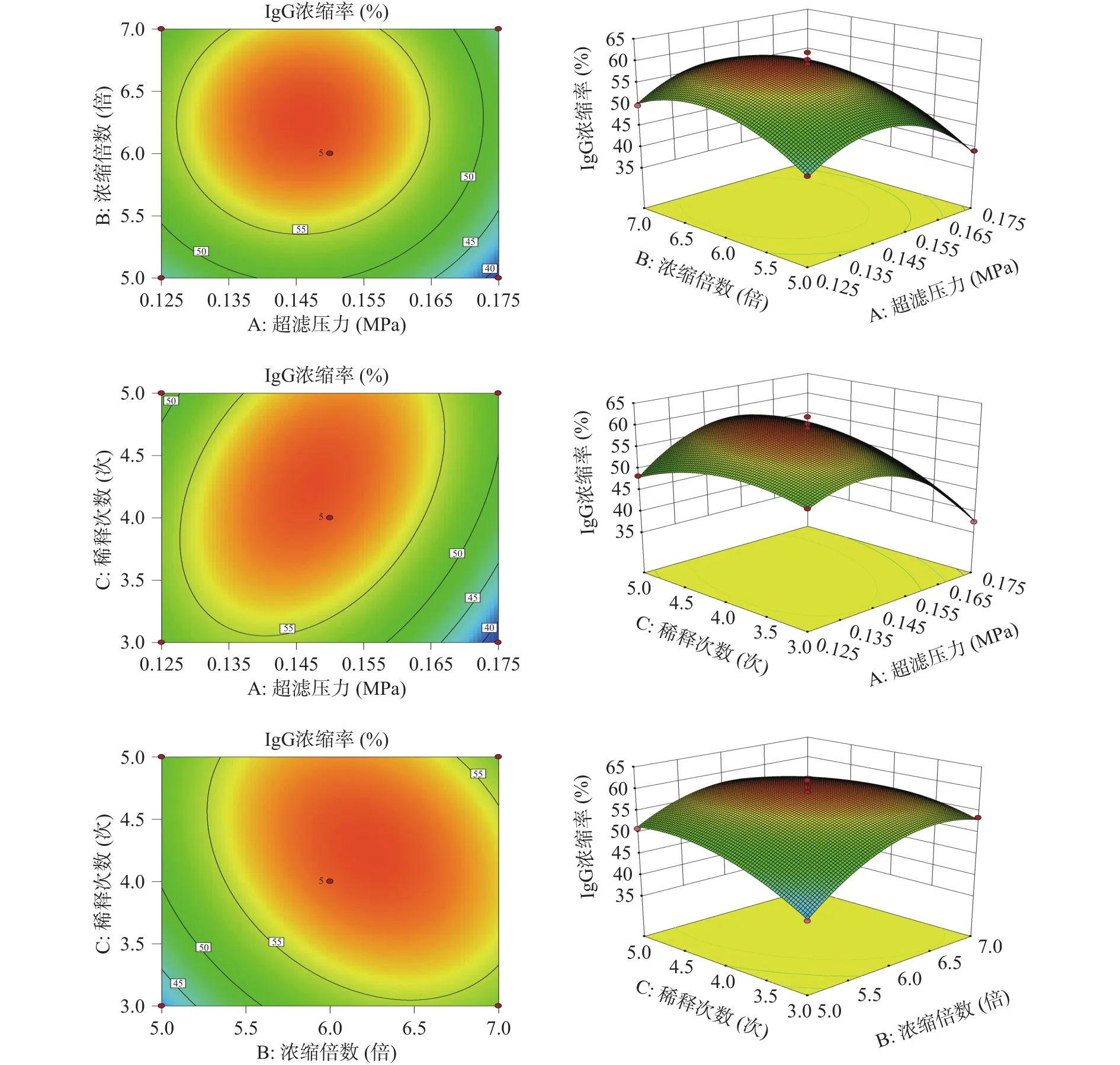
图7 不同因素的交互作用对IgG浓缩率影响的响应面图Fig.7 Response surface map of the interaction of different factors on IgG concentration rate

图8 不同因素的交互作用对膜通量影响的响应面图Fig.8 Response surface map of the interaction of different factors on membrane flux
2.3.3 最优配方的验证试验 对回归模型进行响应面分析,得到最佳工艺条件:压力为0.152 MPa、浓缩倍数为6.04倍、稀释次数为4.05次,在此条件下,IgG浓缩率为59.24%,膜通量为202 L/m·h。考虑到实际操作,选用压力为0.15 MPa、浓缩倍数为6倍、稀释次数为4次,在此条件下进行三次重复试验,得平均 IgG浓缩率为 58.19%,膜通量为 204.46 L/m·h,与模型预测结果接近,表明基于该响应面模型分析优化微滤-超滤联用技术富集牛初乳乳清中IgG工艺条件的方法有效可行。
2.4 理化性质比较
对牛初乳、牛初乳乳清和富集牛初乳乳清中的IgG含量、IgG活性、蛋白含量、脂肪含量以及菌落总数进行测定,如表5所示。
由表5可知,制备初乳乳清使IgG含量损失5.39%,IgG活性损失2.27%,蛋白质含量损失60.98%(主要是酪蛋白),脂肪去除率达到99.04%,菌落总数未发生太大变化。通过微滤-超滤联用技术使IgG含量提高了58.17%,IgG活性提高了86.74%,蛋白质含量提高了110.72%,脂肪去除率达到14.6%,除菌率达99.9%。

表5 牛初乳乳清富集后品质指标的变化Table 5 Changes of quality indexes after enrichment of bovine colostrum and whey
3 结论
本文探究了牛初乳乳清中IgG富集的基本工艺条件,通过单因素实验确定微滤除菌的最佳工艺条件:微滤压力为0.20 MPa、温度为30 ℃。在单因素实验的基础上,通过响应面法建立了多元回归模型,确定了超滤富集的最优工艺条件:超滤压力为
0.15 MPa、温度为35 ℃、浓缩倍数为6倍、稀释次数为4次。按此条件进行牛初乳乳清的微滤-超滤操作,此时的 IgG浓缩率为 58.19%,膜通量为
204.46 L/m·h,并对富集后的牛初乳乳清进行了品质分析:IgG含量为22760 μg/mL,IgG活性为718.31 IU/L,蛋白质含量为7.86%,脂肪含量为0.035%,菌落总数为2.4 lg CFU/mL。由于整个工艺在温度较低的条件下进行,牛初乳中的热敏性成分(IgG)损失较少,提高了产品的质量,为牛初乳乳清中IgG的进一步开发与综合利用提供了一定的参考依据。但作为功能性食品要大规模开发必需解决以下基本问题。一是缺乏相应的国家标准,目前只有行业规范;二是国家缺乏对牛初乳产品的监管机制及监管办法。
