CRISPR-Cas9技术修饰乳酸杆菌的研究进展
2022-10-27余咏诗
余咏诗,刘 辉,2,
(1.佛山科学技术学院食品科学与工程学院,广东佛山 528225;2.佛山科学技术学院医学院,广东佛山 528000)
几个世纪以来,乳酸杆菌作为一种能发酵食物的益生菌,已成为开发食品配方和益生菌产品最常用的微生物之一。随着对乳酸杆菌研究的不断深入,乳酸杆菌的生理机制和生物特性被广泛开发与利用。通过对乳酸杆菌的基因进行修饰,从而开发出具有更优良性质的可用于食品、药物生产的新型乳酸杆菌,是目前研究的热点之一。因此,高效的基因修饰技术是必不可缺的工具。
近年来,CRISPR-Cas9技术以效率高、简便、成本低等特点在农业、医疗药物等领域中大放异彩。但美中不足的是,该技术的效率、精确性还有待提高,同时消费者和工业界对转基因产物的安全性也持有怀疑的态度,因此经过基因修饰的产物会受到严格的监管。但从科学的角度来看,基因编辑的转基因乳酸杆菌是很有潜力的,且国内外也已经允许了一部分应用CRISPR-Cas9技术编辑植物的使用。因此,利用CRISPR-Cas9技术对乳酸杆菌进行改造是一个值得关注的研究方向。
目前,CRISPR-Cas9技术在乳酸杆菌中的应用较少。现有研究主要集中在对乳酸杆菌自身CRISPRCas系统的分析和研究,而对乳酸杆菌原位基因修饰的研究报道并不多见。与传统的菌株改良方法相比,CRISPR-Cas9技术可极大地提高乳酸杆菌靶向位点的正确性并做到无痕基因组修饰,通过此技术获得的菌株甚至有可能比通过传统的随机诱变方法获得的菌株更为安全。随着基因编辑技术的逐渐成熟,以及大众接受程度的增加,CRISPR-Cas9技术编辑过的乳酸杆菌将会广泛地应用到人体健康、食品工业等领域。本文对部分乳酸杆菌和CRISPR-Cas9技术进行介绍,对CRISPR-Cas9技术在乳酸杆菌中的应用与存在的问题进行综述,并展望未来CRISPRCas9技术运用到乳酸杆菌的发展趋势,期望为国内乳酸杆菌生物工程化的研究与开发提供一些思路。
1 乳酸杆菌的概述
乳酸菌(Lactic acid bacteria,LAB)是指能利用可发酵碳水化合物并产生大量乳酸的一类无芽孢、革兰氏染色阳性细菌。这类细菌是一种分布极为广泛、具有丰富多样化的物种,以杆菌或球菌为主。乳酸菌至少包括18个属,由200多种已被正式认可的物种和亚种组成,其中乳酸杆菌()最为重要。乳酸杆菌不仅是人类体内的共生菌之一,而且在人类健康和食品工业等方面也起到了不可或缺的作用。
早在公元3世纪,乳酸杆菌就已经开始被人类用于发酵食物,而对乳酸杆菌长期的研究和应用早已证明了一些乳酸杆菌是安全的、具有多种功能作用的益生菌,因此它们也被广泛应用于保健食品,促进人体健康。其中,最典型的是乳酸杆菌可以防治乳糖不耐症(喝鲜奶时出现的腹胀、腹泻等症状),因为乳糖会被乳酸杆菌产生的乳糖酶所降解形成更容易吸收的小分子状态,使得乳糖不耐受患者可以接受乳制品。同时,乳酸杆菌可以增加肠道有益菌群,改善人体胃肠道功能,恢复人体肠道内的菌群平衡,形成抗菌生物屏障,维护人体健康。此外,乳酸杆菌可抑制脂肪酸的吸收,进而减少体脂增加。Jang等利用动物喂养实验的方法分别对小鼠进行口服灌胃鼠李糖乳杆菌和生理盐水的处理,以评估鼠李糖乳杆菌()对肝脏脂质积聚和造成肥胖的慢性作用,结果表明口服鼠李糖乳杆菌的小鼠肠道显著减少了对脂肪酸的吸收。
乳酸杆菌不仅对人体有着许多有益的功能,同时也是食品工业中的重要菌种,能赋予食品独特的风味以及改善食品的品质和营养成分。唐立伟等研究了鼠李糖乳杆菌()、瑞士乳杆菌()、副干酪乳杆菌()等四种典型的乳酸杆菌在乳品发酵过程中的pH、酸度变化、货架期内的活菌数变化及耐胃酸的能力,结果表明发酵乳产酸快但货架期短,而和的发酵乳货架期稳定性优良。此外,乳酸杆菌在养殖业中也发挥了重要作用,唾液乳杆菌()可以改善鸡的生长性能,有效增加体重和免疫器官的相对重量,而且还可减轻热应激引起的器官损伤以及增强传染性法氏囊病(Infectious bursal disease virus, IBDV)疫苗免疫后的免疫应答。
上述研究结果表明,乳酸杆菌不仅能促进人体健康,在发酵食品中的工业应用和养殖业等领域同样也占据着非常重要的地位。表1列出了一些乳酸杆菌的代表菌种及其在食品加工中的应用。

表1 部分乳酸杆菌的菌种及其在食品加工中的应用Table 1 Some Lactobacillus strains and their application in food processing
2 CRISPR-Cas9技术的发现及作用机制
基因编辑是能精确插入、删除、替换生物体中含有遗传信息的基因序列的新兴技术,而CRISPR-Cas9是继锌指核酸酶技术(Zinc-finger nuclease,ZFNs)、转录激活因子样效应物核酸酶技术(Transcription activator-like effector nuclease,TALENs)等基因编辑技术推出后的第三代基因编辑技术。短短几年内,CRISPR-Cas9技术风靡全球,成为现有基因编辑和基因修饰里面效率最高、最简便、成本最低、最容易上手的技术之一,也是当今最主流的基因编辑系统。前两代基因编辑技术都需要构建结合蛋白和Fok I核酸内切酶的结构域组成的复杂系统。ZFNs作为第一代基因编辑技术,锌指蛋白能识别特定的3个连续碱基对,由Fok I核酸内切酶的结构域负责切割DNA,其设计依赖上下游序列,脱靶率高,具有细胞毒性,且这项技术专利被美国Sangamo垄断,因此自问世以来无大规模应用。第二代的TALENs与ZFNs类似,TALENs由TALE基序串联成决定靶向性的DNA识别模块,一个TALE基序识别一个碱基对,特异性高,细胞毒性比ZFNs低。但TALENs存在较多的重复序列,需要大量测序工作,且模块组装过程繁琐。而CRISPR-Cas9技术除了靶向精准、脱靶率低、细胞毒性低等特点外,另一个显著优势是它能够同时编辑多个基因,利用多个gRNAs靶向不同的基因,为复杂的多基因编辑研究开辟了新的可能性。
CRISPR是1987年由石野良纯等在大肠杆菌()基因组中意外发现的一系列串联重复DNA片段,这些片段含29个保守碱基且被另一段含32个碱基的可变序列隔开,但当时对这种结构的生物学功能不得而知。九十年代,随着研究者在多种细菌和古细菌基因组中都发现了这种特殊的重复片段,因此在2000年将其统称为短规律性间隔重复(Short regularly spaced repeat, SRSR)序列。直到2002年,Jansen等对这种特殊结构进行深入研究后,正式将这种结构命名为成簇规律性间隔短回文(Clustered regularly interspaced short palindromic repeats,CRISPR)序列。随后研究者陆续发现许多与CRISPR序列功能相关联的基因,并将其统称为CRISPR-相关因子(CRISPR-associated,Cas)。最初对于CRISPR-Cas功能的假设是其可能参与细胞的DNA限制性保护和复制子分配等过程。然而在2005年,有研究者提出CRISPR-Cas是一种适应性免疫系统的假说,且这个假说在2007年成功被Barrangou等验证。Barrangou等发现这个系统可以将新的噬菌体DNA整合到CRISPR阵列中,这使它们被同样的病毒再次入侵时细菌就有了抗性,使其免遭攻击。Bolotin等在研究嗜热链球菌()的基因组时,发现了一个不寻常的CRISPR基因座。尽管这个CRISPR阵列与先前报道的系统相似,但它不仅缺少一些已知的Cas基因,又包含新的Cas基因,包括编码大分子蛋白质的基因。Bolotin等预测该基因表达的蛋白具有核酸酶活性,这个基因就是Cas9。自此,对CRISPR-Cas9系统相关的研究开始增加。
目前,CRISPR-Cas系统被分为I、II和III型三种主要类型,而 CRISPR-Cas9属于 II型系统。CRISPR-Cas9系统在适应性免疫时遵循着三个步骤:间隔序列的获取,crRNA的形成与干扰(图1)。具体步骤表现为当外源病毒或质粒DNA进入细胞时,细胞通过专门的Cas蛋白将外源DNA序列剪成小片段并整合到连续的DNA片段中,形成一个新的CRISPR间隔序列。然后这个新的间隔序列被转录成CRISPR RNA前体(Pre-crRNA)和反式激活RNA(Trans-activating RNA,tracrRNA),然后在核糖核酸酶 III(Ribonuclease III,RNaseIII)的作用下形成成熟的crRNA。最后crRNA协同tracrRNA通过特异性的方式引导Cas9蛋白去切割入侵的目标DNA以达到免疫干扰的效果。在Cas9蛋白被证实能对特定的DNA进行靶向断裂后,Jinek等的研究指出,可以将CRISPR-Cas9系统中的crRNA和tracrRNA融合在一起,形成一个单一的合成导向RNA,即单导向 RNA(Single-guide RNA,sgRNA),进一步简化了系统,为CRISPR-Cas9技术广泛应用于基因靶向和基因编辑奠定了基础。之后陆续有研究者将这种技术应用于基因编辑技术。总的来说,CRISPR-Cas9技术由于具有实验简单,操作容易,用时短等优势,已经被研究者们广泛应用在植物、小鼠和人类细胞中,并进行了临床试验。
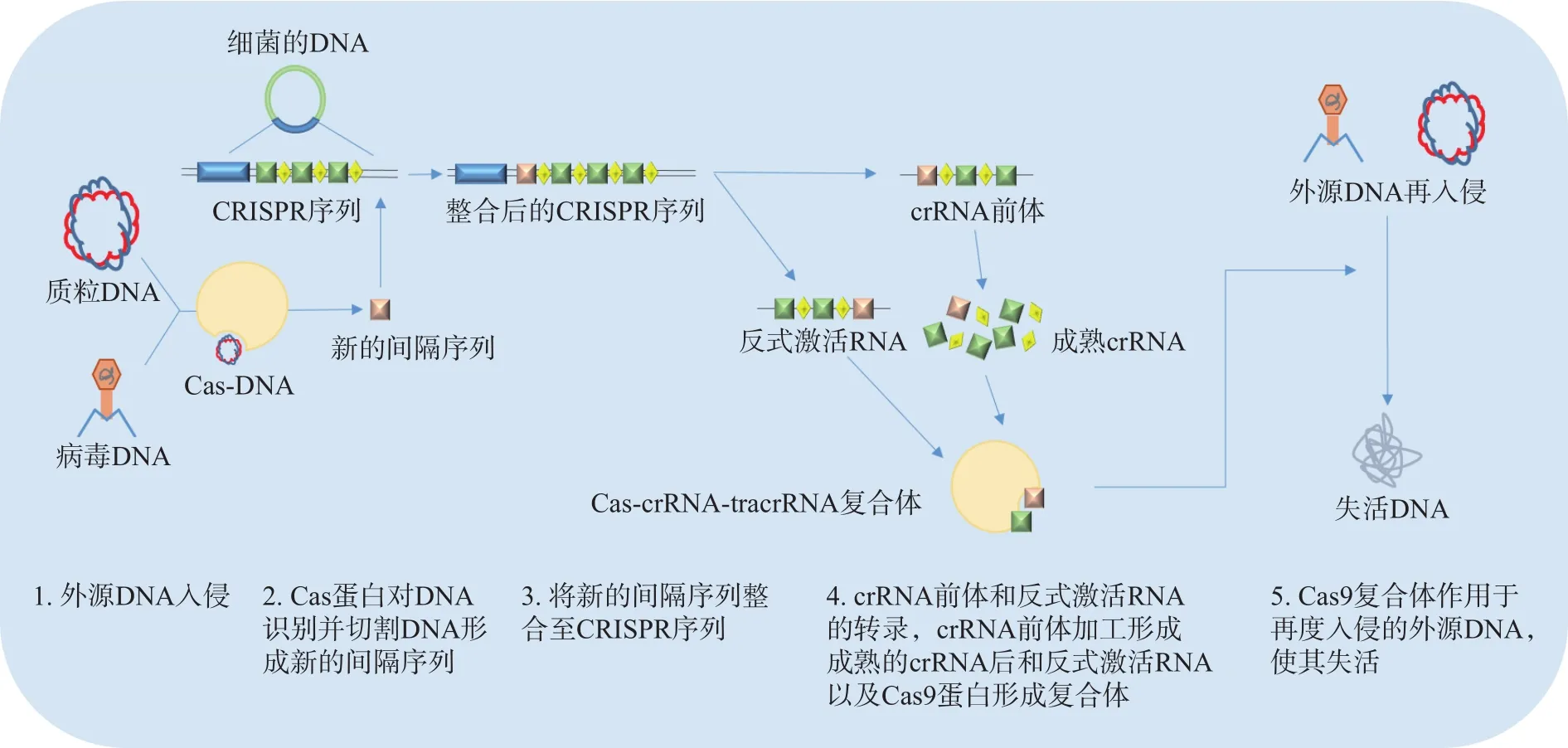
图1 CRISPR-Cas9系统适应性免疫的简化步骤Fig.1 Simplified steps for adaptive immunity of CRISPR-Cas9 system
3 CRISPR-Cas9技术应用于乳酸杆菌基因的编辑
3.1 CRISPR-Cas9技术改造乳酸杆菌
多年来,乳酸杆菌早已被用作为微生物工厂,用于生产各种蛋白质和代谢产物以及生物催化剂。通过CRISPR-Cas9基因编辑技术去打造更优质的菌种,其目的在于改良乳酸杆菌的性状、提升产物的质和量,或者降低乳酸杆菌释放污染物和有害物污染环境的风险。
利用CRISPR-Cas9技术可以把乳酸杆菌打造成具有优良性状的菌株。Goh 等将细胞表面相关的果糖糖苷酶基因敲入无法代谢低聚果糖(Fructooligosaccharide,FOS)的中,重组菌株能在含有FOS的mMRS培养基中生长,这表明了重组菌株拥有了对果糖的代谢能力。CRISPR-Cas9系统还可以被编辑成选择性地靶向乳酸杆菌中的抗生素耐药基因,Hidalgo-Cantabrana等利用CRISPR-Cas9技术敲掉乳酸杆菌的与抗生素耐药性有关的基因,从而减少和转移了乳酸杆菌的抗生素耐药性。
在食品工业中,乳酸杆菌常常被用于生产胞外多糖(Exopolysaccharides,EPS),EPS 由于可赋予发酵乳制品特殊的质构和风味,从而广泛用于食品的增稠、稳定、乳化、胶凝及持水。为了进一步利用乳酸杆菌生产EPS的能力,有必要对其结构与功能基因进行深入了解以达到优化生产的目的。Song等使用CRIPSR-Cas9技术对的EPS生物合成基因进行了敲除,研究结果表明敲除后菌株的EPS产量明显降低。Mayer等鉴定出约翰逊氏乳杆菌()中的一种假定基因细菌烯醇糖基转移酶(FI9785-242,242)对EPS-1的合成很重要,在FI9785基因组中利用CRISPR-Cas9技术敲除基因以构建菌株Δ242,而菌株Δ242细胞沉淀和上清液中均未检测到EPS-1。Dertli等研究报道指出,FI9785 能够产生两种不同的EPS,分别是EPS-1和EPS-2,该研究进一步鉴定出了与EPS合成相关的基因簇,而其中的基因是合成EPS-1和EPS-2的关键基因。这些或许是乳酸杆菌EPS生物合成的机制的一部分,为利用CRISPR-Cas9技术构建菌体外生产合成EPS提供了一个新的思路。Zhou等采用CRISPR-Cas9技术对进行了无缝基因组编辑,设计并构建了可以产生n-乙酰氨基葡萄糖的菌株,在未引入外源标记基因和质粒的情况下,最终菌株的生产n-乙酰氨基葡萄糖的量为797.3 mg/L。Dato等研究表明酿酒酵母()腺苷甲硫氨酸同工酶 2(S-adenosylmethionine2,SAM2)的表达量与L-乳酸的合成量相关,利用CRISPR-Cas9技术除掉菌株的基因后,菌株的乳酸产量比正常菌株平均增加了5.4%,并且敲除掉基因基本不会影响菌株的活力。总的来说,通过对乳酸杆菌生产代谢产物的基因结构运用生物工程的方法进行优化,是一种非常有效且具有前景的策略手段。
除产生有益物质外,乳酸杆菌也会产生一些对人体有害的物质,例如D-乳酸。因为人和动物体内并不存在D-乳酸脱氢酶,因此不能分解代谢D-乳酸,人体摄入过多D-乳酸会导致出现代谢紊乱,甚至中毒的症状。通常来说,乳酸杆菌会同时产生两种乳酸,分别是L-乳酸和D-乳酸,而调控生产这两种乳酸的关键基因是一个D-乳酸脱氢酶基因和 L-乳酸脱氢酶基因。研究表明,通过CRISPR-Cas9技术敲除或替换掉是降低乳酸杆菌生产D-乳酸的一种有效方法。张一凡通过CRISPR-Cas9技术构建了一株被敲除掉基因、过表达L-乳酸脱氢酶的突变菌株,发现突变菌株产生L-乳酸的产量提高了16.3%,光学纯度也由95.2%提升至99.0%,大大提高了高纯度L-乳酸的产量,降低了D-乳酸的生成。上述的研究表明利用CRISPR-Cas9技术可有效降低乳酸杆菌中对人体有害物质的产生。
尽管D-乳酸对人体有害,但不能否认它在生物可降解塑料工业中的价值。随着基因编辑技术的进步,通过基因工程打造合适的乳酸杆菌用于生产D-乳酸在近几年也成为了研究热点之一。Huang等研究表明的同源基因和在过表达的情况下能让菌株生产更多D-乳酸。Assavasirijinda等将的基因通过CRISPR-Cas9技术导入工程化的嗜碱芽孢杆菌()菌株,并通过破坏负责合成胞外多糖的关键基因,以增加产量并简化下游生产过程。Ozaki等通过CRISPR-Cas9基因组编辑技术将中的基因导入至栗酒裂殖酵母(),并通过CRISPR基因敲除破坏了菌株中竞争D-乳酸合成相关的丙酮酸脱氢酶的基因和和编码L-乳酸的基因,显著促进了菌株利用葡萄糖转化生成D-乳酸的效率。
近年来,基于CRISPR-Cas9技术去修饰编辑菌株,改善其性状、将其改造作为“生产工厂”来产生所需物质的报道越来越多。而乳酸杆菌作为一种公认的益生菌,利用CRISPR-Cas9技术对其合理化改造将会是未来的研究的主要的方向。
3.2 CRISPR-Cas9技术应用于乳酸杆菌基因编辑存在的问题
大多数天然的乳酸杆菌都属于“公认安全”标准(Generally recognized as safe,GRAS)的范畴,因此,这类乳酸杆菌在食品工业、医药等方面已经被广泛运用。但目前还没有转基因乳酸杆菌被美国食品药品监督管理局认定为GRAS,主要是因为乳酸杆菌基因组被改造后,其遗传的稳定性、对人体潜在的安全性尚未得知,且现有的基因编辑技术依然存在问题缺陷,如目标损坏、脱靶编辑、低效率等问题,即使是目前最先进的第三代基因编辑技术CRISPR-Cas9也不能保证每次都能完美地打造出产品。
如何提高准确率,避免脱靶是目前基因编辑技术面临的最大挑战。虽然CRISPR-Cas9相较于ZFNs和TALENs技术对靶向基因操作更加简单便捷,CRISPR-Cas9只需要将引导RNA序列与特定的靶区匹配,就可以将Cas酶引导到该位点,引入双链断裂,但同样存在脱靶的风险,影响基因编辑成功率。在利用CRISPR-Cas9打造乳酸杆菌时,可能会发生靶向位点的大量缺失、基因组重排列、切割位点远端病变等脱靶效应,从而使乳酸杆菌产生有害物质或造成乳酸杆菌的死亡,甚至会打造成一种有害的微生物。而当这些有害物质或者重组的有害微生物没有及时处理,被意外或人为地释放到自然界中,有可能会打破生态平衡,最终对人类造成严重的威胁。其中一个影响脱靶的重要原因是CRISPR-Cas9系统依赖于内源性DNA修复因子不能被有效地控制,也不能预测该因子产生的错误。为了解决缺乏稳健的DNA修复机制的问题,Goh等在乳酸杆菌中的非同源性末端接合(Non-homologous end joining,NHEJ)的DNA损伤修复机制中,利用化脓性链球菌()的切口酶变体Cas9在嗜酸乳杆菌()中进行靶向基因删除和插入,从而减少因为双链断裂引起的死亡。尽管现在已有科学家研究开发出缓解脱靶问题的方法,但是造成脱靶有着许多因素的影响,如细胞类型、CRISPRCas9组件的表达水平、传递方法等,一个因素或多个因素共同影响都会导致脱靶。目前,CRISPR-Cas9系统号称能实现多个基因的编辑,但在大规模地打造乳酸杆菌的过程中,其精确性、效率仍然有上升的空间。Leenay等在中使用CRISPRCas9技术进行基因编辑,但多次编辑同一位点并不总是成功的,编辑的结果也会因运用的方法和打造的菌株种类而产生差异。总的来说,有效地解决脱靶问题,同时提高基因编辑的效率和精确性,是研究者们目前亟待解决的问题。
CRISPR-Cas9技术修饰乳酸杆菌仍需要面对许多挑战,且该技术的有些机制人类尚未完全掌握,如潜在靶位点识别机制和原间隔序列邻近基(Protospacer-adjacent motif,PAM)依赖的基础等。尽管目前从科学的角度看,转基因乳酸杆菌有着更加合理、优良的性状,能成为代谢产物的生产工厂,但人们依然对转基因乳酸杆菌闻之色变,认为其已被基因操控,对人体产生的风险是一个未知数。因此,在广泛应用转基因乳酸杆菌之前,政府和科学家们都要进行批判性的风险评估。随着CRISPR-Cas9技术地不断发展,科学家们需要不断地研究克服技术缺陷,这将会打造出更加稳定的转基因乳酸杆菌。
3.3 CRISPR-Cas9技术应用于乳酸杆菌未来展望
3.3.1 改善乳酸杆菌的抗胁迫性 乳酸杆菌被广泛地应用于食品工业的过程中,需要面对在生产、储存和分配过程中所形成的物理、化学多种胁迫,影响乳酸杆菌发挥生理功能。乳酸杆菌作为发酵剂在发酵过程中,其稳定性影响着发酵工艺,而作为益生菌被人体食用后,则需要在对肠道的恶劣条件中存活才能发挥其活性。因此,运用CRISPR-Cas9技术对乳酸杆菌的基因进行改造,使乳酸杆菌具有更强的稳定性,从而适应不同条件的生存环境。
乳酸杆菌在工业发酵时自身会产生有机酸,常常面临酸胁迫,导致乳酸杆菌的细胞活力和发酵产量降低。谷氨酸脱羧酶(The glutamate decarboxylase,GAD)系统是乳酸杆菌最重要的抗酸系统之一。正因为GAD的抗酸能力的存在,乳酸杆菌才能在酸胁迫环境下抑制杂菌生长的同时自身也能够正常发酵生长。Gong等在研究短乳杆菌()的GAD系统时,发现的GAD系统中潜在的转录调节基因所表达的GadR蛋白一旦失活,会极大地降低制药工业中的一种重要化合物—-氨基丁酸(Gamma-aminobutyric acid,GABA)的产生,同时也降低了的耐酸性。该研究表明GadR是调控的耐酸性和GABA合成的正反馈调节剂。可以预想的是,通过CRISPR-Cas9构建高表达GadR的乳酸杆菌是增强菌种抗酸性及工业化规模生产GABA的有效方法。Gong等研究表明中的氮代谢全局性转录调控蛋白基因表达的GlnR蛋白能够影响细菌的抗酸性和GABA的产生。该研究证实了GlnR是一种负调控GAD表达的蛋白,能够降低细菌的抗酸性和GABA的转化合成。因此,通过CRISPR-Cas9技术敲除掉基因也是一种增强菌株抗胁迫能力的有效方法。
温度也是影响乳酸杆菌活性的重要条件之一。在食品工业中,为了保持食品的安全卫生,发酵食品常常需要经过加热、巴氏消毒法进行杀菌,这也导致乳酸杆菌的数量和细胞活力急速下降,因此提高乳酸杆菌的抗热性在食品生产加工中尤为重要。热休克反应(Heat shock response,HSR)是乳酸杆菌面对热压力产生的防御适应反应,诱导热休克蛋白(Heat shock proteins,HSPs)的基因表达,形成如小热休克蛋白、Clp ATP酶等帮助受损细胞蛋白重新折叠的分子蛋白和ClpP、FtsH等来降解不可逆转的受损蛋白质的蛋白酶,从而改善乳酸杆菌对外界热变化的适应性。Chastanet等证实,HSP中的基因和基因受到三级应激基因阻遏物CtsR和HrcA的双重调控作用。当发生热休克反应,HrcA会失活,同时CtsR调控ClpEP复合物进行表达,进而ClpEP复合物把CtsR降解。因CtsR是一种高度保守的转录抑制因子,当CtsR被降解后,其控制Clp ATP酶才能全部表达来提高乳酸杆菌对热的适应性。Desmond等对的操纵子进行PCR扩增诱导表达,当重组菌株受到热应激时,生产过量GroESL蛋白,大大提高耐热性。因此,可以通过CRISPR-Cas9技术修饰HSPs相关基因,增强对HSPs的诱导,从而使乳酸杆菌能在高温下保持活性。
在食品加工中改善乳酸杆菌的抗胁迫性是非常有必要的。在外界的压力下,乳酸杆菌的抗胁迫性越强,就越能在食品加工中保持细胞活性,从而在开发的产品中展现出其独特的生理功能。
3.3.2 利用CRISPR-Cas9技术增强乳酸杆菌的抗菌活性 乳酸杆菌被广泛用于食品和制药工业中,很大原因是乳酸杆菌具有良好的抗菌活性,而乳酸杆菌的抗菌机制很复杂,其中很重要的一个方面则是能产生细菌素。细菌素是核糖体合成的蛋白质或短肽链,具有一定的抗菌活性,可以通过与特定的表面受体相互作用导致细胞的破裂,从而抑制特定的或有着相关结构的菌株的生长,因此可被食品工业用于生物防腐。
目前研究最多且应用最广泛的乳酸链球菌细菌素(Nisin,亦称乳链菌肽)被认为是食品和制药工业中用于防止食物变质和杂菌污染生长的重要化合物。近年来,随着对细菌素研究的深入,通过生物工程的方法对Nisin进行编辑修饰的研究越来越多。Reiners等对乳酸乳球菌()的Nisin的基因序列的N端区域进行定点诱变,诱导表达得到Nisin A和Nisin H。测试两种Nisin的对金黄色葡萄球菌()的最小抑菌浓度,结果显示Nisin A的最小抑菌浓度是6.25 μmol/L,而Nisin H为0.78 μmol/L,显然,经过定点突变的Nisin H比Nisin A抗菌效力更好。同样,O’sullivan等发现由头状葡萄球菌()菌株所产生的乳链菌肽变体Nisin J对多种革兰氏阳性病原体都表现出较强的抗菌活性,使用打孔扩散法测试Nisin A和Nisin J对金黄色葡萄球菌的抗菌能力,Nisin J的抑菌圈面积为153.1 mm,而Nisin A的抑菌圈面积只有109.4 mm。而Nisin J相比于典型的Nisin A在结构上的区别在于其中有9个氨基酸都发生了变化,这导致了Nisin J缺少了乳链菌肽调节基因和乳链菌肽免疫基因,从而形成了一种新型的抗菌细菌素。上述研究是基于通过PCR定点诱变的方法得到乳链菌肽,这也说明了通过生物工程的方法去改造乳酸杆菌进而得到更完善的益生菌是可能的。Oh等利用CRISPRCas9对罗伊氏乳杆菌()的和基因进行定点饱和诱变,对含有NNK基序(N=A/T/G/C和K=G/T)的寡核苷酸进行一次转化,其中一个密码子被修饰为编码所有20个氨基酸,结果发现这一重组体增强的抗菌活性。Van等对构建单链DNA(ssDNA)重组工程,在pdu操纵子上游的启动子区域进行了6个碱基变化,从而使抗微生物化合物罗伊氏菌素的产量增加了3倍,且与野生型菌株相比,对的杀伤效率提高了3倍。随着技术的不断完善,研究者通过CRISPRCas9技术对一些有益的乳酸杆菌的染色体中的密码子进行精确诱变,打造出具有强抗菌性的乳酸杆菌是可以实现的。
乳酸杆菌产生的细菌素在抑菌谱、产量、稳定性等方面还能进一步改进和提升,上述的研究成果为利用CRISPR-Cas9技术去修饰乳酸杆菌的抗菌活性,并将其改造为一种更有价值的益生菌菌株的研究与开发提供了新思路。
3.3.3 改变乳酸杆菌的免疫调节特性 对乳酸杆菌中有助于免疫调节的相关基因进行编辑修饰,是改变乳酸杆菌免疫调节特性的方法之一。一些乳酸杆菌对宿主具有调节、改善或防止免疫有关的疾病的功效,Steidler等构建重组分泌小鼠白细胞介素10(IL-10),当小鼠口服重组菌株可显着减少肠道炎症,这是最先将转基因乳酸菌运用在调节免疫治疗中,为治疗炎症性肠病(Inflammatory bowel disease, IBD)提供新的思路。尽管现在科学家们还缺乏对细菌类的免疫特性整体机制的理解,但有相关研究表明,细菌的外细胞表面蛋白在细菌与宿主之间的相互作用中起了关键的作用。细菌的细胞外壁通常由细胞壁和细胞膜组成,但在许多古细菌和真细菌中发现还有一层表面层(Surface layers)结构,也称为s-层(S-layers),该层是通过一类特殊的蛋白质(称为S层蛋白)之间的相互作用所构建的二维晶格结构所组成。许多研究结果都表明了S层蛋白具有介导免疫调节的功能,为改变乳酸杆菌免疫调节特性提供了潜在的目标。SIGNR3是小鼠8个同源的树突细胞受体(DC-sepecific ICAM-grabbing non-integrin,DC-SIGN)之一,与人DC-SIGN的生物特征高度相似。Lightfoot等研究发现了的S层蛋白可与小鼠的SIGNR3连接,进而表达出调控信号,缓解小鼠的结肠炎症。而Johnson等的研究中也发现了中与S层相关的丝氨酸蛋白酶同源物PrtX(PrtX, lba1578)突变增强了对白细胞介素 6(Interleukin 6,IL-6)、IL-12 和 IL-10的刺激,可能导致改变上皮肠细胞基质的结构和特性。此外,Uroić等发现了在有S层蛋白的情况下会对机体产生特别的保护以及增强了对肠细胞的粘附作用,并且的S层蛋白可以在单核细胞衍生的树突状细胞(Monocyte-deriveddendritic cells,moDC)中诱导肿瘤坏死因子-(Tumor necrosis factor-,TNF-)的生成。除了发酵乳杆菌()和等某些物种不会产生S层结构,许多原核生物中都存在S层结构,且S-层的结构都是保守的,不会轻易地变异。通过运用CRISPR-Cas9基因编辑技术去精确改变某些乳酸杆菌S层蛋白的表达,可以做到稳定长期地增强这类菌株的益生功能。
总的来说,对一些精选出来的益生菌或非益生菌的结构更深入的了解,利用CRISPR-Cas9技术敲入高诱导性启动子来驱动这些基因的过表达,进而调整优化这些结构来达到改变其免疫特性的目的。
4 结语
乳酸杆菌作为一种与人类生活密切联系的微生物,在农业、工业和医药等领域都发挥着重要的作用。而随着人们生活水平的不断提高以及对美好生活的需要,开发一些更符合人民需求且更优良的新型乳酸杆菌变得尤为重要。近年来,通过CRISPR-Cas9基因编辑技术打造改良菌株的技术方法引起了国内外学者的广泛关注,大批研究者通过该技术改造乳酸杆菌,但转基因乳酸杆菌的应用仍处于实验室验证阶段。目前作为新一代的基因编辑技术CRISPR-Cas9仍然存在脱靶的问题,精确性和效率有待提高。因此,科学家们不断地追求着更加精准、高效的CRISPRCas9介导乳酸杆菌的基因编辑方法,并将其运用到不同种类的乳酸杆菌中。为了满足人类的需要,改善乳酸杆菌的特性和功能,通过CRISPR-Cas9技术打造出具有高抗胁迫性、高抗菌活性、不同的免疫活性等特性的乳酸杆菌,将会是未来发展的趋势。可以预见的是,随着CRISPR-Cas9技术进一步地发展以及对一些精选出来的乳酸杆菌的基因结构进行更深入的了解后,将有望打造出更优良且能够被公众所接受的乳酸杆菌菌株。
