纳米硒多糖载体的构建及其抗肿瘤应用的研究进展
2022-10-27刘晓庆魏凌峰贾继来周娇娇程水源
刘晓庆,魏凌峰,贾继来,周娇娇,程水源,蔡 杰,
(1.武汉轻工大学硒科学与工程现代产业学院/国家富硒农产品加工技术研发专业中心,湖北武汉 430023;2.武汉轻工大学食品科学与工程学院,湖北武汉 430023)
硒(Se,Selenium)最早于1817年由瑞典化学家Jons Jacob Berzelius在硫酸厂铅室壁上的红色沉积物中制得,并选用希腊神话中月亮女神之名将其命名为“硒”。之后的几十年里研究者们发现硒是维持机体重要功能所必需的微量元素之一,是体内多种含硒酶的重要组成成分,具有重要的生物活性。同时,硒元素还有“抗癌之王”的称号,对多种癌细胞具有抑制作用。人摄取硒的主要来源是食物,土壤硒含量是决定食物硒含量的一个重要因素,而自然界中的硒以多种价态的化合物形式存在,在碱性土壤中,以硒酸盐为存在形式的六价态硒容易被植物吸收,亚硒酸盐等四价态硒一般需要被氧化为六价态的硒酸盐后才能被吸收利用,而零价态的硒单质由于其水溶性差而难以被利用。无论是哪一种价态的硒源,有效剂量和毒性剂量之间的极窄范围极大限制了它的实际应用。纳米技术的出现改变了硒元素开发的窘境,具有纳米尺寸的单质硒显示出更大的细胞摄取量和活性,为人们开发硒元素提供了新思路。
纳米硒(Selenium nanoparticles,SeNPs)是一种红色单质硒,可利用亚硒酸钠与抗坏血酸通过氧化还原反应制得。纳米硒表面能量高,在没有稳定剂对其进行分散的情况下,裸露的纳米硒不稳定,易聚集,导致其粒径增大至微米级,从而致使其生物利用度下降。当稳定剂存在时,纳米硒的生成会受到稳定剂的调控,其粒径稳定在纳米级别,用于稳定纳米硒的分散剂一般为生物大分子,无机材料作为分散剂也有报道。经分散剂调控后的纳米硒粒径更小且生物活性更高,因此,选用绿色、环境友好型方法制备纳米硒成为目前硒科学研究的重点之一。为了提高纳米硒的生物活性以及生物利用率,学者们先后筛选出了蛋白质、多酚、多肽和多糖等模板稳定来纳米硒。但蛋白质、多酚、多肽等物质具有易降解、易聚集及热不稳定等特性,限制了其在纳米硒制备中的应用。相比于其他物质,多糖类物质在纳米硒的制备中较为稳定,且结构上有很多活性羟基,生物相容性高,可降解,因此多糖更适于作为纳米硒的稳定剂。同时,多糖类物质还具有抗炎、抗病毒以及抗癌等功效,有文献报道了多糖和纳米硒之间具有强大的协同效应,基于此,多糖类物质一直以来是首选的模板物质,有着其他分散剂不可比拟的优势。此外,针对肿瘤细胞新陈代谢旺盛、生长速度快、葡萄糖特异性受体高表达等特点,以多糖作为配体修饰的纳米粒子具有肿瘤细胞主动靶向性作用,这也为纳米硒主动靶向癌细胞提供了一种可行的途径,进一步拓宽了纳米硒在抑制肿瘤方面的应用。
本文阐述了近几年来多糖载体构建纳米硒的相关研究内容,从多糖与纳米硒的结合作用、多糖种类对纳米硒体系特性的影响以及不同反应条件对多糖-纳米硒结合的影响等三个角度论述了多糖-纳米硒的构建机理,总结了纳米硒以及多糖-纳米硒的抗肿瘤机制,并对其后期抗肿瘤的相关应用做出展望,旨在为后续研究提供理论基础。
1 多糖载体构建纳米硒的研究
纳米硒可以通过物理、化学以及生物方法合成。其中,化学还原法是制备纳米硒最常见的方法。应用纳米技术制备的纳米硒体系大部分为分散于水或高分子物质的红色透明胶体溶液,主要以“元素硒-分散剂”形成表面覆盖(分散剂覆盖在纳米硒表面)或相互嵌套的形式存在。利用化学法制备纳米硒时,常常采用硒酸盐、亚硒酸盐、二氧化硒等含硒的氧酸盐或者氧化物作为硒源,并引入稳定剂或分散剂控制粒径,还原剂则主要是抗坏血酸、谷胱甘肽、亚硫酸钠、硫代硫酸钠等具有还原性的物质。下面笔者将从多糖类物质稳定纳米硒的机理、不同合成条件对多糖-纳米硒体系的影响等方面介绍多糖载体构建纳米硒的机制。
1.1 多糖与纳米硒结合机理
天然多糖以及改性多糖含有-OH、-COOH、-NH、-C=O等官能团,这些官能团能与纳米硒结合,沿聚合物链形成分子间和分子内氢键,从而增强纳米硒的稳定性(图1)。Xiao 等研究发现冬虫夏草胞外多糖的-OH基团与纳米硒之间形成了新的C-OSe键,使纳米硒具有良好的分散性和稳定性。穆静静等研究发现不同品种的茶叶中提取的粗多糖都能起到稳定纳米硒的作用,主要通过-OH、C=O、NH等基团与纳米硒结合。此外,对于壳寡糖-纳米硒体系,SeO可以通过静电相互作用与壳寡糖分子中的-NH结合,由于空间位阻或引力作用使纳米硒粒子稳定分散在溶液中。有学者研究发现,多糖与纳米硒之间还可以通过其他方式连接。Cai等比较了犀牛木素多糖-纳米硒(LRP-SeNPs)和纯犀牛木素多糖(LRP)的FT-IR红外光谱图之间的相似性以及硒的形态和分布,发现相对于纯LRP,C-O-H带对应的峰强度略有变化,但并未明显向更高或更低的波数移动。这一结果表明,LRP-SeNPs中硒和-OH之间的相互作用较弱,多糖分子可能通过简单的物理吸附与纳米硒结合,进一步扩大了多糖类模板稳定纳米硒的应用。基于多糖与纳米硒之间多样化的连接方式,多糖类物质是一种优良的模板。
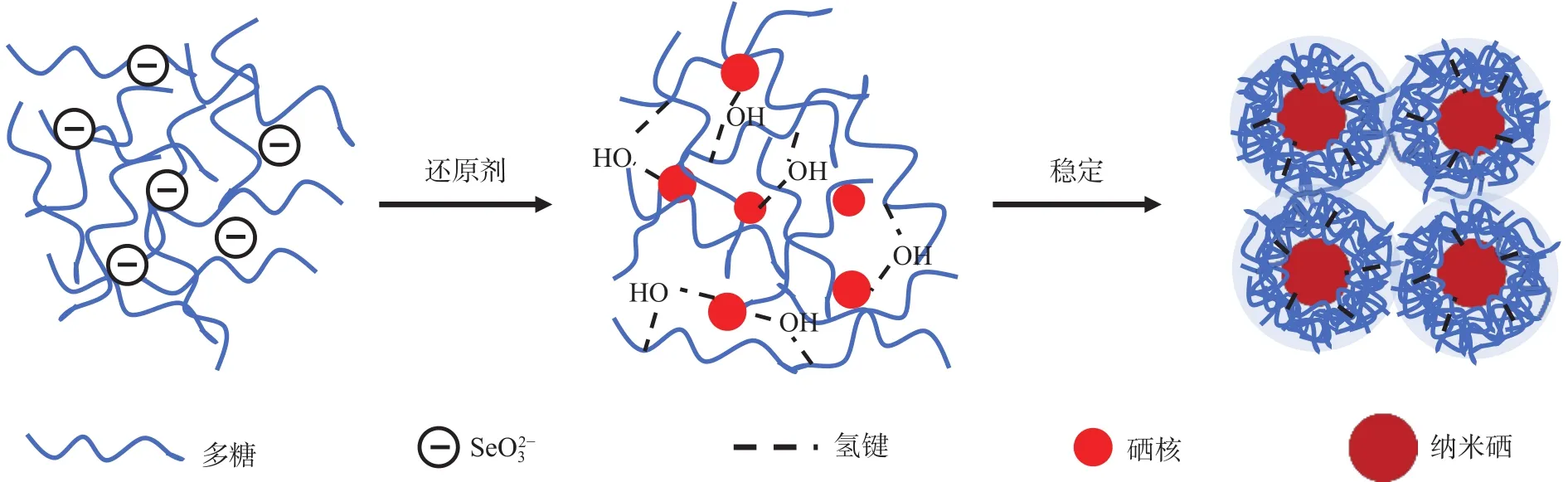
图1 多糖-纳米硒的形成、分散和稳定示意图[22]Fig.1 Schematic diagram of formation, dispersion and stabilization of polysaccharide-nano-selenium[22]
1.2 不同多糖对多糖共轭纳米硒体系性质的影响
多糖的结构和性质是影响多糖共轭纳米硒体系的关键因素,同时也决定了纳米硒的理化性质。王红艳以葡聚糖、壳寡糖、壳聚糖、阿拉伯胶、羧甲基纤维素钠等多糖分子作为软模板,在不同合成条件下制备了形态多样的纳米硒,结果表明不同结构的多糖分子均可稳定分散纳米硒,且在多糖分子模板的引导作用下可以制备不同形貌的纳米硒。阿拉伯胶分子结构为支链型,制备的纳米硒形貌为球形;羧甲基纤维素钠分子结构为线型,引导硒纳米粒子在一定方向上生长;葡聚糖属于非离子型多羟基大分子,通过氢键与硒纳米粒子结合,最终获得蝌蚪形态的纳米硒粒子;壳寡糖和壳聚糖结构分子中的羟基和氨基都可与Se结合,能够引导纳米硒粒子沿着聚合物链生长,最终得到棒状的纳米硒复合物。Bai等研究了不同糖类(葡萄糖、蔗糖、壳聚糖)对纳米硒的修饰作用,研究发现在没有模板的纳米硒溶液中,硒纳米颗粒的形态为椭圆形和球形,尺寸在100~500 nm;在硒-葡萄糖溶胶中,纳米硒的形态为椭圆形和球形,尺寸在50~350 nm;在硒-1%蔗糖溶胶中,硒纳米颗粒的形态为树枝状和球形,其尺寸分别在20~100 nm和10~20 nm;在硒-1%壳聚糖溶胶中,纳米硒颗粒的形貌为椭圆形和棒状,尺寸在10~20 nm范围内。证明了不同糖类的分子结构对纳米硒的组装具有调节和修饰作用,且随着糖类分子量的增加,纳米硒-多糖溶液的氢键作用也随之增强,从而增强了对纳米硒颗粒形貌的调节作用。
1.3 反应条件对多糖共轭纳米硒体系的性质的影响
纳米硒的合成条件会影响其形貌和尺寸。多糖类模板被确定后,硒源和模板的比例、还原剂和硒源的比例、反应时间、反应温度、是否超声辅助制备都能影响纳米硒的形貌和粒径。表1总结了不同种类多糖和不同反应条件对多糖-纳米硒的形貌和粒径的影响。

表1 不同反应条件下的多糖-纳米硒体系Table 1 Polysaccharide-nano-selenium system under different reaction conditions
Qiu 等以果胶(Pectin,PEC)为稳定剂和分散剂制备纳米硒体系,探讨了硒源和模板的不同比例对纳米硒制备的影响,研究发现较小尺寸和较高硒含量的PEC-SeNPs具有较高的抗氧化活性。当Se/PEC比率从1:40增加到1:2时,PEC-SeNPs的粒径从358.3 nm逐渐减小到242.5 nm;当Se/PEC比率从1:2变为 4:3时,PEC-SeNPs的粒径从 242.5 nm逐渐增大到330.3 nm。Cai等研究了四种不同质量比(Se/LRP=1/20、1/15、1/10和 1/5)对犀牛多糖-纳米硒(LRP-SeNPs)粒径的影响,研究发现当Se/LRP比值从0增加到1/10时,LRP-SeNPs粒径逐渐减小(从 670±20 nm 到 345±10 nm),当 Se/LRP比进一步增加到1/5,粒径反而增大(从345±10 nm到430±40 nm)。这是因为多糖浓度过低时,体系中没有足够的模板分散纳米硒,被还原的纳米硒会团聚形成沉淀;随着多糖比例的逐渐增加,多糖上的羟基可以与纳米硒结合,从而阻碍纳米硒粒子的生长和聚集,达到分散和控制其粒径的效果;但是当多糖浓度进一步增大时,多糖分子之间会相互聚集,活性羟基数量减少,多糖对纳米硒的吸附作用减弱,复合物粒径增大且达不到分散效果。
在以抗坏血酸作为还原剂的体系中大多数抗坏血酸和硒源的摩尔比在1:1~5:1范围内,理论上抗坏血酸和HSeO(硒源)以2:1的计量关系发生氧化还原反应,过量的抗坏血酸能提供还原性的介质,稳定纳米硒。郑晓凤等以桔梗多糖为模板制备了纳米硒,结果表明,在一定范围内,随着抗坏血酸和NaSeO比值的增加,纳米硒的稳定性逐渐提高,当两者的比值为2:1时,紫外吸光度比值达到最大并趋于稳定,说明该比值下桔梗多糖-纳米硒复合物的粒径较小且分散性较好。
反应时间和温度也会影响纳米硒的粒径大小。王红艳研究发现在一定范围内,随着反应时间的增加,吸光度增大。在4 h之后,吸光度最大且趋于平稳,说明此时形成的纳米硒溶液均匀且稳定。陈琬雯利用壳聚糖作为稳定剂合成纳米硒,发现当反应温度由 90 ℃增加到 120 ℃时,粒径由 118 nm增加至170 nm,反应温度升高至150 ℃时,合成的纳米硒粒径峰增加到219 nm。说明纳米硒的平均粒径与反应温度可能存在正相关性,但其抗氧化活性随着粒径的增大而降低。通常,多糖-纳米硒的合成在相对较低的温度(25 ℃或37 ℃)下进行。此外,超声处理可减小多糖的尺寸并增加比表面积,提供足够的活性位点,从而提高纳米硒稳定性和生物活性。可根据不同的需求选择合适的多糖以及合成条件构建兼有纳米硒和多糖的生理功效的复合物,在防病治病和营养保健等方面将有广阔的应用前景。在特殊实验条件下可以制备球形、螺旋管状、棒状、网状等不同形貌的纳米硒,可作为特殊材料在半导体、光电材料等领域发挥重要的应用价值。
2 多糖载体构建纳米硒在抗肿瘤中的研究
癌症是除心脏病及感染性疾病以外死亡率最高的疾病,每年因癌症死亡的人数占所有疾病致死人数的四分之一,对公众健康构成巨大威胁。化疗是癌症的主要治疗方法之一,虽然有效,但它受到抗肿瘤药物的副作用和癌细胞产生的耐药性限制。为了进一步治疗癌症,仍然需要新型高效低毒药物。迄今为止,已有大量关于硒化物抗肿瘤的报道,硒补充剂被认为是潜在的癌症预防剂。纳米硒具有比其他硒化合物更高的抗癌功效。笔者根据现有文献,对纳米硒抗肿瘤机制以及应用现状进行了总结,希望能对后续研究方向提供新思路。
2.1 多糖载体构建纳米硒抗肿瘤机理
多糖和纳米硒组合展现出很高的抗肿瘤活性,硒元素通常在抗肿瘤中发挥主要作用。纳米硒的抗癌机制主要包括诱导细胞凋亡和细胞周期停滞,增强免疫力等以显示其抗肿瘤活性。现有研究表明纳米硒的抗肿瘤作用主要通过提高癌细胞胞内活性氧(Reactive oxygen species,ROS)水平,导致线粒体膜电位下降,进而使线粒体损伤诱导癌细胞凋亡。多糖-纳米硒结合物通过癌细胞的内吞作用进入胞内,然后触发凋亡信号通路诱导细胞凋亡,图2为多糖修饰的纳米硒诱导肿瘤细胞凋亡的可能机制。杨聪聪通过流式细胞术、免疫荧光实验与Western blot实验表明黄芪多糖-纳米硒(AP-SeNPs)可以通过激活线粒体介导的内源性通路诱导乳腺癌细胞凋亡,同时还可以诱导细胞的不完全自噬,增强APSeNPs对乳腺癌细胞的抑制作用。竹荪多糖-纳米硒复合物(DP1-SeNPs)能够很好的抑制人体多种肿瘤细胞的增殖,其抗增殖活性与细胞核浓缩、染色体团聚、DNA断裂和S期细胞阻滞等典型的细胞凋亡现象有关。DP1-SeNPs诱导肿瘤细胞凋亡的机制是促进死亡结构域蛋白的表达,激活Caspase-3、-8和-9,促进ROS过度产生,导致线粒体功能障碍。此工作的结论与本课题组前期对多糖-纳米硒抗肿瘤机理相关研究一致,葡聚糖-纳米硒(Glucan-SeNPs)和葡聚糖-迷迭香酸-葡聚糖(Glucan-RA-SeNPs)均通过激活Caspase-3和Caspase-9诱导HepG2细胞凋亡,且Glucan-RA-SeNPs有着更强的诱导能力,这项工作为改善基于多糖载体稳定纳米硒的结构提出了可行的策略。除了直接诱导肿瘤细胞凋亡外,硒和多糖的组合可以增强免疫力以显示抗肿瘤活性。Mao等发现灰树花多糖和纳米硒的结合物(Se-GP11)在体外对HepG-2细胞无毒性作用,但在体内可显著抑制HepG2肿瘤的生长。它增加了相对胸腺和脾脏指数、血清肿瘤坏死因子和白细胞介素2水平。此外,与对照组相比,Se-GP11促进了RAW264.7的吞噬作用和一氧化氮的产生。结果表明,Se-GP11可能通过提高荷瘤小鼠的免疫功能而显示其抗肿瘤活性。这些结果表明,多糖-纳米硒可能是作为人类癌症化学预防剂的候选物,使用多糖作为表面装饰剂的策略可能是提高纳米材料细胞吸收和抗癌功效的高效方法。

图2 多糖修饰的纳米硒诱导肿瘤细胞凋亡的信号通路Fig.2 Signal pathway of polysaccharide-modified nano-selenium inducing tumor cell apoptosis
2.2 多糖载体构建纳米硒在抗肿瘤中的应用
基于多糖的硒纳米粒子由于其优异的理化性能和生物活性,在食品、医药、和农业等众多领域得到了广泛的应用。多糖-纳米硒在医药方面的应用主要体现在靶向给药和协同抗肿瘤药物的抑制肿瘤细胞方面。
2.2.1 多糖-纳米硒复合物靶向抗肿瘤 近年来,一些活性多糖被用来制作癌症辅助治疗剂,以期改善治疗效果。纳米材料具有尺寸效应和表面效应并且对癌细胞和正常细胞具有较强的选择性,这种高选择性主要通过实体瘤的高通透和滞留效应(Enhanced permeability and retention effect,EPR)来实现的。Ping等利用具有高抗肿瘤活性的高度支化的-(1→3)-D-葡聚糖(AF1)为模板,通过 Se-O 键将平均粒径为46 nm的球形硒纳米粒子包埋在AF1中空纳米纤维的空腔中,形成了高度稳定和分散性良好的硒纳米粒子。体外和体内试验结果表明,AF1-Se纳米复合材料显著增强了癌细胞对硒纳米粒子的摄取,增强了纳米硒对癌细胞的杀伤能力,且对正常细胞的损伤较小。随着Se含量的增加,AF1-Se对MCF-7细胞的抑制率从25%增加到75%,远高于单独使用AF1处理时的抑制率。Jiang等采用龙须菜多糖修饰纳米硒(GLP-SeNPs),发现其在正常细胞和癌细胞之间表现出高度的选择性。GLP对胶质母细胞瘤的细胞毒性显著增强。因为GLP可以识别并结合U87细胞膜中过度表达的整合素受体,GLP-SeNPs对U87细胞的生物选择性高于C6细胞。内化GLPSeNPs通过激活p53和MAPK的细胞信号通路,触发细胞内ROS下调,从而加速细胞凋亡。由GLP修饰的SeNPS的肿瘤靶向性设计可能为有效的抗母细胞瘤药物递送提供可行的解决方案。
然而上述靶向多为被动靶向,在靶向肿瘤细胞的同时还可能有少部分进入到正常组织,从而对正常组织造成一定的损伤。因此为进一步提高纳米硒的靶向性,通过高分子聚合物以及生物大分子等对纳米材料表面修饰。基于配体受体识别系统,通过表面修饰配体、多糖等聚合物等提高纳米硒的靶向性,使其以主动靶向的方式进入癌细胞,纳米硒对癌细胞具有较高的选择性,可以优先在癌细胞中聚集并发挥抗肿瘤作用,进而增强纳米硒的抗癌效果。如透明质酸(Hyaluronic acid,HA)受体 CD44大量存在于各种癌细胞中,如HepG2细胞、HeLa细胞、A549细胞等。为了提高纳米硒对肿瘤细胞的靶向性,Yu等将HA修饰到纳米硒颗粒(SeNPs)上,随后负载阿霉素(Doxorubicin,DOX),利用HA和CD44之间的特异性识别作用制备了具有肿瘤靶向功能的硒纳米颗粒(HA-Se@DOX)。研究发现HA-Se@DOX在使用剂量下不会对主要器官造成损害,且HA-Se@DOX在体外和体内抗肿瘤活性强于游离DOX和Se@DOX,说明该策略显著增强了纳米硒对癌细胞中的靶向性,为癌症治疗提供了一种新的治疗策略。
2.2.2 多糖纳米硒载体负载抗肿瘤药物协同抗肿瘤多糖-纳米硒不但能够单独发挥抗肿瘤作用,还可以作为载体,与抗肿瘤药物发挥协同抗肿瘤作用。这些材料的纳米尺寸可以被各种类型的细胞有效吸收,并在靶点处累积药物,减弱单独使用抗肿瘤药物时的毒副作用。例如,顺铂治疗的临床疗效在很大程度上受到顺铂耐药性的限制,而顺铂耐药性与缺氧诱导因子1的激活有关,但纳米硒可以减弱由顺铂诱导的ROS应激反应,并在顺铂发挥治疗作用的同时阻止缺氧诱导因子1的激活,以此来降低顺铂耐药中的副作用,并发挥协同抗肿瘤作用。Zhang等利用分子间的静电相互作用,制备了负载着顺铂药物的壳聚糖-纳米硒复合物,经表征后发现壳聚糖-纳米硒复合物是壳核结构,壳聚糖作为外壳包覆着顺铂-纳米硒。此外,他们还发现壳聚糖-纳米硒对顺铂的抗肿瘤作用具有协同作用,能增强顺铂药物的药效并降低其副作用。Yu等的研究也发现了相类似的结论,他们利用半乳糖(Galactose,GA)和去唾液酸糖蛋白受体(ASGR)之间的特异性识别作用,用半乳糖作为肿瘤靶向部分对纳米硒进行修饰以制备半乳糖-纳米硒载体(GA-SeNPs),然后将阿霉素(Doxorubicin,DOX)负载到GA-SeNPs表面以提高阿霉素对肿瘤细胞的抑制作用。与游离DOX和Se@DOX相比,GA-Se@DOX在抑制HepG2细胞增殖和诱导HepG2细胞凋亡方面表现更优异。Wu等制备了果胶稳定的硒纳米粒子并负载黄素(果胶-纳米硒-姜黄素),与游离姜黄素和果胶-纳米硒相比,果胶-纳米硒-姜黄素表现出更好的水溶性、分散性和储存稳定性,而且还展现出更高的自由基清除能力和抗氧化能力;体外抗肿瘤活性试验表明,果胶-纳米硒-姜黄素复合物能抑制HepG2细胞的生长,且抑制效果在一定范围内随着果胶-纳米硒-姜黄素复合物的浓度提升而升高,呈现出浓度依赖性。由此来看,多糖-纳米硒载体是一种优良的活性物质负载平台,无论是作为药物载体还是具抗肿瘤作用的活性物质,均能提高它们的水溶性、稳定性和生物活性,为肿瘤治疗提供了一种新方案,相关研究成果为癌症群体带来了新希望,对人类抗肿瘤事业的发展具有积极意义。
3 总结与展望
综上所述,纳米硒作为一种高效低毒的制剂,在抗癌方面展现出了良好的应用前景。相比于其他模板,多糖类物质以其稳定、生物相容性高等特点显示出巨大的潜力。笔者所在课题组就基于多糖微/纳载体合成了多种类型的纳米硒,其在体外抗氧化以及抗肿瘤方面显现出较高的活性。近期许多学者提出了抗肿瘤的新靶点:多糖靶点,并进行了相关实验,研究结果表明,多糖物质有望成为肿瘤细胞靶向的潜在物质。因此,以多糖为模板制备纳米硒,可以提高纳米硒对肿瘤细胞的识别能力,同时还可以保留多糖类物质所具有的特殊功效。此外,多糖-纳米硒既可以作为单独的抗肿瘤药物,还可以作为抗肿瘤药物的载体与抗肿瘤药物联用,发挥协同抗肿瘤作用。选择合适的多糖以及合成条件可以构建理想的纳米颗粒,这拓宽了其作为纳米营养素或药物载体在食品、医疗和制药领域的应用。但目前,对多糖-纳米硒复合物的研究仅仅停留在体系的构建以及生物活性的研究上,对其生物学效应的产生机制和硒化学形式尚未完全了解,相信随着科学技术的不断发展和研究工作的不断深入,多糖-纳米硒材料在抗癌、药物载体等领域将取得越来越广阔的应用。
