鼠李糖乳杆菌MP108缓解细菌性腹泻的作用研究
2022-10-27赵玥明侯艳梅赵怡晴
赵玥明,侯艳梅,赵怡晴
(1.东北农业大学食品科学系乳品科学教育部重点实验室,黑龙江哈尔滨 150030;2.海普诺凯营养品有限公司,湖南长沙 410011;3.湖南省食品科学与生物技术重点实验室,湖南长沙 410125)
肠毒性大肠杆菌(Enterotoxic,ETEC)是发展中国家儿童腹泻和旅行者腹泻的主要原因之一。ETEC产生不耐热肠毒素和耐热肠毒素,改变肠道紧密连接的完整性,引发炎症、肠道功能障碍,同时破坏细胞外离子通道、溶质通道和水通道,最终导致腹泻。通常预防ETEC引起的腹泻的药物是抗生素,但这些药物存在副作用,包括胃肠道不适、中枢神经系统反应异常、头痛、头晕等症状,长期使用不利于人体健康。近年来,包括有益的微生物代谢物、短链脂肪酸和益生菌在内调节肠道菌群的功能性食品引起了人们极大的研究兴趣。肠道微生物群对维持宿主健康很重要,与腹泻的发病机制具有密切的联系。
乳杆菌是人体肠道菌群中重要的益生菌之一,可以促进短链脂肪酸产生菌的增殖,增加短链脂肪酸(Short-chain fatty acid,SCFA)的含量,从而有助于抑制有害细菌。一项随机双盲安慰剂对照试验结果表明,对 55名成年慢性腹泻患者进行4周益生菌干预,发现植物乳杆菌CCFM1143可显著改善排便频率及粪便性状,另外,CCFM1143可抑制白细胞介素6(Interleukin-6,IL-6)升高和胃动素下降,增加粪便中乙酸和丙酸含量,调节肠道菌群组成,表现为益生菌组患者的粪便菌群中,拟杆菌属及埃格特菌属等有害菌的丰度降低,阿克曼菌属、及等有益菌属的丰度增加。同样,植物乳杆菌ZLP001也能够降低ETEC致腹泻小鼠血清中的 IL-6、肿瘤坏死因子(Tumor necrosis factor-,TNF-)、白细胞介素 8(Interleukin-8,IL-8)的表达和分泌,同时增加了SCFA的水平。国内一项小鼠研究发现给怀孕的小鼠或新生小鼠定植鼠李糖乳杆菌GG(LGG)可缓解子代的炎症反应,保护肠道,当LGG活菌组的小鼠8月龄时,与长寿相关的细菌以及产SCFA的细菌丰度增加,盲肠中SCFA水平增加,抗氧化能力增强和DNA损伤减轻,进一步研究发现LGG的早期定植激活了SIRT1/AMPK/PGc-1通路,从而减轻肠道炎症反应,而肠上皮细胞SIRT1沉默后,LGG的保护作用减弱。此外另一项关于鼠李糖杆菌GG株的研究证实,其可通过抑制病原体附着到细胞上来保护人结直肠腺癌Caco-2细胞免受ETECK88诱导的炎症相关反应。这些研究表明乳杆菌具有通过调节肠道菌群及免疫应答缓解腹泻症状的作用,然而不同菌株的缓解作用机制存在差异。本研究在细菌性腹泻的临床症状和炎症应答变化的基础上,进一步分析与细菌性腹泻的发病机制密切相关的肠道菌群的变化,旨在扩充鼠李糖益生菌预防大肠杆菌诱导的细菌性腹泻可能的作用机制,同时也为鼠李糖乳杆菌防治大肠杆菌腹泻提供理论支持。
1 材料与方法
1.1 材料与仪器
24只雄性 SPF级BALB/c小鼠(6周龄,体重18~20 g) 购于北京维通利华实验动物技术有限公司(动物合格证编号:320727210100177965);鼠李糖乳杆菌 MP108(MP108)购自爱益森生物科技有限公司;肠毒性大肠杆菌ETEC O78:K80(,ETEC) 购自中国工业菌种采集中心(北京);血清TNF-、IL-6、IL-10、干扰素(Interferon,IFN-)、水通道蛋白 3(Aquaporin 3,AQP3)、铁蛋白(Serum ferritin,ST)、Toll样受体 4(Toll-like receptor 4,TLR4)和免疫球蛋白A(Immunoglobulin A,IgA)酶联免疫试剂盒南京森贝伽生物科技有限公司;粪便DNA快速提取试剂盒 美国MP biomedicals有限公司;胶回收试剂盒 倍沃医学科技有限公司;胰蛋白胨、酵母提取物、D-无水葡萄糖、无水乙酸钠、牛肉浸膏、七水合硫酸镁、一水合硫酸锰、半胱氨酸盐酸盐、蔗糖、甘油、乙醇、胰蛋白酶1:250(酶活力≥50000 U/g)等试剂 国药集团化学试剂有限公司; Luria-Bertani(LB)培养基 青岛海博公司;胃蛋白酶(猪源)1:3000 上海麦克林生化科技有限公司;苏木精-伊红(Hematoxylin and eosin,H&E)染色液 南昌雨露实验器材有限公司。
ZHJH-C1115B型超净工作台 上海智诚分析仪器制造有限公司;SX-300高温高压灭菌锅 SANYO公司(日本);5424R高速冷冻离心机 Eppen-dorf 公司;Multiskan go 1510酶标仪 Thermo(美国)公司;Pannormic MIDI数字切片扫描仪 匈牙利3D Histech;HWS-150型恒温恒湿培养箱 上海森信实验仪器有限公司;llumina miseq pe300高通量测序仪Illumina公司。
1.2 实验方法
1.2.1 菌体培养及制备 将鼠李糖乳杆菌MP108接种至5 mL液体MRS培养基中,在正常空气条件下于37 ℃恒温培养箱中培养到平台初期,获得第一代活化菌液,重复操作,获得第三代活化菌液。按Yang等的方法使用LB培养基培养毒性大肠杆菌ETEC O78:K80,即将挑取单菌落,转入到LB液体培养基中,在180 r/min和37 ℃条件下摇动培养18 h左右,随后在4 ℃下4000×g离心10 min,最后用无菌磷酸缓冲盐溶液对细菌沉淀清洗,重悬于生理盐水以用于动物实验。
1.2.2 MP108菌株耐酸、耐胆盐能力测定 按靳志强等的方法提前配制好模拟肠液和胃液。简单来说,将胰蛋白酶加入pH=8.0灭菌生理盐水中,配制成浓度为1 g/L并加入一定量胆盐,过膜处理得到模拟肠液。而模拟胃液则是将胃蛋白酶溶于pH=3.0的灭菌生理盐水中,调节浓度为3 g/L并过膜处理。将培养基中发酵好的鼠李糖乳杆菌MP108菌液以5000×g离心5 min收集1 mL菌体于两个1.5 mL离心管内,弃上清,用生理盐水洗两遍菌体。其中一个离心管菌体分别重悬于模拟肠液和胃液中,使用分光光度计测得肠液和胃液OD值为1.250(此时菌浓度为1×10CFU/mL),通过平板计数和稀释度换算进而得到加入模拟肠液和胃液中的菌量。另一个离心管加入等体积的生理盐水作为对照,37 ℃培养4 h后进行平板活菌计数,每个稀释度做两个平行。
1.2.3 动物实验及分组 24只雄性SPF级BALB/c小鼠(6周龄,体重18~20 g)饲养于实验动物中心屏障环境内,动物实验设计及实验方法经伦理委员会批准许可(JN.No20210315b0400501[018])。适应性喂养一周后,小鼠随机分成空白对照组、模型组、MP108产品组,高剂量MP108产品组(n=6/组),详细分组及处理见表1,益生菌溶液由鼠李糖乳杆菌MP108冻干粉溶于无菌生理盐水配制而成,MP108产品组灌胃剂量为36.9 mg/只/d,而MP108高剂量组的灌胃剂量为184.5 mg/只/d。第三周时,在饮用水中加入链霉素(5 g/L)处理3 d,将小鼠肠道菌群扰乱。然后用无菌水代替含有链霉素的水,造模前18 h前停止进食。从本周第4 d开始,空白对照组每天灌胃3次生理盐水,模型组先灌胃1次生理盐水,然后每天灌胃2次浓度为1.2×10CFU/mL的ETEC O78:K80悬液,每只小鼠灌胃0.2 mL,连续灌胃4 d,每次间隔2 h,灌胃ETEC后更换鼠笼,不添加垫料,而是在鼠笼中铺滤纸,每隔2 h观察小鼠的腹泻情况和死亡率,持续4 d;其余各组则分别先灌胃相应产品的溶液,然后每天再灌胃2次浓度为1.2×10CFU/mL的ETEC O78:K80悬液,每只小鼠每次灌胃0.2 mL,其余处理同模型组小鼠。

表1 实验分组及处理Table 1 Experimental groups and treatments
1.2.4 实验指标测定
1.2.4.1 小鼠粪便含水量测定 小鼠处死前一天,收集小鼠粪便,按Lee等的方法测量粪便含水量,测得冻干前后重量后进行计算。计算公式如下:(粪便冻干前湿重-粪便冻干后干重)/粪便冻干前湿重。
1.2.4.2 血清腹泻相关蛋白及炎症因子水平测定在最后一次灌胃的24 h后,从眶静脉丛血样采集,血液静置,4000×g离心10 min,离心后取血清,置于-80 ℃冰箱保存,采用酶联免疫吸附测定方法检测小鼠血清中 AQP3、ST、TLR4、IgA、TNF-、IL-6、IL-10和IFN-的含量。
1.2.4.3 小鼠空肠病理症状变化 取部分空肠固定在4%的多聚甲醛溶液中,石蜡包埋,然后利用石蜡切片机获得5 mm厚的切片,之后进行苏木精伊红(H&E)染色。封片晾干之后,使用病理切片扫描仪,观察染色切片,随机采集图像。
1.2.4.4 小鼠肠道菌群的变化 按照试剂盒说明采用FastDNA粪便提取试剂盒提取小鼠粪便的总DNA,以V3-V4区域进行聚合酶链式反应扩增,切胶后采用BIOMIGA纯化试剂盒进行纯化。DNA浓度测定后,以等摩尔浓度混合文库,利用Illumina MiSeq高通量测序平台进行16S rRNA测序。下机数据经过质控,基于QIIME2.0流程分析肠道菌群的变化。通过非度量多维尺度分析(Nonmetric multidimensional scaling,NMDS)的方法分析菌群的多样性分析,利用线性判别分析(Linear discriminant analysis,LEfSe)方法分析组间差异菌群。
1.3 数据处理
本文中,所有的实验数据均用平均值±标准误差(mean±SEM)表示,数据统计学分析采用单因素ANOVA检验对各组平均值的差异进行分析。
2 结果与分析
2.1 鼠李糖乳杆菌MP108的耐酸、耐胆盐能力
利用耐酸耐胆盐实验测试鼠李糖乳杆菌MP108在胃液和肠液中的耐受能力。与对照组相比,经模拟肠液处理后,鼠李糖乳杆菌MP108活菌数下降(<0.001),而胃液干预后鼠李糖乳杆菌MP108与对照组相比则无显著性差异(图1)。综合分析表明鼠李糖乳杆菌MP108对酸和胆盐具有较好的耐受能力,处理后的活菌数均大于1×10CFU/mL,说明该菌株在体内有潜力发挥其益生作用。

图1 鼠李糖乳杆菌MP108菌株的耐酸耐胆盐能力Fig.1 Acid and bile salt tolerance of Lacticaseibacillus rhamnosus MP108
2.2 鼠李糖乳杆菌MP108产品对粪便含水量和空肠组织形态的影响
细菌性腹泻会导致小鼠粪便不成形,因此通过小鼠的粪便含水量可衡量腹泻症状的变化。与空白组相比,模型组小鼠因腹泻导致粪便含水量过多,说明腹泻模型造模成功。与模型组相比较,MP108产品组及高剂量MP108产品组的粪便含水量显著性降低(<0.05),其中高剂量MP108产品组下降最为显著(<0.001),同时该组粪便含水量与空白组相当(图2a)。

图2 鼠李糖乳杆菌MP108产品对小鼠粪便含水量和空肠组织形态的影响Fig.2 Effects of Lacticaseibacillus rhamnosus MP108 product on fecal water content and jejunum morphology
空肠H&E染色的切片显示空白组肠壁无空隙,固有层结构完整且正常,而模型组空肠肠壁变薄,肠壁有空隙,固有层结构松散;肠绒毛变短且失去正常形态,肠通道变宽,形态不完整,并且有少许炎症细胞浸润(图2b)。MP108产品组及高剂量MP108产品组相较于模型组,症状明显改变,肠道组织形态有一定的恢复作用,肠绒毛长度趋于正常,结构相对完整;肠壁空隙恢复,固有层结构正常,黏膜完整,细胞浸润不明显。
王春荣等认为绒毛结构在肠道受到外界病原菌的侵入或发生应激反应时,会因损伤而变短。这给予一定的启发,益生菌鼠李糖乳杆菌MP108的摄入可以改善由于肠毒性大肠杆菌引起的小鼠空肠损伤。赵凯科等研究显示使用葎草醇提物治疗后与金黄色葡萄球菌感染致腹泻的模型组小鼠相比症状明显改变,小肠绒毛排列整齐,与空白组结构大致相同。另外研究发现植物乳杆菌在ETEC引起的腹泻小鼠中改善了肠上皮屏障,此外对DSS诱导结肠炎小鼠,植物乳杆菌NCU116的胞外多糖EPS116通过减少免疫细胞浸润、促进小鼠结肠隐窝的再生以及ISC(肠干细胞)增殖分化来修复肠道屏障,还改变了DSS小鼠的菌群结构,使肠道再生和聚糖代谢相关的微生物丰度增加,促使宿主产生更多的细胞增殖因子,与本文的研究结果相一致的是鼠李糖乳杆菌MP108产品灌胃后改善了腹泻小鼠的小肠结构,使其与空白组小鼠的小肠形态相似,因此鼠李糖乳杆菌MP108产品具有恢复小鼠因腹泻损伤的小肠结构变化的作用。
2.3 鼠李糖乳杆菌MP108产品调控腹泻相关蛋白水平
AQP3可调控肠道内水分子的吸收,其含量升高则可降低粪便含水量;IgA可影响肠道微环境的免疫应答;ST和TLR4的表达则与炎症细胞的浸润密切相关。通过检测小鼠血清中以上四种腹泻相关蛋白含量,判断鼠李糖乳杆菌MP108产品缓解腹泻的作用。与空白组的IgA含量相比,模型组的IgA显著降低(<0.001);MP108产品及高剂量MP108产品处理之后,IgA 含量显著上升(<0.01)(图3a)。此外,高剂量MP108产品组还显著提高AQP3的水平(<0.001)(图3b)。与空白组的 ST和 TLR4 相比,模型组的ST和TLR4水平显著升高(<0.001);鼠李糖乳杆菌MP108产品可显著降低ST和TLR4的表达(<0.001)(图3c和3d)。综合说明鼠李糖乳杆菌MP108各产品组具有调节缓解细菌性腹泻相关蛋白的作用,可能有助于缓解小鼠的腹泻症状。
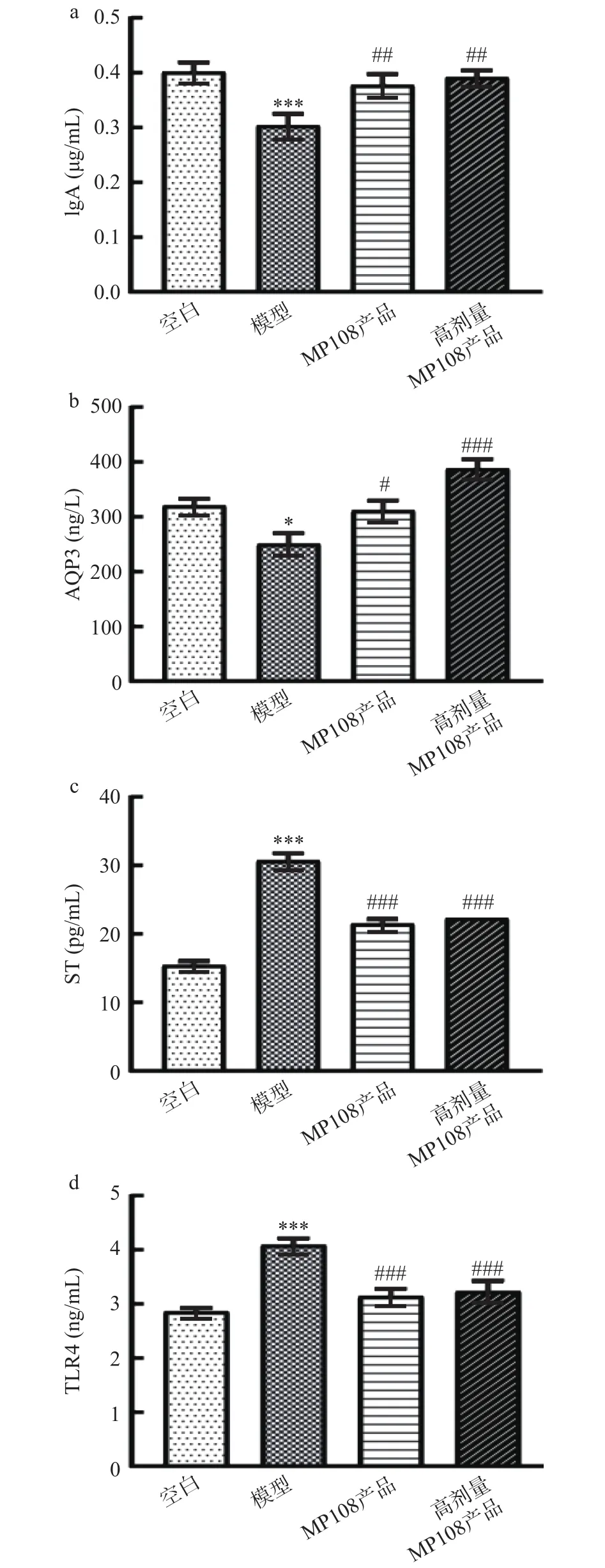
图3 鼠李糖乳杆菌MP108产品对血清中腹泻相关蛋白含量的影响Fig.3 Effects of L.rhamnosus MP108 product on diarrhea related protein content in serum
岳月等研究表明植物乳杆菌能够缓解ETEC引起的腹泻,给腹泻小鼠灌胃植物乳杆菌可以增加AQP3的水平,降低ST和TLR4的水平,这些腹泻相关蛋白水平的变化是其缓解腹泻的原因之一。张睦清等研究表明车前子具有止泻作用,作用机制与上调AQP3基因蛋白的表达水平,增加小肠对水的吸收、调节水液代谢有关。因此推测鼠李糖乳杆菌MP108产品可通过调控腹泻相关蛋白水平进而有助于缓解腹泻症状。
2.4 鼠李糖乳杆菌MP108产品降低血清炎症因子水平
TNF-和IL-6含量的变化可能与腹泻的发生和发展,甚至恢复密切相关。在模型组中两者的含量均相比空白组显著提高(<0.001),而MP108产品组及高剂量MP108产品组该两者的含量相比于模型组显著降低(<0.05)(图4a和 4b)。IL-10 和IFN-在模型组中含量相比于空白组极显著下降(<0.01),而在MP108产品组及高剂量MP108产品组中IL-10和IFN-的水平相比于模型组则极显著提高(<0.01)(图4c和 4d)。细菌性腹泻引起小鼠血清中的炎症因子的上调,灌胃鼠李糖乳杆菌MP108产品则有助于降低腹泻小鼠血清中炎症因子的水平。
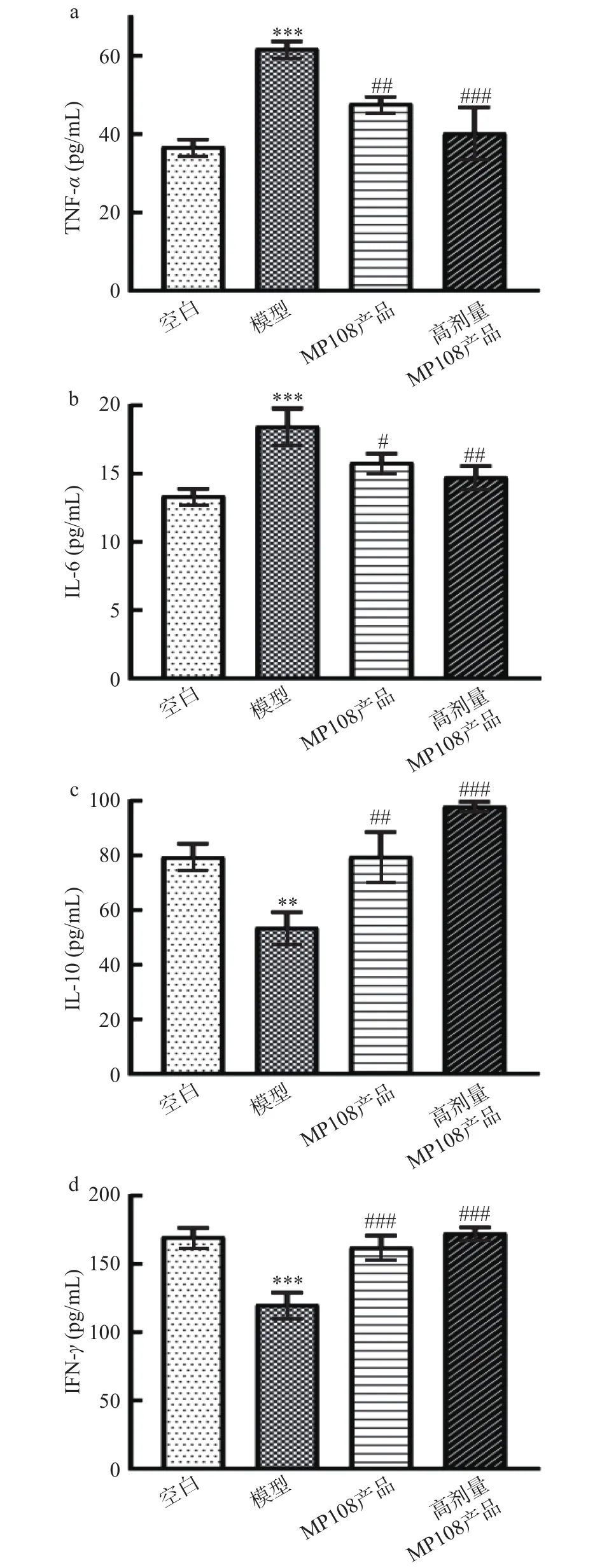
图4 鼠李糖乳杆菌MP108产品对血清中细胞因子含量的影响Fig.4 Effect of L.rhamnosus MP108 product on serum cytokine content
减轻炎症,增加机体抗炎能力也是缓解腹泻的途径之一。丁晓洁等发现乌梅丸可以缓解腹泻症状,与降低血清TNF-、IL-6含量有关。另一项研究显示,有效缓解腹泻的双歧杆菌不仅降低了TNF-,此外还增加IL-10的含量。对炎症因子的调节结果与本研究一致,鼠李糖乳杆菌MP108产品可以通过降低血清中 TNF-、IL-6的含量,增加IL-10和IFN-的含量,从而有助于缓解小鼠的腹泻症状。因此,调控炎性细胞因子是鼠李糖乳杆菌MP108产品缓解ETEC引起的腹泻的重要途径之一。
2.5 鼠李糖乳杆菌MP108产品调节腹泻小鼠的肠道菌群
2.5.1多样性和多样性 肠道微生物区系与宿主之间存在共生关系,这种共生关系可能受到ETEC发病机制的损害。国外一项人群实验报道了在400名严重急性营养不良儿童中,补充益生菌(鼠李糖乳杆菌GG和动物双歧杆菌乳双歧亚种BB-12)可恢复患儿失调的肠道菌群,且益生菌的成功定殖可显著降低腹泻发病率。为研究鼠李糖乳杆菌MP108产品对细菌性腹泻小鼠的肠道微生物结构和组成的影响,利用16S rRNA扩增测序技术分析肠道菌群的变化。基于Observed、Shannon、Simpson和Chao1指数,分别从OTU数量、物种及丰度、均匀度和物种间进化关系衡量组内菌群的多样性。结果显示,小鼠感染后,肠道菌群多样性显著降低,尤其体现在 Observed和 Chao1指数(<0.001)(图5a和5b)。干预后,MP108产品组及高剂量MP108产品组小鼠肠道多样性有不同程度的升高,特别在Shannon和Simpson指数上显著增加(<0.01)(图5c和5d)。说明模型组物种均匀度差异大,物种多样性也远远低于其他组别,而通过灌胃鼠李糖乳杆菌MP108产品可有效提高肠道中物种的丰富度和多样性。使用基于Bray-Curtis指数的NMDS分析小鼠肠道微生物多样性,模型组与其他四组菌群结构差异大,并且MP108产品组及高剂量MP108产品组这两个干预组之间的菌群结构也有一定的差异性(图5e)。
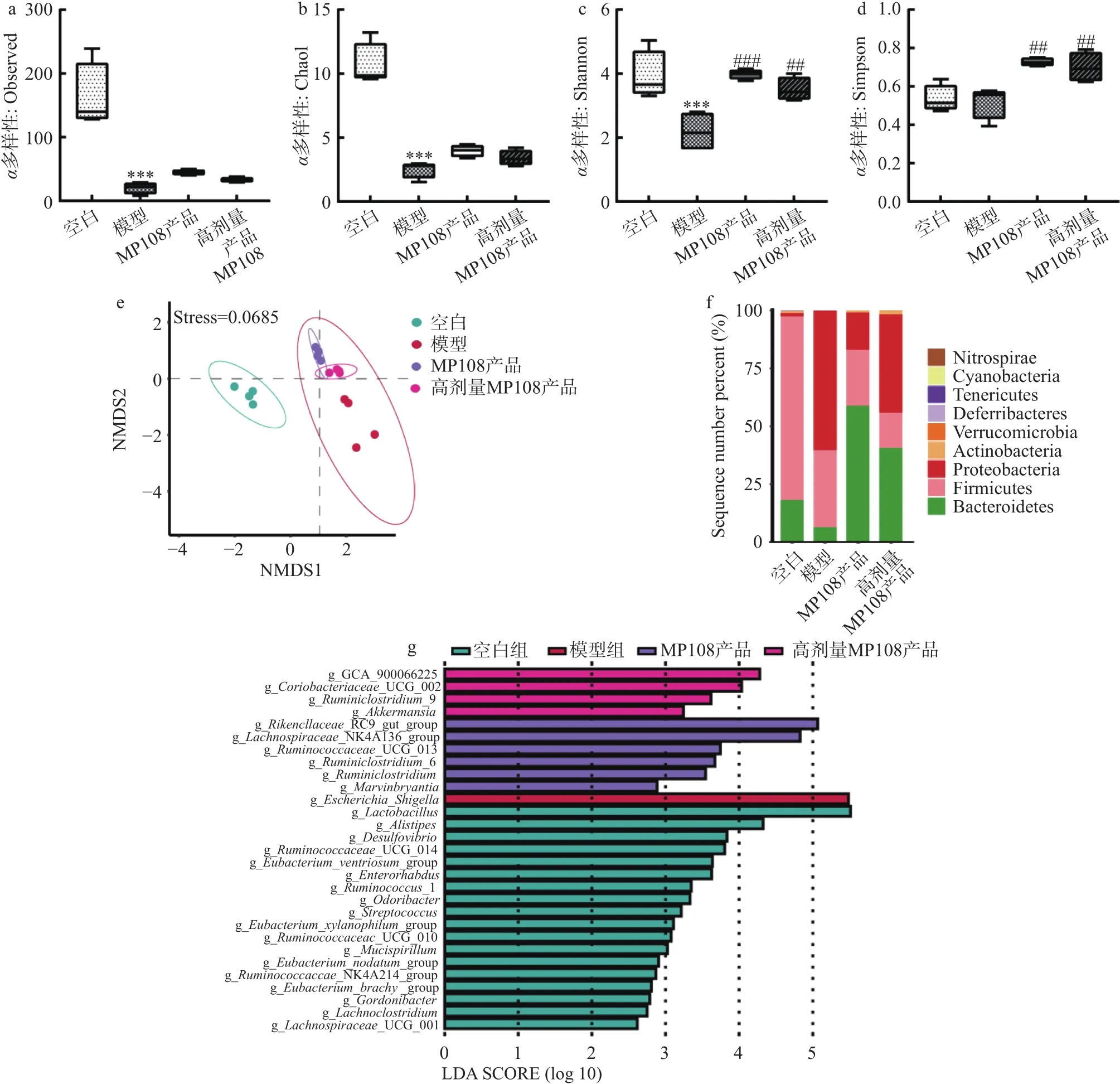
图5 鼠李糖乳杆菌MP108产品对小鼠肠道菌群的影响Fig.5 Effects of L.rhamnosus MP108 product on gut microbiota in mice
2.5.2 菌群组成和差异分析 相对于空白组肠道菌群门水平组成,造模后的模型组中Proteobacteria(变形菌门)相对丰度显著增加,Firmicutes(厚壁菌门)相对丰度剧烈降低;而干预后,Proteobacteria丰度在两个鼠李糖乳杆菌MP108产品组中明显降低。并且两个干预组中Actinobacteria(放线菌门)和Bacteroidetes(拟杆菌门)丰度相较于模型组均增加,高剂量组的Actinobacteria丰度更高,而Bacteroidetes丰度增加不如MP108产品组(图5f)。通过LEfSe分析发现,模型组的优势菌属是条件致病菌(大肠埃希菌志贺氏菌),在炎症条件下具有较高的感染致病能力;在Bin等的研究中,ETEC诱导的腹泻导致肠道微生物多样性降低,的相对丰度升高。经过干预,鼠李糖乳杆菌MP108产品组中RC9 gut group,NK4A136 group,UCG_013,6,和则是优势菌属;而高剂量MP108产品组的优势均属则是GCA 900066225,UCG_002,和9(图5g)。MP108产品组和高剂量MP108产品组中优势菌种不同,优势的菌属均集中在产短链脂肪酸的菌属中,因此,推测灌胃鼠李糖乳杆菌MP108产品增加肠道菌群的多样性,提高产SCFA菌属的丰度,例如,和是产丁酸盐的关键菌,有助于调节小鼠肠道菌群结构和组成,从而改善小鼠的腹泻症状。Liu等的研究表明葛根芩连汤逆转了肠道微生物区系丰富度的下降,改变了肠道微生物结构,增加肠道菌群的多样性,并显著增加了(阿克曼氏菌属),(拟杆菌属),(梭菌属)和(瘤胃球菌属)等产生短链脂肪酸的菌属的相对丰度,减轻猪的腹泻症状。此外,在模型组小鼠肠道中丰度降低,这代表着肠道黏液层较薄,导致肠道屏障功能减弱及细菌毒素易位,因此,高剂量MP108产品增加的相对丰度有助于改善肠道屏障功能,降低肠道炎症。RC9 gut group和NK4A136 group为产丁酸菌,对于维持肠道SCFA的水平具有重要的作用。罗伊氏乳杆菌CCFM8631通过增加,NK4A136 group等细菌的相对丰度和调节维生素B6代谢,从而改善高胆固醇血症。此外,和NK4A136 group等细菌在鞣花单宁Geraniin处理后富集,有助于缓解高脂饮食诱导的代谢综合征症状。综上,MP108产品和高剂量MP108产品处理提高小鼠肠道中有益菌的丰度,有助于恢复肠道菌群的平衡,进而改善小鼠细菌性腹泻的症状。
3 结论
产品中的鼠李糖乳杆菌MP108可以通过调节血清中腹泻相关蛋白的水平(<0.05),调节肠道微生物失衡,降低条件致病菌的相对丰度,从而有助于减少小鼠粪便的含水量(<0.05);此外,鼠李糖乳杆菌MP108产品通过抑制血清中促炎因子的表达(<0.05),提高产SCFA菌群的相对丰度如,,,从而有助于改善腹泻小鼠的小肠组织病理形态。综合来说,鼠李糖乳杆菌MP108产品可能通过调节肠道微生物的组成及其代谢活动影响宿主的免疫应答及腹泻相关蛋白的表达,从而有助于缓解小鼠的腹泻症状。
