肠道菌群成为帕金森病治疗的新靶点
2022-10-27赵飞燕
于 洁,李 琪,赵飞燕
(内蒙古农业大学乳品生物技术与工程教育部重点实验室,农业农村部奶制品加工重点实验室,内蒙古自治区乳品生物技术与工程重点实验室,内蒙古呼和浩特 010018)
肠道作为人体最大的器官之一,寄居着数以万计的微生物。这些微生物参与机体的各类活动,与机体的健康存在着密不可分的关系。近年来,关于微生物-肠-脑轴的研究正进行的如火如荼,大量研究表明肠道微生物可能是影响神经性疾病的关键物质,同时一些临床研究结果显示肠道菌群的改变与部分神经性疾病的临床症状改善相关。
帕金森病(Parkinson’s disease,PD)是一种常见于中老年人群的中枢神经退化性疾病,其行为特征具体表现为运动障碍、肌肉僵直、震颤等,除此之外还伴有痴呆、抑郁及胃肠道疾病等非运动性症状。1817年,英国医生James Parkinson首次对帕金森病进行了详细的描述,目前通常认为帕金森病与遗传、环境、年龄等多种因素有关,但其确切病因至今仍不明确。多巴胺能神经元的退化和死亡是帕金森病的重要病理之一,而在近期研究中发现黑质中含-突触核蛋白(-synuclein,-syn)的路易小体的形成也被认为是影响帕金森病发生与发展的重要病理。-syn是与帕金森病发病相关的常染色体显性遗传性帕金森病致病基因,大量动物实验(基因突变(-syn基因上的和基因)和基因敲除(大肠杆菌的基因))证明-syn的过度表达会引起典型的帕金森病症状,而敲除致病基因可以改善神经元功能,减轻帕金森病症状。同时,Wallen等通过临床试验发现:基因变异的同时会调节syn的表达;条件致病菌的富集受到宿主基因型的调控,与帕金森病具有关联性。研究表明影响帕金森病的基因(如)可能通过与菌群的相互作用,影响宿主帕金森病的易感性。值得注意的是,现在大多数的帕金森病患者在患病的同时会伴有便秘、腹痛、腹胀等胃肠道疾病,这些疾病症状可能在帕金森病患者出现运动症状前的5~20年便会存在。因此,肠道菌群与帕金森病密切相关。Horsager等将帕金森病分为身体优先型(自下而上)和脑优先型(自上而下)两种亚型,本文针对身体优先型进行重点讨论,从肠道菌群、帕金森病程和治疗方法等方面进行综述,总结当前研究中肠道微生物在帕金森病程中的作用。同时,对益生菌干预的新型治疗方法进行讨论,为帕金森疾病治疗提供新的见解。
1 帕金森病与肠道菌群的关系
1.1 肠道菌群通过肠-脑轴传递α-syn影响帕金森病程
肠道被称为“第二大脑”,通过神经、免疫和内分泌三大系统与大脑相互作用形成“肠-脑轴”。肠道微生物通过自身及其代谢物直接或间接参与肠-脑轴的交流网络,影响帕金森病程。2006年,帕金森病可能起源于胃肠道的假说被提出:胃粘膜层的病原菌可能在特定条件下使-syn发生错误折叠和聚集,并通过一系列连续的投射神经元到达大脑,进而促进帕金森病的发生。由此,肠道菌群可能作为一个新的帕金森病治疗靶点引起研究者的广泛关注。Holmqvist等研究证明-syn可能通过迷走神经从肠道传递到大脑来引起运动障碍。随后,Ahn等证实由syn和Tau蛋白在天冬酰胺内肽酶(asparaginyl endopeptidase,AEP)的作用下产生的-synN103和TauN368两种片段复合物可以通过促进彼此的纤维化从肠道逆向传递到大脑,进而触发黑质多巴胺能神经元的丢失,导致帕金森病的患病。表明-syn可能通过不同方式到达大脑导致患病,进一步证明了帕金森病与肠道菌群之间的密切关系。此外,2021年,Boehme等通过粪菌移植(fecal microbiota transplantation,FMT)将年轻小鼠和年老小鼠的粪便移植到衰老小鼠肠道中,发现年轻小鼠的粪便可以减轻衰老小鼠与年龄相关的认知行为障碍,表明肠道菌群的改变是影响退化性神经疾病的重要因素。Challis等发现将-syn的预制原纤维(preformed fibrils,PFF)接种到小鼠的十二指肠壁中可引起肠神经中致病性-syn聚集,破坏小鼠的肠神经连接,引起小鼠胃肠功能障碍、机体炎症并使小鼠出现运动障碍。上述研究均为帕金森病起源于肠道提供证据,并且证明了肠-脑轴在帕金森病程中发挥着双向调节的重要作用。
1.2 肠道菌群通过调节宿主免疫、代谢和肠道通透性影响帕金森病程
帕金森病作为慢性神经性疾病,其特征是小胶质细胞和星形胶质细胞被激活,产生大量的促炎因子,增加活性氧和氮形态(ROS/RNS),而促炎因子和ROS/RNS均会促进神经元和胶质细胞的凋亡,增加血脑屏障的通透性,加重脑损伤的程度。肠道微生物及其代谢产物可以通过调节免疫系统,进而影响局部、全身炎症,肠道上皮屏障功能以及神经营养分子。帕金森病程中,肠道微生物扮演着“驱动者、延续者、调节者”的作用。在相关机理的探究中,Li等对313名受试者进行肠道菌群及菌群相关表位(microbiota-associated epitopes,MEs)的分析发现,氨基酸、异丙醇和丙酮酸的生物合成与肠道中一些特定菌(放线菌门和厚壁菌门)的丰度呈现显著的相关性,肠道细菌可以通过调节炎症标志物水平和驱动T细胞应答参与机体免疫。Zhou等使用MPTP诱导帕金森病小鼠模型后, 利用头孢曲松钠治疗帕金森病小鼠,发现小鼠肠道中肠道致病菌()的丰度下降,潜在益生菌()的丰度升高,同时小鼠的机体炎症得到显著改善,具体表现为:脑中与炎症相关通路的表达(TLR4、MyD88 和 NF-B)、星形神经胶质细胞和小神经胶质细胞的标志物表达下降,血清促炎因子IL-1、IL-6和TNF-的浓度降低。而小肠中IL-1的分泌与肠道中的菌群呈现相关性。表明肠道菌群也许可以通过调节帕金森病患者的机体免疫来影响帕金森病的病程。2021年,研究发现肠道中肠球菌含有酪氨酸羟化酶(tyrosine hydroxylase,促进L-酪氨酸生成多巴)和多巴脱羧酶(dopa decarboxylase,促进多巴转化为多巴胺),并首次提出肠道是多巴/多巴胺产生的新场所。多巴胺的减少是帕金森病的病因之一,表明肠道菌群也可以直接合成一些神经递质(多巴胺,去甲肾上腺素和血清素)和神经调节剂(氨基丁酸和短链脂肪酸)来影响神经网络的健康。同时,还发现帕金森病患者肠道中拟球梭菌与柔嫩梭菌的丰度降低,肠道菌群产丁酸盐的能力降低,而丁酸及其盐类被证明与帕金森病患者的步态障碍评分和肠道屏障功能呈正相关。此外,Omenetti等研究发现肠道中共生细菌分节丝状菌(segmented filamentous bacteria,SFB)诱导产生的Th17细胞具有维持肠道屏障完整性的作用。因此,肠道微生物可以通过调节宿主免疫、代谢和肠道通透性来影响帕金森病患者的身体状况(表1)。

表1 帕金森病与肠道菌群的关系Table 1 Relationship between Parkinson's disease and intestinal flora
2 帕金森病患者肠道菌群特点
2.1 细菌
随着测序技术的不断发展,越来越多的科研工作者选择将高通量测序等分子生物学手段作为研究肠道菌群多样性的重要手段之一。基于大量测序数据的结果发现,与健康人相比,帕金森病患者的肠道菌群组成和结构发生了显著变化,且处于疾病不同阶段的肠道菌群也存在差异。
细菌是影响帕金森病程的主要肠道微生物。Wallen等基于人群数据发现帕金森病患者的肠道菌群并不是独立变化的,而是存在一定关联,首次提出条件致病菌的显著增加是帕金森病患者肠道菌群失调的特点,并将帕金森病患者的菌群组成变化分为三类:第一类由、和组成,这些细菌常见于感染和慢性炎症,被认为是条件致病菌;第二类由柔嫩梭菌属、斯氏菌属和丁酸梭菌属等组成,它们常被认为与肠道中短链脂肪酸的产生相关;第三类则是由通常被认为是益生菌的乳杆菌属和双歧杆菌属组成。同时,Cirstea等发现帕金森病患者肠道菌群的变化不是单个菌属的变化,而是共丰度菌簇的变化,主要表现为与产生短链脂肪酸相关的细菌簇显著减少,与肠粘膜降解有关的细菌簇显著富集。这两项研究结果表明帕金森病患者肠道中的细菌会伴随疾病发生群体性的变化。
针对这些变化带来的影响,Li等通过研究帕金森病患者与健康人的粪便菌群发现帕金森病的严重程度和持续时间与纤维素降解菌的数量呈负相关,与可能的致病菌呈正相关,这些致病菌可能减少短链脂肪酸的生成,产生更多外毒素和神经毒素,促进帕金森病程。除此之外,多项基于国内外帕金森病的大人群实验和动物实验也证实了帕金森病患者肠道中细菌多样性增加,Akk菌属、双歧杆菌属等增加;普氏杆菌、毛螺菌科和粪杆菌属等减少。Akk菌属是近几年广受关注的新兴益生菌株,大量研究表明其可以改善糖尿病、结肠炎和肥胖等疾病。黏蛋白与肠道通透性和免疫反应等存在很强的相关性。Akk菌属以黏蛋白作为能量来源,其在帕金森病患者体内数量的异常增加可能与肠屏障功能紊乱有关。普氏杆菌属是肠道中的重要成员之一,参与肠道黏液层糖蛋白的分泌和短链脂肪酸的代谢。肠道中分解纤维素、产生短链脂肪酸的细菌减少可能导致促炎症状态,并与帕金森病患者的复发性胃肠道症状相关。除此之外,Tan等通过对200名受试者(104名PD患者,96名对照组)进行临床表型及粪便代谢组分析,发现帕金森病患者肠道中短链脂肪酸等生物活性分子与对照组有显著差异,短链脂肪酸水平的降低与帕金森病患者较差的认知能力和身体质量显著相关。
同时,这些研究中也发现了不同的结果,比如相比于对照组,Qian等发现在中国帕金森病患者肠道中乳杆菌属显著降低,而Romano等发现帕金森病患者肠道中乳杆菌属呈富集状态。由此推断帕金森病患者肠道中双歧杆菌的增加可能与肠粘膜降解相关。因此,帕金森病患者肠道中乳杆菌和双歧杆菌的升高是病理性升高还是克服微生态失调的补偿机制仍有待研究。
2.2 真菌
除了对细菌的研究外,还有一些研究对帕金森病肠道中真菌进行了分析。2021年Wris等对59名受试者(34名PD患者和25名年龄匹配的对照)粪便真核生物微生物群进行对比分析发现,相比于对照组,PD组粪便中真核微生物群的-多样性显著降低,而-多样性具有显著差异;PD组地丝菌属丰度显著升高,曲霉菌属/青霉菌属、轮藻门/亚麻属、未鉴别的后鞭毛生物()、中3个属的相对丰度显著降低,表明帕金森病的发生伴随着肠道真菌群落的改变,为帕金森病的研究提供了一种新的思路。但是也有研究提出,帕金森病患者肠道中真菌的负载量极低,且研究确定的属大都来自于补充的饮食和环境,肠道真菌与帕金森病间无显著相关性。因此,肠道真菌群落的改变是否对帕金森病疾病的发生与发展具有重要影响仍有较大争议。
2.3 其他
此外,大量研究表明帕金森患者肠道菌群的丰度和多样性显著升高,这可能是小肠细菌过度增长(small intestinal bacterial overgrowth,SIBO),也可能与其本身的便秘状态相关。SIBO的出现是由于肠道蠕动减少和肠道通过时间增加,表明SIBO可能是帕金森病的结果而非原因。便秘通常与结肠转运时间的增加和粪便硬度具有直接联系。肠道微生物与结肠转运之间的机制和关系是双向的,较短的转运时间(腹泻)有利于冲洗走一些生长缓慢的细菌,而较长的转运时间(便秘)则与肠道中较低的养分利用率相关,该环境更适合生长速率慢或可以使用多种能源的细菌。这二者均会导致肠道炎症和肠屏障完整性的缺失,加剧有害微生物的暴露,促进帕金森病的发生。未来需要更多研究来进一步证明SIBO和便秘在帕金森病中的作用。
3 益生菌对帕金森患者临床症状的影响
目前国内外对于帕金森病的治疗仍以药物治疗为主,例如:左旋多巴(FLZ)、多巴胺激动剂、多巴胺降解酶抑制剂等。Rekdal等发现肠道中的粪肠球菌可以将左旋多巴降解为多巴胺,随后由进一步分解为间酪胺,从而降低药物利用率并导致副作用。2021年,Wang等发现嗜酸乳杆菌仅可以增加肠道中左旋多巴的产生,而对左旋多巴转化为多巴胺的过程并无显著影响。FLZ是一种潜在的帕金森病治疗药物,可穿过血脑屏障,并在多种帕金森病动物模型中起到显著的神经保护作用,目前正处于临床1期试验阶段。Shang等研究发现使用抗生素干扰小鼠的肠道菌群可显著降低小鼠血液中FLZ及M1(FLZ被肠道菌群分解的主要代谢产物)浓度,从而抑制了FLZ对帕金森病的改善作用。这些研究结果揭示了抗帕金森药物治疗效果随时间减弱、副作用大的原因。运动治疗可以作为一种辅助治疗帕金森病的手段显著提高帕金森病患者的运动障碍,但是帕金森病的患者大多集中于老年人,因此,寻找一种强度弱、效果好、副作用小的治疗手段具有重要意义。在为数不多关于帕金森病的临床研究中,多数结果都显示益生菌可以显著改善患者的腹涨、腹痛和粪便坚硬程度,同时增加自发排便频率。且益生菌对患者胃肠道症状改善效果与药物的效果基本一致,说明益生菌的确可以缓解帕金森患者便秘情况和提高患者的生活质量,因此可以考虑将益生菌作为帕金森病的辅助治疗手段之一。
虽然早在2006年就有研究提出帕金森病与肠道菌群密切相关,但目前关于益生菌辅助治疗帕金森病的相关研究仍然较少。Cassani等和Arichella等通过给帕金森病患者服用益生菌发酵产品12周和4周,发现益生菌发酵产品可以增加患者的排便次数,同时减轻腹痛、腹胀等症状。随后,有研究者基于随机对照实验发现,补充复合益生菌12周可显著降低患者MDS-UPDRS评分,同时显著降低患者血浆中高敏C反应蛋白和丙二醛的含量,显著增加谷胱甘肽的含量。2021年,Tan等发现与对照组相比,服用复合益生菌4周可显著增加帕金森病患者每周的自发排便频率,改善粪便坚硬程度和便秘患者的生活质量评分,但对患者粪便钙卫蛋白水平无显著影响,同时益生菌组患者对治疗效果的满意程度远高于安慰剂组(益生菌组vs安慰剂组:65.6% vs 21.6%)。说明服用复合益生菌可以通过改善帕金森病患者的机体炎症水平和抗氧化能力进而缓解疾病严重程度,是一种患者接受度高、治疗效果更好的帕金森病辅助治疗手段。值得注意的是,Georgescu等以老年帕金森病患者作为研究对象,探究了益生菌和曲美布汀对患者便秘及相关症状改善情况,结果显示益生菌组患者腹痛和腹胀的发生率与曲美布汀组患者相同。综上所述,服用益生菌发酵产品或直接服用益生菌均可以对帕金森病的临床症状起到改善作用,且其对患者胃肠道症状的干预效果接近药物治疗水平。
此外,关于益生菌对患者机体炎症因子的结果不一致,这可能与两次试验中的受试者、检测样本(血液和粪便)、干预时间、菌株组成以及其活菌数的差异有关(表2)。目前,益生菌与益生元相结合的方法是最新的MDS(帕金森病诊断标准)循证指南推荐的唯一“有效”和“临床有用”的治疗方法。因此仍需要更高质量、大规模和全面的随机对照实验验证益生菌对帕金森患者炎症水平的作用。

表2 益生菌辅助治疗帕金森病研究进展Table 2 Research progress of probiotics in adjuvant treatment of Parkinson's disease
4 益生菌改善帕金森病的潜在机理
无论是益生菌联合药物治疗或是单独使用益生菌均对帕金森病具有显著的改善作用。左旋多巴是帕金森病治疗的主要药物,进入机体后在小肠部位分解成多巴胺随后通过体循环到达大脑,补充中脑部位的多巴胺信号,从而改善帕金森病症状。但随着机体对左旋多巴抗性的逐渐增强,现在研究者们致力于寻找左旋多巴结合饮食、益生菌或其他药物等来联合治疗的方式对帕金森病进行治疗。
益生菌发挥作用的方式则更为复杂。一方面,益生菌自身及其代谢物可以影响帕金森病的发生和发展。Goya等发现枯草芽孢杆菌可以通过调节包括鞘脂代谢在内的几种宿主代谢途径抑制线虫syn的聚集,从而改善帕金森病。
另一方面,益生菌进入肠道会改变肠道菌群的组成及丰度,通过增加有益菌和减少有害菌的方式来改善肠道环境。肠道菌群的正向调节会进一步激发其代谢物潜力,通过提高机体的免疫功能和抗氧化功能,进而改善帕金森病的神经炎症。还有研究发现,服用益生菌可以改善肠屏障受损,降低肠道微生物因肠屏障受损进入机体引发感染的风险。除此之外,益生菌联合药物治疗在帕金森病的临床研究中也取得了很多成果。因此,益生菌以直接干预或辅助药物治疗的方式均可以改善患者帕金森病的症状,提高其生活质量,是今后帕金森病治疗/辅助治疗的有效手段。
总而言之,益生菌可以通过调节肠道菌群,降低炎症、提高免疫和抗氧化能力、修复肠屏障等来改善帕金森病患者的临床症状,相关机理如图1所示。但是,并没有研究将服用益生菌后肠道特定微生物的改变与患者体内具体的炎症因子和免疫通路相关联,缺乏对益生菌改善帕金森病更深一步的机理探究,需要更多研究进行补充。
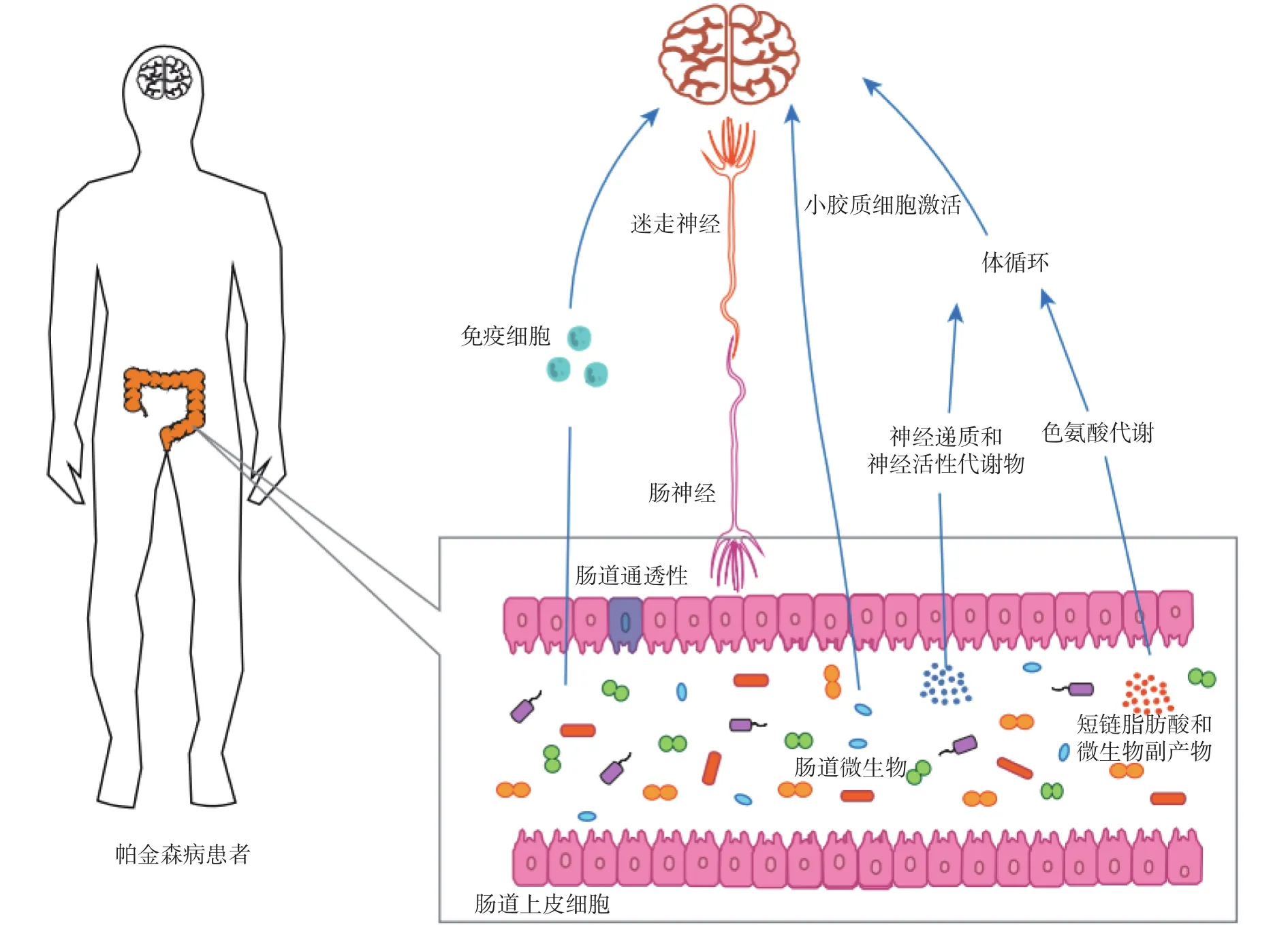
图1 帕金森微生物-肠-脑轴机理图[1,21,46]Fig.1 Mechanism diagram of Parkinson's disease microbe-gut-brain axis[1,21,46]
5 结论与展望
综上所述,帕金森的发病机制主要可以概括为三个方面:神经炎症、-突触核蛋白错误折叠和线粒体功能紊乱。肠道中特定微生物(如Akk菌、普氏杆菌和乳杆菌等)可以通过微生物-肠-脑轴参与影响这些过程。目前研究者们主要发现肠道菌群通过自身及其分泌的代谢物来调节机体炎症、免疫、胃肠道功能等,对帕金森病具有重要影响,这使得肠道菌群可以作为帕金森病治疗的新靶点。虽然提出了益生菌治疗/辅助治疗帕金森病的新方法,但研究所用的益生菌产品(益生菌、发酵乳、发酵乳饮料等)不同、菌种单一、机制不明,结论大都只是停留在现象的讨论而缺乏因果水平上的探究,在未来需要进行更多研究来补充。此外,当前多数研究均是基于16S rRNA基因片段分析帕金森病患者菌群多样性和功能变化,而基于16S rRNA手段预测获得的功能信息具有一定的局限性。因此,若想更深层次对帕金森病进行探究,日后相关的研究需倾向于采用更高分类分辨率的多组学方法,结合受试者的详细现象和基因分型,对肠道微生物及其代谢物如何与宿主相互作用并影响帕金森病的病因、症状和进展进行更为透彻的解析。
本文从肠道菌群与帕金森病的相关性论述了肠道菌群成为帕金森病治疗新靶点的可能性。同时,总结了当前益生菌治疗/辅助治疗帕金森病这一方法的研究现状和局限性,以期为帕金森病的治疗提供新的参考。
