致貉流产死胎肠外致病性大肠杆菌的分离鉴定及生物学特性
2022-10-21张召兴贾青辉张艳英高桂生史秋梅
张召兴,贾青辉,张艳英,高桂生 史秋梅*
(1.河北旅游职业学院 畜牧兽医系,河北 承德 067000;2.河北科技师范学院 河北省预防兽医学重点实验室,河北 秦皇岛 066604)
近几年,河北地区毛皮动物(貉、狐、貂)养殖数量增加,在养殖过程中出现死胎、流产成为临床中常见的疾病,给养殖户造成严重的经济损失。国内相关研究表明犬瘟热病毒、阿留申病毒、伪狂犬病病毒、加德纳氏菌、布氏杆菌、大肠杆菌、沙门菌、金黄色葡萄球菌等多种病原均可以引起貉、狐、貂死胎、流产[1-2]。大肠杆菌(Escherichiacoli,E.coli)是临床中重要人畜共患的病原菌之一,该菌根据发病的临床症状及遗传学可以分为3个菌群类型,其中,肠外致病性大肠杆(extraintestinal pathogenicEscherichiacoli,ExPEC)是可以引起肠道以外组织感染的一类E.coli,主要引起人和动物的神经系统、呼吸系统、循环系统及泌尿生殖系统感染等,严重者可以导致其急性死亡。该菌抗原结构复杂,具有多种致病性血清型且无交出保护性,也无有效疫苗保护,因此导致E.coli病在不同的地区广泛发生与流行,对人和动物危害性很大[3-6]。该菌基因组中编码许多毒力基因,毒力基因的在对宿主致病过程中起着重要的作用,其中毒力ExPEC至少有2种以上基因[7]。细菌生物被膜(bacterial biofilm,BBF)是组成结构性细菌群落的主要物质,且在自然界中能形成BF。许多研究表明细菌的BF形成能力与其毒力及耐药性具有一定相关性[8]。临床中主要用抗生素进行治疗,抗生素的滥用,致使耐药性严重,且出现多重耐药菌株,加大了该病的治疗难度,同时耐药性和药物残留威胁着人类健康[9]。
本试验2017—2020年采集河北地区养殖场中流产貉阴道分泌物、死胎等病料组织243份进行ExPEC分离并对其生物学特性进行研究,为该地区致貉流产、死胎综合防控提供参考依据。
1 材料与方法
1.1 病料来源2018—2020年河北地区养殖场中,妊娠25~40日龄的貉,出现死胎、流产情况,采集貉阴道分泌物、死胎等病料组织243份进行病原检测。
1.2 主要试验材料麦康凯培养基、96孔细菌培养板、显色培养基、营养肉汤,购自北京双旋微生物培养基制备科技公司;药物纸片购自杭州天和微生物制剂有限公司;细菌生化试纸条,购自上海研晶生物科技有限公司;DL2000 DNA Marker购自中科瑞泰生物科技有限公司;2×Taq Marker Mix购自宝生物工程(大连)有限公司;病毒基因组DNA、细菌基因组DNA提取试剂盒均购自Omega Bio-Tek公司;O抗原鉴定因子购自中国食品药品监察所;35~40 g健康妊娠14日龄的昆明系小鼠610只购自北京维通利华实验动物技术有限公司,饲养于河北省预防兽医学重点实验。
1.3 病毒性病原检测参考文献[10-11]报道阿留申病毒、伪狂犬病病毒、犬瘟热病毒鉴定引物,按照说明提取病料中DNA和 RNA,进行 PCR检测。
1.4 细菌的分离鉴定对采集流产貉阴道分泌物、死胎等病料组织样品处理后,无菌条件下接种于麦康凯培养基进行鉴别培养。37℃恒温培养18~24 h,挑取单个菌落接种于显色培养基于37℃培养12~18 h,挑显色培养基上的单个菌落接种于营养肉汤纯化培养后进行镜检和生化试验。
1.5 细菌的PCR检测根据细菌16S rRNA 基因序列,设计细菌通用的16S rRNA鉴定引物,27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1429R:5′-TACGGCTACCTTGTTACGACTT-3′,目的片段约为 1 500 bp。按照提取试剂盒说明书提取分离菌基因组DNA,用 16S rRNA 基因序列对分离菌株进行PCR鉴定。
1.6 致病性试验参考文献[11-12]报道的方法,将分离菌株培养至对数期,用平板计数法进行菌落计数,每1株分离菌株阴道注射妊娠期昆明系小鼠5只,0.25 mL/只(108CFU/mL),对照组给予等量的无菌生理盐水,攻毒12 h后,试验期为7 d,试验期间观察其发病情况,对发病的小鼠进行细菌分离鉴定。
1.7 细菌血清型检测参考文献[13],采用玻板凝集试验对分离菌株进行血清型检测。
1.8 细菌毒力基因的检测参照文献[14-15]的报道ExPEC 的特异性毒力基因(papA/papC、sfa/foc、afa/dra、iutA、kpsMTⅡ)和其他毒力基因(fyuA、irp1、fimH、hlyA、yjaA、ibeA、iss、iroN、ompTchuA、fimC、gafD、tsh、nfaE)引物序列,对分离菌株进行 PCR 检测。
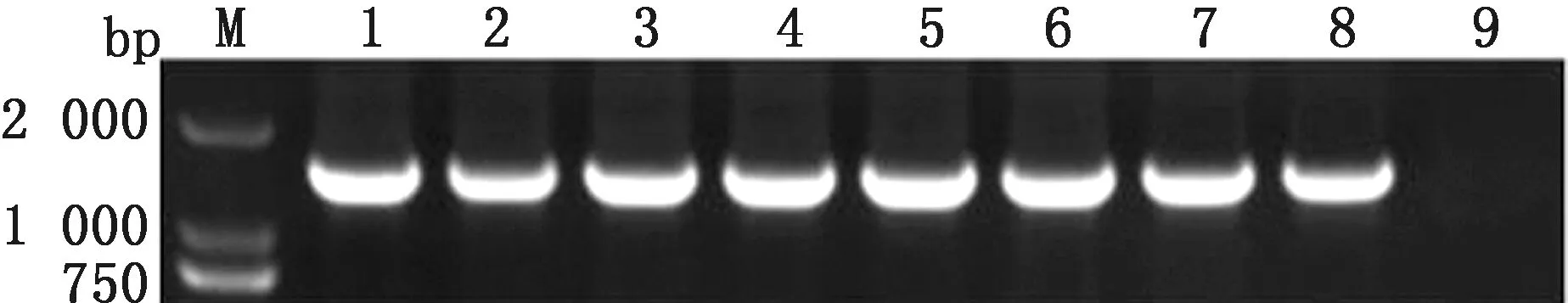
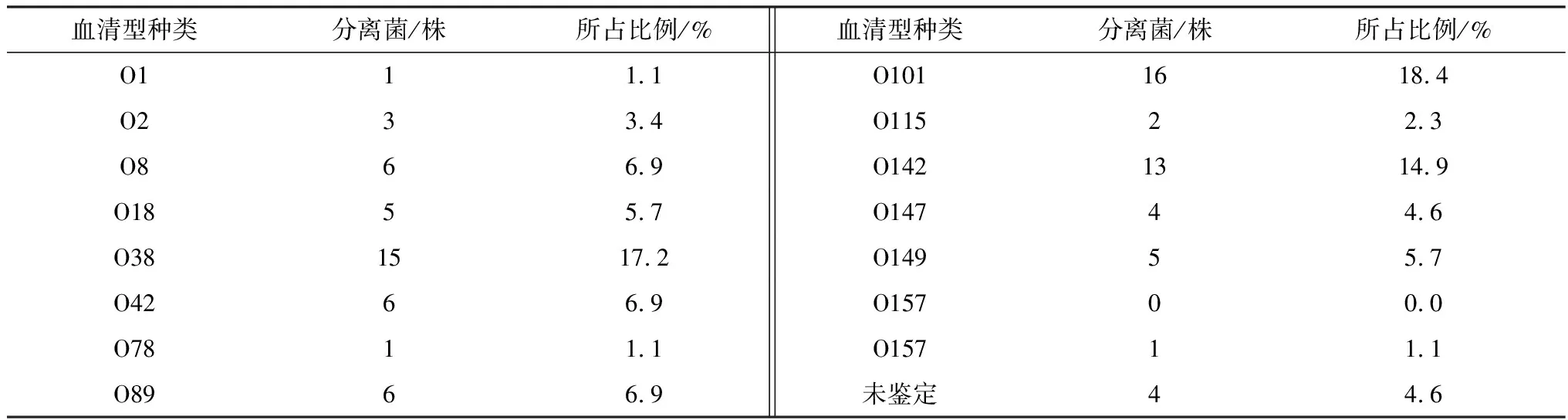
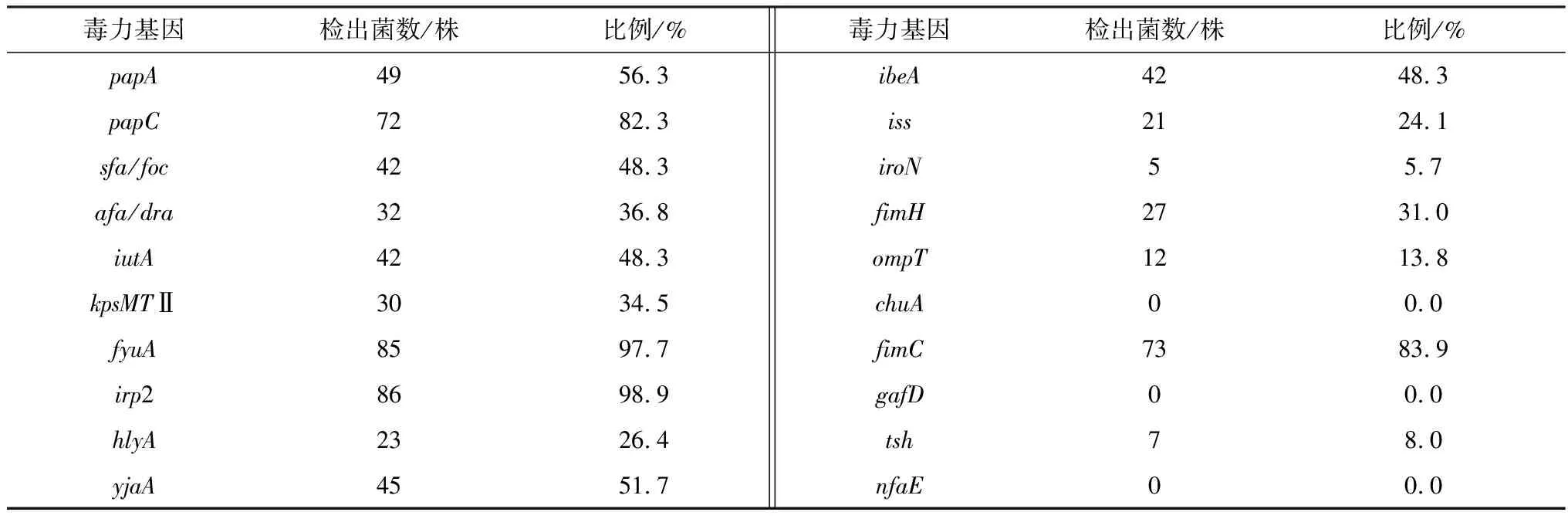
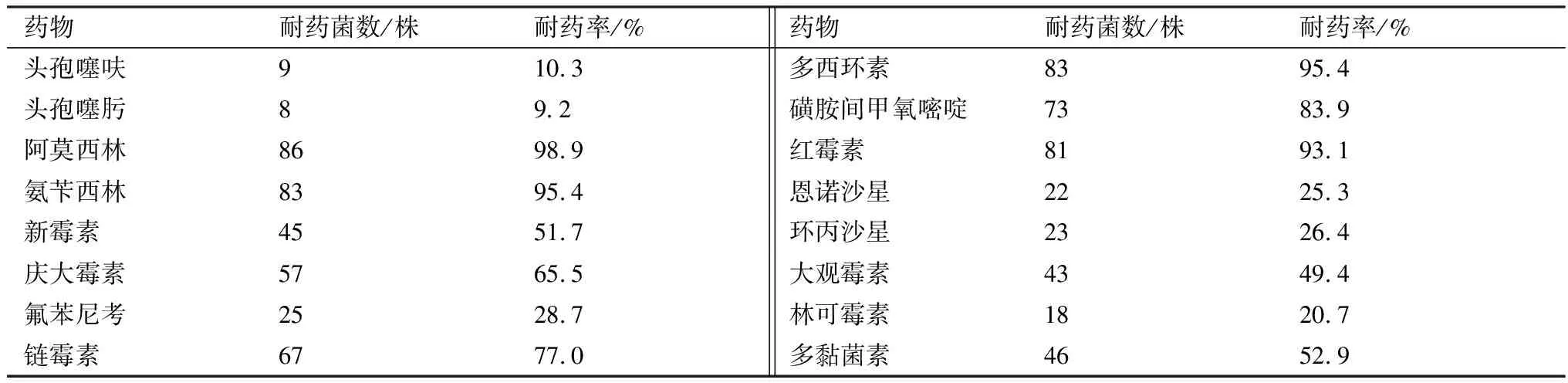
1.9 细菌的BF 检测参考文献[3]所报道的方法,对分离菌株进行 BF形成能力测定,判定标准以阴性对照孔D值的2倍作为判断能否形成 BF 的临界点 ODc,当D≤ODc 时,表示BF形成 能力为零;当 ODc 1.10 药敏试验分离菌参照药物纸片法进行操作,根据美国临床实验室标准化协会(CLSI)推荐的标准进行试验结果判断。 2.1 病毒性病原检测结果采集的貉阴道分泌物、死胎等病料组织243份中犬瘟热病毒、伪狂犬病病毒、阿留申病毒PCR检测均为阴性。 2.2 细菌分离培养结果疑似分离菌株在麦糠凯培养基、E.coli显色培养基长出的菌落形态、镜检形态学及生化特性与报道的E.coli的培养特性、形态学及生化特性基本一致。经统计采集的243份样品中121株分离菌株初步鉴定为E.coli。 2.3 细菌的PCR检测结果对初步鉴定为E.coli分离株用16S rRNA 通用引物对其分离菌株进行 PCR进一步鉴定。结果显示,分离菌株的目的条带约为 1 500 bp,与预期结果相符(图 1)。分离菌株测序后与 NCBI 中报道的E.coli16S rRNA 序列同源均≥99.9%,测序比对结果表明分离株均为E.coli。 M.DL2000 DNA Marker;1~8.分离菌株;9.空白对照 2.4 致病性检测结果攻毒组的小鼠在攻毒后的2~4 d出现采食量减少、嗜睡及流产等不同的发病情况,且个别小鼠出现急性死亡,从发病剖检死亡的小鼠分离得到E.coli。对照组的小鼠健康存活。通过统计87株E.coli对妊娠小鼠具有不同致病性,致小鼠死亡5只菌株有25株、致小白鼠死亡4只菌株有32株、致小鼠死亡3只菌株有16株、致小鼠死亡2只菌株有14株,以致小鼠死亡4或5只菌株最多,分别占分离菌株的36.9%,28.7%。 2.5 细菌的血清型检测结果用玻板凝集试验对分离的87株ExPEC进行血清鉴定。结果显示,所分离的87株ExPEC属于14种不同的血清型,其中以O101(18.4%)、O38(17.2%),和O142(14.9%)为主要流行的血清型(表1)。 表1 致病性菌株的血清型检测结果 2.6 细菌毒力基因的检测结果对分离的87株ExPEC进行毒力基因检测,其中ExPEC 的特异性毒力基因papA/papC、sfa/foc、afa/dra、iutA、kpsMⅡ的检出率为34.5%~82.3%,其他毒力基因fyuA、irp1、fimH、hlyA、yjaA、ibeA、iss、iroN、ompT、fimC、tsh的检出率为5.7%~98.9%,毒力基因chuA、gafD、nfaE未检测到(表2)。分离的87株致病菌株,携带多种毒力基因型,至少携带3种特异性毒力基因和5种其他毒力基因(表3)。 表2 致病性菌株的毒力基因检测结果 表3 致病性菌株与毒力基因相关性分析结果 2.7 BF 形成能力分离的87株ExPEC中,强形成膜能力菌株有 24株(26.6%)、中形成膜能力菌株有34株(43.6%)、弱形成膜能力菌株有17株(19.5%)、不形成BF菌株的有12株(15.4%)。 2.8 耐药性分析分离的87株ExPEC耐药性严重,对阿莫西林、氨苄西林、链霉素等10种药物的耐药率较高,耐药率为49.4%~98.9%,对头孢噻呋、头孢噻肟、氟苯尼考等7种药物的耐药率为9.2%~26.4%;分离的87株ExPEC呈现多重耐药性,耐 16,3种药物各有 1 株、耐 15,6,4 种药物各3株,耐 14,7种药物各8 株,耐13种药物有 8株,耐9种药物有7株,耐8,5种药物各有 4株,耐10,11,12种药物的分离菌株最多,分别占分离菌株的18.4%,16.1%和14.9 %(表4)。 表4 药敏试验检测结果 2.9 BF 形成能力与耐药性相关性分析结果显示,分离的87株ExPEC的BF形成能力与头孢噻肟、林可霉素、庆大霉素、氟苯尼考、磺胺间甲氧嘧啶、红霉素、恩诺沙星、环丙沙星、大观霉素、新霉素10种抗生素的耐药性符合率在90.1%~100.0%之间;与头孢噻呋、阿莫西林、氨苄西林、链霉素、多西环素、多黏菌素6种生素的耐药性符合率在87.2%~89.1%之间,说明分离的87株ExPEC的BF形成能力与耐药性相关(表5)。 表5 BF 形成能力与耐药性相关性分析结果 ExPEC是临床重要的人畜共患病原菌,对人和动物危害较大,可以引起人和动物一系列临床症状,严重者可导致死亡[16]。许多研究表明ExPEC可以引起种成年母畜死胎与流产。本研究从2017—2020年采集243份流产貉阴道分泌物、死胎等病料组织中分离出单一病原菌E.coli,且对妊娠小鼠具有不同的致病性,同时犬瘟热、阿留申、伪狂犬等病毒性疾病感染检测为阴性。说明分离得到ExPEC可能是引起貉死胎、流产等生殖道疾病的主要病原菌之一。前期本课题组在2018年从死胎流产的蓝狐体内检出ExPEC[12]。说明ExPEC对母貉具有潜在的危害,应该注意该病的综合防控。根据国内报道的不同动物源ExPEC具有不同血清型,不同地区,其血清型也存在一定的差异性[7]。本试验研究表明分离的87株ExPEC 以O38、O101和O142为主要流行优势血清型,国内未见报道。国内O38、O101和O142在猪源ExPEC中流行较多[17]。可能在貉的基础日粮中添加的猪货下脚料,污染病原菌,从而导致母貉流产、死胎。与前期本课题组在2018年从死胎流产的蓝狐体内检出的ExPEC血清型存在差异性,可能与感染的宿主及饲料组成与来源有关。O38、O101和O142代表菌株可以作为研制多价疫苗的候选株,为进一步研究该菌疫苗奠定基础。 国外学者研究报道肠道ExPEC基因组中编码了许多的毒力基因,毒力基因的携带及表达与其ExPEC的致病性具有一定的相关性,ExPEC分离菌株携带特定毒力基因papA/papC、sfa/foc、afa/dra、iutA、kpsMTⅡ中的2种及以上基因[15-17]。本试验结果表明,分离的87株ExPEC携带5种ExPEC 的特异性毒力基因和11种其他毒力基因,至少携带3种特异性毒力基因和5种他毒力基因;说明特异性毒力基因和其他毒力基因在ExPEC对宿主致病性过程中起着重要作用,其致病性与携带毒力基因相关。与芮萍等[4]、许腾林等[7]分离的不同动物源ExPEC携带多种毒力基因一致。ExPEC编码的毒力基因通过多种途径分布于宿主的体内并进行表达,在多种毒力基因共同作用下导致宿主发病[18]。ExPEC在宿主体内器官繁殖并产生内毒素,通过宿主器官内血液循环,引起菌、毒血症,同时在毒素作用下可以促进炎性因子的释放,降低机体免疫力,导致子宫异常收缩,从而导致孕畜的死胎、流产。其作用机理有待进一步研究。 国内许多研究表明细菌形成BF可以抵抗外界不利环境因素的影响,是一种自我保护机制[7-9]。本试验研究表明,分离的87株ExPEC以强、中形成BF能力致病菌株为主,与张召兴等[3]报道河北地区蛋鸡源E.coli具有BF形成能力一致。李金朋等[7]报道从河南分离的猪源E.coli具有BF形成能力,与上述报道的一致。细菌BF形成能力是适应外界环境的一种自我保护形式,其BF形成能力与其毒力及耐药性具有一定相关性。抗生素是临床中防治E.coli病的主要手段,不合理使用抗菌药物,可导致很强的耐药性,且E.coli的耐药性可在不同菌株之间传播[14]。本试验研究表明分离的87株ExPEC耐药性严重,呈现多重耐药性,其BF形成能力增强细菌耐药性的机理尚未明确,有待进一步研究。因此,在临床中防治ExPEC应该选择敏感药物,交替使用降低耐药性,提高治疗效果。E.coli广泛存于环境中,可以通过多种途径进入体内,尤其在母貉配种前、后应该使用抗生素对细菌性疾病进行净化,配种过程中应该注意环境的消毒,减少外界病原通过阴道入侵体内,同时加强饲养管理,防止食源性感染。本研究为该地区致貉流产、死胎E.coli综合防控提供参考依据。2 结果


3 讨论
