葛根芩连汤对溃疡性结肠炎小鼠肠道菌群及炎性因子的影响
2022-10-21郑晨曦郭兴华吴天鸽徐少宇冯嘉轩
郑晨曦,郭兴华,吴天鸽,徐少宇,冯嘉轩,孙 聪
(1.长春中医药大学 药学院,吉林 长春 130117;2.吉林大学 第二临床医院,吉林 长春 130041;3.敦化市畜牧站,吉林 敦化 133799;4.长春中医药大学 临床医学院,吉林 长春 130117)
溃疡性结肠炎(ulcerative colitis,UC)是一种与肠道微生物生态失调、黏膜免疫系统受损及环境因素有关的炎症性疾病,与克罗恩病(CD)统称为炎症性肠病(IBD),发病机制暂不明确[1]。UC发病年龄趋于年轻化,患病率及死亡率在全球范围内逐渐上升[2]。目前,UC的治疗药物主要有5-氨基水杨酸、免疫抑制剂和糖皮质激素,但长期服用存在药物毒性、感染等副作用[3]。因此探讨UC可能的治疗机制成为亟待解决的科学问题。
UC发病过程中肠道菌群紊乱可导致大量细菌死亡溶解释放脂多糖(LPS)入侵机体,LPS可能作为炎症的起始环节影响UC的发生,常用于UC模型的制备和早期诊断指标[4]。肠道免疫异常导致的黏膜免疫屏障功能受损是UC发病的重要因素,肠道免疫屏障中起核心作用的是分泌型免疫球蛋白A(sIgA)[5]。sIgA是肠道分泌最多的免疫调节蛋白,通过调节免疫反应有效保护肠道屏障的完整性,是维持肠黏膜稳态的第一道防线[6]。外周血单核细胞(MONO)是血液中体积最大的白细胞,可分化为巨噬细胞和树突状细胞,临床上常作为炎症检查的辅助诊断方法。UC患者MONO的数量与UC疾病活动度密切相关,单核细胞计数可以作为潜在的UC生物标志物[7]。
UC临床表现为腹痛、腹泻、黏液脓血便、里急后重等,属于中医“泄泻”,“痢疾”,“肠澼”等范畴,葛根芩连汤(GQD)是治疗湿热所致腹泻和痢疾的经典方剂,被认为是治疗UC的经典良方[8]。GQD能调节肠道菌群及其代谢途径保护肠道[9]。但是其调节肠道菌群与炎性因子间相关性的机制仍不明确。因此,本研究旨在将肠道菌群和炎性因子相关联,探究GQD治疗UC小鼠的可能机制,为UC的防制及相关微生态制剂研发提供依据。
1 材料与方法
1.1 实验动物及分组48只SPF级BALB/c雄性小鼠[SCXK(辽)-2020-0001]购自辽宁长生生物科技股份有限公司。动物在(22±1)℃的温度,45%~65%的相对湿度下饲养,12 h光照/黑暗循环适应性饲养5 d后,将小鼠随机分为对照组(Control)、模型组(Model,4% DSS)、阳性药美沙拉嗪组(Mes,0.60 g/kg)、葛根芩连汤低剂量组(GQD-L,6.25 g/kg)、葛根芩连汤中剂量组(GQD-M,12.50 g/kg)、葛根芩连汤高剂量组(GQD-H,25.00 g/kg),每组8只。Control组正常给予饮食和饮水,其余各组给予4% DSS自由饮用6 d。随后,Mes组和GQD组每日灌胃相应药物治疗,Control和Model组灌胃0.9%生理盐水,每日1次,连续14 d,每天记录小鼠体质量和粪便状态及隐血情况。试验结束后处死小鼠收集结肠组织,结肠内容物及血用于后续分析。
1.2 试剂及药物制备葛根芩连汤由葛根15 g,黄芩9 g,黄连9 g,甘草6 g组成,均为中药配方颗粒,购自广东一方制药有限公司(0095453,0123763,0112593,0101713)。将所有配方颗粒混匀后加入蒸馏水分别配置成6.25,12.50,25.00 g/kg混悬液;葡聚糖硫酸钠(DSS,M.W.=36 000~50 000)购自MP Biomedicals(NO.S4140)。精密称定4 g DSS溶于100 mL蒸馏水中,配制成4% DSS溶液,每日现用现配。美沙拉嗪肠溶片购自葵花药业集团佳木斯鹿灵制药有限公司(200403),配制成0.60 g/kg水溶液;sIgA及LPS所需ELISA试剂盒购自FEIMOBIO公司(E20210701A);粪便隐血试剂盒购自雷根生物(0615A21);QIAamp®DNA Stool Mini Kit购自德国Qiagen,Hilden;MiSeq Reagent Kit v3试剂盒购自美国Illumina公司(MS-102-3003);Agencourt AMPure XP PCR Purification Beads购自美国Beckman Coulter公司(A-A63880);TopTap DNA聚合酶试剂盒购自Transgen(AP151-03)。
1.3 指标检测
1.3.1疾病活动指数(DAI) 通过小鼠体质量变化、粪便特征和粪便隐血试验计算DAI分数[10]。
1.3.2苏木精伊红(HE)染色和组织学分析 末次给药后,小鼠禁食不禁水12 h,颈椎脱臼法处死小鼠,结肠组织用4%多聚甲醛固定24 h,乙醇梯度洗脱,二甲苯浸泡,石蜡包埋后4 μm厚切片,苏木精伊红染色,镜下观察结肠损伤程度和炎性细胞浸润情况,进行组织学分析[11]。
1.3.3肠道菌群16S rRNA测序 收集结肠中粪便样品进行粪便基因组DNA提取,琼脂糖凝胶电泳检测DAN完整性。以341F:CCTACGGGNGGCWGCAG为上游引物,以805R:GACTACHVGGGTATCTAATCC为下游引物进行细菌16S rDNA的V3~V4区域PCR扩增。琼脂糖凝胶电泳和QuantiFluorTM-ST荧光定量系统用于纯化和定量检测PCR扩增产物[12]。纯化的PCR产物进行DNA文库构建,通过Genesky Biotechnologies Inc.(中国上海)在Illumina MiSeq平台进行样本2×250 bp双端测序和生物信息学分析。使用QIIME2、flash2和R等软件对Reads进行数据质控和统计,运用Usearch10进行Amplicon Sequence Variants(ASV)非聚类去噪,对质控拼接好的序列按照97%相似性进行OTU聚类分析,生成操作分类单元(OTU/ASV)[13]。基于OTU/ASV聚类分析结果,利用R对α、β多样性及群落物种组成差异性进行分析。
1.3.4炎性细胞因子检测 小鼠眼球取血置于EDTA抗凝管内,全自动血液分析仪检测MONO比例。按照ELISA试剂盒说明书,将收集的血液3 000 r/min 离心10 min分离血清,洗板后各孔分别加标准品和各组待测样品50 μL,辣根过氧化物酶(HRP)标记的检测抗体100 μL,封口膜封住37℃温育60 min,洗板后各孔加入底物A、B各50 μL,37℃避光孵育15 min,每孔加入终止液50 μL,测定D450值。
1.4 数据统计分析SPSS20.0统计软件单因素方差分析(ANOVA)检验各组数据,LSD法进行多重比较。使用QIIME2、R ggplot2(v3.3.0)进行肠道菌群多样性指数分析和多样本物种组成柱状图分析。P<0.05具有统计学意义。
2 结果
2.1 小鼠体质量及疾病活动指数(DAI)变化Control组小鼠饮水量、摄食量及毛色正常,大便成形,体质量逐渐上升,各造模组小鼠饮水及摄食量减少,背毛粗糙且无光泽,体质量下降,试验3 d出现便稀或便血现象。7 d,Model及Mes组各死亡1只小鼠,其余小鼠正常存活。治疗结束后,与Control组比较,Model组小鼠体质量显著下降(P<0.001),DAI评分显著上升(P<0.001)。与Model组比较,Mes组体质量上升(P<0.05),GQD-L组体质量升高(P<0.01),GQD-M、GQD-H组体质量显著升高(P<0.001),DAI评分均显著下降(P<0.001)(图1A,B)。
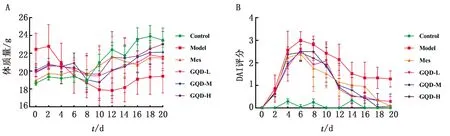
图1 不同给药对UC小鼠体质量(A)及DAI评分(B)的影响
2.2 组织病理学观察及评分结果如HE染色结果所示,Control组结肠组织黏膜上皮层完整,腺体结构清晰,隐窝完整,没有溃疡点;Model组结肠可见广泛的黏膜损伤和溃疡,黏膜及黏膜下层有大量炎性细胞浸润,腺体及隐窝缺失;Mes组结肠组织部分腺体恢复;GQD各组结肠组织溃疡情况较Model组明显改善,仅有少量炎性细胞浸润(图2A)。对结肠病理损伤进行评分,Model组的组织学评分显着高于Control组(P<0.001),与Model组比较,Mes及GQD各组可显著抑制结肠组织损伤(P<0.001),其中GQD-H组效果最显著(图2B)。
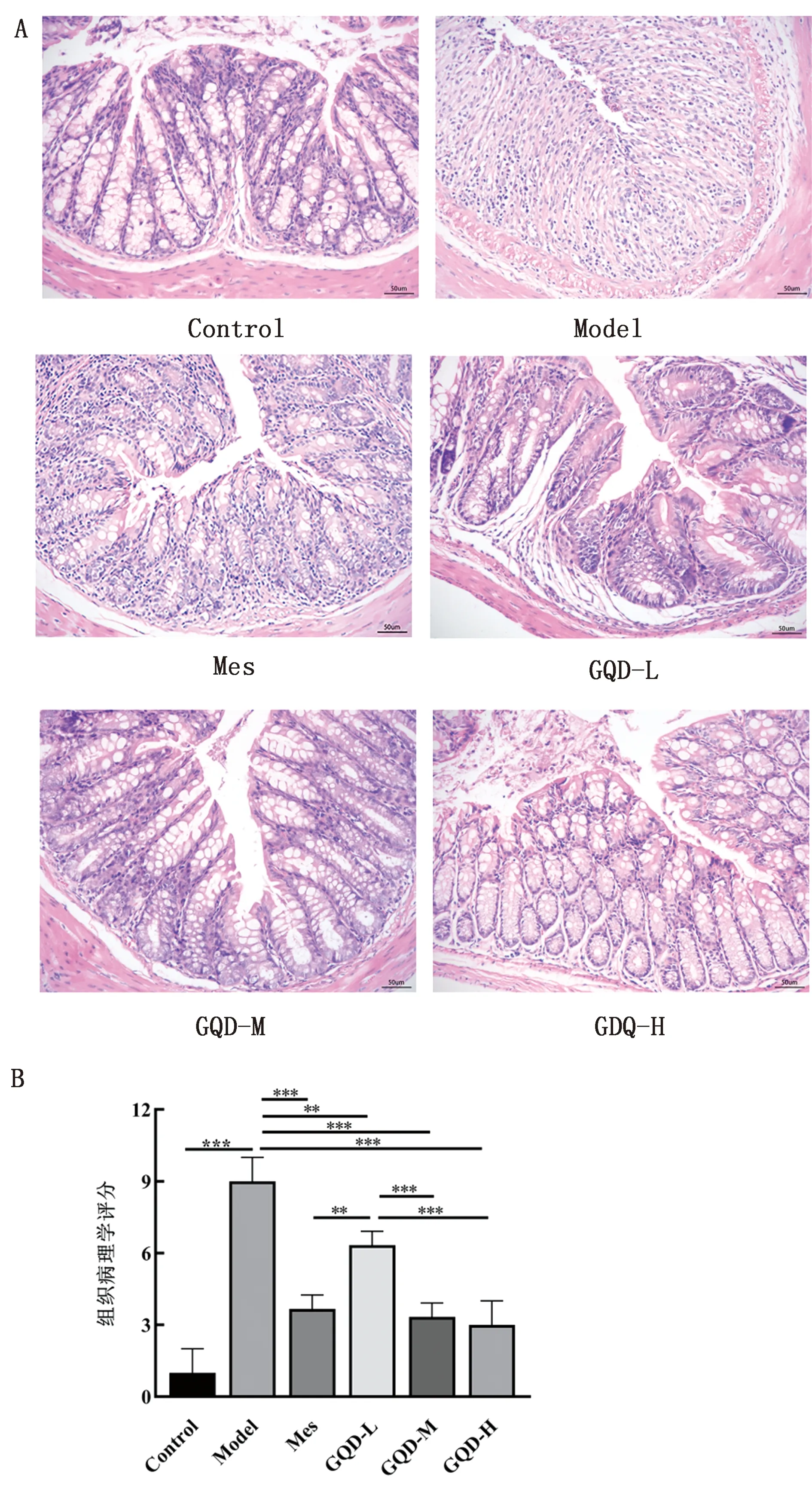
A.小鼠结肠组织HE染色(×200);B.组织病理学评分;*P<0.05;**P<0.01;***P<0.001。下同
2.3 葛根芩连汤对UC小鼠肠道菌群的影响
2.3.1多样性分析 以抽取的序列数及其对应的多样性指数构建Shannon-Wiener曲线,随着测序数据量的增加曲线趋于平坦,说明测序数据量足够大,可以反映样本中绝大多数的微生物信息(图3A)。采用OTU Venn图分析菌群OTU数量及其种类交叉情况,Control和Model组的总 OTU分别为616,612个,特异性 OTU 分别为84,80个,共有 OTU为532个,占总OTU数的76.44%。与Control组比较,Model组肠道菌群物种丰度降低(图3B)。

A.样品Shannon-Wiener曲线;B.Venn图
2.3.2门水平物种组成差异 门水平上各组小鼠肠道菌群主要由厚壁菌门(Firmicutes),(各组占比60.231 9%,44.866 4%,54.479 1%,50.342 4%,52.925 3%,52.560 0%),拟杆菌门(Bacteroidetes)(各组占比24.996 0%,36.009 7%,24.103 2%,39.295 0%,28.724 7%,33.303 1%),变形菌门(Proteobacteria)(各组占比7.132 1%,10.259 4%,9.236 7%,4.988 0%,6.675 3%,5.335 6%)和放线菌门(Actinobacteria)(各组占比3.681 6%,2.206 0%,4.146 6%,1.469 8%,2.262 7%,1.607 4%)组成。与Control组比较,Model组小鼠的Firmicutes(P<0.001)和Actinobacteria(P<0.05)比例降低,Bacteroidetes(P<0.01)和Proteobacteria(P>0.05)比例升高,治疗后部分菌群回调。Firmicutes与Bacteroidete比值(F/B)被证明与UC病程相关[14]。本研究中Model组F/B降低,符合UC肠道菌群失调的病理特征,经Mes及不同浓度GQD干预后,F/B均上升(图4A~D)。

A~D.不同给药对UC小鼠Firmicutes,Bacteroidetes,Proteobacteria和Actinobacteria的影响
2.3.3属水平物种组成差异 为进一步比较组间差异菌群,本试验基于属水平以P<0.05作为差异显著性筛选阈值,分析各组中具有显著差异的物种,结果发现乳酸杆菌属(Lactobacillus)、韦荣球菌科未定属(Erysipelotrichaceae_incertae_sedis)、埃希菌/志贺菌属(Escherichia/Shigella)和肠球菌属(Enterococcus)是组间差异较大菌属。与Control组比较,Model组Lactobacillus比例降低15.678 1%(P<0.001),其余3种菌属比例分别上升0.110 8%(P<0.001),0.090 0%(P<0.001)和0.023 9%(P<0.001)。与Model组比较,Mes组Lactobacillus比例升高5.754 4%(P>0.05),其余3种菌属比例分别下降0.117 9%(P<0.001),0.090 2%(P<0.001)和0.023 5%(P<0.001)。GQD-L组与Model组比较,Lactobacillus比例上升9.97%(P<0.05),Erysipelotrichaceae_incertae_sedis、Escherichia/Shigella和Enterococcus比例分别下降0.088 1%(P<0.01),0.090 7%(P<0.001)和0.030 6%(P<0.001)。GQD-M组与Model组比较,Lactobacillus比例上升2.920 0%(P>0.05),另3种菌属比例分别下降0.118 1%(P<0.001),0.062 7%(P<0.01)和0.026 2%(P<0.001)。GQD-H组与Model组比较,Lactobacillus比例上升8.087 8%(P>0.05),另3种菌属比例分别下降0.115 2%(P<0.001),0.091 3%(P<0.001)和0.030 6%(P<0.001)。4种菌属在Mes组和不同GQD组间均无显著性差异(P>0.05)(表1)。

表1 属水平小鼠肠道差异菌群丰度 %
2.4 葛根芩连汤对UC小鼠炎症因子的调节作用与Control组比较,Model组小鼠MONO比例(P<0.01)及LPS水平(P<0.001)升高,sIgA水平(P<0.001)水平降低。与Model组比较,经Mes干预后,MONO比例下降(P<0.05),sIgA水平上升(P<0.001)。GQD-L组对3种炎性因子水平无显著性影响(P>0.05)。GQD-M组降低MONO比例(P<0.05)和LPS水平(P<0.05),升高sIgA水平(P<0.01)。GQD-H组降低MONO比例(P<0.05)和LPS水平(P<0.01),升高sIgA水平(P<0.01)(图5A~C)。

A.MONO比例变化;B.LPS水平变化;C.sIgA水平变化
3 讨论
在UC的治疗中,以GQD为主的中药复方在治疗方法总有效率、不良反应发生率方面优于西药[15]。GQD能够通过改善肠道炎症反应和修复肠道黏膜屏障显著治疗UC[16-17]。在这项研究中,发现UC小鼠毛发稀疏无光泽,体质量减轻,DAI评分升高,大便松散不成形,腹泻甚至便血。HE染色观察到小鼠结肠组织溃疡点,局部隐窝消失,腺体不完整及大量炎性细胞浸润。GQD可明显改善DSS所诱导的UC的病理症状,表现DAI评分和组织病理学评分降低,结肠组织溃疡点及炎性细胞浸润减少等。
UC患者的肠道菌群失调是肠道黏膜损伤的主要因素,也是衡量病程的参数之一[18]。本研究发现UC小鼠的肠道菌群多样性及F/B比值降低,与先前报道一致[19]。GQD提高了F/B比值,调节了菌群失衡状态。在门水平,各组小鼠肠道菌群主要由Firmicutes,Bacteroidetes,Actinobacteria和Proteobacteria组成。在属水平,GQD主要通过调节Lactobacillus、Erysipelotrichaceae_incertae_sedis、Escherichia/Shigella和Enterococcus水平发挥作用。Lactobacillus是肠道中的优势有益菌群,能拮抗致病菌,保持机体健康状态[20]。Erysipelotrichaceae与肠道炎症密切相关,研究表明小鼠中-重度回肠炎及结肠炎急性炎症期时肠道菌群多样性降低,Erysipelotrichaceae丰度增加[21]。用促炎因子TNF诱导引发CD样小鼠结肠透壁性炎症时,Erysipelotrichaceae的丰度也显著增加,表明Erysipelotrichaceae和 TNF水平有相关性[22]。另有研究探讨了包括 UC、CD、伪膜性结肠炎和结肠癌的3 048个公共数据库的人类肠道炎症疾病菌群表达谱,发现肠道发生炎症疾病时Erysipelotrichaceae家族丰度增高[23]。这些研究都表明Erysipelotrichaceae与UC密切相关,并且能促进肠道炎症发展。运用四氯化碳预处理豚鼠后灌入Escherichia/Shigella,豚鼠们表现出了致命的肠道感染。同样有研究检测UC患者肠道菌群,发现其肠道微生态失调主要表现为Escherichia/Shigella丰度增加,与本研究结果一致[24]。Enterococcus是肠道表层的代表菌群,在特定条件下能直接侵袭机体,导致机体发病[25]。Enterococcus在小鼠模型中促进结肠炎的发生,与健康人相比,UC患者的Enterococcus数量增加[26]。本试验结果与上述理论相符,提示GQD升高了有益菌丰度,降低了有害菌丰度,调节了UC小鼠的肠道菌群失衡状态。
肠道菌群失调通过引发肠道黏膜持续慢性炎症以及免疫异常促进UC的发生[27]。研究发现肠道菌群紊乱会导致LPS释放菌以及肠道LPS释放增加,使肠道摄入更多LPS入血并持续激活炎症通路,LPS可能是肠道菌群激发炎症反应的源头,因此LPS在UC的发展中极其重要[28]。sIgA可以中和LPS,防止细菌黏附于肠壁上,UC发病时sIgA的分泌受到抑制,肠道的抗菌定植能力减弱,有利于LPS和细菌入侵体内。sIgA通过促进细菌凝集,阻断病原体对黏膜的黏附,同时调节肠道微生物群结构维持肠腔内稳态,在肠道黏膜免疫中发挥主要作用[29]。研究表明,UC患者肠道免疫屏障受损是由于sIgA分泌障碍,减少的sIgA使病原体黏附增加,引起肠道稳态失衡,肠道黏膜受损后,肠道屏障通透性增加,进入肠道的细菌、LPS等抗原成分增多,引起炎症反应和组织破坏[30]。严伟等[31]通过研究不同严重程度的UC患者MONO计数,结果提示其与UC严重程度具有重要关系。本研究发现GQD可以回调UC小鼠MONO,LPS及sIgA水平。已知Mes主要通过抑制炎症反应治疗UC,本试验中GQD-M和GQD-H组与Mes对炎性因子的影响无显著差别,表明GQD同样有效抑制了UC的炎症反应,但GQD具体调节哪些信号通路发挥作用仍需进一步研究。
综上所述,GQD可有效修复UC结肠病变程度,升高肠道中有益菌丰度,降低有害菌丰度,调节菌群失衡状态,从而降低菌群紊乱造成的LPS水平升高,同时增加sIgA水平发挥抗炎作用。这将为UC临床上的新药研发提供理论依据。
