巨胞饮途径介导的新冠原始株病毒蛋白入胞的细胞水平初步研究
2022-10-21杨于权陈曜星侯照远高小玲陈红专
江 淦,杨于权,陈曜星,侯照远,高小玲,陈红专,3#,贾 浩#
1.上海交通大学基础医学院药理学与化学生物学系,上海高校转化医学协同创新中心,上海 200025;2.上海交通大学基础医学院生物化学与分子细胞生物学系,上海市肿瘤微环境与炎症重点实验室,上海 200025;3.上海中医药大学交叉科学研究院,上海 201203
严重急性呼吸综合征(severe acute respiratory syndromes,SARS)冠状病毒和中东呼吸综合征冠状病毒均可诱导持续的巨胞饮作用,而抑制该作用可降低相关的病毒滴度[1]。值得注意的是,细胞因子、趋化因子和脂多糖(lipopolysaccharide,LPS)均可诱导炎症细胞的巨胞饮作用,提示合并感染或者炎症因子风暴会进一步加强细胞的巨胞饮作用[2-3]。此前已有预测发现,严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)的蛋白与人细胞蛋白之间存在蛋白-蛋白相互作用,且与细胞骨架和许多其他功能蛋白密切相关[2,4]。因此,探索SARS-COV-2 原始株蛋白对促进细胞尤其是炎症相关细胞的巨胞饮作用具有重要的价值和意义。
巨胞饮是一种高度保守的内吞途径,蛋白质、生长因子、细胞因子、病毒等胞外物质通过刺激细胞膜形成褶皱,进而形成可被内化的巨胞饮囊泡。在细胞中,巨胞饮受多种与肌动蛋白、微丝重构、皱褶形成、囊泡形成等相关的基因的调控。正常状态下,巨胞饮作用与细胞生长、抗原提呈、凋亡细胞清除等有关[5-7]。而在病理状态(如肿瘤、炎症等)下,巨胞饮作用将会被上调[8-9],尤其是在囊膜病毒(如冠状病毒、流感病毒、HIV病毒、埃博拉病毒等)中。这些病毒可利用巨胞饮途径进入细胞,在病毒感染后4 h即可启动复制,而在病毒衣壳蛋白、核苷酸物质完全进入细胞后更加显著,并在病毒复制、细胞间传播中起到重要作用,该过程与囊膜表面的糖蛋白、病毒表面蛋白促进宿主细胞的巨胞饮作用均有关联[10-13]。因此,SARS-COV-2原始株表面及其入侵相关的病毒蛋白是否能够促进细胞的巨胞饮作用需要进一步的探索。
基于此,本研究通过免疫共沉淀技术、高内涵筛选、共聚焦显微成像、流式细胞术等分析原始株SARS-CoV-2 的表面蛋白——刺突蛋白受体结合域(spike protein receptor-binding domain,S-RBD)、核衣壳蛋白(nucleocapsid protein,N)和SARS-CoV-2的入侵相关蛋白——非结构蛋白7(non-structural protein-7,NSP7)等病毒蛋白与细胞内蛋白的相互作用,及与多种细胞模型的巨胞饮水平的关系。同时,在本课题组的前期研究[14-15]中,我们已建立了可递送干扰小RNA(small interfering RNA,siRNA)的脂蛋白纳米药物载体平台,该系统可通过巨胞饮作用被靶细胞内化。因此,本研究再利用5-(N-乙基-N-异丙基)阿米洛利(EIPA,一种巨胞饮的内吞作用抑制剂)、载带Rab5siRNA 的磷酸钙-重组高密度脂蛋白(CaP-rHDL)纳米药物载体共2 种方式干扰巨胞饮水平,以分析细胞对病毒蛋白的摄取情况,从而为可能的抑制巨胞饮作用的潜在先导药物研究提供筛选通路。
1 材料和方法
1.1 实验材料
1.1.1 细胞及质粒 人胚肾细胞HEK-293T、小鼠脑微血管内皮细胞bEnd.3 均购自美国菌种保藏中心,人支气管上皮细胞Beas-2b 由上海交通大学基础医学院沈瑛课题组惠赠。表达质粒His-SARS-CoV-2 SRBD、His-SARS-CoV-2 N 和His-SARS-CoV-2 NSP7均由上海交通大学系统生物医学研究院陶生策教授惠赠。
1.1.2 主要试剂 His(sc-8036)抗体、Rab5(sc-46692)抗体均购自美国Santa Cruz 公司,快速银染试剂盒(P0017S)购自上海碧云天生物技术有限公司,1,2-油酰基磷脂酸(DOPA)、1,2-二肉豆蔻酰-SN-甘油-3-磷酰胆碱(DMPC)均购自美国Avanti Polar Lipids 公司,重组人载脂蛋白E3(apoliprotein E3,ApoE3)购自美国派普泰克公司,质粒提取试剂盒、凝胶回收试剂盒均购自美国Axygene公司,RNA提取试剂、BCA 蛋白定量试剂盒和探针法荧光定量PCR 试剂盒(qPCR Mix)均购自翌圣生物科技(上海)股份有限公司。
1.2 实验方法
1.2.1 纳米药物载体的制备 采用反相微乳法制备载有Rab5siRNA 的磷酸钙药物核心,并进一步与4 mg DMPC 混合。37 ℃下,将该混合物于旋蒸仪(德国,Büchi)上(100 r/min)旋蒸1 h 以去除氯仿,并形成含磷酸钙药物的磷脂薄膜。将获得的脂质膜用4 mL 双蒸水进行水化,并行短暂的超声处理。而后,将上述脂质体与ApoE3于37 ℃下孵育36 h(ApoE3与DMPC的质量比为1∶8),以获得载带Rab5siRNA 的磷酸钙-重组高密度脂蛋白(CaP-rHDL)纳米药物载体。
1.2.2 重组蛋白的表达与纯化 将表达质粒His-SARS-CoV-2 S-RBD、His-SARS-CoV-2 N 原 始 株 和His-SARS-CoV-2 NSP7 分别转入大肠埃希菌E.coliBL21 感受态细胞中,经倒置培养后将获得的阳性克隆接种于5 mL LB 液体培养基(含100 μg/mL 羧苄青霉素),并于37 ℃、180 r/min 下震荡3 h。当细菌培养液D(600 nm)达到0.6~0.8 时,分别向其中加入0.2 μmmol/L IPTG,并于150 r/min摇床上16 ℃过夜。经离心后,将细菌沉淀重悬于裂解缓冲液[含50 μmol/L Tris-HCl (pH 8.0)、500 μmol/L NaCl 和20 μmol/L咪唑(pH 8.0)]中。将裂解后的上述3种菌体上清液分别经镍柱琼脂糖珠纯化后,再用裂解缓冲液进行洗涤,最后用1 mL 缓冲液[含50 μmol/L Tris-HCl(pH 8.0)、500 μmol/L NaCl 和300 μmol/L咪唑(pH 8.0)]洗脱后冻存。
1.2.3 质谱法鉴定SARS-CoV-2 原始株的S-RBD、N、NSP7病毒蛋白的互作蛋白 将SARS-CoV-2原始株的S-RBD、N、NSP7病毒蛋白分别与HEK-293T细胞 共 孵 育 后 , 采 用 免 疫 共 沉 淀 (coimmunoprecipitation) 和蛋白质印迹法(Western blotting)分析与病毒蛋白相互作用的胞内蛋白;其中,前者分别使用His抗体和Rab5抗体进行富集,后者采用8%的分离胶进行蛋白纯化,具体步骤见前期研究[16]。随后,用质谱法(Mass Spectrometry,MS)检测与原始株病毒蛋白发生相互作用的蛋白。本实验所用蛋白组学检测及分析均委托上海交通大学医学院基础医学公共技术平台——蛋白组学平台完成。
1.2.4 SARS-CoV-2 原始株的病毒蛋白的细胞摄取和巨胞饮水平分析
(1)高内涵筛选:分别将HEK-293T、bEnd.3 和Beas-2b 细胞(正常细胞模型)接种至96 孔板中,并于37 ℃、5%CO2条件下培养过夜。将上述3 种细胞分别与SARS-CoV-2 原始株的病毒蛋白(S-RBD、N和Nsp7)或DMEM 培养基在37 ℃下孵育1.5 h 或8.5 h, 再分别向其中添加异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的70 kDa 葡聚糖(FITC-70 kDa-葡聚糖,即巨胞饮特异性标志物)后共培养1.5 h。将上述细胞进行洗涤、4%甲醛固定后,于高内涵筛选进行分析。
(2)共聚焦显微成像及流式细胞仪分析:将HEK-293T细胞(正常细胞模型)分别接种至96孔板或12 孔板中,于37 ℃、5%CO2条件下培养过夜。取1 μg/mL LPS 与HEK-293T 细 胞 共 孵 育24 h,获 得LPS诱导的炎症细胞模型。将上述正常细胞、炎症细胞分别与75 μmol/L EIPA 或DMEM 培养基预孵育0.5 h,再分别与SARS-CoV-2 原始株的病毒蛋白(SRBD、N 和Nsp7)于37 ℃下孵育1.5 h,而后分别向其中添加FITC-70 kDa-葡聚糖,共培养1.5 h。经固定后,将上述细胞分别与His 抗体共孵育过夜,再行荧光二抗孵育,于共聚焦显微镜下观察细胞的荧光水平,再利用Image J软件对共聚焦图像中的荧光强度进行分析;或通过流式细胞仪检测上述细胞的荧光水平,以反映细胞的巨胞饮水平及病毒蛋白入胞的变化。
1.2.5 经纳米药物载体处理后细胞的巨胞饮水平分析 将载带Rab5siRNA 的磷酸钙-重组高密度脂蛋白(CaP-rHDL)纳米药物载体与HEK-293T 细胞孵育12 h 后,采用实时荧光定量PCR(quantitative realtime PCR,qPCR)和Western blotting 分析Rab5的表达,以验证其敲低水平。而后,以Rab5被抑制的HEK-293T细胞为对象,将其分别与3个SARS-CoV-2原始株的病毒蛋白于37 ℃下孵育1.5 h,添加FITC-70 kDa-葡聚糖后共培养1.5 h,于流式细胞仪检测上述细胞的荧光水平变化。Rab5siRNA 由上海吉玛制药技术有限公司合成,序列如表1。

表1 Rab5 siRNA序列Tab 1 Sequences of Rab5 siRNA
1.3 统计学方法
采用SPSS 19.0 软件对数据进行统计分析。采用皮尔森相关系数对细胞的共聚焦图像进行分析,表征His 标签的病毒蛋白与巨胞饮囊泡(FITC-70 kDa-葡聚糖)的共定位水平。采用单因素方差分析(oneway ANOVA)、双因素方差分析(two-way ANOVA)对细胞荧光水平进行比较,并采用Bonferroni 进行检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 SARS-CoV-2原始株的S-RBD、N和NSP-7入胞后与Rab家族蛋白结合
本研究用表达质粒His-SARS-CoV-2 S-RBD、His-SARS-CoV-2 N 和His-SARS-CoV-2 NSP7原始株模拟病毒蛋白感染的过程,分析病毒蛋白在HEK-293T原始株细胞中的表达。Western blotting检测结果(图1)显示,经纯化和表达的His-S-RBD、His-N和His-NSP7蛋白具有良好的特异性,与之前的报道[17]相一致。

图1 Western blotting 检测His-S-RBD、His-N 和His-NSP7 蛋白的纯化表达Fig 1 Detection of purified expressions of His-S-RBD, His-N and His-NSP7 proteins by Western blotting
随后,在HEK-293T 细胞中利用免疫共沉淀技术分析与S-RBD、N 和NSP7 病毒蛋白的互作蛋白,经纯化、分离、银染后我们发现互作蛋白存在不同的条带(图2A);继而表明,SARS-CoV-2 原始株的3 个病毒蛋白可与细胞内多种蛋白发生相互作用。通过MS 对上述条带进行分析,我们鉴定得到了大量的互作蛋白,其中Rab小GTPase超家族分别与3个病毒蛋白的结合数量均较多,即与S-RBD 蛋白结合了101 个、与N 蛋白结合了97 个、与NSP7 蛋白结合了111个(图2B)。进一步我们发现,在与NSP7结合的Rab 小GTPase 超家族中,Rab5 的表达量最高(图2C),且先前研究[18]提示Rab5 参与了巨胞饮的调控过程,故本研究提示病毒蛋白入胞后可能参与调控巨胞饮通路。此观点有待进一步验证。
随后,免疫共沉淀实验中我们利用His 抗体进行富集,再采用Western blotting 对富集结果进行检测,结果(图2D)显示SARS-CoV-2 原始株的病毒蛋白(S-RBD、N 和NSP7)在HEK-293T 细胞中均可与内源性Rab5 蛋白相互作用;且与S-RBD、N 蛋白相比,SARS-CoV-2原始株的NSP7蛋白与Rab5的结合更强。与此同时,我们利用Rab5 抗体进行富集后再行Western blotting 检测,结果(图2E)显示,内源性Rab5 蛋白也能与SARS-CoV-2 原始株蛋白(S-RBD、N和NSP7)相结合。

图2 SARS-COV-2原始株的S-RBD、N和NSP7蛋白与Rab5小GTPase家族蛋白的相互作用Fig 2 Interaction between S-RBD,N and NSP7 proteins of SARS-COV-2 and Rab5 small GTPase family proteins
2.2 SARS-CoV-2原始株的S-RBD、N和NSP-7蛋白可以增强HEK-293T/bEnd.3/Beas-2b 细胞的巨胞饮水平
于体外检测SARS-CoV-2 原始株的关键蛋白(SRBD、N 和NSP7)能否刺激3 种正常细胞模型产生巨胞饮作用。本研究利用高内涵筛选分析细胞模型内化FITC-70 kDa-葡聚糖后的荧光水平。在HEK-293T细胞模型中,共聚焦显微成像显示,分别与S-RBD、N 和NSP7 病毒蛋白孵育3 h 后的细胞内化FITC-70 kDa-葡聚糖的能力均高于DMEM 组(均P<0.05,图3A、3B);且S-RBD、N 和NSP7 病毒蛋白被摄取入胞后,均可与FITC-70 kDa-葡聚糖共定位(图3C、3D)。流式细胞术的结果(图3E)同样显示,在分别与3 个病毒蛋白孵育3 h 后,细胞的巨胞饮作用均有所增强。综合上述结果我们发现,SARS-COV-2 原始株的S-RBD、N 和NSP7 病毒蛋白可刺激HEK-293T细胞的巨胞饮作用。
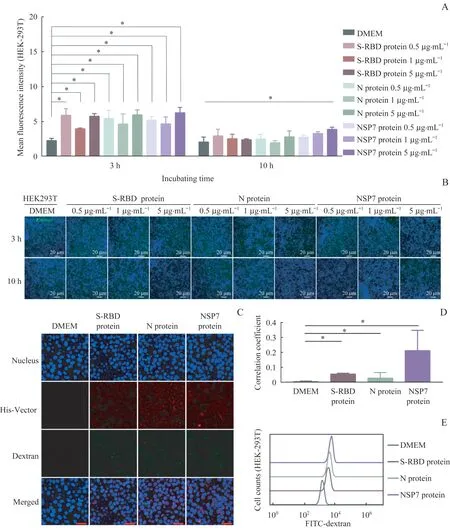
图3 SARS-COV-2原始株的S-RBD、N和NSP7蛋白刺激HEK-293T细胞的巨胞饮作用Fig 3 S-RBD,N and NSP7 proteins of SARS-COV-2 stimulated the macropinocytosis in HEK-293T cells
同时,在bEnd.3细胞模型、Beas-2b细胞模型中,共聚焦显微镜结果(图4A~4D) 显示,分别与SARS-COV-2 原始株的S-RBD、N 和NSP7 病毒蛋白孵育后,上述2 种细胞的胞内FITC-70 kDa-葡聚糖水平也有显著上调。流式细胞术分析结果(图4E、4F)亦显示,分别与3个病毒蛋白孵育3 h后,该2种细胞的巨胞饮水平均有所增强。
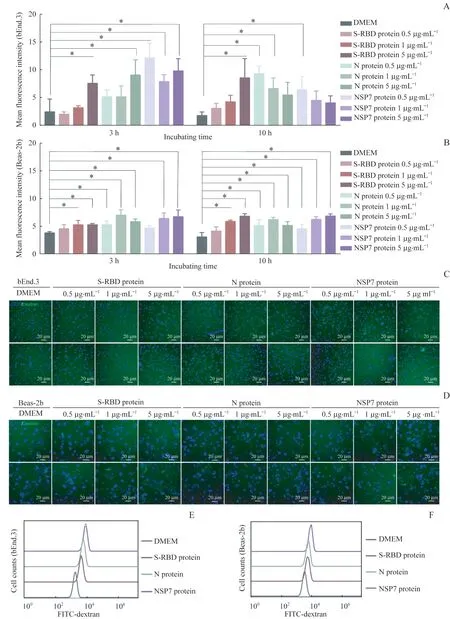
图4 SARS-COV-2原始株的S-RBD、N和NSP7蛋白刺激bEnd.3和Beas-2b细胞的巨胞饮作用Fig 4 S-RBD,N and NSP7 proteins of SARS-COV-2 stimulated the macropinocytosis in bEnd.3 and Beas-2b cells
2.3 SARS-CoV-2原始株的S-RBD、N和NSP-7蛋白可以增强LPS诱导的炎症细胞的巨胞饮水平
本研究进一步分析相关病毒蛋白对炎症细胞的巨胞饮作用。共聚焦显微成像结果(图5A、5B)显示,分别与原始株S-RBD、N 和NSP7 病毒蛋白孵育后,LPS 诱导的HEK-293T 细胞的巨胞饮作用均有明显上升;且S-RBD、NSP7 病毒蛋白与FITC-70 kDa-葡聚糖有明显的共定位,而N 病毒蛋白共定位的系数较低。流式细胞术分析的结果(图5C)显示,LPS 诱导的HEK-293T 细胞在分别与S-RBD 原始株、N 和NSP7 病毒蛋白孵育后,其摄取的FITC-70 kDa-葡聚糖的水平较未经LPS 诱导的HEK-293T 细胞有显著升高。这些结果均提示,SARS-CoV-2 原始株的病毒蛋白可诱导多种细胞特别是炎症细胞的巨胞饮作用,且在合并炎症的情况下可能会进一步加强细胞对病毒蛋白的摄取能力。

图5 SARS-CoV-2原始株的S-RBD、N和NSP-7蛋白刺激LPS诱导的炎症细胞的巨胞饮作用Fig 5 S-RBD,N and NSP7 proteins of SARS-COV-2 stimulated the macropinocytosis in LPS-induced inflammatory cells
2.4 EIPA 可以抑制由SARS-CoV-2 原始株的SRBD、N 和NSP-7 蛋白刺激的正常及炎症细胞的巨胞饮水平
采用共聚焦显微成像和流式细胞术就巨胞饮抑制剂——EIPA 对病毒蛋白刺激的巨胞饮水平的抑制作用及对His 标记的病毒蛋白进入细胞模型的抑制作用进行分析。在EIPA 的预处理下,无论是正常细胞还是LPS 诱导的炎症细胞,由S-RBD、N 和NSP7 原始株病毒蛋白刺激的巨胞饮水平都受到了显著抑制(图6A、6B)。这一结果表明,EIPA 可以通过抑制细胞巨胞饮水平来抑制病毒蛋白的入胞。
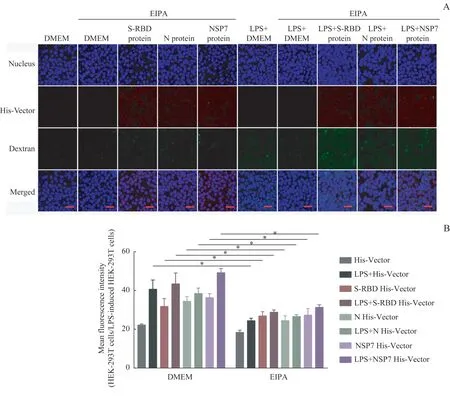
图6 EIPA抑制正常细胞、LPS诱导的炎症细胞的巨胞饮水平,以及His标记的SARS-CoV-2原始株病毒蛋白的摄入Fig 6 EIPA could inhibit the macropinocytosis level in normal cells and LPS-induced inflammatory cells, and the uptake of His-labeled SARS-CoV-2 proteins
2.5 Rab5 siRNA 纳米载体可以抑制由SARS-CoV-2原始株的S-RBD、N 和NSP-7蛋白刺激的巨胞饮水平
将载带Rab5siRNA的纳米药物载体与HEK-293T细胞共孵育后,分别采用qPCR 和Western blotting 进行检测,结果(图7A、7B)发现细胞中的Rab5的mRNA及蛋白表达均被有效抑制。随后,利用流式细胞仪检测被抑制Rab5表达的细胞分别与3 个病毒蛋白孵育后的巨胞饮水平变化,结果(图7C)显示,在100 nmol/L siRab5-1浓度孵育12 h后,Rab5siRNA纳米药物载体可有效抑制由该3 个病毒蛋白引起的细胞巨胞饮作用。因此,综合上述结果我们推测,Rab5可能是抑制由SARS-CoV-2原始株的病毒蛋白诱导细胞巨胞饮上调的潜在靶点。
图7 Rab5 siRNA纳米药物载体抑制由SARS-COV-2原始株的病毒蛋白上调的细胞巨胞饮作用Fig 7 Lipoprotein nano-drug carriers loaded with Rab5 siRNA could inhibit the macropinocytosis level up-regulated by SARS-COV-2 viral proteins
3 讨论
本研究表明,SARS-CoV-2原始株相关病毒蛋白可上调多种正常细胞和LPS诱导的炎症细胞中的巨胞饮水平,在有囊膜病毒入胞后,病毒蛋白与细胞内的正常蛋白可相互作用。同时,我们还发现利用巨胞饮抑制剂——EIPA和之前建立的Rab5siRNA脂蛋白纳米药物载体均可有效减少相关病毒蛋白上调的巨胞饮过程。
巨胞饮途径在多种细胞的病理生理过程中发挥着重要作用,并受到多种胞外物质的调控[19]。目前,SARS-CoV-2原始株已被证明能够通过巨胞饮作用的方式形成病毒复制复合物以修饰细胞质膜[1,20]。且相关研究[21]显示,包括SARS-CoV-2在内的多种病毒均可利用巨胞饮途径进入细胞,这种入侵方式可适应其颗粒的大小并实现免疫逃逸。我们推测,SARS-CoV-2原始株可能存在同样的细胞侵入方式。但由于实验条件的限制,本研究只能探索SARS-CoV-2 原始株的关键几种病毒蛋白与模型细胞孵育后的相互作用,结果显示在有囊膜病毒入胞后确实存在蛋白质-蛋白质的相互作用。有研究[4]已发现Rab家族可能参与了这种相互作用,将SARS-CoV-2 原始株病毒携带至细胞器;继而提示,该家族可能是一种关键的下游蛋白,能够进一步刺激细胞产生巨胞饮。
除此之外,新型冠状病毒肺炎(corona virus disease 2019,COVID-19)重症患者的细胞因子风暴程度远高于轻症患者,且细胞因子风暴与疾病的严重程度密切相关[22]。与正常细胞相比,炎症细胞具有更高水平的巨胞饮作用,小G蛋白超家族小分子鸟苷三磷酸酶在LPS诱导的炎症细胞模型中更为丰富和活跃。因此,SARS-CoV-2 原始株的病毒蛋白是否会导致炎症细胞内的巨胞饮水平显著上升,使得在感染后期病毒进入细胞的数量增加,导致进一步的感染从而形成恶性循环,值得我们继续探索。
在肿瘤细胞中,该类细胞可利用显著增加的巨胞饮途径大量摄取入胞的药物制剂,使得正常细胞与肿瘤细胞间存在摄取差异,从而实现靶向肿瘤的给药。而在炎症细胞中,同样存在被上调的巨胞饮机制,因此同样可以利用炎症细胞主动摄取通过巨胞饮途径入胞的药物制剂,提高对炎症细胞的主动靶向给药效率。由于SARSCoV-2原始株的病毒蛋白确实可以刺激炎症细胞更高水平的巨胞饮囊泡形成,因此,我们采用定制的脂蛋白纳米药物载体作为工具,利用其巨胞饮这一主要摄取途径,将siRab5输送到这些模型细胞中,抑制Rab5的水平从而抑制蛋白-蛋白的相互作用。此外,EIPA是一种临床批准的利尿剂,同样也可以抑制细胞的巨胞饮水平,从而抑制病毒的入胞,然而该药物在肺部和靶细胞的富集尚不如纳米药物载体的靶向富集效果。由于条件受限,本研究尚无法进一步完成假病毒实验和体内试验的验证,且近期有报道提示EIPA仅在较高浓度时(80 μmol/L)可对Spike的假病毒模型入侵293T细胞有抑制效果,但在体内、合并炎症感染或重症炎症因子风暴产生时是否有更明显的差异,还需进一步的探索。总之,本研究提示了巨胞饮机制在SARS-CoV-2原始株感染中的作用以及抑制该机制的潜在靶点,或将为有针对性的先导药物筛选提供参考。
利益冲突声明/Conflict of Interests
所有作者声明不存在利益冲突。All authors disclose no relevant conflict of interests.
作者贡献/Authors'Contributions
江淦、贾浩参与了实验设计、实验验证和论文写作;杨于权、陈曜星协助完成实验验证;侯照远、高小玲、陈红专、贾浩和江淦参与了论文的写作和修改。所有作者均阅读并同意了最终稿件的提交。
The study was designed and verified by JIANG Gan and JIA Hao.The manuscript was written by JIANG Gan and JIA Hao. The experiments were carried out by YANG Yuquan and CHEN Yaoxing. The manuscript was drafted and revised by HOU Zhaoyuan,GAO Xiaoling,CHEN Hongzhuan,JIA Hao and JIANG Gan. All the authors have read the last version of paper and consented for submission.
·Received:2022-03-16
检测工作贯穿于沥青混凝土路面施工的全过程,碾压成型后的路面必须满足设计及规范的要求。检测内容包括:平整度、厚度、宽度、高程等。钻芯取样的试件送到试验室后,要做马歇尔试验及其他试验,根据试验结果,准确评价沥青混凝土路面的物理力学性能。检测项目主要包括:压实度、空隙率、容重、稳定度、流值等。
·Accepted:2022-05-18
·Published online:2022-06-29
参·考·文·献
[1] FREEMAN M C, PEEK C T, BECKER M M, et al. Coronaviruses induce entry-independent, continuous macropinocytosis[J]. mBio,2014,5(4):e01340-e01314.
[2] XU J R, YANG Y Q, HOU Z Y, et al. TRPV2-spike protein interaction mediates the entry of SARS-CoV-2 into macrophages in febrile conditions[J]. Theranostics,2021,11(15):7379-7390.
[3] REDKA D S, GÜTSCHOW M, GRINSTEIN S, et al. Differential ability of proinflammatory and anti-inflammatory macrophages to perform macropinocytosis[J]. Mol Biol Cell,2018,29(1):53-65.
[4] GORDON D E,JANG G M,BOUHADDOU M,et al. A SARS-CoV-2 protein interaction map reveals targets for drug repurposing[J]. Nature,2020,583(7816):459-468.
[5] PACITTO R, GAETA I, SWANSON J A, et al. CXCL12-induced macropinocytosis modulates two distinct pathways to activate mTORC1 in macrophages[J]. J Leukoc Biol,2017,101(3):683-692.
[6] WEST M A, WALLIN R P A, MATTHEWS S P, et al. Enhanced dendritic cell antigen captureviatoll-like receptor-induced actin remodeling[J]. Science,2004,305(5687):1153-1157.
[8] COMMISSO C, DAVIDSON S M, SOYDANER-AZELOGLU R G,et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells[J]. Nature,2013,497(7451):633-637.
[9] WANG H B,ZHANG H,ZHANG J P,et al. Neuropilin 1 is an entry factor that promotes EBV infection of nasopharyngeal epithelial cells[J].Nat Commun,2015,6:6240.
[10] RAGHU H, SHARMA-WALIA N, VEETTIL M V, et al. Kaposi's sarcoma-associated herpesvirus utilizes an actin polymerizationdependent macropinocytic pathway to enter human dermal microvascular endothelial and human umbilical vein endothelial cells[J].J Virol,2009,83(10):4895-4911.
[11] SAKURAI Y, KOLOKOLTSOV A A, CHEN C C, et al. Ebola virus. Two-pore channels control Ebola virus host cell entry and are drug targets for disease treatment[J]. Science, 2015, 347(6225):995-998.
[12] NANBO A,IMAI M,WATANABE S,et al. Ebolavirus is internalized into host cellsviamacropinocytosis in a viral glycoprotein-dependent manner[J]. PLoS Pathog,2010,6(9):e1001121.
[13] SHEMA MUGISHA C, VUONG H R, PURAY-CHAVEZ M, et al.A simplified quantitative real-time PCR assay for monitoring SARSCoV-2 growth in cell culture[J]. mSphere, 2020, 5(5): e00658-e00620.
[14] JIANG G, CHEN H, HUANG J L, et al. Tailored lipoprotein-like miRNA delivery nanostructure suppresses glioma stemness and drug resistance through receptor-stimulated macropinocytosis[J]. Adv Sci(Weinh),2020,7(5):1903290.
[15] HUANG J L, JIANG G, SONG Q X, et al. Lipoprotein-biomimetic nanostructure enables efficient targeting delivery of siRNA to Rasactivated glioblastoma cellsviamacropinocytosis[J]. Nat Commun,2017,8:15144.
[16] JIA H,YANG Y Q, LI M Y, et al. Snail enhances arginine synthesis by inhibiting ubiquitination-mediated degradation of ASS1[J].EMBO Rep,2021,22(8):e51780.
[17] JIANG H W, LI Y, ZHANG H N, et al. SARS-CoV-2 proteome microarray for global profiling of COVID-19 specific IgG and IgM responses[J]. Nat Commun,2020,11(1):3581.
[18] COYNE C B, SHEN L, TURNER J R, et al. Coxsackievirus entry across epithelial tight junctions requires occludin and the small GTPases Rab34 and Rab5[J]. Cell Host Microbe, 2007, 2(3):181-192.
[19] DOODNAUTH S A, GRINSTEIN S, MAXSON M E. Constitutive and stimulated macropinocytosis in macrophages: roles in immunity and in the pathogenesis of atherosclerosis[J]. Philos Trans R Soc Lond B Biol Sci,2019,374(1765):20180147.
[20] ANGELINI M M, AKHLAGHPOUR M, NEUMAN B W, et al.Severe acute respiratory syndrome coronavirus nonstructural proteins 3, 4, and 6 induce double-membrane vesicles[J]. mBio, 2013, 4(4):e00524-e00513.
[21] MERCER J, HELENIUS A. Virus entry by macropinocytosis[J].Nat Cell Biol,2009,11(5):510-520.
[22] LIU J,LI S M,LIU J,et al. Longitudinal characteristics of lymphocyte responses and cytokine profiles in the peripheral blood of SARS-CoV-2 infected patients[J]. EBioMedicine,2020,55:102763.
