海绵来源的smenospongine 通过抑制非小细胞肺癌细胞中的EGFR-Akt-ABCG2信号通路抑制顺铂耐药
2022-10-21廖雅慧刘丽云朱泓睿林厚文严继舟
廖雅慧,刘丽云,朱泓睿,林厚文,严继舟,孙 凡#
1.上海海洋大学海洋生物与组织再生实验室,上海 201306;2.上海交通大学医学院附属仁济医院海洋药物实验室,上海200127;3.上海交通大学医学院附属第九人民医院黄浦分院药剂科,上海 200011
肺癌的发病率和死亡率均高居全球恶性肿瘤之首。据统计资料表明,2020 年全球肺癌发病人数220万,死亡人数亦高达180万[1]。肺癌在临床上分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC)。其中,NSCLC 包括肺腺癌(adenocarcinoma)、肺鳞癌(squamous cell carcinoma)和大细胞肺癌(large-cell carcinoma),占肺癌总数的85%[1]。NSCLC 治疗的方法主要有手术治疗和化学治疗(化疗),近年来靶向药物和免疫治疗的应用也逐渐广泛。但许多NSCLC 患者在最初就被诊断为ⅢB 或Ⅳ期,或在手术后复发[2],靶向药物如表皮生长因子受体(epidermal growth factor receptor,EGFR)的酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)和免疫抑制剂如程序性死亡蛋白-1(programmed death-1,PD-1)抑制剂的用药指征尚不明确,因此化疗仍然是目前主要的治疗方法。由于肿瘤出现化疗耐药,NSCLC 患 者 的5 年 生 存 率 仅 为26%[3]。以 顺 铂(cisplatin, cis-diamminedichloroplatinum, DDP) 为基础的治疗方案是晚期NSCLC 治疗中应用最广泛的方案[4]。因此,寻找逆转顺铂耐药的方法是NSCLC治疗中亟待解决的关键问题。目前,顺铂耐药的主要原因有:癌细胞DNA 损伤修复能力增强、多药耐药(multi-drug resistance,MDR)蛋白的过度表达以及癌细胞对凋亡的抵抗[5-7]。在多药耐药机制中,ATP结合盒(ATP-binding cassette,ABC)蛋白的过度表达被认为是最常见的[8]。迄今为止已经发现至少15种ABC 蛋白,这些蛋白形成药物外排泵,与介导MDR 有关[9]。一项对结肠癌奥沙利铂耐药株的研究[10]发现,与母本细胞相比,耐药株中ABC 蛋白G超家族成员2 (ATP-binding cassette superfamily G member 2,ABCG2) 表达水平明显增高,加入ABCG2抑制剂维拉帕米可诱导内质网应激进而导致细胞凋亡。磷脂酰肌醇3 激酶(phosphoinositide 3-kinase,PI3K)/丝氨酸苏氨酸蛋白激酶(serine/threonine kinase,Akt)信号通路通过对细胞外刺激做出应答,参与调控增殖、生长、存活、运动性和代谢等多种细胞功能,该通路的异常激活是加速癌症发展的因素。Akt是PI3K的主要下游效应因子之一,最初被认为是胰岛素受体细胞内信号转导的重要组成部分。有研究者[11]发现,Akt1 在肺腺癌细胞A549 顺铂耐药株中过表达,并通过调控Rapamycin/p70S6K1信号通路产生耐药。当抑制Akt1 活性时,耐药株对顺铂的敏感性显著增加。
Smenospongine (SME) 是 本 实 验 室 从 海 绵Spongia pertusaesper 中分离得到的一种倍半萜氨基醌[12]。据报道[13-14],SME 可诱导K562 细胞红系分化,诱导白血病细胞的G1 期阻滞和凋亡。其他研究[15-16]也报道了SME 在人脐静脉内皮细胞中的抗增殖和抗血管生成活性。本实验室前期研究[17]发现SME 对肿瘤干细胞样细胞有抑制作用。然而,SME对NSCLC顺铂耐药的作用和机制尚未见报道。
本研究构建了NSCLC顺铂耐药株A549/DDP,并深入探讨了SME对该耐药株的抑制作用和分子机制。
1 材料和方法
1.1 材料
1.1.1 实验用细胞 人NSCLC 系A549 购自中国科学院上海细胞库,顺铂耐药细胞株A549/DDP 购自湖南丰晖生物科技有限公司。
1.1.2 主要试剂及仪器 DMEM F12k 培养基、RPMI 1640 培养基、10%胎牛血清购自美国Gibco 公司;CCK-8 试剂盒购于日本东仁化学;RNA Simple Total RNA Kit 购于北京天根生物科技公司,Prime Script RNA RT试剂盒、SYBR®Premix Ex TaqⅡ(Tli RNAseH Plus)购于日本Takara 公司;顺铂、吉西他滨(gemcitabine,GEM)、培美曲塞、酒石酸长春瑞滨(vinorelbine,NVB)购于美国Selleck 公司;鱼藤素(deguelin)购于上海皓元生物医药科技有限公司;表皮生长因子(epidermal growth factor,EGF)购于美国Gibco公司;BCA 蛋白检测试剂盒购自江苏碧云天生物技术有限公司;抗E-cadherin、N-cadherin、锌指转录因子slug(SNAI2)、Bcl-2 相关X 蛋白(Bcl-2 associated X protein,Bax)、重组人B细胞淋巴瘤因子2 xL(recombinant human B-cell leukemia/lymphoma 2 xL,Bcl-xL)、Akt、p-Akt、EGFR、p-EGFR、甘油醛-3- 磷 酸 脱 氢 酶 (glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体,抗兔IgG,辣根过氧化物酶(horseradish peroxidase,HRP)偶联二抗和抗鼠IgG 购自美国Cell Signaling Technology 公司;抗ABCG2抗体购于英国Abcam公司;PAGE凝胶快速制备试剂盒购于上海雅酶生物医药科技有限公司;蛋白酶抑制剂苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、结晶紫染色液和TUNEL (TdTmediated dUTP Nick-end labeling)试剂盒购于江苏碧云天生物技术有限公司; 聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜购自美国Merck Millipore 公司;封闭液购于美国Odyssey 公司;PI/RNAse染色液和Transwell小室购于美国BD公司。
SME 的提取和分离由本实验室从南海海绵Spongia pertusaesper中分离得到,其结构和纯度已由本实验室确定,SME的纯度超过98%[17]。
二氧化碳培养箱购于美国Thermo Fisher Scientific公司;核酸和蛋白分析仪购于美国Beckman公司;Amersham Imager 600 超灵敏多功能成像仪购于美国GE 公司;荧光定量PCR 仪Light Cycler 480 购于瑞士Roche 公司;-80 ℃低温冰箱、流式细胞仪购于美国Thermo Fisher公司。
1.2 实验方法
1.2.1 细胞培养 NSCLC 细胞A549 培养于DMEM F12k 培养基(含10%胎牛血清和1%青霉素/链霉素)中,A549/DDP细胞培养于RPMI 1640培养基(含10%胎牛血清、1%青霉素/链霉素和1 μg/mL 顺铂)中,2种细胞均于37 ℃、5%CO2的细胞培养箱中培养。
1.2.2 CCK-8 实验 将各实验组细胞按3 000个/孔接种于96孔板中,每组5个复孔,37 ℃培养过夜,待细胞贴壁之后,分别加入顺铂、GEM、培美曲塞、NVB和5-氟尿嘧啶等抗癌药物。培养48 h 后,每孔加入10 μL CCK-8 工作液,继续避光45 min。随后以酶标仪检测细胞活力,最后绘制不同时间细胞的生长曲线。
1.2.3 克隆形成试验 采用结晶紫染色和定量方法进行集落形成实验。细胞以每孔1 000 个细胞的密度种植在6孔板中。37 ℃培养48 h后加入药物。药物处理8~9 d,每3 d 更换含药培养基。最后细胞用4%甲醛固定,0.5%结晶紫染色。
1.2.4 蛋白质印迹法 将收集的细胞样品加入RIPA蛋白裂解液,用BCA 试剂盒测定蛋白浓度;取12 μg总蛋白量上样至SDS-PAGE 胶进行电泳;电泳结束后,转移SDS-PAGE 胶至PVDF 膜上;转膜结束后,5%脱脂牛奶室温封闭1 h;加入一抗,4 ℃孵育过夜;加入二抗,室温孵育2 h;化学发光成像系统进行显色反应。
1.2.5 实时荧光定量PCR 检测A549 和A549/DDP 经处理后ABCG2的mRNA 表达水平 用试剂盒提取总RNA、Prime Script RNA RT 试剂盒合成cDNA。实时荧 光 定 量PCR (quantitative real-time PCR, qRTPCR) 的10 μL 扩增体系:5 μL SYBR®Premix Ex Taq Ⅱ(2×),1 μL RT 反应液(cDNA 溶液)、上下引物各0.2 μL,3.6 μL dH2O(灭菌蒸馏水)。程序设置为:95 ℃3 min;95 ℃5 s,60 ℃25 s,72 ℃25 s,循环数为40 次。每个样本设置3 个复孔,采用2-ΔΔCT法对2 株细胞的ABCG2、β-actin 表达水平进行分析。所设计的ABCG2的上游和下游引物分别为5'-GGAT GAGCCTACAACTGGCTT-3'、 5'-TTCCTGAGGCCA ATAAGGTG-3';β-actin 的上游和下游引物分别为5'-CCTGGCACCCAGCAGCAAT-3'、 5'-GGGCCGGAC TCGTCATAC-3'。
1.2.6 细胞周期分析 将细胞暴露于不同浓度的SME 中24 h 后,用70%乙醇固定,置于-20 ℃过夜。采用PI-RNase 溶液避光染色15 min。流式细胞仪分析细胞周期分布。并用Modfit软件分析细胞周期分布以及绘图。
1.2.7 TUNEL 法检测细胞凋亡 将细胞固定在4%多聚甲醛中,按说明用TUNEL 试剂盒染色。荧光信号在荧光显微镜上捕捉。
1.2.8 Transwell侵袭实验 细胞用100 μL无血清培养基重悬接种于Transwell上室,下室加入500 μL含10%血清培养基,置于培养箱中常规培养24 h。用4%多聚甲醛固定30 min,0.1%结晶紫染色20 min,并将小室适当风干,于显微镜下观察,拍照,并计数。
1.3 统计学方法
采用GraphPad Prism 8.0 软件进行数据分析和绘图。定量资料用表示。采用独立样本t检验分析2组数据间的差异;P<0.05表示差异有统计学意义。
2 结果
2.1 顺铂耐药株A549/DDP的鉴定
我们首先利用顺铂诱导获得A549/DDP 细胞并对其耐药性进行了检测。对顺铂在A549和A549/DDP细胞中的IC50检测结果如图1 所示,发现A549 的IC50为3.73 μmol/L,而A549/DDP 的IC50为155.10 μmol/L,即A549/DDP 是A549 的41.55 倍,表 明A549/DDP 细胞对高浓度的顺铂具有耐药性。为了检测A549/DDP对其他药物的反应,我们检测了一些临床上常用的一线NSCLC 化疗药物[GEM、NVB、培美曲塞和5-氟尿嘧啶(5-FU)]对2 种细胞的IC50。结果如表1 所示。我们利用GEM、NVB 和培美曲塞同时处理2 株细胞,发现A549/DDP 的耐药指数分别是A549 的5.050 倍、895.000 倍以及6.342 倍。结果提示A549/DDP与母本细胞相比获得了MDR特性。
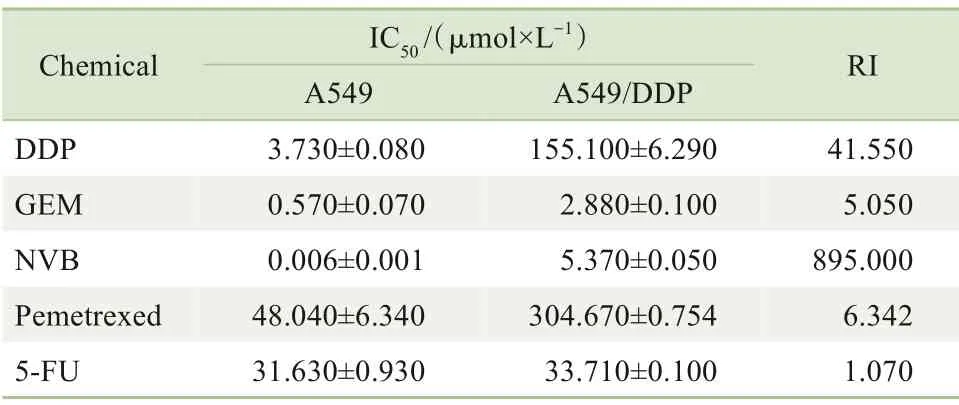
表1 顺铂耐药株的MDR特性Tab 1 MDR features of cisplatin-resistant cells

图1 顺铂耐药株的鉴定Fig 1 Authentication of cisplatin-resistant cells
2.2 SME抑制顺铂耐药细胞增殖和转移
为了研究SME 对A549/DDP 细胞的作用,我们用SME 处理A549 和A549/DDP 细胞,以CCK-8 检测了细胞对SME 的IC50。结果可见,SME 对A549/DDP的IC50与A549 十分接近,甚至小于A549(图2A),提示SME 对顺铂耐药细胞的增殖有抑制作用,甚至优于母本细胞。进一步利用克隆形成实验验证SME对细胞增殖的抑制作用。图2B 可见,在对照组中A549 和A549/DDP 的克隆有明显的差异(图2B 左)。然而,当分别用5 和20 μmol/L SME 处理细胞时,克隆形成明显减少(图2B中和右),几乎与母本细胞相同。上述结果提示SME 可有效抑制A549/DDP 细胞增殖。
为了研究SME 对A549/DDP 迁移能力影响,我们进行了Transwell 实验。结果显示,5 和20 μmol/L SME 能明显抑制A549/DDP 细胞的迁移能力(图2C)。此外,利用蛋白质印迹法(Western blotting)检测上皮间质转化(epithelial to mesenchymal transition,EMT)标志物蛋白,结果发现与A549 细胞相比,A549/DDP 细胞的上皮标志物E-cadherin 蛋白水平较低,而间质标志物slug 和N-cadherin 较高(图2D)。提示在耐药细胞中发生了EMT。随后我们用0、5、10 和20 μmol/L SME 分别处理A549/DDP 24 h,随着实验中SME 浓度的增加,A549/DDP 细胞E-cadherin 蛋白水平升高,slug 和N-cadherin 蛋白水平则逐渐下调(图2E),提示SME可有效抑制耐药细胞EMT和迁移能力。
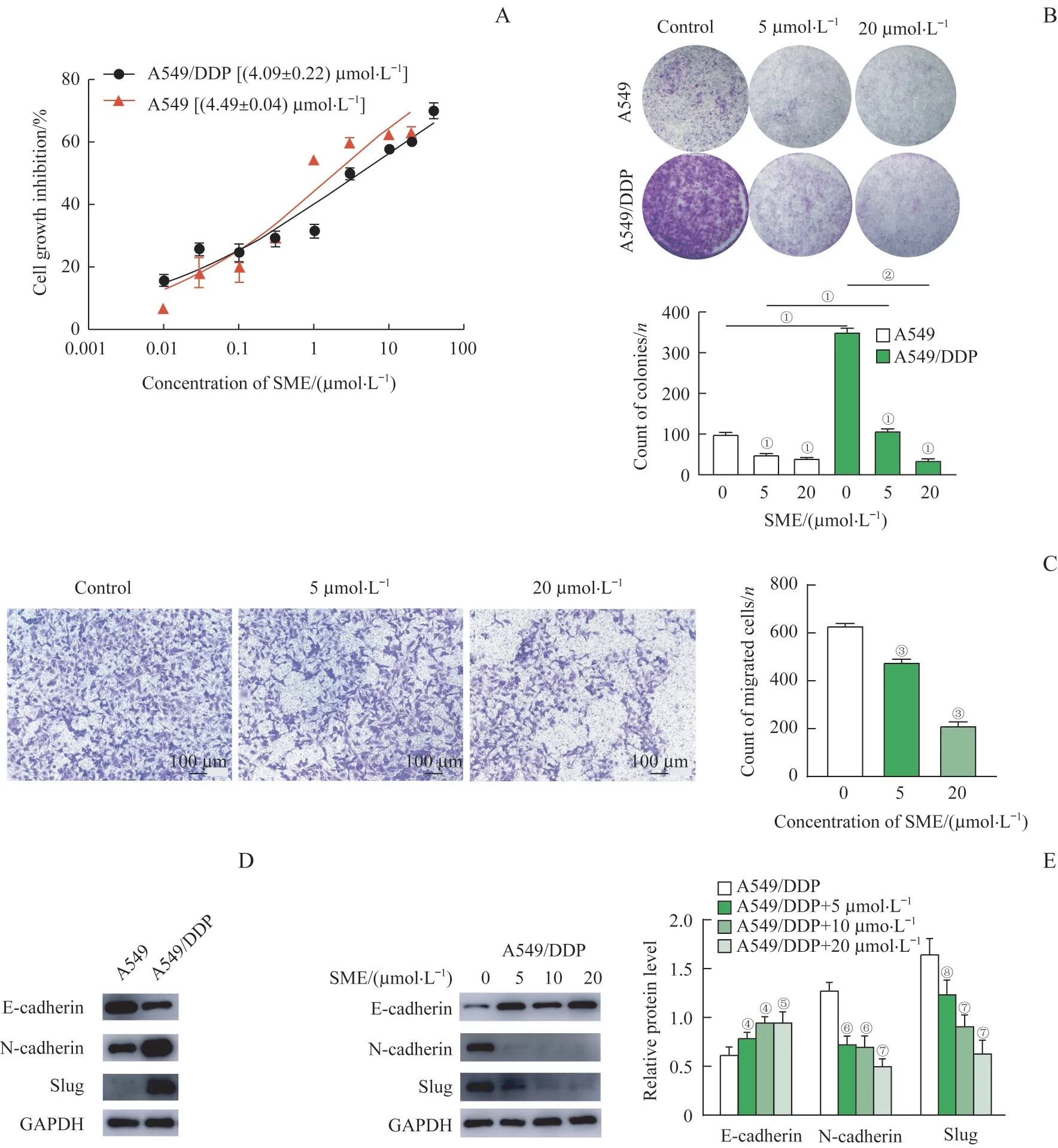
图2 SME抑制顺铂耐药细胞增殖和转移Fig 2 SME inhibits cell proliferation and EMT in cisplatin-resistant cells
上述结果表明,SME 可有效抑制顺铂耐药细胞的增殖能力和迁移能力,抑制耐药细胞的增长。
2.3 SME抑制顺铂耐药细胞ABCG2基因表达
为了揭示SME 抑制耐药细胞的机制,我们研究了SME 作用下,A549/DDP 细胞中与MDR 密切相关的ABC 家族蛋白水平的变化。利用0、5、10 和20 μmol/L SME 分 别 处 理A549/DDP 细 胞,采 用Western blotting 检 测ABCC11 和ABCB1 蛋 白 水 平(图3A)。结果发现,在SME 的作用下,ABCC11 和ABCB1 均无明显差别。进一步研究发现,以0、5、10 和20 μmol/L SME 处理A549 和A549/DDP 24 h 后,ABCG2 蛋白水平呈SME 浓度梯度依赖性下调,SME浓度越高,对ABCG2 蛋白抑制越明显。同时结果显示耐药细胞中的ABCG2 水平明显高于母本细胞(图3B)。为了检测SME是否影响ABCG2的mRNA水平,我 们 对A549 和A549/DDP 中ABCG2进 行 了qRT-PCR检测,结果发现以20 μmol/L SME处理,可显著降低A549 和A549/DDP 中ABCG2mRNA 水平(图3C)。这些结果表明,SME 可抑制ABCG2的基因转录进而减少蛋白表达,A549/DDP的耐药性可能与ABCG2上调相关。
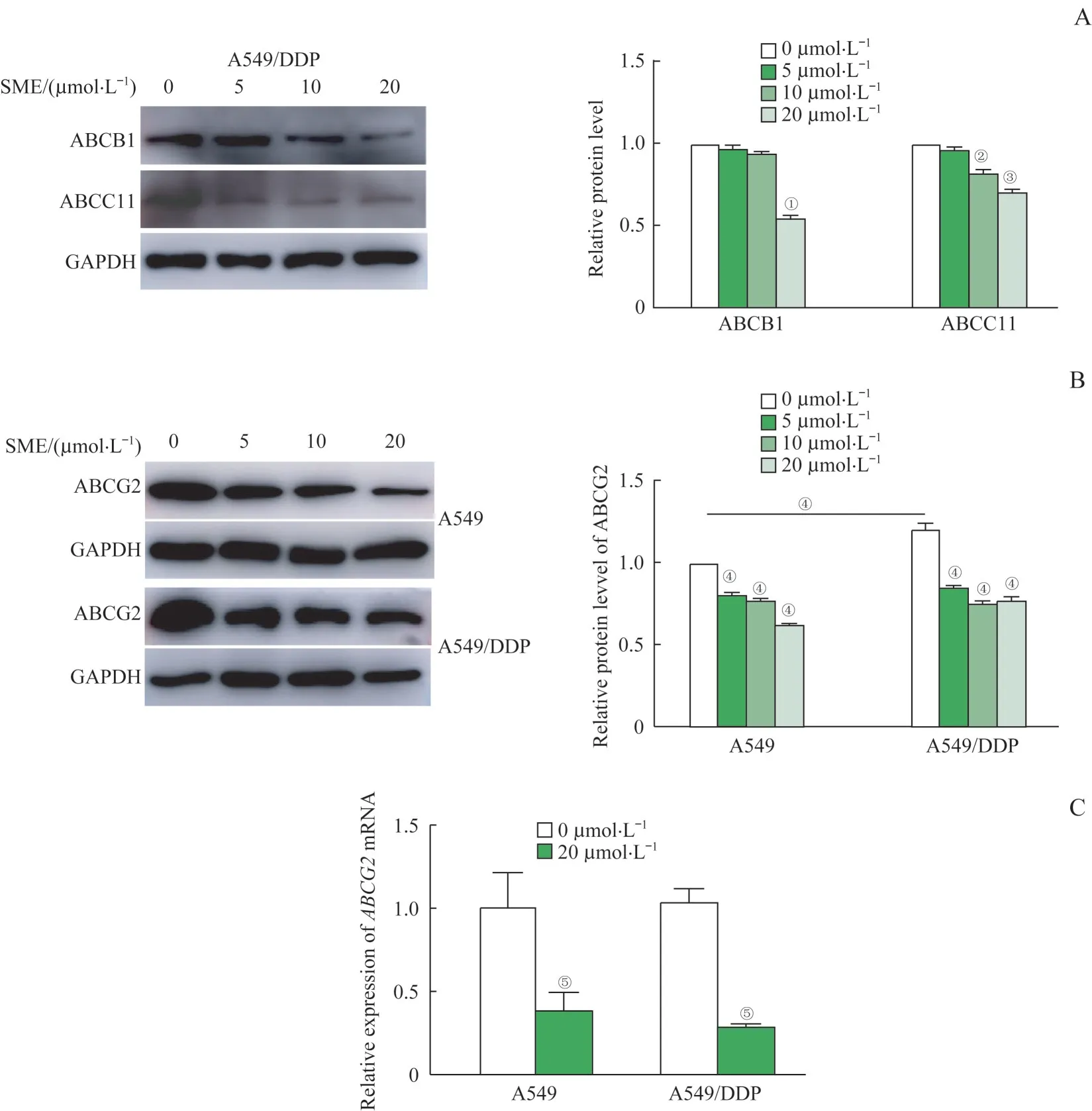
图3 SME抑制顺铂耐药细胞ABCG2基因表达Fig 3 SME inhibits the mRNA expression of ABCG2 in cisplatin-resistant cells
2.4 SME抑制顺铂耐药细胞EGFR-Akt信号通路活性
为了深入探究SME 抑制耐药株的分子机制,我们用Western blotting检测了与细胞代谢、生长和增殖相关的信号通路的活性,包括p38、AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)、胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、c-Jun 氨基端激酶(c-Jun N-terminal kinase,JNK)、PI3K 等(数据未显示)。结果发现,使用SME 处理后,磷酸化Akt(p-Akt)明显降低。相一致的是,以0、5、10 和20 μmol/L SME 处理后,受Akt抑制的下游蛋白forkhead box protein O1(FoxO1)在A549 和A549/DDP 中明显增加(图4A)。为了进一步证实SME 对Akt 磷酸化水平的抑制作用,我们利用Akt 抑制剂deguelin 和SME 处理母本细胞和耐药株;结果显示,250 nmol deguelin 和20 μmol/L SME均可抑制p-Akt,同时上调FoxO1 蛋白。二者同时处理细胞后,对p-Akt 的抑制作用更加显著,提示deguelin 和SME 对抑制p-Akt 有协同作用(图4B)。进一步对Akt 与ABCG2 的调控关系进行探究,结果显 示,250 nmol deguelin 和20 μmol/L SME 可 抑 制A549 和A549/DDP 中ABCG2 蛋白水平,并且二者对ABCG2 的抑制也有协同作用(图4C)。这些结果提示Akt 是ABCG2 的上游调控信号,Akt 上调ABCG2的同时抑制FoxO1。SME 通过抑制Akt 信号而下调ABCG2,同时上调FoxO1。
为了进一步检测SME 可能的抑制靶点,我们检测了Akt 上游蛋白EGFR 的活性。我们用100 nmol EGF 处理细胞以激活EGFR,结果表明20 μmol/L SME 可降低EGF 激活的磷酸化EGFR(p-EGFR)蛋白水平(图4D)。提示SME 可通过抑制EGFR 活性,进而抑制下游Akt-ABCG2信号通路。
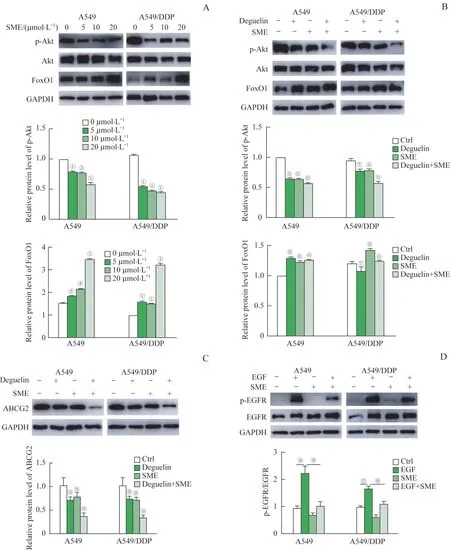
图4 SME抑制顺铂耐药细胞EGFR-Akt信号通路活性Fig 4 SME inhibits the activity of EGFR-Akt pathway in cisplatin-resistant cells
2.5 SME 诱导顺铂耐药细胞G0/G1 期阻滞和细胞凋亡
诱导肿瘤细胞周期阻滞和细胞凋亡是多种化疗药物的作用机制[18]。为了研究SME 对肿瘤细胞周期阻滞和细胞凋亡的影响,我们首先采用流式细胞仪检测细 胞 周 期;如 图5A 和5B 所 示,20 μmol/L SME 使A549 的G0/G1 期细胞比例从55.79%升至81.00%,而A549/DDP 的G0/G1 期 细 胞 比 例 从64.41% 升 至74.63%。表明SME 可诱导细胞G0/G1 期阻滞。进一步利用TUNEL 检测细胞凋亡,结果显示,以20 μmol/L SME 处理后,提示凋亡的绿色荧光信号明显增多(图5C、5D)。随后我们利用Western blotting检测凋亡蛋白,发现分别以0、5、10 和20 μmol/L SME 处理后,A549/DDP 中促凋亡蛋白Bax 增加而抗凋亡蛋白Bcl-xL 降低(图5E),与TUNEL 结果相一致。该结果表明SME可诱导A549/DDP细胞凋亡。

图5 SME诱导顺铂耐药细胞G0/G1期阻滞和细胞凋亡Fig 5 SME induces G0/G1 arrest and apoptosis in cisplatin-resistant cells
综上所述,SME 可通过抑制EGFR-Akt-ABCG2信号通路,抑制MDR基因ABCG2的表达,同时上调受Akt 抑制的下游蛋白FoxO1,诱导耐药细胞G0/G1期阻滞和细胞凋亡,从而抑制A549/DDP 的增长(图6)。

图6 SME抑制EGFR-Akt-ABCG2信号通路模式图Fig 6 A schematic diagram depicting a model of the inhibition of SME on the EGFR-Akt-ABCG2 pathway
3 讨论
化疗耐药是长期困扰NSCLC 临床治疗的瓶颈问题。化疗后的获得性化疗耐药是导致患者死亡的最主要的原因[19]。我们利用NSCLC 细胞株A549 诱导建立了顺铂耐药株A549/DDP。通过检测不同化疗药物的IC50,我们发现A549/DDP具有MDR特征。与前人报道的一旦肺癌细胞对顺铂产生耐药就很难进行有效治疗的现象一致[20]。
利用本实验室分离得到的小分子化合物SME 处理细胞,我们发现SME 对A549 和A549/DDP 2 种细胞的IC50很接近,提示SME不仅对A549有抑制作用,同时也对其耐药细胞A549/DDP 有抑制作用。细胞克隆形成实验是观察肿瘤细胞增殖的另一指标。与SME 抑制A549/DDP 细胞生长现象一致,我们发现SME可有效抑制A549/DDP的克隆形成。迁移能力是肿瘤细胞的恶性特征之一。化疗后肿瘤细胞发生EMT,迁移能力提高并发生转移是导致预后不良的主要原因[21]。我们发现SME 可下调间质细胞标志物N-cadherin 和slug 的表达,同时上调上皮细胞标志物E-cadherin 的表达[22]。这些结果表明SME 逆转A549/DDP的EMT,抑制A549/DDP的迁移能力。
在化疗耐药机制中最为重要的是ABC 蛋白家族的上调。ABC 蛋白作为细胞膜上的离子泵,可将化疗药物泵出癌细胞,从而导致耐药[23]。我们通过对与MDR 密切相关的ABC 家族蛋白进行筛选,发现SME 可 抑 制ABCG2 蛋 白。多 项 研 究[24]表 明,ABCG2水平的升高会导致顺铂耐药和患者预后不良。抑制肺癌干细胞中的ABCG2 水平可增强肺癌干细胞对顺铂的敏感性[25]。我们的研究发现ABCG2 在A549/DDP 细胞中表达增加,提示ABCG2 可能是A549/DDP 发生MDR 的机制。SME 不仅可明显降低ABCG2 蛋白水平,也可降低ABCG2的mRNA 水平,提示SME 可能通过抑制ABCG2的转录调控而减少ABCG2的蛋白表达。
EGFR 作为肿瘤生长的激酶信号通路,其突变和过表达导致的异常激活与NSCLC 的发生有关。EGFR-Akt 信号通路可通过调控多种转录因子促进肿瘤细胞的增殖、抑制凋亡并增强细胞的侵袭和转移能力[26]。EGFR-Akt 下游还可以抑制诱导细胞凋亡的FoxO1。因此PI3K/Akt/FoxO1通路的激活减少了细胞凋亡并刺激了细胞增殖并且最终导致癌症[27]。有报道表明ABCG2 受PI3K/Akt 信号通路的调控[28]。与上述报道相一致,我们的结果表明,利用Akt的抑制剂deguelin处理细胞,deguelin和SME协同抑制p-Akt的同时也抑制了ABCG2,因此,我们推测Akt 是ABCG2 的上游。与deguelin 相似,SME 也可有效抑制A549/DDP 中p-Akt 和ABCG2 表达,并升高FoxO1蛋白水平,表明SME 可抑制Akt 信号通路。进一步研究表明SME 可降低EGF 激发的p-EGFR 蛋白水平。提示SME可通过抑制顺铂耐药细胞中EGFR-Akt信号通路进而抑制下游ABCG2 蛋白表达,同时增加凋亡诱导蛋白FoxO1。
最后,我们通过肿瘤细胞周期阻滞和细胞凋亡的检测证明了SME 的抗肿瘤活性。SME 不仅可诱导耐药细胞发生G0/G1 期阻滞,TUNEL 实验和凋亡蛋白的检测均表明SME还可以诱导耐药细胞的凋亡。
总之,我们的研究发现了能抑制顺铂耐药的新化合物SME,并阐明其作用机制。即SME 通过抑制EGFR 活性,一方面抑制EGFR-Akt-ABCG2 信号通路,下调ABCG2 蛋白水平,抑制肿瘤细胞耐药;另一方面激活FoxO1,诱导细胞G0/G1期阻滞和细胞凋亡;最终达到抑制NSCLC顺铂耐药的目的。
利益冲突声明/Conflict of Interests
所有作者声明不存在利益冲突。
All authors disclose no relevant conflict of interests.
作者贡献/Authors'Contributions
廖雅慧、刘丽云参与了实验设计和实验操作;廖雅慧、刘丽云、朱泓睿、林厚文参与了论文的写作和修改;严继舟、孙凡参与了课题设计和论文修改;所有作者均阅读并同意了最终稿件的提交。
The study was designed and conducted by LIAO Yahui and LIU Liyun.The manuscript was drafted and revised by LIAO Yahui,LIU Liyun,ZHU Hongrui and LIN Houwen. The project was designed and the manuscript was revised by YAN Jizhou and SUN Fan.All the authors have read the last version of paper and consented for submission.
·Received:2022-03-11
·Accepted:2022-05-13
·Published online:2022-08-28
参·考·文·献
[1] WILD C P, WEIDERPASS E, STEWART B W. World Cancer Report: cancer research for cancer prevention[M]. Lyon: IARC press,2020.
[2] FENNELL D A, SUMMERS Y, CADRANEL J, et al. Cisplatin in the modern era: the backbone of first-line chemotherapy for nonsmall cell lung cancer[J]. Cancer Treat Rev,2016,44:42-50.
[3] MILLER K D, SIEGEL R L, LIN C C, et al. Cancer treatment and survivorship statistics, 2016[J]. CA A Cancer J Clin, 2016, 66(4):271-289.
[4] ROSSI A, DI MAIO M. Platinum-based chemotherapy in advanced non-small-cell lung cancer: optimal number of treatment cycles[J].Expert Rev Anticancer Ther,2016,16(6):653-660.
[5] GOLER-BARON V,ASSARAF Y G. Structure and function of ABCG2-rich extracellular vesicles mediating multidrug resistance[J]. PLoS One,2011,6(1):e16007.
[6] GONEN N,ASSARAF Y G. Antifolates in cancer therapy:structure,activity and mechanisms of drug resistance[J]. Drug Resist Updat,2012,15(4):183-210.
[7] STEWART D J. Wnt signaling pathway in non-small cell lung cancer[J].J Natl Cancer Inst,2014,106(1):djt356.
[8] MAHMOUD N,SAEED M E M,SUGIMOTO Y,et al. Cytotoxicity of nimbolide towards multidrug-resistant tumor cells and hypersensitivityviacellular metabolic modulation[J]. Oncotarget,2018,9(87):35762-35779.
[9] FUKUDA Y, SCHUETZ J D. ABC transporters and their role in nucleoside and nucleotide drug resistance[J]. Biochem Pharmacol,2012,83(8):1073-1083.
[10] LI W, ZHANG H, ASSARAF Y G, et al. Overcoming ABC transporter-mediated multidrug resistance: molecular mechanisms and novel therapeutic drug strategies[J]. Drug Resist Updat, 2016,27:14-29.
[11] LIU L Z, ZHOU X D, QIAN G S, et al. AKT1 amplification regulates cisplatin resistance in human lung cancer cells through the mammalian target of rapamycin/p70S6K1 pathway[J]. Cancer Res,2007,67(13):6325-6332.
[12] LI J, GU B B, SUN F, et al. Sesquiterpene quinones/hydroquinones from the marine spongeSpongia pertusaesper[J]. J Nat Prod, 2017,80(5):1436-1445.
[13] AOKI S, KONG D X, MATSUI K, et al. Smenospongine, a spongean sesquiterpene aminoquinone, induces erythroid differentiation in K562 cells[J]. Anticancer Drugs, 2004, 15(4):363-369.
[14] KONG D X, AOKI S, SOWA Y, et al. Smenospongine, a sesquiterpene aminoquinone from a marine sponge, induces G1 arrest or apoptosis in different leukemia cells[J]. Mar Drugs, 2008,6(3):480-488.
[15] KONG D X, YAMORI T, KOBAYASHI M, et al. Antiproliferative and antiangiogenic activities of smenospongine, a marine sponge sesquiterpene aminoquinone[J]. Mar Drugs,2011,9(2):154-161.
[16] PARK S, HWANG I H, KIM J, et al. Smenospongidine suppresses the proliferation of multiple myeloma cells by promoting CCAAT/enhancer-binding protein homologous protein-mediated β-catenin degradation[J]. Arch Pharm Res,2017,40(5):592-600.
[17] TANG J, WU W, YANG F, et al. Marine sponge-derived smenospongine preferentially eliminates breast cancer stem-like cellsviap38/AMPKα pathways[J]. Cancer Med,2018,7(8):3965-3976.
[18] HIRSCH G E, PARISI M M, MARTINS L A M, et al. γ-Oryzanol reduces caveolin-1 and PCGEM1 expression, markers of aggressiveness in prostate cancer cell lines[J]. Prostate, 2015, 75(8):783-797.
[19] MORO M, CAIOLA E, GANZINELLI M, et al. Metformin enhances cisplatin-induced apoptosis and prevents resistance to cisplatin in co-mutated KRAS/LKB1 NSCLC[J]. J Thorac Oncol,2018,13(11):1692-1704.
[20] LOU J S,YAN L,BI C W,et al. Yu Ping Feng San reverses cisplatininduced multi-drug resistance in lung cancer cellsviaregulating drug transporters and p62/TRAF6 signalling[J]. Sci Rep,2016,6:31926.
[21] WANG G F, BAI X S, JIANG G Q, et al. GIT1 overexpression promotes epithelial-mesenchymal transition and predicts poor prognosis in hepatocellular carcinoma[J]. Bioengineered, 2021,12(1):30-43.
[22] YOUSEFI M, BAHRAMI T, SALMANINEJAD A, et al. Lung cancer-associated brain metastasis: molecular mechanisms and therapeutic options[J]. Cell Oncol(Dordr),2017,40(5):419-441.
[23] GOTTESMAN M M,PASTAN I H. The role of multidrug resistance efflux pumps in cancer: revisiting a JNCI publication exploring expression of the MDR1 (P-glycoprotein) gene[J]. J Natl Cancer Inst,2015,107(9):djv222.
[24] KIM S,LEE M,DHANASEKARAN D N,et al. Activation of LXRα/β by cholesterol in malignant ascites promotes chemoresistance in ovarian cancer[J]. BMC Cancer,2018,18(1):1232.
[25] LIM Y C, KANG H J, MOON J H. C-Met pathway promotes selfrenewal and tumorigenecity of head and neck squamous cell carcinoma stem-like cell[J]. Oral Oncol,2014,50(7):633-639.
[26] LI H, SCHMID-BINDERT G, WANG D, et al. Blocking the PI3K/AKT and MEK/ERK signaling pathways can overcome gefitinibresistance in non-small cell lung cancer cell lines[J]. Adv Med Sci,2011,56(2):275-284.
[27] XU Z W, MEI J, TAN Y. Baicalin attenuates DDP (cisplatin)resistance in lung cancer by downregulating MARK2 and p-Akt[J].Int J Oncol,2017,50(1):93-100.
[28] WANG L, LIN N, LI Y. The PI3K/AKT signaling pathway regulates ABCG2 expression and confers resistance to chemotherapy in human multiple myeloma[J]. Oncol Rep,2019,41(3):1678-1690.
