黏蛋白1与肿瘤相关蛋白的调控网络研究
2022-10-21褚云开廖春华邓华云
褚云开,廖春华,邓华云,黄 雷
上海交通大学医学院组织胚胎学与遗传发育学系,上海 200025
黏蛋白1(mucin1,MUC1)属于黏蛋白家族,是一种Ⅰ型跨膜蛋白,相对分子质量120 000~225 000。在正常组织中,MUC1 广泛表达于消化道和呼吸道等分泌型上皮细胞管腔表面,呈极性分布,起润滑和保护作用[1]。在肿瘤组织中,MUC1失去极性,均匀地表达在肿瘤细胞表面;此时,肿瘤细胞蛋白水平异常升高,可达正常细胞的50~100 倍。临床研究[2-3]表明,MUC1 水平与肿瘤的发生发展密切相关。
MUC1通过和多种肿瘤相关蛋白相互作用,促进肿瘤的发生发展。MUC1 与核因子κB (nuclear factor-κB,NF-κB)和p65 转录因子形成复合物,上调尿激酶型血浆素原激活剂(urokinase-type plasminogen activator,uPA)转录水平,增加卵巢癌细胞的侵袭性[4];另一方面,MUC1 激活NF-κB 信号通路,诱导M2 型巨噬细胞浸润,促进肿瘤形成[5]。MUC1 也可结合转录因子p53 并抑制其活性,减少细胞凋亡;还有报道表明MUC1-C与雄激素受体(androgen receptor, AR) 的DNA 结 合 结 构 域(DNA-binding domain,DBD)结合,占用并抑制前列腺特异性抗原(prostate specific antigen,PSA)启动子,诱导前列腺癌细胞的侵袭和上皮间质转化[6]。MUC1 还与表皮生长因子受体(epidermal growth factor receptor,EGFR)相互作用,激活EGFR/三磷酸腺苷结合盒B 亚家族成员1 转运蛋白(ATP-binding cassette subfamily B member 1 transporter,ABCB1)信号轴和EGFR/白细胞介素-6(interleukin 6,IL-6)信号,导致肿瘤干细胞增殖及化学治疗(化疗)获得性耐药[7-8]的产生。
除了核受体相关蛋白,MUC1还和多种细胞质蛋白 结 合 。 MUC1 与 磷 酸 肌 醇 -3- 激 酶(phosphoinositide 3-kinase,PI3K)结合并激活PI3K/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号轴促进肿瘤的发展[9]。MUC1 通过与β-连环蛋白(β-catenin)相互作用并使其稳定,激活Wnt信号通路,导致细胞恶性转化[10-12]。MUC1 与共济失调毛细血管扩张突变(ataxia-telangiectasia mutated,ATM)蛋白相互作用,促进DNA 修复,导致乳腺癌细胞系对放射治疗(放疗)不敏感[13]。最近研究发现MUC1 与E3 泛 素 连 接 酶WWP1 (WW domain containing E3 ubiquitin protein ligase 1)相互作用,并阐明了WWP1 通过内体-自噬-溶酶体途径降解MUC1的分子机制;更重要的是,我们发现蛋白酶体抑制剂可激活该降解作用,进而抑制MUC1介导的肿瘤增殖和肿瘤干细胞自我更新[14]。
为了更全面地了解MUC1与肿瘤的关系,揭示新的作用机制,本文针对MUC1在不同癌症中的水平及其对患者生存的影响进行分析研究。同时,通过免疫共沉淀(co-immunoprecipitation,Co-IP)、液相色谱-串 联 质 谱 (liquid chromatography-tandem mass spectrometry,LC-MS/MS)联用的方式得到MUC1在细胞内的结合蛋白,用生物信息学分析其调控网络,以期为MUC1 阳性的肿瘤的发病机制研究和MUC1新功能发掘提供依据。
1 材料与方法
1.1 材料
1.1.1 细胞 人胚胎肾细胞HEK293T 来源于中科院上海生命科学研究院细胞资源中心。
1.1.2 试剂与仪器 DMEM 高糖培养基和PBS(上海源培生物科技股份有限公司,中国),100 mm细胞培养皿(上海越夷生物科技有限公司,中国),SDSPAGE 预制胶、胰蛋白酶、青霉素-链霉素和Nano293T 转染试剂(苏州新赛美生物公司,中国),胎牛血清(fetal bovine serum,FBS)(Gibco 公司,美国),HA-beads(Santa Cruz,美国),考马斯亮蓝染液(500 mL 甲醇+100 mL 冰乙酸+400 mL ddH2O+考马斯亮蓝),考马斯亮蓝洗脱液(500 mL甲醇+100 mL 冰乙酸+400 mL ddH2O),NETN150细胞裂解液(2.5 mL 50 mmol/L Tris pH7.6+2.5 mL 100 mmol/L NaCl+2.5 mL 0.5% NP 40+ddH2O 定容至50 mL)。超净工作台(Thermo,美国),Western blotting 蛋白电泳仪(Bio-Rad,美国),超声波破碎仪(Bio-Rad,美国),高速冷冻离心机(Thermo,美国)。
1.2 方法
1.2.1 细胞培养 将HEK293T 细胞放入含有10%FBS的DMEM培养液中培养。
1.2.2 HEK293T 细胞转染 细胞汇合度约60%时,用Nano293T 转染试剂,转染vector-HA 或MUC1-HA质粒,48 h后收集细胞。
1.2.3 质谱样品制备和检测 用NETN150 细胞裂解液裂解细胞,定量后与HA-beads 4 ℃孵育过夜。将样品以16×g离心10 min。样品经SDS-PAGE 胶分离,进行考马斯亮蓝染色[14]。染好的凝胶送上海交通大学基础医学院质谱平台进行LC-MS/MS检测。质谱谱图分析、结果分析均由上海交通大学基础医学院质谱平台完成。
1.2.4MUC1差异性表达和生存分析 使用GEPIA 2(gene expression profiling and interactive analyses 2)在线分析平台(http://gepia2.cancer-pku.cn/)分析癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中MUC1在33 种癌症中的转录水平。筛选MUC1高表达癌症作预后生存分析,采取Kaplan-Meier方法,并评估风险比(hazard ratio,HR)、95%置信区间(confidence interval,CI)和Log rankP值。P<0.05表示差异具有统计学意义。
1.2.5 MUC1结合蛋白的分析和相互作用网络构建使用String 11.5(https://string-db.org/)这一能在线搜索已知蛋白质之间相互作用的数据库。选[Multiple proteins] 并输入质谱分析得到的526 个MUC1 结合蛋白,[Organism] 选[homo sapiens];在[minimum required interaction score]将置信度得分设置为0.9[15]。对蛋白进行基因本体数据库(Gene Ontology,GO)和京都基因与基因组百科全书 (Kyoto Encyclopedia of Genes and Genomes,KEGG) 信号通路分析,同时构建蛋白相互作用网络。
1.3 统计学方法
使用GraphPad Prism 8.0 软件对数据进行统计。组间比较采用Student'st检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 MUC1在多种肿瘤组织中高表达
本研究用GEPIA 2 在线平台分析了33 种癌症中MUC1的转录水平(图1)。MUC1在乳腺癌(breast carcinoma,BRCA)、宫颈癌(cervical squamous cell carcinoma and endocervical adenocarcinoma,CESC)、弥漫性大B 细胞瘤(lymphoid neoplasm diffuse large B-cell lymphoma,DLBC)、多发性胶质细胞瘤(glioblastoma multiforme,GBM)、低级别脑胶质瘤(brain lower grade glioma,LGG)、卵巢癌(ovarian carcinoma, OV) 、 胰 腺 癌 (pancreatic adenocarcinoma, PAAD)、 胸 腺 癌 (thymoma,THYM) 和子宫内膜癌(uterine corpus endometrial carcinoma,UCEC)共9 种恶性肿瘤中高表达(红色);在肾上腺皮质癌(adrenocortical carcinoma,ACC)等6 种恶性肿瘤中低表达(绿色);在膀胱尿路上皮细胞癌(bladder urothelial carcinoma,BLCA)等18种恶性肿瘤中无明显差异(黑色)。

图1 MUC1在不同肿瘤组织中的转录水平Fig 1 Transcription levels of MUC1 in different tumor tissues
2.2 MUC1 高表达与多种恶性肿瘤患者生存期较短相关
为进一步探究MUC1高表达对不同恶性肿瘤患者生存期的影响,我们对上述9 种MUC1高表达的恶性肿瘤患者进行总体生存期(overall survival,OS)分析。在乳腺癌(BRCA,P=0.001)、宫颈癌(CESC,P=0.044)、多发性胶质细胞瘤(GBM,P=0.049)、低 级 别 脑 胶 质 瘤(LGG,P=0.000)、 胰 腺 癌(PAAD,P=0.008) 和 胸 腺 癌(THYM,P=0.035)6种肿瘤中,MUC1高表达组患者的OS较短,并具有统计学意义;而在弥漫性大B 淋巴细胞瘤(DLBC,P=0.250)、卵巢癌(OV,P=0.610)和子宫内膜癌(UCEC,P=0.950) 中, 差 异 均 无 统 计 学 意 义(图2)。

图2 9种癌症中MUC1表达与患者OS的关系Fig 2 Relationship between MUC1 expression and OS in 9 kinds of cancers
2.3 MUC1 结合蛋白主要定位于细胞器并与离子通道和酶的活性相关
我们通过质谱发现526 个MUC1 结合蛋白,用String 11.5 在线数据库对质谱数据进行分析。出乎意料的是,MUC1 结合蛋白在细胞器(organelle)中定位最多,其次才是细胞质(cytoplasm) 和膜结构(membrane)等(图3A)。进一步对这些蛋白的分子功能进行分析发现(图3B),排在前面的主要功能是蛋白结合(protein binding)、离子结合(ion binding)和酶活性(catalytic activity)。其他依次为核苷酸结合(nucleotide binding)、 信 号 受 体 结 合(signaling receptor binding)和信号受体活性(signaling receptor activity)。该结果提示MUC1可与不同亚细胞定位的蛋白相互作用,可能参与细胞器、离子通道和酶的功能调控。

图3 MUC1结合蛋白的亚细胞定位和分子功能分析Fig 3 Subcellular localization and molecular function of MUC1-binding proteins
2.4 MUC1 参与细胞应激等重要生理过程并与代谢性疾病和肿瘤密切相关
我们还进一步分析MUC1 结合蛋白涉及的疾病。结果显示,MUC1 结合蛋白主要在解剖实体性疾病(disease of anatomical entity)、细胞增殖性疾病(disease of cellular proliferation)、 代 谢 性 疾 病(disease of metabolism)和癌症(cancer)中发挥作用(图4A)。对MUC1 结合蛋白进行GO 功能分析,这些蛋白主要参与调控细胞应激、代谢过程、发育过程和生物合成过程等(图4B)。用KEGG 富集分析深入研究MUC1结合蛋白的信号通路,发现这些蛋白大多参与代谢相关通路和癌症相关通路(图4C)。这些结果提示MUC1在调控细胞应激、代谢过程、发育过程和生物合成过程中发挥重要作用,并与代谢性疾病和肿瘤密切相关。
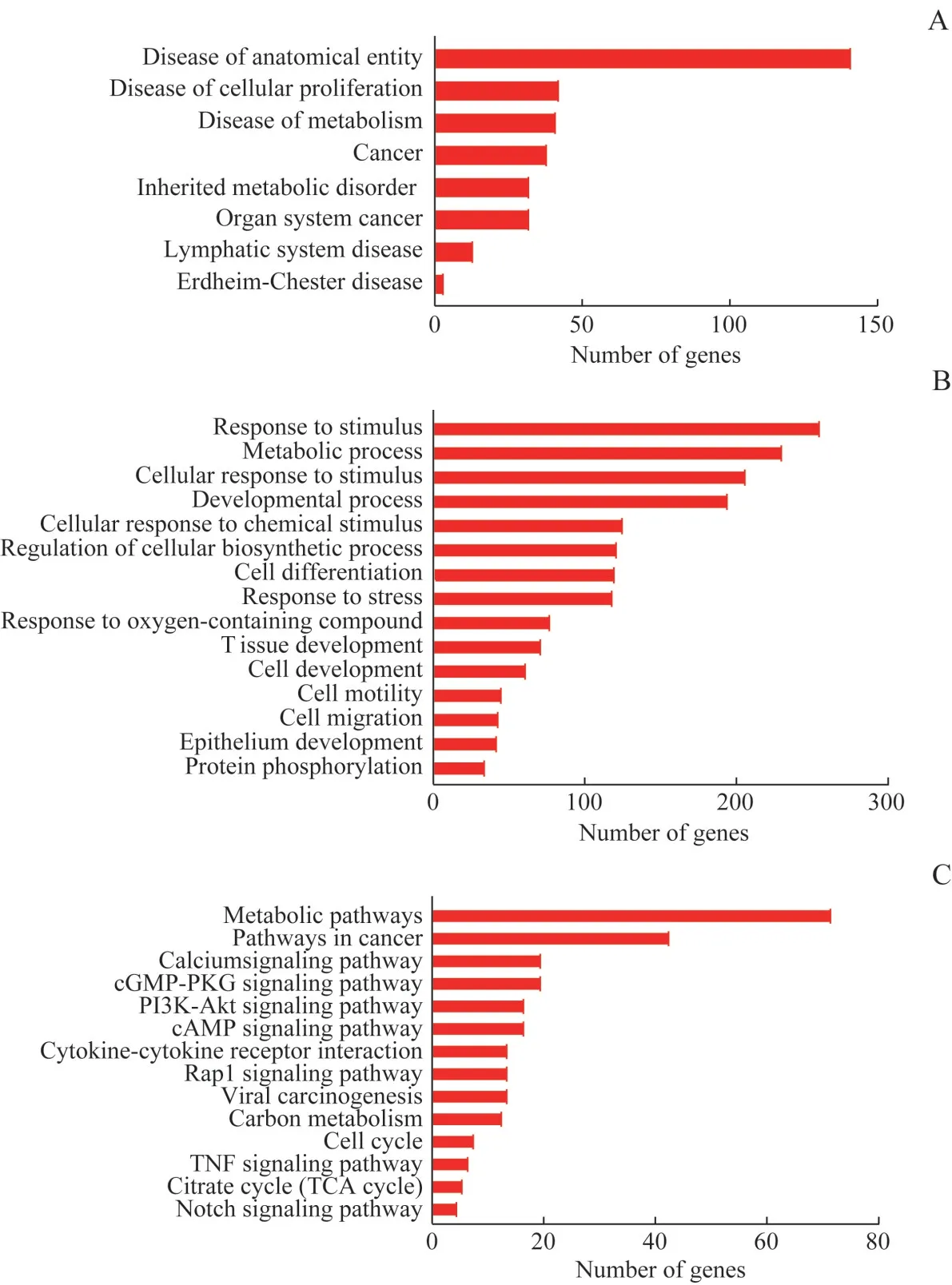
图4 与MUC1结合蛋白有关的疾病、生物学进程和信号通路Fig 4 Diseases,biological processes and signaling pathways associated with MUC1-binding proteins
2.5 MUC1结合蛋白参与调控网络分析
2.5.1 癌症相关通路 对MUC1 结合蛋白的癌症相关通路进行深入分析(图5A),发现主要有:βcatenin、 NOTCH1、 腺 苷 酸 环 化 酶7 (adenylate cyclase 7,ADCY7) 和磷酯酶Cγ-1(phospholipase Cγ 1,PLCG1)等。β-catenin 的上调能激活Wnt/βcatenin (蓝色) 信号通路,促进肿瘤恶性转化。NOTCH1 属于Notch 家族受体,是在肿瘤组织中最常被检测到的。Notch 信号通路(红色)异常与食管癌、胃癌、宫颈癌及结直肠癌密切相关[16]。ADCY7上调会激活cAMP通路介导的抗炎症反应(绿色)和细胞增殖[17]。而PLCG1 上调能激活成纤维细胞生长因 子 受 体1 (fibroblast growth factor receptor 1,FGFR1)信号轴,抑制炎症反应并促进多种肿瘤细胞增殖[18]。这些结果提示MUC1 可与上述蛋白发生相互作用,直接调控癌症相关信号通路来促进肿瘤的发生和发展。
2.5.2 代谢相关通路 从蛋白相互作用关系网络中能发现,MUC1 结合的代谢通路相关蛋白(图5B)主要涉及:三羧酸循环(红色)、脂肪酸代谢(蓝色)和丙氨酸/天门冬氨酸/谷氨酸(绿色)代谢。其中,柠檬酸合酶(citrate synthase,CS)和顺乌头酸酶2(aconitase 2,ACO2)存在于线粒体,均为三羧酸循环中重要的催化酶[19];乙酰辅酶A 乙酰转移酶2(acetyl-CoA acetyltransferase 2,ACAT2)主要在肠道和肝脏中表达,在胆固醇生物合成中发挥重要作用[20]。酰 基 辅 酶A 氧 化 酶1 (acyl coenzyme A oxidase 1,ACOX1)是过氧化物酶体脂肪酸氧化的限速酶,在过氧化物酶体途径的脂肪酸β-氧化中发挥重要作用[21];丙氨酸乙醛酸氨基转移酶(alanineglyoxylate transaminase,AGXT)能将乙醛酸转化为甘氨酸,同时也参与糖异生为细胞供能,而谷氨酸脱氢酶2(glutamate dehydrogenase 2,GLUD2)将谷氨酸可逆氧化脱氨为α-酮戊二酸[22-23]。其中,CS 又和ACAT2 和GLUD2 存在相互作用关系,将三羧酸循环、脂肪酸代谢和氨基酸代谢联系起来。这些结果表明MUC1 结合蛋白之间的相互作用关系和三羧酸循环、脂肪酸代谢和丙氨酸/天门冬氨酸/谷氨酸代谢密切相关。MUC1可能通过调节上述代谢通路发挥促瘤作用。
2.5.3 cGMP-PKG 信号通路 研究[24]表明,cGMP-依赖cGMP 的蛋白激酶(cGMP-dependent protein kinase,PKG)信号的激活能抑制Wnt/β-catenin 通路,进而抑制黑色素细胞瘤的生长。腺苷酸环化酶(adenylate cyclase,ADCY)1/3/7/8 等(红色)属于ADCY 家族,能催化ATP 向cAMP 转化,是cAMP 合成的关键分子[25]。研究表明cAMP上调能激活cAMP交换蛋白(exchange proteins directly activated by cAMP,EPACs)并促进多种肿瘤细胞的增殖和转移[26],同时cAMP 与cGMP 有拮抗作用,cAMP 上调能抑制cGMP-PKG 通路(图5C)。该结果提示MUC1可能参与ADCY1/3/7/8 的结合和调控,通过抑制cGMP-PKG信号发挥促肿瘤作用。
2.5.4 肿瘤坏死因子信号通路 在MUC1 结合蛋白参与的信号通路中,我们还发现肿瘤坏死因子-α(tumor necrosis factor α,TNF-α) 信 号 通 路(图5D)。TNF-α 通路能抑制肿瘤细胞增殖并诱导凋亡[27]。TNF 诱导肿瘤细胞凋亡途径主要有:胱天蛋白酶(caspase)介导的凋亡、NF-κB 凋亡通路和Jun激酶(Jun kinase,JNK)凋亡通路。其中,caspase-8 的活化是caspase 信号通路激活的重要环节,caspase-8 活化后将通过级联反应直接激活下游的caspase-3、caspase-6 和caspase-7,进而裂解细胞骨架蛋白、细胞外基质蛋白和凋亡抑制效应蛋白,使细胞凋亡[28]。丝裂原活化蛋白激酶13(mitogen-activated protein kinase 13,MAPK13)属于MAPK 家族,活化的MAPK13 能被caspase-3 识别、切割并露出催化结构 域[29],促 进 凋 亡。JAG1 属 于Notch 信 号 转 导 配体,JAG1 降低可抑制乳腺癌MDA-MB-231 细胞增殖并诱导JNK 凋亡途径[30]。这些结果表明,MUC1 可能参与调控TNF-α 诱导的多种凋亡途径,影响肿瘤的发生发展。
2.5.5 细胞周期 最后,我们还分析参与细胞周期调控的MUC1 结合蛋白(图5E)。周期蛋白依赖性激酶7(cyclin-dependent kinases 7,CDK7)、周期蛋白H (cyclin-H,CCNH)、检查点激酶1 (checkpoint kinase 1,CHEK1)、转录因子E2/3/4(transcription factor E2/3/4,E2F2/3/4)与细胞周期调控密切相关(红色);其中,CCNH 和CDK7 两者能形成复合物并推进细胞周期进行[31];E2F2和E2F3(蓝色)均为细胞周期激活因子[32]。这些结果提示MUC1 可能与上述蛋白发生相互作用来调控细胞周期。
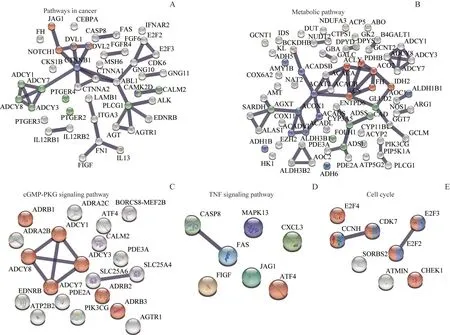
图5 MUC1结合蛋白参与的信号通路Fig 5 Signaling pathways of MUC1-binding proteins
总之,我们通过生物信息学分析发现MUC1结合蛋白参与癌症、代谢、cGMP-PKG、TNF和细胞周期等肿瘤相关信号通路,提示MUC1在调控肿瘤发生发展中的潜在机制。
3 讨论
我们用GEPIA 2对33种肿瘤进行MUC1转录水平分析,发现MUC1在乳腺癌、宫颈癌和弥漫性大B细胞瘤等9种癌症的肿瘤组织中呈现高表达;对这9种癌症进行生存分析发现,在乳腺癌、宫颈癌、多发性胶质细胞瘤、低级别脑胶质瘤、胰腺导管癌和胸腺癌中,MUC1高表达组患者总体生存期较短且有统计学意义。除乳腺癌和宫颈癌之外,我们首次发现在多发性胶质细胞瘤、低级别脑胶质瘤、胰腺癌和胸腺癌共4 种癌症中,MUC1高表达患者的总体生存期较短。
为全面了解MUC1在细胞中的蛋白调控网络,我们通过质谱实验检测到526 个MUC1 结合蛋白并进行GO 分析。令人惊讶的是,作为跨膜蛋白的MUC1,其结合蛋白最多定位于细胞器,其次才是细胞质和细胞膜。MUC1 在细胞器的定位目前仅有线粒体的报道,具体功能不明[33-34]。我们发现MUC1 与CS和ACO2 等三羧酸循环关键酶存在结合,提示MUC1 可能参与调控三羧酸循环。内质网参与磷脂的合成,一部分会被转化为磷脂酰肌醇-4,5-二磷酸(phosphatidylinositol-4,5-bisphosphate,PIP2)组成细胞质膜,当细胞受外界刺激后分解为二酰甘油(diacylglycerol, DAG) 和 三 磷 酸 肌 醇(inositol triphosphate,IP3),后者作为PI3K 前体参与PI3KAkt信号通路(图4C),进而促进肿瘤的发展[35];我们也发现一些MUC1 结合蛋白具有调控钙信号通路(calcium signaling pathway)功能(图4C)。内质网上存在大量钙释放激活的钙通道(Ca2+release activated Ca2+channel,CRAC-C),这些钙离子通道参与调控内质网应激,通过多种机制促进肿瘤生长、耐药和转移[36]。我们的发现与这些细胞器本身的功能相吻合,提示MUC1 可能参与调控多种细胞器功能并影响细胞代谢等生命活动。进一步对MUC1 结合蛋白进行分子功能分析发现,MUC1 结合蛋白主要参与蛋白结合、离子结合和酶活性等功能。有研究[37]表明,MUC1 结合雌激素受体α(estrogen receptor,ERα)并上调Rab31 的转录,而Rab31 又能正反馈促进MUC1 的表达,最终促进乳腺癌恶性转化。EZH2组蛋白甲基转移酶在各类癌症中高表达,而MUC1与EZH2 结合并提高其活性,促进肿瘤发生发展[38];我们的结果与文献报道一致。总之,这些发现表明MUC1 可与不同亚细胞定位的蛋白发生相互作用,可能参与细胞器、离子通道和酶的功能调控,提示更重要的功能有待被挖掘。
对MUC1结合蛋白涉及的疾病进行分析发现,这些蛋白主要涉及解剖实体疾病、细胞增殖性疾病、代谢疾病和癌症。细胞增殖异常和代谢紊乱也可能导致肿瘤的发生发展,与MUC1在肿瘤中发挥的功能相吻合。对MUC1 结合蛋白的GO 生物学进程分析显示,这些蛋白主要在应对外来刺激和代谢过程中发挥功能,除此之外我们也观察到不少蛋白在发育过程(developmental process) 和 上 皮 细 胞 发 育(epithelium development) 中 发 挥 作 用, 这 也 和MUC1 在正常上皮细胞中的保护作用[39]和在小鼠胚胎干细胞中MUC1 降低活性氧(reactive oxygen species,ROS)水平[40]等发现一致。
我们还对MUC1 结合蛋白进行KEGG 通路分析,这些蛋白主要参与到代谢通路和癌症相关通路中。首先,异常的能量代谢是肿瘤的特点。在肿瘤生长过程中,除了经糖酵解和三羧酸循环途径大量生成ATP之外,细胞也需要大量的氨基酸和脂肪等物质[36],GLUD2 和ACAT2 恰为氨基酸和脂肪酸代谢的关键分子。目前尚没有研究表明MUC1和这些代谢通路上的酶存在相互作用,因此我们推测MUC1 可能通过与两者相互作用来提高氨基酸和脂肪酸的代谢水平进而促进肿瘤的发生发展。其次,还发现cAMP、Wnt/β-catenin 和Notch 等促肿瘤信号通路,与报道一致[7,11,41]。另外,我们也发现MUC1与TNF-α凋亡通路存在相互作用。有研究表明MUC1 与caspase-8 竞争结合Fas 相关死亡结构域(Fas-associating protein with a novel death domain,FADD)进而减少细胞凋亡[42],MUC1还可结合JNK1并激活JNK信号通路减少结肠癌细胞凋亡[43],这些报道与我们的发现相一致。此外,我们还发现MUC1 也参与细胞周期的调控。有研究[44-46]表明E2F2 和E2F3 在小细胞肺癌、乳腺癌和前列腺癌等癌症中高表达,对肿瘤细胞增殖具有促进作用。在肿瘤细胞中,周期蛋白依赖性激酶9(cyclin-dependent kinases 9,CDK9)普遍上调从而导致有丝分裂被持续激活[47]。我们首次发现MUC1与CDK7和CCNH 相互作用,因此MUC1调控细胞周期也可能是促进肿瘤增殖的机制之一,此结论有待于进一步研究。
综上,本研究广泛筛查分析MUC1在不同肿瘤细胞中的表达水平和对患者生存期的影响;采用质谱检测到526 种MUC1 结合蛋白,对其进行生物信息学分析并探讨MUC1结合蛋白主要的分子功能、参与的生物学过程和信号通路,创新性地发现多个新的MUC1结合蛋白,为研究MUC1生物学新功能奠定基础。未来的工作将深入研究MUC1与氨基酸和脂肪代谢的关系以及MUC1和细胞周期调控的关系,以揭示MUC1在肿瘤中新的生物学功能和作用机制。
利益冲突声明/Conflict of Interests
所有作者声明不存在利益冲突。
All authors disclose no relevant conflict of interests.
作者贡献/Authors'Contributions
廖春华、邓华云参与实验设计;褚云开参与实验实施、数据总结、论文写作和修改;黄雷全程指导论文写作和修改。所有作者均阅读并同意最终稿件的提交。
The study was designed by LIAO Chunhua and DENG Huayun. The experiment was conducted,the data was summarized and the manuscript was drafted by CHU Yunkai.The project was designed and the manuscript was revised by HUANG Lei.All the authors have read the last version of paper and consented for submission.
·Received:2022-04-01
·Accepted:2022-07-01
·Published online:2022-08-19
参·考·文·献
[1] LI W,HAN Y,SUN C,et al. Novel insights into the roles and therapeutic implications of MUC1 oncoproteinviaregulating proteins and noncoding RNAs in cancer[J]. Theranostics,2022,12(3):999-1011.
[2] LAKSHMANAN I, PONNUSAMY M P, MACHA M A, et al.Mucins in lung cancer: diagnostic, prognostic, and therapeutic implications[J]. J Thorac Oncol,2015,10(1):19-27.
[3] REN J,AGATA N,CHEN D,et al. Human MUC1 carcinoma-associated protein confers resistance to genotoxic anticancer agents[J]. Cancer Cell,2004,5(2):163-175.
[4] MORI Y, AKITA K, TANIDA S, et al. MUC1 protein induces urokinase-type plasminogen activator (uPA) by forming a complex with NF-κB p65 transcription factor and binding to the uPA promoter,leading to enhanced invasiveness of cancer cells[J]. J Biol Chem,2014,289(51):35193-35204.
[5] LI Y, PANG Z, DONG X, et al. MUC1 induces M2 type macrophage influx during postpartum mammary gland involution and triggers breast cancer[J]. Oncotarget,2017,9(3):3446-3458.
[6] RAJABI H,AHMAD R, JIN C, et al. MUC1-C oncoprotein confers androgen-independent growth of human prostate cancer cells[J].Prostate,2012,72(15):1659-1668.
[7] JIN W, LIAO X, LV Y, et al. MUC1 induces acquired chemoresistance by upregulating ABCB1 in EGFR-dependent manner[J]. Cell Death Dis,2017,8(8):e2980.
[8] LV Y,CANG W,LI Q,et al. Erlotinib overcomes paclitaxel-resistant cancer stem cells by blocking the EGFR-CREB/GRβ-IL-6 axis in MUC1-positive cervical cancer[J]. Oncogenesis,2019,8(12):70.
[9] RAINA D, KOSUGI M, AHMAD R, et al. Dependence on the MUC1-C oncoprotein in non-small cell lung cancer cells[J]. Mol Cancer Ther,2011,10(5):806-816.
[10] HUANG L, REN J, CHEN D, et al. MUC1 cytoplasmic domain coactivates Wnt target gene transcription and confers transformation[J].Cancer Biol Ther,2003,2(6):702-706.
[11] HUANG L, CHEN D, LIU D, et al. MUC1 oncoprotein blocks glycogen synthase kinase 3β-mediated phosphorylation and degradation of β-catenin[J]. Cancer Res,2005,65(22):10413-10422.
[12] LI Y,YI H,YAO Y,et al. The cytoplasmic domain of MUC1 induces hyperplasia in the mammary gland and correlates with nuclear accumulation of β-catenin[J]. PLoS One,2011,6(4):e19102.
[13] HUANG L, LIAO X, BECKETT M, et al. MUC1-C oncoprotein interacts directly with ATM and promotes the DNA damage response to ionizing radiation[J]. Genes Cancer,2010,1(3):239-250.
[14] LIAO C,YU L,PANG Z,et al. WWP1 targeting MUC1 for ubiquitinmediated lysosomal degradation to suppress carcinogenesis[J]. Signal Transduct Target Ther,2021,6(1):297.
[15] SZKLARCZYK D, GABLE A L, LYON D, et al. STRING v11:protein-protein association networks with increased coverage,supporting functional discovery in genome-wide experimental datasets[J]. Nucleic Acids Res,2018,47(D1):D607-D613.
[16] ASTER J C, PEAR W S, BLACKLOW S C. The varied roles of Notch in cancer[J]. Annu Rev Pathol,2017,12:245-275.
[17] WANG Y, ZHAI S, XING J, et al. LncRNA GAS5 promotes abdominal aortic aneurysm formation through regulating the miR-185-5p/ADCY7 axis[J]. Anticancer Drugs,2022,33(3):225-234.
[18] KINKL N, HAGEMAN G S, SAHEL J A, et al. Fibroblast growth factor receptor (FGFR) and candidate signaling molecule distribution within rat and human retina[J]. Mol Vis,2002,8:149-160.
[19] MARTÍNEZ-REYES I, CHANDEL N S. Mitochondrial TCA cycle metabolites control physiology and disease[J]. Nat Commun, 2020,11(1):102.
[20] ROMEO S. ACAT2 as a novel therapeutic target to treat fatty liver disease[J]. J Intern Med,2022,292(2):175-176.
[21] VAMECQ J,ANDREOLETTI P, EL KEBBAJ R, et al. Peroxisomal acyl-CoA oxidase type 1: anti-inflammatory and anti-aging properties with a special emphasis on studies with LPS and argan oil as a model transposable to aging[J]. Oxid Med Cell Longev, 2018,2018:6986984.
[22] RODIONOV R N, JARZEBSKA N, WEISS N, et al. AGXT2: a promiscuous aminotransferase[J]. Trends Pharmacol Sci, 2014,35(11):575-582.
[23] PLAITAKIS A, LATSOUDIS H, SPANAKI C. The human GLUD2 glutamate dehydrogenase and its regulation in health and disease[J].Neurochem Int,2011,59(4):495-509.
[24] PIAZZA G A, WARD A, CHEN X, et al. PDE5 and PDE10 inhibition activates cGMP/PKG signaling to block Wnt/β-catenin transcription, cancer cell growth, and tumor immunity[J]. Drug Discov Today,2020,25(8):1521-1527.
[25] ZOU T, LIU J, SHE L, et al. A perspective profile of ADCY1 in cAMP signaling with drug-resistance in lung cancer[J]. J Cancer,2019,10(27):6848-6857.
[26] GAO Z, LEI W I, LEE L T O. The role of neuropeptide-stimulated cAMP-EPACs signalling in cancer cells[J]. Molecules,2022,27(1):311.
[27] DONG Y, CHEN H, GAO J, et al. Molecular machinery and interplay of apoptosis and autophagy in coronary heart disease[J].J Mol Cell Cardiol,2019,136:27-41.
[28] MCILWAIN D R, BERGER T, MAK T W. Caspase functions in cell death and disease[J]. Cold Spring Harb Perspect Biol, 2013, 5(4):a008656.
[29] YUE J, LÓPEZ J M. Understanding MAPK signaling pathways in apoptosis[J]. Int J Mol Sci,2020,21(7):E2346.
[30] PIWARSKI S A, THOMPSON C, CHAUDHRY A R, et al. The putative endogenous AHR ligand ITE reduces JAG1 and associated NOTCH1 signaling in triple negative breast cancer cells[J].Biochem Pharmacol,2020,174:113845.
[31] FUJII W, NISHIMURA T, KANO K, et al. CDK7 and CCNH are components of CDK-activating kinase and are required for meiotic progression of pig oocytes[J]. Biol Reprod,2011,85(6):1124-1132.
[32] DEGREGORI J. The genetics of the E2F family of transcription factors:shared functions and unique roles[J]. Biochim Biophys Acta,2002,1602(2):131-150.
[33] REN J, BHARTI A, RAINA D, et al. MUC1 oncoprotein is targeted to mitochondria by heregulin-induced activation of c-Src and the molecular chaperone HSP90[J]. Oncogene,2006,25(1):20-31.
[34] AHMAD R,ALAM M,RAJABI H,et al. The MUC1-C oncoprotein binds to the BH3 domain of the pro-apoptotic BAX protein and blocks BAX function[J]. J Biol Chem,2012,287(25):20866-20875.
[35] FRUMAN D A, CHIU H, HOPKINS B D, et al. The PI3K pathway in human disease[J]. Cell,2017,170(4):605-635.
[36] CUI C, MERRITT R, FU L, et al. Targeting calcium signaling in cancer therapy[J]. Acta Pharm Sin B,2017,7(1):3-17.
[37] JIN C,RAJABI H,PITRODA S,et al. Cooperative interaction between the MUC1-C oncoprotein and the Rab31 GTPase in estrogen receptorpositive breast cancer cells[J]. PLoS One,2012,7(7):e39432.
[38] RAJABI H, HIRAKI M, TAGDE A, et al. MUC1-C activates EZH2 expression and function in human cancer cells[J]. Sci Rep, 2017,7(1):7481.
[39] MA J,RUBIN B K,VOYNOW J A. Mucins,mucus,and goblet cells[J].Chest,2018,154(1):169-176.
[40] PARK J A, PARK S, CHOI J K, et al. Inhibition of MUC1-C increases ROS and cell death in mouse embryonic stem cells[J]. Int J Stem Cells,2021,14(2):180-190.
[41] HAGIWARA M, YASUMIZU Y, YAMASHITA N, et al. MUC1-C activates the BAF (mSWI/SNF) complex in prostate cancer stem cells[J]. Cancer Res,2021,81(4):1111-1122.
[42] AGATA N, AHMAD R, KAWANO T, et al. MUC1 oncoprotein blocks death receptor-mediated apoptosis by inhibiting recruitment of caspase-8[J]. Cancer Res,2008,68(15):6136-6144.
[43] CHEN Q, LI D, REN J, et al. MUC1 activates JNK1 and inhibits apoptosis under genotoxic stress[J]. Biochem Biophys Res Commun,2013,440(1):179-183.
[44] SUN C C, ZHOU Q, HU W, et al. Transcriptional E2F1/2/5/8 as potential targets and transcriptional E2F3/6/7 as new biomarkers for the prognosis of human lung carcinoma[J]. Aging (Albany NY),2018,10(5):973-987.
[45] TAN P Y, WEN L J, LI H N, et al. miR-548c-3p inhibits the proliferation, migration and invasion of human breast cancer cell by targeting E2F3[J]. Cytotechnology,2020,72(5):751-761.
[46] TYAGI A, AGARWAL C, AGARWAL R. Inhibition of retinoblastoma protein (Rb) phosphorylation at serine sites and an increase in Rb-E2F complex formation by silibinin in androgendependent human prostate carcinoma LNCaP cells: role in prostate cancer prevention[J]. Mol Cancer Ther,2002,1(7):525-532.
[47] EVAN G I, VOUSDEN K H. Proliferation, cell cycle and apoptosis in cancer[J]. Nature,2001,411(6835):342-348.
