阳离子脂质体-siRNA 复合物对K562 细胞凋亡诱导的作用机制
2022-10-21王保全陈江涛申智慧周黎明李文倩史朝辉翟巧玲张永州
王保全 陈江涛 申智慧 周黎明 李文倩 史朝辉 翟巧玲 张永州
1.河南大学淮河医院药学部,河南开封 475004;2.河南大学淮河医院普外科,河南开封 475004;3.河南省肿瘤医院血液科,河南郑州 450009;4.河南大学郑州颐和医院药学部,河南郑州 450047
RNA 干扰(RNA interference,RNAi)是指细胞在发展进程中高度保守的、由双链RNA(doublestranded RNA,dsRNA)诱发的、同源信使RNA(messenger RNA,mRNA)高效特异性降解的现象。其作为基因治疗的一种新模式,始终是当前肿瘤防治研究的热点话题,在治疗上,RNAi 通过递送小RNA 双链结合体,包括内源性微RNA、外源性干扰小RNA(small interfering RNA,siRNA),短发夹RNA(short hairpin RNA,shRNA)等实现基因干预效应。但siRNA 进入人体后易被人类血清中的核糖核酸酶家族降解,且由于siRNA 自身电荷特异性难以进入正常细胞内,所以对siRNA 递送体系的研究是将siRNA 应用于临床治疗的一大挑战。基因载体主要分为病毒载体和非病毒载体。病毒载体质粒转染效率高,但对人体毒性过大影响其临床应用;非病毒载体可填补病毒载体的部分不足,近年来备受重视。如脂质体介导的基因组转化与病毒载体比较,优势凸显。阳离子脂质体携带的正电荷可中和siRNA 带有的负电荷,形成具有紧密结构的复合物,极大地延长循环时间,促进siRNA 递送。本研究以K562 细胞为研究对象,选择阳离子磷脂、硫酸鱼精蛋白、小牛胸腺DNA,制备新型阳离子脂质体-siRNA 复合体,观察其对K562 细胞生长的影响,并探讨其可能的分子机制。
1 材料和方法
1.1 试剂与仪器
1,2 二油酰基-3-三甲基氨基丙烷(美国Sigma公司),胆固醇、小牛胸腺DNA、琼脂糖(上海生物工程有限公司),DNA-Marker(上海生物工程有限公司),吖啶橙(美国Sigma 公司),反转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)试剂盒(大连宝生物公司),胎牛血清(美国Introgen 公司),RPMI-1640 培养基(美国Hyclone 公司),二甲亚砜(DMSO,上海生物工程有限公司),MTT 细胞增殖与毒性检测试剂盒(杭州碧云天公司),聚合酶链反应(polymerase chain reaction,PCR)仪(美国Bio 公司),JEM-4000透射电子显微镜(日本岛津公司),FTS-3000 傅里叶红外光谱仪(美国戴尔公司),其他试剂均为分析纯,根据bcr/ablmRNA 碱基序列5′-AAGCGUUC AAGCUUCAGCGGCAGGUA-3′设计siRNA;所有序列和引物均由上海生物工程有限公司合成。
1.2 实验细胞
K562 细胞(购自河南省肿瘤医院)在含100ml/L胎牛血清、100U/L 青霉素、100mg/L 链霉素的RPMI-1640 培养基中,放置于37℃、50ml/L CO的培养箱中传代,每隔3~5d 传代1 次,取对数期细胞以磷酸盐缓冲液(phosphate buffered saline,PBS)调整浓度至2×10/L 进行试验。
1.3 方法
1.3.1 空白脂质体的制备 采用逆向蒸发法制备,将磷脂与胆固醇(摩尔比3∶1,2∶1,1∶1)置于25ml 茄形瓶中,超声溶入5ml 氯仿,旋蒸15min(水浴25℃,压力0.06MPa)形成均匀的分散膜,加入5ml HO,置于旋蒸仪上旋蒸水合50min(水浴50℃,常压),超声5min,过0.45/0.22μm 滤膜,以HEPES和100mmol/L NaCl 稀释后备用。
1.3.2 脂质体-siRNA 复合物的制备、表征 混合小牛胸腺细胞DNA 和siRNA,添加不同配比的硫酸鱼精蛋白(按siRNA 与小牛胸腺质量比为1∶0.5~2.1),再添加空白脂质体(按siRNA 与磷脂比值为1∶100~1000),室温下孵育15~20min,孵育后的脂质体-siRNA 复合物固定在碳支持膜上,以负染剂(20ml/L 磷钨酸)洗染约20min,使用JEM-4000EX透射电镜观察脂质体复合物形态。
1.3.3 脂质体-siRNA 复合物对K562 细胞生长的抑制作用 取对数生长期K562 细胞,以2×10/L 的密度接种于96 孔板上,每孔接种2×10个细胞,放置于37℃、500ml/L CO培养箱中培养12h 后,分别加入100、150、200、250、300μmol/L 的脂质体-siRNA复合物,以不加任何药物的K562 细胞混悬液为对照组,并设有调零孔(只含RPMI-1640 培养液),每组设4 个复孔,持续培育24、48 和72h 后,每孔加入20μl MTT 试剂,在培育箱中持续培育4h 后,弃去培养液,加入二甲亚砜200μl,摇床上震荡10min,将酶标仪调零,测定值,实验重复3 次,计算细胞生长抑制率。细胞生长抑制率=(1-处理组值/对照组值)×100%,重复测量3 次取平均值。
1.3.4 脂质体-siRNA 复合物在K562 细胞中表达的荧光显微镜观察 实验另设空白对照组、单siRNA 组、Lipofectamine+siRNA 组、脂质体+siRNA 组和脂质体-siRNA 复合物组(siRNA 以荧光标记),将各递送系统与K562 细胞孵育12h 后从培养箱中取出,弃去培养基,预冷PBS 洗涤,40ml/L 多聚甲醛固定45min,PBS 再洗涤,加入20mg/L 的PI 染色液30min后以PBS 洗涤,加盖玻片以甘油封片,置于荧光显微镜下观察。
1.3.5 脂质体-siRNA 复合物对K562 细胞凋亡的影响 收集K562 细胞和脂质体-siRNA 复合物处理48h 后的K562 细胞,700ml/L 乙醇4℃固定过夜,预冷PBS 洗涤细胞3 次,加1g/L 核糖核酸酶A 200μl,37℃孵育30min,加入100μg/l 碘化丙啶染色液800μL,混匀,4℃避光静置30min 后进行检测,上流式细胞仪测定DNA 水平,分析细胞周期分布直方图。
1.3.6 K562 细胞bcl-2、bax、caspase-3 蛋白表达的检测 将K562 细胞接种在培养皿中,待细胞处于对数生长期且细胞密度为80%时,将脂质体-siRNA 复合物加入不同的培养皿中,并将最终浓度调整为100、150、200、250、300μmol/L。培养48h 后,在4℃下离心15min,收集细胞,添加细胞裂解液以收集总细胞蛋白,采用BCA 法测定蛋白浓度,制备100g/L SDS-PAGE 凝胶电泳2.0~2.5h。膜转移2h后,将蛋白质转移到硝酸纤维膜上,用50g/L TBST制备的脱脂乳密封1h。滴加一抗bcl-2、bax(1∶200稀释)、caspase-3(1∶1000 稀释),4℃孵育过夜,随后回收一抗并以TBST 洗涤膜3 次,每次5min。使用ECL 超敏溶液进行发光显影,用GAPDH 检测作为内部参考。ImageJ 软件分析目标蛋白和内部参考蛋白的灰度值,蛋白质相对表达=目标灰度值/内部参考灰度值。
1.3.7 实时荧光定量RT-PCR 检测K562 细胞内mRNA的表达 采用一步法提取细胞总RNA。琼脂糖凝胶电泳鉴定RNA 质量,分光光度计测定RNA 浓度。根据试剂盒的操作进行cDNA 逆转录。实时荧光定量PCR 检测bcl-2、bax 和caspase-3 基因表达,用MGB 标记bcl-2、bax 和caspase-3 基因,用FAM 标记GAPDH 基因,扩增条件:95℃预变性2min,再变性15s,复性60s,共40 个周期,每次设置多个试管作为阴性对照,以GAPDH 为内标,10g/L 琼脂糖凝聚电泳后,通过GIS 数字凝胶图像处理系统获得PCR 产物的吸光度值,以各组bcl-2、bax 和caspase-3的值/GAPDH 的值表示各mRNA 表达水平,各引物和探针序列见表1。
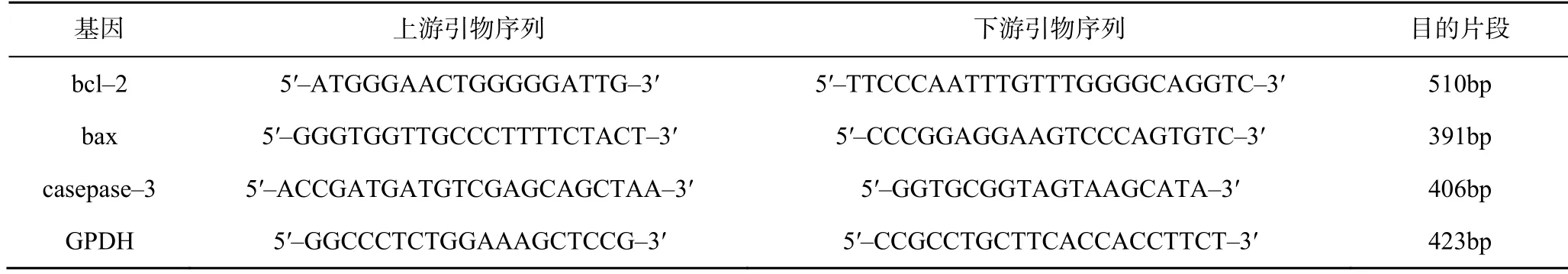
表1 相关因子引物及引物序列
1.4 统计学方法
2 结果
2.1 脂质体-siRNA 复合体对K562 细胞的生长抑制作用
MTT 法检测结果显示,不同浓度的脂质体-siRNA 复合物对K562 细胞均具有抑制作用,浓度为100、150、200、250、300μmol/L 的脂质体-siRNA复合物作用48h 后对K562 细胞的抑制率分别为(21.10±3.55)%、(35.32±5.21)%、(63.89±5.61)%、(90.54±8.51)%和(85.75±4.79)%,浓度为250μmol/L 的脂质体-siRNA 复合物对K562 细胞的抑制作用最强(<0.05),见图1。
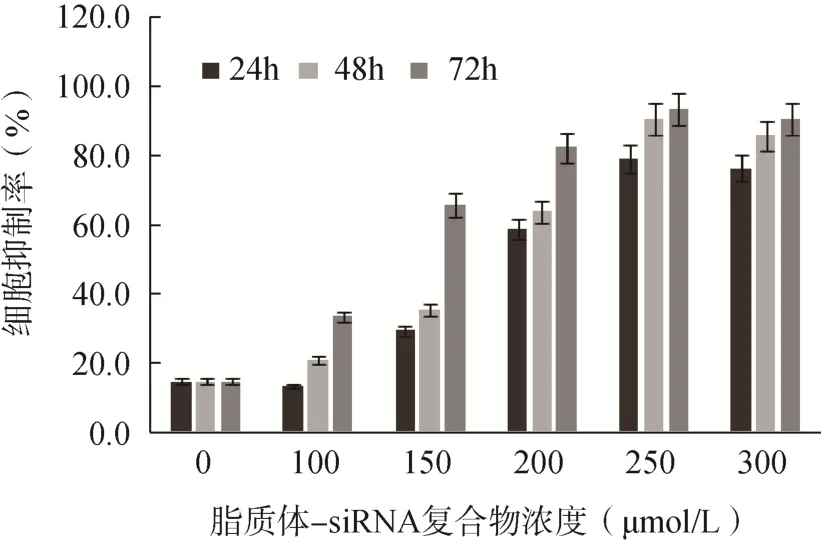
图1 脂质体-siRNA 复合物对K562 细胞的生长抑制作用
2.2 脂质体-siRNA 复合物对K562 细胞周期的影响
固定脂质体-siRNA 复合物浓度为250μmol/L(实验组),实验组的G期细胞显著多于对照组(<0.05),S 期和G/M 期细胞显著少于对照组(<0.05),见表2。
表2 两组细胞周期分布比较(,%)
2.3 荧光显微镜观察siRNA 的入胞效果
荧光显微镜观察FAM标记siRNA各组递送系统转染K562 细胞12h 后入胞效能,结果显示,单siRNA组具有一定的入胞效能,但远低于其他各组入胞效能,小牛胸腺DNA 和鱼精蛋白可显著提高siRNA 入胞效能,且新型脂质体-siRNA 复合物具备较大的质粒转染能力(<0.05),见图2。
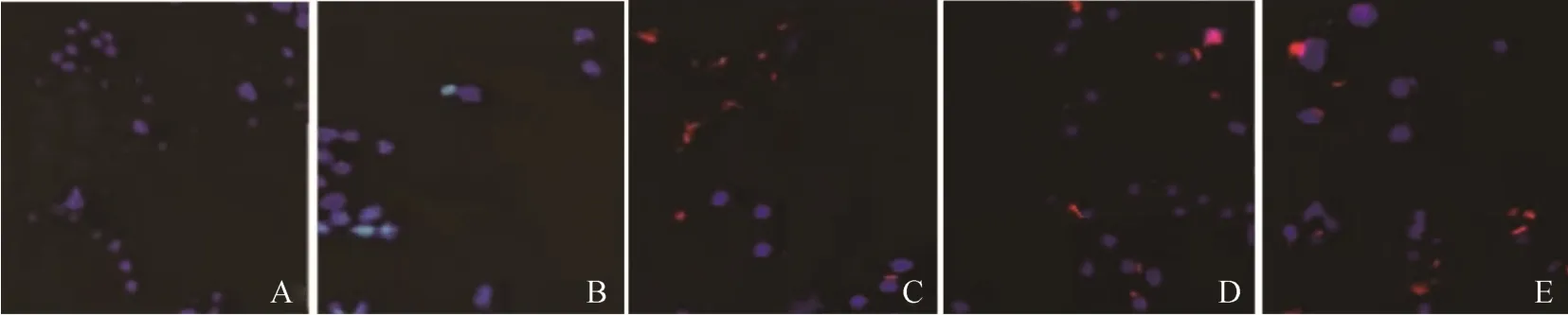
图2 各组脂质体-siRNA 复合物荧光显微镜观察结果(FAM 荧光标记,×200)
2.4 脂质体-siRNA 复合物对bcl-2、bax 和capase-3 mRNA 表达的影响
脂质体-siRNA 复合物在转染K562 细胞后48h,随着复合物浓度的增加,K562 细胞bcl-2 mRNA 表达水平显著下降,bax、caspase-3 mRNA 表达水平显著升高(<0.05),其中脂质体-siRNA 复合物浓度为250μmol/L 时,bcl-2、bax 和caspase-3 mRNA 表达水平变化最为显著,见图3。
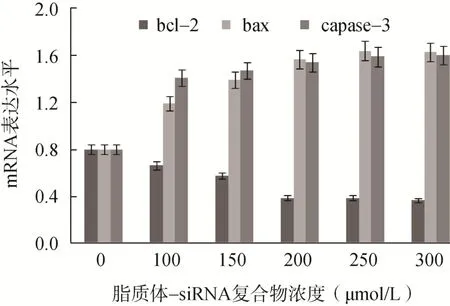
图3 脂质体-siRNA 复合物对bcl-2、bax 和capase-3 mRNA 表达水平的影响
2.5 脂质体-siRNA 复合物对bcl-2、bax 和caspase-3蛋白质表达的影响
蛋白质印迹法检测结果显示,脂质体-siRNA 复合物转染K562 细胞48h 后,对细胞内bcl-2、bax和caspase-3 蛋白表达均呈现不同程度的影响,随着复合物浓度的增加,bcl-2 蛋白表达水平逐渐下降,bax、caspase-3 蛋白表达水平逐渐增加(<0.05),见图4。
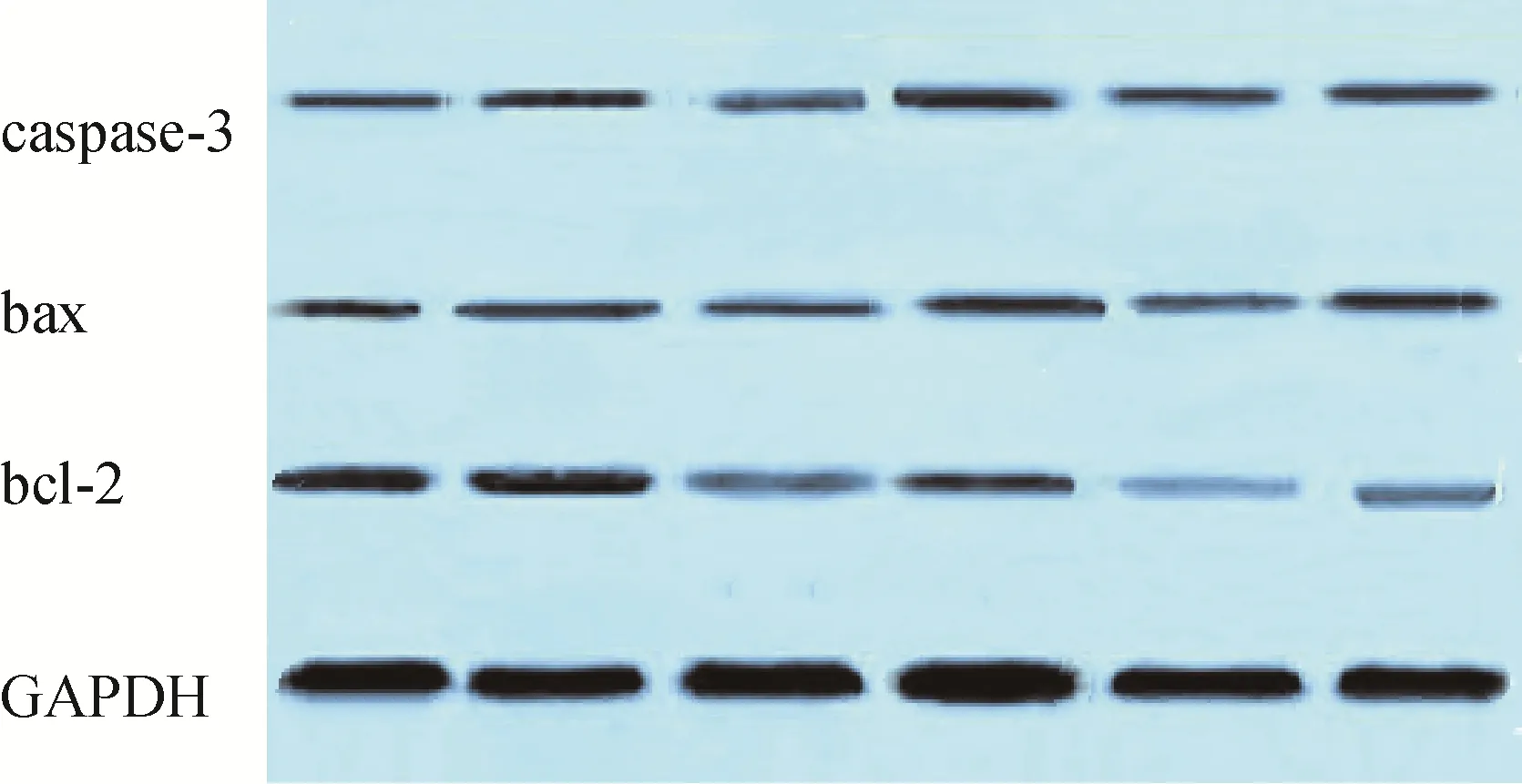
图4 蛋白质印迹法检测bcl-2、bax、caspase-3蛋白表达水平
3 讨论
慢性粒细胞白血病(chronic myelogenous leukemia,CML)是一类造血干细胞异常的克隆性疾病,bcr-abl融合基因的异常表达是其显著特征。研究显示,bcr-abl 基因是由9 号染色体上abl 与22 号染色体上bcr 相互易位形成的融合基因,该基因编码的BCR-ABL 融合蛋白具有较强的酪氨酸激酶活性,可通过多个信号转导途径使细胞发生恶性转化。伊马替尼是首个用于临床的选择性酪氨酸激酶抑制剂,可大大提高CML 患者的生存率,然而长期用药后患者会出现耐药情况。因此,在酪氨酸激酶抑制剂治疗的基础上,寻找新的治疗策略意义重大。
siRNA 作为基因治疗的一种新模式,始终是当前肿瘤防治研究的热点。siRNA 长约21nt,且3’端有两个碱基凸出,可解决反义核酸技术治疗难题。但裸siRNA 进入人体后易被核糖核酸酶降解,因此,选择合适的载体就显得十分重要,阳离子脂质体作为DNA、RNA 载体常用于基因治疗,研究发现,阳离子脂质体与肿瘤新生血管内皮上带负电荷的蛋白聚糖、磷脂、过唾液酸化和过糖基化膜蛋白发生静电作用,从而形成被动靶向作用。Khan 等研究显示,以脂肪酸合成酶为靶点,通过使用人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)抗体修饰的脂质体包裹siRNA 可抑制HER-2 阳性乳腺癌细胞增殖。Atu027 是一种由阳离子脂质体AtuFECT01 介导的siRNA 释放的脂质体释放系统,可抑制蛋白激酶N3 在血管内皮中的表达,减轻肿瘤炎性反应,在临床试验中表现出良好的抗肿瘤活性。动物研究发现,阳离子脂质体能使药物在肿瘤部位富集,抑制肿瘤组织生长,从而延长动物生存时间,降低肿瘤药物毒性。本研究采用转染性较强的阳离子脂质体,设计针对K562 细胞中特异的bcr-abl 基因siRNA 并体外化学合成,用阳离子脂质体包裹siRNA,体外转染CML K562 细胞,与商品化转染试剂相比较,取得良好的实验效果,为新药研发及临床治疗、预防CML 提供了一个新的研究方向。
