鸽源性大肠杆菌的分离鉴定及茶多酚对其体外抑菌效果的研究
2022-10-20钟雅静朱少平陈艾玲马婷婷黄燕华
钟雅静,朱少平,陈艾玲,马婷婷,邓 珊,黄燕华,3,付 晶
(1.仲恺农业工程学院健康养殖创新研究院,广州 510225;2.仲恺农业工程学院动物科技学院,广州 510225;3.岭南现代农业科学与技术广东省实验室,广州 510640)
大肠杆菌(Escherichiacoli)引起的鸽大肠杆菌病是肉鸽养殖业中常见的细菌性疾病之一,主要经呼吸道和消化道感染,全年均可发生,各年龄段的鸽都可感染。该病以精神沉郁、食欲减退和腹泻等为临床症状,心包炎、败血症和腹膜炎等为典型病理变化[1-2],并且常与其他病毒病及支原体病混合感染,增加患病鸽的死亡率,给肉鸽养殖业造成巨大的经济损失。与此同时,养殖生产中抗生素的滥用,使大肠杆菌耐药菌株快速形成,并且在鸽肉和鸽蛋中药物残留现象日趋严重,给人类健康带来极大威胁。因此,探寻安全、有效和绿色防治大肠杆菌病的抗生素替代品,成为肉鸽养殖业的研究热点之一。
茶多酚(TP)主要来源于茶叶,由30多种多酚类物质组成,儿茶素的含量占其总含量中的60%~80%,具有抑菌、抗病毒、抗氧化和免疫调节等生物活性功能[3]。研究表明,茶多酚的抑菌作用具有高效广谱性和选择性,对变形球菌[4]、金黄色葡萄球菌[5]、鼠伤寒沙门氏菌[6]和大肠杆菌[7]等多种肠道致病菌均有抑制效果,还能促进益生菌的增殖[8]。因此,将茶多酚作为植物性抑菌剂运用于肠道细菌性疾病的防治具有一定的前景。但目前茶多酚对鸽细菌性疾病影响的研究仍未见报道。
广州市某规模化鸽场部分种鸽出现精神沉郁,食欲和渴欲降低或废绝,羽毛松乱,呆立,消瘦和排黄白色或黄绿色稀粪等症状,疑似鸽大肠杆菌病。基于此,本研究在无菌条件下采集发病鸽的粪便,通过细菌分离纯化、革兰氏染色镜检、16S rRNA基因测序和构建系统进化树等技术对病原菌进行鉴定,并检测病原菌的药物敏感性和毒力基因携带情况,旨在确定广州市某规模化鸽场腹泻病例的病原菌。同时观察茶多酚对该病原菌的体外抑菌效果,以期为茶多酚对鸽大肠杆菌病的防治提供一定的科学依据。
1 材料与方法
1.1 菌株
试验致病菌株分离自广州市某规模化鸽场的病料样品。大肠杆菌标准菌株ATCC 25922购自青岛海博生物技术有限公司。
1.2 主要试剂与仪器
营养琼脂培养基、麦康凯琼脂培养基、伊红美蓝琼脂培养基、三糖铁琼脂培养基、LB肉汤培养基、MH琼脂培养基、甘油、琼脂粉和胰蛋白胨均购自青岛海博生物技术有限公司;10种药敏纸片均购自温州市康泰生物科技有限公司;2×TaqMasterMix和DM2000 DNA Maker均购自江苏康为世纪生物技术股份有限公司;Gene Red核酸染料购自天根生化科技(北京)有限公司;革兰氏染色试剂盒、50×TAE溶液和茶多酚(纯度≥98.0%)均购自北京索莱宝科技有限公司;细菌总RNA提取试剂盒购自北京全式金生物技术股份有限公司;反转录试剂盒购自TaKaRa公司;ABI PowerUPTMSYBRTMGreen预混液购自赛默飞世尔科技公司。
恒温气浴振荡器购自常州市国旺仪器制造有限公司;生化培养箱购自上海慧泰仪器制造有限公司;普通PCR仪、化学发光荧光成像仪和荧光定量PCR仪均购自伯乐公司;紫外分光光度计购自上海美谱达仪器有限公司。
1.3 病原菌的分离纯化和染色镜检
在无菌超净台内,将适量粪便样品稀释于5 mL无菌生理盐水制备悬浊液,混匀后吸取100 μL悬浊液涂布于营养琼脂培养基,37 ℃生化培养箱中培养12 h,观察并记录菌落生长情况;随后挑取培养基中的单菌落进行纯化培养,重复该操作3次,纯化后的病原菌与50%甘油1∶1混合保存;挑取纯化后的菌落分别接种于三糖铁、麦康凯和伊红美蓝琼脂培养基中,在37 ℃生化培养箱中培养12~24 h,观察并记录菌落形态,同时挑取典型菌落进行常规革兰氏染色镜检。
1.4 病原菌的16S rRNA基因测序和系统进化树的构建
灭菌枪头挑取病原菌单菌落溶解于100 μL ddH2O制备细菌模板,采用细菌16S rRNA通用引物(27F:5′-AGAGTTTGATCMTGGCTCAG-3′和1492R:5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增。PCR反应体系共25 μL:2×TaqMasterMix 12.5 μL,细菌模板1.25 μL,引物27F和1492R各1.25 μL,ddH2O 8.75 μL。PCR反应条件:94 ℃预变性2 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸2 min,共32个循环;72 ℃再延伸10 min,最后4 ℃保存。反应结束后,取1 μL的PCR扩增产物在2.0%琼脂糖凝胶进行电泳,并于化学发光荧光成像仪上观察并拍照记录。将PCR扩增阳性产物送往生工生物工程(上海)股份有限公司进行16S rRNA基因测序,并将测序结果上传至NCBI网站的GenBank数据库中进行Blast序列相似性比对分析。采用Mega 5.0软件中邻接法(Neighbor-Joining)构建基于病原菌、不同宿主的大肠埃希氏菌和5种常见致病性大肠埃希氏菌16S rRNA序列的系统进化树。
1.5 病原菌的药物敏感性试验
试验采用纸片扩散法,以大肠杆菌ATCC 25922作为质控菌株。向新鲜病原菌菌液中加入生理盐水,调制菌液浊度至0.5麦氏单位,用无菌钢珠将适量的菌液均匀涂布于MH琼脂培养基的表面,待培养基表面稍干后贴上药敏片,37 ℃生化培养箱中培养16~20 h,使用游标卡尺测量抑菌圈的直径(mm),并以抗菌药物敏感性判定标准[9]判断病原菌对各抗生素的敏感性。
1.6 检测病原菌携带的毒力基因
参考已报道的序列[10-12]合成大肠杆菌毒力基因fliC、fimH、iroN、hlyF、papC、vat、ibeA和iss的引物,引物信息见表1,参照1.4中的PCR方法检测病原菌携带的毒力基因。

表1 毒力基因引物Table 1 Primers of virulence gene
1.7 茶多酚的体外抑菌效果
1.7.1 茶多酚对病原菌的最低抑菌浓度(MIC)和最低杀菌浓度(MBC) 参考高瑞娟等[13]报道的方法、试验操作和判定标准测定茶多酚对病原菌的MIC和MBC。茶多酚的质量浓度分别为125、250、500、1 000、2 000、4 000和8 000 μg/mL。
1.7.2 茶多酚对病原菌生长的影响 取适量4 mg/mL茶多酚溶液与等量双倍浓度LB肉汤培养基混合,配制2 000 μg/mL的茶多酚母液培养基。将茶多酚母液培养基倍比稀释至浓度分别为125、250、500和1 000 μg/mL的茶多酚培养基。空白对照组为LB肉汤培养基,不作任何处理。取混匀、等量的新鲜病原菌菌液分别接种于各组的培养基中,在37 ℃ 200 r/min恒温气浴振荡器培养,接种后的第0、2、4、6、8、10、12和24 h使用紫外分光光度计测定各组培养基在600 nm时的吸光值(D600 nm值),每组3个重复。
1.7.3 茶多酚对病原菌运动的影响 试验处理及分组同1.7.2。取混匀、等量的新鲜菌液2 μL分别接种于各组的半固体琼脂培养基平板的中心,在37 ℃生化培养箱培养12 h,观察、拍照并测量记录各组平板中病原菌从接种点向四周扩散生长的运动直径(mm),每组3个重复。
1.7.4 茶多酚对病原菌毒力基因表达量的影响 试验设置不同浓度茶多酚组和空白对照组,茶多酚组试验浓度根据1.7.2和1.7.3试验结果决定,培养基的配制同1.7.2。取混匀、等量的新鲜病原菌菌液分别接种于各组的培养基中。各组培养基在37 ℃ 200 r/min恒温气浴振荡器培养12 h后,取适量菌液按照细菌总RNA提取试剂盒和反转录试剂盒的说明提取细菌RNA并制备cDNA模板。根据1.6的结果,采用实时荧光定量PCR法测定各组细菌毒力基因的表达,以大肠杆菌管家基因uidA为内参基因。PCR反应体系20 μL:SYBR Green MasterMix 10 μL,cDNA 1 μL,上、下游引物各1 μL,ddH2O 7 μL。PCR反应条件:95 ℃预变性2 min;95 ℃变性15 s,60 ℃退火1 min,共循环40次;测定熔解曲线,通过公式RQ=2-△△CT计算目基因的相对表达量。
1.8 统计与分析
试验数据采用GraphPad Prism 5进行单因素方差分析(One-way ANOVA);并采用Tukey法进行多重比较,以P<0.05表示差异显著,P>0.05表示差异不显著。
2 结 果
2.1 病原菌的分离纯化和染色镜检
病原菌在三糖铁琼脂培养基接种病原菌后,培养基斜面先呈黄色后转为红色,底部始终保持黄色,并且有气泡产生(图1A);在营养琼脂培养基上长出白色、中间隆起、边缘整齐、表面光滑的圆形菌落(图1B);在麦康凯琼脂培养基上长出鲜桃红色、菌落中心呈深桃红色、圆形、扁平、边缘整齐、表面光滑的菌落(图1C);在伊红美蓝琼脂培养基上长出带有金属光泽的黑色、中间隆起、圆形、表面光滑、边缘整齐的菌落(图1D);病原菌革兰氏染色、镜检后可见粉红色,两端钝圆,单个、成对或成丛排列,无荚膜和芽孢的短小杆菌(图1E),与革兰氏阴性菌形态相符。根据临床症状、分离培养特性和细菌形态学观察的结果,初步证实病原菌为大肠杆菌,命名为GG20210604。
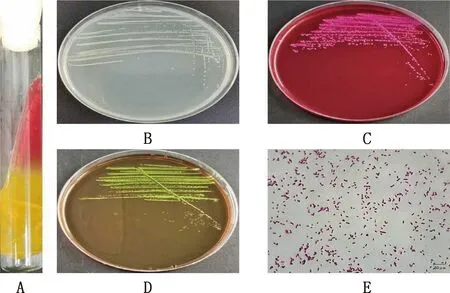
A,在三糖铁琼脂培养基上的菌落形态;B,在营养琼脂培养基上的菌落形态;C,在麦康凯琼脂培养基上的菌落形态;D,在伊红美蓝琼脂培养基上的菌落形态;E,革兰氏染色镜检形态(1 000×) A,Colony morphology in TSI medium;B,Colony morphology in NA medium;C,Colony morphology in MAC medium;D,Colony morphology in EMB medium;E,Gram stain morphology (1 000×)图1 病原菌分离纯化和染色镜检Fig.1 Isolation,purification and microscopic examination of pathogenic bacteria
2.2 16S rRNA基因测序和系统进化树的构建
将GG20210604的16S rRNA扩增产物在2.0%琼脂糖凝胶电泳后得到单一条带,条带大小约1 500 bp(图2),经16S rRNA基因测序证实,该PCR扩增产物大小为1 445 bp,与预期的基因片段大小相符。将GG20210604的16S rRNA序列在NCBI进行Blast相似性比对分析,结果显示GG20210604与GenBank中收录的大肠杆菌(登录号:CP057638.1)相似性最高,为99.8%。系统进化树分析发现,GG20210604与大肠杆菌在同一分支(图3)。结合上述菌落和革兰氏染色形态以及16S rRNA基因测序和系统进化树结果,最终确定GG20210604为大肠杆菌。

图2 GG20210604的16S rRNA基因片段PCR扩增结果Fig.2 PCR amplification results of 16S rRNA gene fragment of GG20210604

图3 基于 16S rRNA基因序列的系统进化树Fig.3 Phylogenetic tree based on 16S rRNA gene sequence
2.3 药物敏感性试验
由表2可知,GG20210604对头孢唑林、庆大霉素、磺胺甲噁唑、头孢呋辛、头孢哌酮和丁胺卡那敏感,对链霉素和头孢噻吩中度敏感,对环丙沙星和氨苄西林耐药。

表2 药敏试验结果Table 2 Drug sensitivity test results
2.4 毒力基因检测结果
由图4可知,GG20210604毒力基因检测中,PCR扩增出与fliC、fimH、iroN和hlyF基因预期大小一致的条带,未扩增出与papC、vat、ibeA和iss基因预期大小一致的条带,说明GG20210604携带fliC、fimH、iroN和hlyF毒力基因。

M,DM2000 DNA Marker;1,fliC基因;2,fimH基因;3,iroN基因;4,hlyF基因;5,papC基因;6,vat基因;7,ibeA基因;8,iss基因;M,DM2000 DNA Marker;1,fliC gene;2,fimH gene;3,iroN gene;4,hlyF gene;5,papC gene;6,vat gene;7,ibeA gene;8,iss gene图4 GG20210604毒力基因的PCR扩增结果Fig.4 PCR amplification results of virulence genes of GG20210604
2.5 茶多酚的体外抑菌效果
2.5.1 茶多酚对GG20210604的MIC和MBC 37 ℃生化培养箱中培养24 h后,阴性孔内肉汤澄清,无细菌生长。对照孔内可见肉汤浑浊,细菌生长良好。茶多酚对GG20210604的MIC和MBC均为4 000 μg/mL。
2.5.2 茶多酚对GG20210604生长的影响 由图5可知,与空白对照组相比,250、500和1 000 μg/mL茶多酚组各阶段的吸光值均显著降低(P<0.05),说明茶多酚能有效减缓GG20210604的生长速率。其中,500和1 000 μg/mL茶多酚对GG20210604生长的抑制效果无显著差异(P>0.05)。
2.5.3 茶多酚对GG20210604运动的影响 由图6可知,与空白对照组相比,各浓度茶多酚组GG20210604的运动直径均显著降低(P<0.05),125、250、500和1 000 μg/mL茶多酚组的GG20210604运动直径分别为空白对照组的46.01%、13.34%、11.54%和8.56%。

A,GG20210604在茶多酚半固体琼脂培养基的运动图;B,茶多酚对GG20210604运动直径影响的柱状图 A,GG20210604 movement image in TP soft agar plates;B,Histogram of the effect of TP on the diameter of GG20210604图6 茶多酚对GG20210604运动的影响Fig.6 Effect of TP on the movement of GG20210604
2.5.4 茶多酚对GG20210604毒力基因表达的影响 综上,当茶多酚浓度为500和1 000 μg/mL时,对GG20210604生长和运动的影响无显著差异,因此本试验只检测250和500 μg/mL茶多酚对GG20210604毒力基因表达的影响。结果见图7,与空白对照组相比,250 μg/mL茶多酚组GG20210604的fimH基因的表达显著降低(P<0.05);250和500 μg/mL茶多酚组GG20210604的fliC、iroN和hlyF基因的表达均显著降低(P<0.05)。

图7 茶多酚对GG20210604毒力基因表达的影响Fig.7 Effect of TP on virulence gene expression of GG20210604
3 讨 论
近年来肉鸽养殖业发展十分迅速,但随之而来的养殖密度增大、鸽舍通风不良导致氨气等有害气体含量高和饲养管理不当等因素导致的传染病暴发屡见不鲜。鸽大肠杆菌病是危害肉鸽养殖业发展的常见传染病之一[2],本研究从疑似感染大肠杆菌病的鸽粪便中分离到1株致病菌株,经分离纯化、染色镜检、16S rRNA基因测序和系统进化树分析,证实该菌株是大肠杆菌,并命名为GG20210604。从药敏试验结果观察到,GG20210604对环丙沙星和氨苄西林耐药,菌株耐药性的产生可能与生产管理中抗生素使用频繁、使用种类单一以及耐药质粒的水平传播有关,建议该鸽场在今后临床治疗中合理规范用药,采取联合、交替用药方式,避免多重耐药菌株的产生。同时可以选择中兽药、植物提取物等天然抗菌剂进行治疗,减少耐药菌株的出现。大肠杆菌的致病性通常由多种毒力因子如黏附素、摄铁系统、脂多糖和侵袭素等相互协调发挥作用,已有研究表明,大肠杆菌的致病性与携带的毒力因子的数量具有显著相关性[14]。因此检测大肠杆菌携带毒力基因对于其致病能力的评估有重要意义。Ewers等[15]认为,非致病性大肠杆菌没有或至多含有3个毒力基因,而致病性大肠杆菌至少含有4个毒力基因。iutA、hlyF、iss、iroN和ompT5个基因与禽致病性大肠杆菌的致病性显著相关[16]。毒力基因检测结果表明,GG20210604携带fliC、fimH、iroN和hlyF4种毒力基因。根据GG20210604的药物敏感性和毒力基因检测结果并结合病死鸽临床症状,提示GG20210604具有一定毒力,对宿主具有较强的致病性,养殖户应加强日常饲养管理,加大对鸽大肠杆菌病的防控力度。
大量研究表明,茶多酚可通过破坏细菌细胞壁膜结构、改变菌体正常形态、细胞内容物外泄、抑制蛋白质合成与表达、影响细菌DNA的转录与复制和与金属离子络合等方式发挥抑菌的生物特性[3]。本试验通过茶多酚对GG20210604的体外抑菌试验发现,茶多酚对鸽源性大肠杆菌具有良好的抑菌效果。试验结果表明,茶多酚对GG20210604的MIC和MBC均为4 000 μg/mL。Ma等[7]试验中,茶多酚对ETEC K88的MIC和MBC分别是5 000和10 000 μg/mL,与本试验结果不相同,可能与菌株的来源和耐药性以及茶多酚的纯度等原因有关。茶多酚对GG20210604生长影响的结果显示,当茶多酚的浓度≥250 μg/mL时,菌株在指数期的生长显著减缓,说明茶多酚对鸽源性大肠杆菌的生长具有抑制作用,并且呈现浓度依赖性。Xiong等[17]研究指出,茶多酚可以诱导大肠杆菌发生内源性氧化应激,从而抑制细菌的生长。Si等[18]研究发现,以茶多酚的主要成分表没食子儿茶素没食子酸酯(EGCG)和没食子儿茶素(EGC)处理细菌后,细菌形态由长杆状变为短棒状或球状,可能是由于细胞分裂受阻所致。茶多酚对GG20210604运动影响的结果表明,茶多酚显著抑制了GG20210604向培养基四周扩散,有效降低了其运动能力,与于淑池等[19]的研究结果一致。肠道致病细菌的运动能力是重要的致病因素之一,可以帮助细菌附着于宿主体内并迁移到营养物质丰富的位置进行增殖,并且细菌的运动能力对生物膜形成以及在宿主表面的黏附聚集过程中具有重要作用[20]。而鞭毛是介导细菌运动能力的主要器官。提示茶多酚能够干扰鞭毛的正常功能,从而调控鸽源性大肠杆菌的运动能力,并且可能影响鸽源性大肠杆菌的生物膜形成和黏附功能。
毒力基因在细菌致病性中起重要作用。Schneier-Rayman等[21]研究结果表示,0.55 mg/mL EGCG使变形链球菌株的gtfC、gtfB和ftf毒力基因表达降低70%~90%。在Apisada等[5]的研究中,500 mg/L EGCG可以使金黄色葡萄球菌溶血活性相关基因表达下调75%,但葡萄糖摄取系统和膜转运相关基因表达上升,推测金黄色葡萄球菌可能通过加强葡萄糖的吸收,促进细胞膜的修复,进而抵抗EGCG的损伤。大肠杆菌fliC基因编码的鞭毛蛋白是鞭毛的主要结构亚基,研究表明,fliC基因对细菌的运动、毒力因子的释放、生物膜形成和对外界压力的抵抗有重要作用[22]。菌毛是细菌在宿主黏膜细胞黏附定居的第一武器,常见的菌毛有Ⅰ型菌毛、P菌毛和Curli菌毛等,其中Ⅰ型菌毛最为常见。黏附素蛋白fimH是菌毛长度和数量的调控因子,同时是Ⅰ型菌毛与D-甘露糖特异性结合的黏附素,可特异性与红细胞和酵母细胞结合,为细菌进一步侵入机体、引发感染创造条件[23]。iroN是参与细菌内部铁离子吸收和转运的相关基因,而铁离子是细菌在生长繁殖过程中必需的离子之一,如果铁离子的吸收或转运障碍,细菌就不能正常的生长和繁殖[24]。溶血素hlyF可以促进外膜囊泡的分泌,将细菌的毒力因子、遗传因子和免疫调控因子等运输到宿主细胞,并且能诱导宿主细胞发生自噬[25]。茶多酚对GG20210604毒力基因表达影响的结果显示,经茶多酚处理后,该菌株的毒力基因fliC、iroN、fimH和hlyF的表达均被显著下调,其中,fliC毒力基因表达下调的结果与茶多酚对GG20210604运动的抑制结果相一致。较为有趣的是,与空白对照组相比,当茶多酚浓度为500 μg/mL时,对fimH基因的表达无显著影响,而250 μg/mL茶多酚则显著降低了fimH基因的表达,推测茶多酚抑制不同毒力基因表达的适宜剂量存在差异性,造成该现象的具体原因有待进一步研究。Lagha等[26]研究指出,茶多酚螯合铁离子的能力是茶多酚发挥抑菌作用的原因之一。白细胞毒素LtxA是放线菌分泌的外膜囊泡蛋白,可通过凋亡效应诱导淋巴细胞死亡,Chang等[27]研究表明,EGCG可改变LtxA的二级结构,阻止LtxA与细胞膜的胆固醇结合。由此推测,茶多酚可能会通过抑制GG20210604毒力基因的表达,降低大肠杆菌对外界环境的抵抗力,并且螯合铁离子和改变蛋白质的结构抑制GG20210604黏附、侵袭、铁摄取和增殖等生理过程达到抑菌效果。
目前,细菌性疾病的防控是肉鸽养殖业面临的巨大挑战之一。茶多酚主要来源于茶叶,具有高效广谱的抑菌作用,且病原菌不易产生耐药性,是一种绿色、天然的植物性抑菌剂。本研究的试验结果与前人研究结果相符合,均肯定了茶多酚对大肠杆菌具有抑制作用。但本研究发现茶多酚抑制不同毒力基因表达的适宜剂量存在差异性。因此,在实际生产中需合理安排茶多酚用药量。随着对茶多酚抑菌机理的深入了解以及茶多酚生产工艺不断升级、优化,茶多酚在今后的细菌性疾病的防控中具有良好的发展前景。
4 结 论
本研究从鸽粪便中分离得到1株大肠杆菌,命名为GG20210604。该菌株对环丙沙星和氨苄西林有一定的耐药性,且携带fliC、fimH、iroN和hlyF4种毒力基因,具有一定的致病性。此外,体外抑菌试验结果表明,茶多酚对该菌株的MIC和MBC均为4 000 μg/mL,125~1 000 μg/mL的茶多酚均可不同程度地抑制该菌株的生长、运动和毒力基因的表达。本研究可为茶多酚应用于鸽大肠杆菌临床感染的预防和治疗提供参考。
