两株ALV-K重组病毒感染性克隆的构建及病毒拯救
2022-10-20陈雪阳王兴明梁雄燕杨玉莹
王 淼,陈雪阳,王兴明,梁雄燕,杨玉莹
(长江大学动物科学学院,荆州 434025)
禽白血病病毒(Avian leukosis virus,ALV)是反转录病毒科、α反转录病毒属的一员,根据病毒囊膜基因env和宿主范围等的不同可将ALV分为11个亚群,其中A~E、J和K亚群的自然宿主是鸡[1]。ALV不仅可以引起鸡产生肿瘤性疾病,还可以引起鸡出现亚临床症状,如鸡体消瘦、产蛋下降等,给中国养禽业带来了巨大的经济损失[2]。目前市场上仍没有出现针对ALV的疫苗和有效的治疗药物,主要通过扑杀阳性鸡的方法来净化鸡群。禽白血病病毒K亚型(ALV-K)是自2012年新出现的亚型[3],多来自于无症状或亚临床症状的鸡,其可能是由于亚群之间的自然重组[4-7]。研究表明,ALV在不同年龄、不同毒株中致病力不同,经试验接种后,发病情况各不相同,这与毒株、鸡品种、接种途径、剂量、鸡的日龄有很大关系[8-9]。
RNA病毒在复制过程中的不稳定性较高,其中的非逆转录RNA病毒并不经过DNA阶段复制,因此很多情况下无法应用DNA重组技术开展病毒基因组的分析,使得研究存在很大的局限性。反向遗传学研究是在已知DNA序列的前提下,通过核苷酸定点突变、插入或缺失等基因改造手段,获取病毒基因组的cDNA,再借助体内、外转录等技术获得具有感染性的转录体,通过在易感细胞内的包装、病毒拯救等重新获得改造的活病毒粒子或者类似病毒物质[10-11],研究病毒改造后产生的表型效应,进而研究相关的生物学功能,这类能够拯救病毒的遗传材料称为感染性克隆。近年来,反向遗传学技术不断发展,广泛地应用于在体内对病毒基因结构、功能和病毒-宿主的相互作用以及新型疫苗的研发等方面。
本试验基于分离到的两株致病力不同的ALV-K,通过测序分析显示两株病毒核酸序列差异集中在5′-端长末端重复序列(5′-LTR),为研究病毒的致病性是否与5′-LTR相关,使用反向遗传学技术对这两株病毒的5′-LTR进行置换,并进行感染性克隆构建及病毒拯救,为进一步研究ALV-K的致病性打下基础。
1 材料与方法
1.1 材料
感染性克隆TOPO-HB2015032-ABC[12]和TOPO-HB2018003-ABC[13]由本实验室冻存;UMNSAH/DF-1细胞株购自中科院上海细胞库,由本实验室冻存。
2×F8 FastLong PCR MasterMix (PC8002)、One Step Seamless Cloning Kit(CV1901)和Zero Background pTOPO-Blunt Simple Cloning Kit(CV1701)均购自北京艾德莱生物科技有限公司;组织/细胞DNA提取试剂盒(GK0122)、琼脂糖凝胶回收试剂盒(GK2403-50)和质粒提取试剂盒(GK2004-50)均购自上海捷瑞生物工程有限公司;0.25%胰酶(GP3108-100ML)购自Genview公司;胎牛血清(FBS,900-108)购自Gemini公司;DMEM细胞培养基(C11995500BT)购自Gibco公司;禽白血病抗原P27 ELISA检测试剂盒购自IDEXX公司;TurboFect Transfection Reagent购自赛默飞生物有限公司;FITC标记的羊抗鼠 IgG (D110105)购自生工生物工程(上海)股份有限公司。
1.2 引物设计及合成
参考HB2018003毒株和HB2015032毒株基因序列(GenBank登录号:KY581580),根据用HB2018003毒株5′-LTR替换HB2015032毒株5′-LTR和用HB2015032毒株5′-LTR替换HB2018003毒株5′-LTR的原则,分别设计扩增HB2018003株5′-LTR和除5′-LTR外的基因组,HB2015032株5′-LTR和除5′-LTR外的基因组的引物(表1);参考GenBank已发表ALV基因序列设计ALV-A/J/K特异性鉴定引物(表1);M13引物为Zero Background pTOPO-Blunt Simple Cloning Kit中所列鉴定引物(表1)。引物由武汉擎科生物有限公司合成。

表1 引物信息Table 1 Primer information
1.3 目的基因的PCR扩增
以质粒TOPO-HB2015032-ABC为模板,分别以TOPO-032和032-LTR为引物PCR扩增TOPO-032和032-LTR;以质粒TOPO-HB2018003-ABC为模板,分别以TOPO-003和003-LTR为引物扩增TOPO-003和003-LTR,4个片段均使用25 μL反应体系:2×F8 FastLong PCR MasterMix 12.5 μL,上、下游引物各1 μL,质粒模板1 μL,ddH2O 9.5 μL。PCR反应条件:94 ℃预变性 1 min;94 ℃变性 10 s,退火 10 s(温度见表1),72 ℃延伸(时间与产物大小相关),共33个循环;72 ℃延伸 5 min。使用1.0%琼脂糖凝胶检测PCR扩增产物并切胶回收。
1.4 感染性克隆的构建及鉴定
使用One Step Seamless Cloning Kit将切胶回收的DNA片段TOPO-032和032-LTR、TOPO-003和003-LTR分别进行重组连接。TOPO-003-032反应体系为2×OneStep Cloning Mix 5 μL,TOPO-032 4 μL,003-LTR 1 μL;TOPO-032-003反应体系为2×OneStep Cloning Mix 5 μL,TOPO-003 3 μL,032-LTR 2 μL。上述反应体系50 ℃孵育1 h后转化大肠杆菌DH5α感受态细胞,复苏后均匀涂布在Amp抗性平板上,37 ℃过夜培养。
为了鉴定感染性克隆是否构建成功,以TOPO-HB2015032-ABC为对照,M13R和003-LTR-R为引物通过PCR的方法检测重组质粒TOPO-003-032;以TOPO-HB2018003-ABC对照、M13F和032-LTR-R为引物检测TOPO-032-003是否重组。PCR反应体系25 μL:2×F8 FastLong PCR MasterMix 12.5 μL,上、下游引物各1 μL,质粒模板1 μL,ddH2O 9.5 μL。PCR反应条件:94 ℃预变性1 min; 94 ℃变性10 s,55 ℃退火10 s,72 ℃延伸20 s,共30个循环; 72 ℃延伸5 min,使用1.0%琼脂糖凝胶进行检测。
1.5 病毒拯救及鉴定
将易感的DF-1细胞铺6孔板,待生长至80%汇合度时,将鉴定和测序正确的质粒TOPO-003-032和TOPO-032-003使用转染试剂TurboFect Transfection Reagent分别转染铺好的DF-1细胞,利用宿主细胞酶系统进行病毒的拯救。将转染质粒的DF-1细胞置于5% CO2的37 ℃细胞培养箱过夜培养;弃去培养基,PBS洗两遍,加入1%血清DMEM培养基,72 h后收取细胞上清进行群特异性抗原P27 ELISA检测。提取盲传3代后DF-1细胞基因组DNA并使用ALV-A/J/K多重PCR对其进行鉴定。PCR反应体系为:2×F8 FastLong PCR MasterMix 12.5 μL,ALV-A/J/K-F 2 μL,ALV-AR 1 μL,ALV-JR 1 μL,ALV-KR 0.5 μL,DNA模板 1 μL,ddH2O 7 μL。PCR反应条件:94 ℃预变性1 min;94 ℃变性 10 s,58 ℃退火10 s,72 ℃延伸20 s,共30个循环;72 ℃延伸5 min,使用1.0%琼脂糖凝胶进行PCR扩增产物检测。
1.6 间接免疫荧光试验(IFA)鉴定
将检验阳性的细胞培养物上清接种于DF-1细胞,在含有5% CO2的37 ℃培养箱培养1 d后弃去培养基,PBS洗涤3次;用4%多聚甲醛固定15 min,PBS洗涤3 次;加入0.5% Triton X-100作用15 min,PBS洗涤后加入10% FBS封闭1 h,PBS洗涤3次;以本实验室制备的抗ALV-K 抗体KM3为一抗(1 000倍稀释),孵育45 min,用PBS洗涤,最后加入200倍稀释的FITC标记的羊抗鼠IgG,PBS洗涤后于倒置荧光显微镜(莱卡 DMi8)观察。
2 结 果
2.1 目的基因扩增
PCR扩增结果显示,TOPO-032、032-LTR、TOPO-003和003-LTR分别扩增出9 243、314、9 247和345 bp的条带(图1),与预期结果一致。
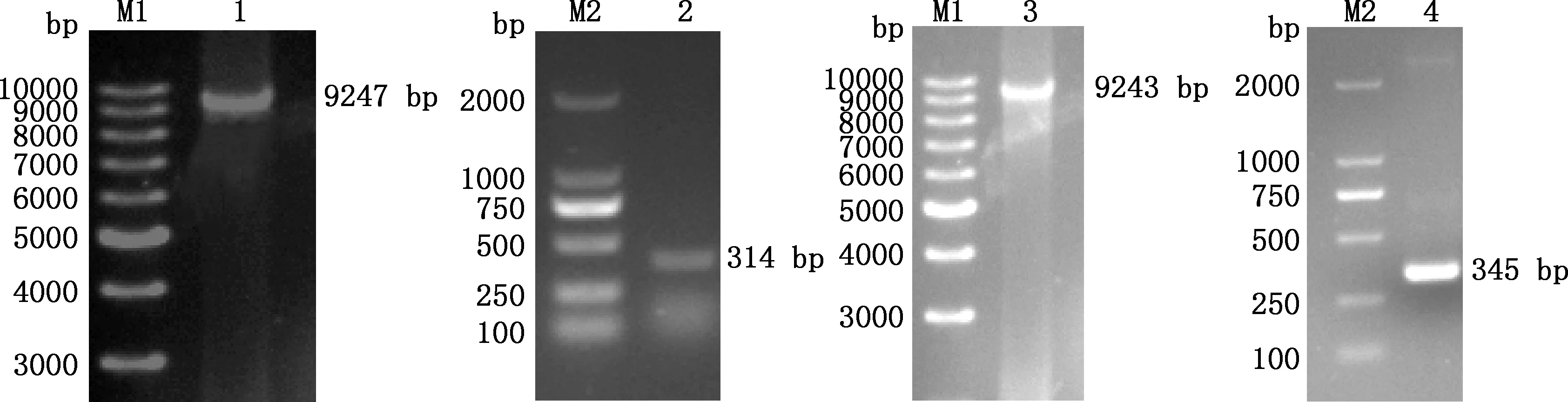
M1,DL10000 DNA Marker;1,TOPO-003;M2,DL2000 DNA Marker;2,032-LTR;3,TOPO-032;4,003-LTR图1 目的基因扩增Fig.1 Objective gene amplification
2.2 重组感染性克隆PCR鉴定
通过PCR对构建的重组质粒TOPO-003-032和TOPO-032-003进行鉴定,结果显示以TOPO-003-032质粒为模板的扩增出417 bp大小的条带,而以TOPO-HB2015032-ABC质粒为模板未见任何条带,表明已重组(图2A);以TOPO-032-003质粒为模板的扩增出369 bp大小的条带,而以TOPO-HB2018003-ABC质粒为模板未见任何条带,表明已重组(图2B)。

M,DL2000 DNA Marker;1,TOPO-003-032;2,TOPO-HB2015032-ABC;3,TOPO-032-003;4,TOPO-HB2018003-ABC图2 重组感染性克隆TOPO-003-032(A)和TOPO-032-003(B)的PCR鉴定Fig.2 PCR identification of recombinant infectious clones TOPO-003-032 (A) and TOPO-032-003 (B)
2.3 病毒拯救及鉴定
提取转染重组质粒TOPO-003-032和TOPO-032-003并盲传3代的DF-1细胞基因组DNA,应用ALV-A/J/K多重PCR鉴定,结果显示均在535 bp(ALV-K)处出现预期条带,未出现715(ALV-A)和430 bp(ALV-J)条带(图3)。
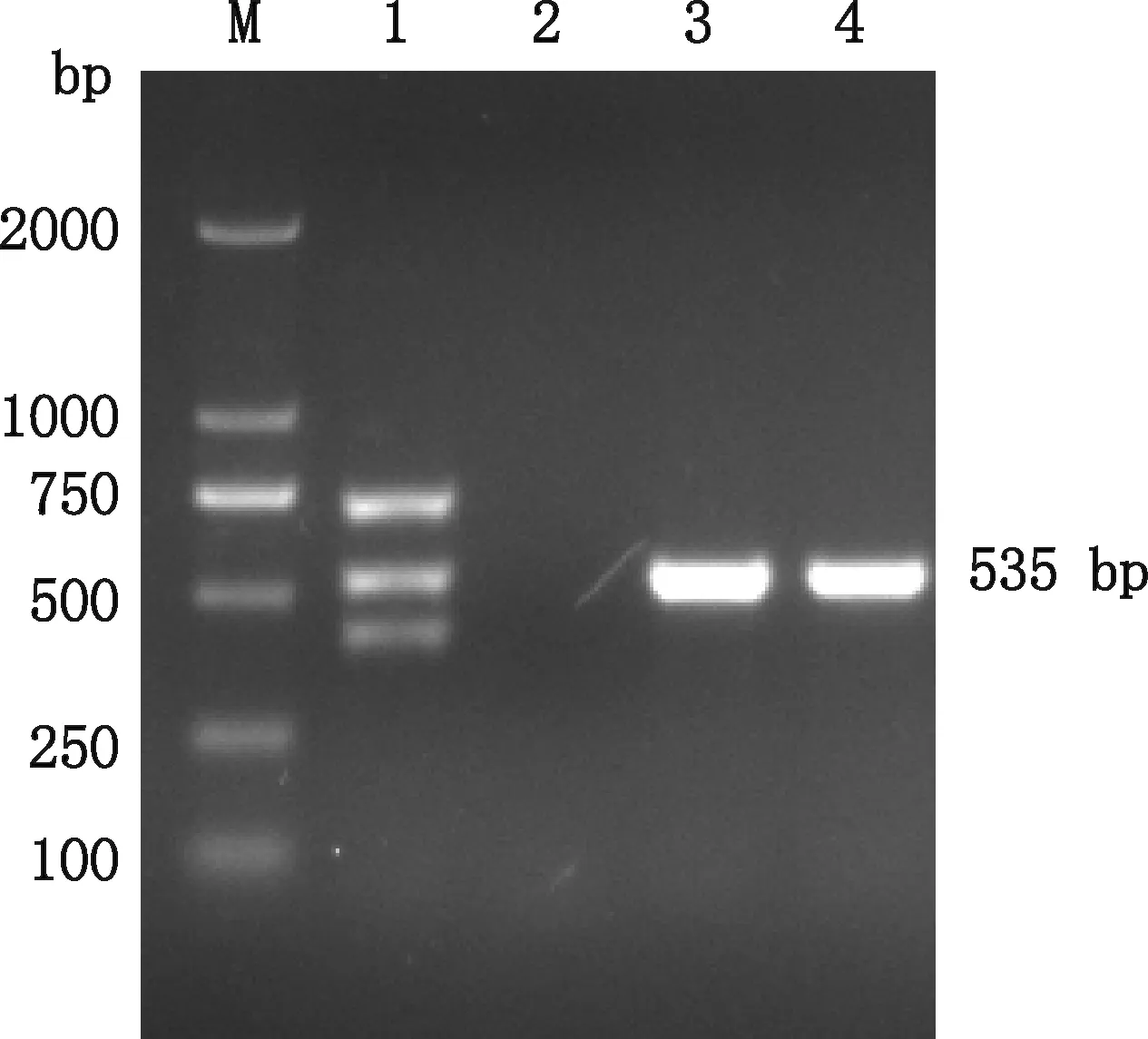
M,DL2000 DNA Marker;1,ALV-A/J/K阳性对照;2,阴性对照;3,转染重组质粒TOPO-003-032的DF-1细胞;4,转染重组质粒TOPO-032-003的DF-1细胞 M,DL2000 DNA Marker;1,ALV-A/J/K positive control;2,Negative control;3,DF-1 cells transfected with recombinant plasmid TOPO-003-032;4,DF-1 cells transfected with recombinant plasmid TOPO-032-003图3 ALV-A/J/K多重PCR鉴定Fig.3 Mulit PCR identification of ALV-A/J/K
2.4 间接免疫荧光试验鉴定
以本实验室制备的抗ALV-K单抗KM3为一抗孵育接种了拯救的两株病毒的DF-1细胞出现明显的亮绿荧光,阴性对照则没有出现荧光(图4)。结果表明成功拯救出病毒,并分别将拯救的病毒命名为rHB2022050(TOPO-032-003)和rHB2022051(TOPO-003-032)。
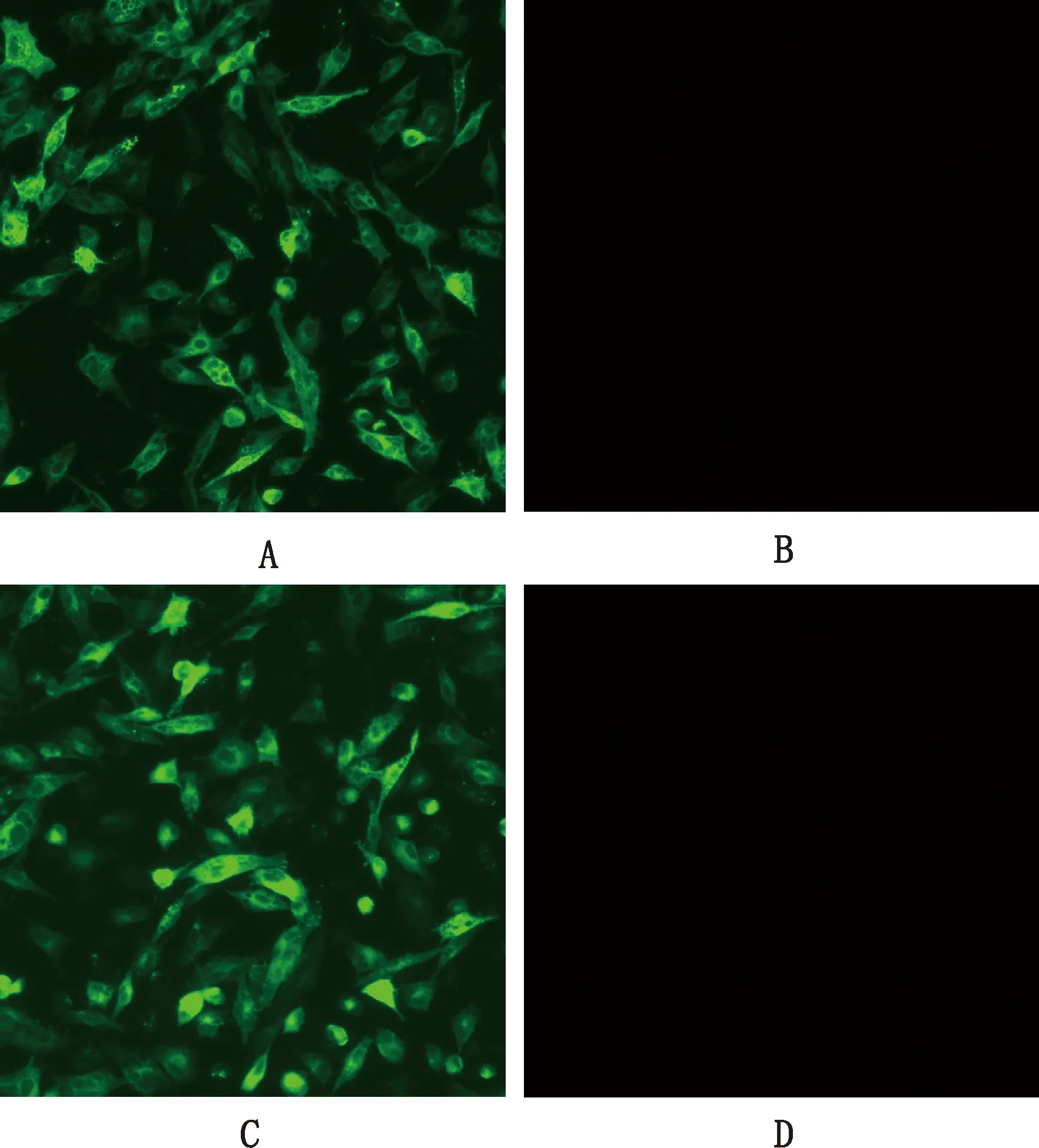
A,rHB2022050(TOPO-032-003);B、D,阴性对照;C,rHB2022051(TOPO-003-032) A,rHB2022050(TOPO-032-003);B and D,Negative control;C,rHB2022051(TOPO-003-032)图4 间接免疫荧光试验(200×)Fig.4 Indirect immunofluorescence assay (200×)
3 讨 论
ALV可引起禽类免疫抑制病,生长缓慢,同时也可以引起多器官肿瘤,导致死亡,与马立克氏病、网状内皮组织增生症并称禽类三大肿瘤性疾病,ALV感染后可导致髓细胞瘤、淋巴细胞瘤、成红细胞瘤等[14]。2012年,自王鑫等[3]发现ALV-K后,在中国其他地区陆续发现该毒株,海外地区如日本等也有相关报道[5-7,15-16]。由于ALV-K多在无临床症状或者亚临床症状的鸡群中分离,且该亚群病毒致病力和病毒复制能力等较弱,在实际生产中极易被忽视。中国科学院国家基因研究中心(NCGR)对ALV-K进行监测和分离,发现ALV-K的分离率逐渐上升,且新分离的毒株复制能力明显增强,对新的ALV-K分离株进行序列分析等发现,pol基因存在单核苷酸缺失,导致病毒的逆转录酶活性、病毒复制能力和垂直传播水平等都有显著提高[17]。在病毒复制过程中突变时发生,只有能够帮助病毒获得新功能或竞争优势的突变才能稳定保留下来。ALV-J在5′-端非编码区插入19个碱基可以提高其在DF-1细胞中的复制能力[18],而在3′-端非编码区缺失会使其致瘤性和致死率急剧上升[19],说明病毒基因组在进化过程中保留的突变会带来生物学特性极大的变化。ALV-K可能成为继J亚群禽白血病病毒之后成为中国养鸡业新的重大潜在威胁[6,20]。
ALV属于RNA病毒,病毒在复制过程中极容易发生突变,而反向遗传学技术是研究病毒分子特性的重要工具,可以获得较为稳定且遗传背景清晰的病毒[21]。HB2015032为致瘤型ALV-K[22],而HB2018003自然病例在剖检等研究过程中未发现明显的病变。通过基因序列比对发现HB2018003和HB2015032两株病毒的核苷酸同源性约为94.7%,且变异的区域主要集中在5′-LTR[23]。为验证这种致瘤性的差异是否是由这种集中在5′-LTR区域的变异引起的,因此将两株病毒的5′-LTR区进行互换后重组,以本实验室前期构建的HB2018003和HB2015032的感染性克隆为模板,使用PCR扩增相关的基因并进行同源重组,成功构建出5′-LTR相互置换的两株ALV-K。酶切法是构建感染性克隆的经典方法,应用广泛,但病毒基因组中可能需要插入相关的分子标记,此过程中可能会出现移码、突变等问题。在设计引物的过程中添加20 bp左右病毒基因组作为同源臂从而避免引入外源酶切位点的问题。同源重组法可同时将2条或以上的片段一次性连接,并且操作相对简单快捷,阳性率高,从而减少浪费大量时间。两株重组病毒的构建为后续研究ALV-K相关的生物学特性、致病性等方面提供材料,同时也为进一步了解ALV的进化和发展提供了一定的参考。
4 结 论
本研究以两株ALV-K(HB2015012和HB2018003)为亲本株采用同源重组的方法构建了5′-LTR互换的感染性克隆TOPO-003-032和TOPO-032-003,并成功拯救出病毒rHB2022050(TOPO-032-003)和rHB2022051(TOPO-003-032)。
