猪神经介素B受体基因慢病毒过表达载体的构建与鉴定
2022-10-20邵淑玉张金龙马志禹
邵淑玉,李 佳,马 卓,2,于 畅,2,张 莹,张金龙,2,马志禹,2
(1.扬州大学兽医学院,扬州 225009;2.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州 225009;3.中国农业科学院家禽研究所,扬州 225125)
蛙皮素(bombesin)作为一种重要的神经肽,在动物体内通过与其受体结合发挥重要的生理功能[1]。哺乳动物蛙皮素受体主要包括:神经介素B受体(neuromedin B receptor,NMBR)、胃泌素释放肽受体(gastrin-releasing peptide receptor,GRPR)和蛙皮素样受体3(bombesin-like receptor 3,BRS3),均为G蛋白偶联受体,具有典型的7次跨膜结构域[2-3]。在体内,NMBR与其内源性配体(NMB)结合,刺激胃肠道和泌尿生殖道平滑肌收缩[4]、调节垂体促甲状腺激素合成和分泌[5]、影响正常和肿瘤细胞生长、调节免疫反应[6]和生殖功能等多种生物学作用[7-10]。研究发现,NMBR基因在人、大鼠、小鼠、兔、猪等的睾丸组织中均有表达,且主要分布于睾丸间质细胞(Leydig cells)中[11-13];一定浓度的NMB能够调节猪[14]和兔[15]Leydig细胞睾酮的合成和分泌,说明NMB在雄性动物生殖调控中发挥着重要作用。
过表达技术在研究基因功能中愈来愈重要,通过构建外源基因过表达能够有效增加细胞中特定基因的表达。NMBR基因可能在猪Leydig细胞睾酮合成和分泌过程中发挥重要的作用,但NMBR基因过表达在猪上的研究还鲜见报道。由于与其他的载体系统相比,慢病毒载体能够携带较长的目的基因片段和稳定高效地转导细胞系或原代细胞,并且不会启动细胞的免疫应答机制。pCD513B-1属于第3代慢病毒过表达载体,具有生物安全性更高,病毒包装效率更高等优点。因此,本试验拟以pCD513B-1质粒为载体,通过重组构建猪NMBR基因慢病毒过表达载体,包装获得猪NMBR基因过表达慢病毒,并将获得的慢病毒转染猪Leydig细胞,为后续研究NMBR基因过表达在猪Leydig细胞中的功能奠定基础。
1 材料与方法
1.1 细胞、主要试剂及仪器
猪Leydig细胞由上海市农业科学院惠赠;pMD19-T载体、RNAiso Plus、XbaⅠ、EcoR Ⅰ、T4 DNA连接酶和DNA Marker均购自宝日医生物技术(北京)有限公司;2×TaqPlus MasterMix、反转录试剂盒和SYBR®Green Master Mix Kit均购自南京诺唯赞生物技术有限公司;DMEM、TurboFect、胎牛血清(FBS)、Advanced DMEM和Opti-MEM均购自赛默飞世尔科技(中国)有限公司;胶回收试剂盒、高纯度质粒小提试剂盒和大肠杆菌DH5α感受态细胞均购自天根生化科技(北京)有限公司;猪NMBR基因克隆质粒、pCD513B-1慢病毒过表达质粒、辅助质粒(pGag/Pol、pRev和pVSV-G)均由扬州大学兽医学院动物解剖学实验室保存。恒温振荡培养箱(IS-RDV1)购自Benchmark公司;凝胶成像系统(Tanon-2500)购自上海天能科技有限公司;PCR仪(T100)、荧光定量PCR仪(7500)均购自Bio-Rad公司;Ti-E倒置荧光显微镜(CKX53)购自Nikon公司。
1.2 猪NMBR CDS序列的获得

1.2.2 目的片段的扩增与纯化 以猪NMBR基因克隆质粒为模板,使用2×TaqPlus MasterMix对目的片段进行RT-PCR扩增。PCR反应体系25 μL:2×TaqPlus MasterMix 12.5 μL,模板2 μL,上、下游引物各1 μL,ddH2O 8.5 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸90 s,共35个循环;72 ℃延伸7 min;4 ℃保存。RT-PCR扩增产物用1.2%琼脂糖凝胶电泳进行检测,并按照胶回收试剂盒说明书纯化、回收目的片段。
1.3 慢病毒过表达载体pCD513B-1-NMBR构建
1.3.1 pMD19-T-NMBR质粒的获得 根据pMD19-T质粒说明书将目的片段插入pMD19-T质粒构建pMD19-T-NMBR重组质粒,将4 μL目的片段、1 μL pMD19-T质粒和5 μL Solution Ⅰ混合液在离心管中轻轻吹打混匀,16 ℃水浴30 min进行连接。将连接产物转化大肠杆菌DH5α感受态细胞,混匀后冰上放置30 min,将静置后的混合物在42 ℃水浴中热激60 s,冰上静置2 min后加入800 μL无氨苄LB液体培养基,37 ℃、180 r/min摇床上复壮45 min,菌液涂布于LB固体培养基上,37 ℃倒置培养过夜。挑取单菌落置于5 mL LB液体培养基中,37 ℃、180 r/min摇床上培养过夜,通过细菌培养扩增pMD19-T-NMBR质粒。按照高纯度质粒小提试剂盒说明书提取质粒,并以质粒为模板按照1.2.2方法进行RT-PCR检测。
1.3.2 双酶切pCD513B-1和pMD19-T-NMBR质粒 按照XbaⅠ和EcoRⅠ说明书分别对pCD513B-1和pMD19-T-NMBR质粒进行双酶切,酶切体系50 μL:XbaⅠ和EcoRⅠ各2.5 μL,0.1% BSA 5 μL,10×M Buffer 5 μL,pCD513B-1/pMD19-T-NMBR质粒25 μL,ddH2O 10 μL。酶切程序:37 ℃水浴2 h,加入10×Loading Buffer 6 μL 终止酶切反应。酶切产物用1.0%琼脂糖凝胶电泳进行检测,根据线性化pCD513B-1和NMBR片段大小分别切取凝胶,然后通过胶回收试剂盒纯化、回收获得线性化pCD513B-1和NMBR片段。
1.3.3 pCD513B-1-NMBR重组质粒的获得 在T4 DNA连接酶作用下将线性化pCD513B-1和NMBR进行连接,构建pCD513B-1-NMBR重组质粒;将重组质粒转化大肠杆菌DH5α感受态细胞获得DH5α-pCD513B-1-NMBR菌株,并通过细菌培养扩增获得pCD513B-1-NMBR重组质粒。将获得的质粒进行RT-PCR检测,PCR产物经胶回收试剂盒回收后送南京擎科生物科技有限公司测序。
1.4 猪NMBR基因过表达慢病毒的获得
1.4.1 HEK-293T细胞的复苏和培养 将保存的HEK-293T细胞37 ℃温浴复苏,用含10% FBS的DMEM培养液进行培养,传2~3代即可进行慢病毒的包装。按照1×106/mL将HEK-293T细胞接种于25 cm2细胞培养瓶中,置于37 ℃、5% CO2细胞培养箱中培养16~24 h,当细胞汇合度达到90%时,即可进行后续试验。
1.4.2 慢病毒的包装 将pCD513B-1-NMBR质粒及辅助质粒(pGag/Pol、pRev和pVSV-G)各1.0 μg加入Opti-MEM中混匀,再加入TurboFect转染试剂12 μL,轻轻混匀,室温避光静置20 min;然后将质粒混合物逐滴加入HEK-293T细胞中继续培养16 h;弃去细胞培养瓶中培养液,换为Advanced DMEM培养液继续培养48 h;通过荧光倒置显微镜观察慢病毒培养情况(GFP标签为绿色荧光),收集细胞培养液,1 000 r/min离心5 min,取上清液,于―80 ℃保存备用。
1.4.3 病毒效价测定 按照3×103/mL将HEK-293T细胞接种至96孔细胞培养板中,待细胞贴壁后进行病毒效价测定。将病毒用DMEM培养液倍比稀释为101~106倍;弃去96孔细胞培养板中培养液,加入稀释的病毒液,病毒和细胞共培养12 h后,更换正常的DMEM培养液继续培养48 h;用荧光显微镜观察GFP阳性细胞数;根据GFP阳性细胞数计算病毒效价。病毒效价(TU/mL)=GFP阳性细胞数×稀释倍数/接种病毒体积。
1.5 猪NMBR基因过表达慢病毒的鉴定
1.5.1 慢病毒转染猪Leydig细胞 传代培养猪Leydig细胞,按照1×105/mL将细胞接种于6孔细胞培养板中,细胞贴壁后进行猪NMBR基因过表达慢病毒转染(pCD513B-1-NMBR),不转染慢病毒的细胞为对照组(Control);细胞继续培养48 h后,通过观察绿色荧光检测转染效率。然后更换正常的DMEM培养液继续培养24 h,收集过表达组和对照组细胞。
1.5.2 实时荧光定量PCR 按照RNAiso Plus试剂盒说明书提取猪Leydig细胞过表达组和对照组细胞RNA,按照反转录试剂盒说明书反转录为cDNA,通过实时荧光定量PCR检测细胞中NMBR基因的表达情况。根据猪NMBR基因序列(GenBank登录号:KM058699),用Primer Premier 5.0软件设计猪NMBR实时荧光定量PCR引物,引物序列为:上游引物:5′-TAGGCCACATGATT-GTCAC-3′,下游引物:5′-GACTTCCTTCCGCA-ACAGA-3′;以β-actin为内参基因,其引物序列为:上游引物:5′-CTCCATCATGAAGTGCGACGT-3′,下游引物:5′-GTGATCTCCTTCTGCATCCT-GTC-3′[12]。引物均由南京擎科生物科技有限公司合成。PCR反应体系20 μL:2×AceQ实时荧光定量PCR SYBR Green Master Mix 10 μL,模板cDNA 2 μL,上、下游引物各0.4 μL,50×ROX Reference Dye 2 0.4 μL,ddH2O 6.8 μL。PCR反应程序:95 ℃预变性 5 min;95 ℃变性10 s,60 ℃退火延伸34 s,共40个循环。熔解曲线:95 ℃ 15 s,60 ℃ 60 s,95 ℃ 5。用2-ΔΔCt法计算各组细胞中NMBR基因的相对表达量。
1.6 数据分析
用SPSS 17.0软件中的t检验进行差异显著性分析。结果用平均值±标准误表示,用GraphPad Prism 5.0软件进行作图。P<0.01表示差异极显著。
2 结 果
2.1 猪NMBR CDS序列的获得
由图1可知,扩增产物条带单一,条带大小约为1 173 bp,与猪NMBR CDS序列片段大小一致,说明成功获得目的片段。
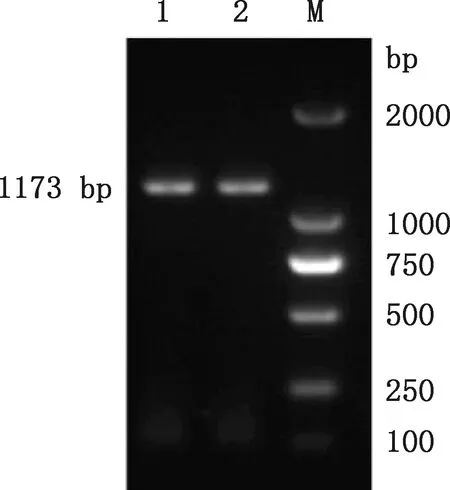
1、2,猪NMBR基因克隆质粒;M,DL2000 DNA Marker 1 and 2,Porcine NMBR gene cloning plasmids;M,DL2000 DNA Marker图1 猪NMBR CDS序列PCR扩增产物Fig.1 PCR amplification products of porcine NMBR CDS sequence
2.2 慢病毒过表达载体构建结果
将目的片段插入pMD19-T质粒构建pMD19-T-NMBR重组质粒,XbaⅠ和EcoR Ⅰ双酶切结果显示,重组质粒被双酶切为2条特异性条带(图2A),条带大小分别约为2 700和1 173 bp,与pMD19-T质粒和猪NMBR CDS序列片段大小一致,表明成功构建pMD19-T-NMBR重组质粒,并通过胶回收获得线性化NMBR。
将线性化pCD513B-1和NMBR连接构建pCD513B-1-NMBR重组质粒,RT-PCR检测结果显示,扩增产物条带大小约1 173 bp(图2B),与目的片段大小一致。另外,pCD513B-1-NMBR质粒测序结果与猪NMBR CDS序列碱基比对结果完全一致,表明成功构建慢病毒过表达载体pCD513B-1-NMBR。

①A,pMD19-T-NMBR重组质粒双酶切结果;B,pCD513B-1-NMBR重组质粒RT-PCR检测结果。②M1,DL5000 DNA Marker;1~3,pMD19-T-NMBR重组质粒;M2,DL2000 DNA Marker;4、5,pCD513B-1-NMBR重组质粒 ①A,The results of double digestion of recombinant plasmid pMD19-T-NMBR;B,The results of RT-PCR detection of recombinant plasmid pCD513B-1-NMBR.②M1,DL5000 DNA Marker;1-3,pMD19-T-NMBR recombinant plasmids;M2,DL2000 DNA Marker;4 and 5,pCD513B-1-NMBR recombinant plasmids图2 猪NMBR重组质粒鉴定结果Fig.2 Identification results of porcine NMBR recombinant plasmid
2.3 猪NMBR基因过表达慢病毒包装和效价测定
将pCD513B-1-NMBR/pCD513B-1和辅助质粒共转染HEK-293T细胞48 h,GFP表达情况结果显示,pCD513B-1-NMBR转染细胞细胞中呈现大量绿色荧光(图3B),与pCD513B-1转染细胞48 h观察到的现象(图3C、3D)一致,表明猪NMBR基因过表达慢病毒包装成功。由图4可知,与阴性对照相比,病毒稀释10倍转染细胞后表达GFP细胞较多,病毒稀释103倍后表达GFP细胞数量明显减少,当病毒稀释105倍后仅有几个细胞表达GFP。通过计算得到病毒的效价约为4×106TU/mL。

A,pCD513B-1-NMBR组细胞的明场图;B,pCD513B-1-NMBR组细胞的绿色荧光图;C,pCD513B-1组细胞的明场图;D,pCD513B-1组细胞的绿色荧光图 A,The bright field diagram of the pCD513B-1-NMBR group;B,The green fluorescence diagram of the pCD513B-1-NMBR group;C,The bright field diagram of the pCD513B-1 group;D,The green fluorescence diagram of the pCD513B-1 group图3 猪NMBR基因过表达慢病毒包装过程中GFP的表达(400×)Fig.3 Expression of GFP during the packaging of porcine NMBR gene overexpression lentivirus (400×)
2.4 猪NMBR基因过表达慢病毒的鉴定
由图5可知,猪NMBR慢病毒转染猪Leydig细胞48 h后80%以上细胞表达GFP,表明大部分细胞成功转染慢病毒。细胞继续培养24 h,GFP表达量明显增加。实时荧光定量PCR检测结果显示,与对照组相比,慢病毒转染细胞后能够极显著增加猪NMBR mRNA的表达水平(P<0.01,图6)。

A~D,分别为10、103、105倍猪NMBR慢病毒稀释液组和阴性对照组细胞的明场图;E~H,分别为10、103、105倍猪NMBR慢病毒稀释液组和阴性对照组细胞的绿色荧光图 A-D,The bright field diagram of 10,103,105 porcine NMBR lentivirus diluent group and negative control group,respectively;E-H,The green fluorescence diagram of 10,103,105 porcine NMBR lentivirus diluent group and negative control group,respectively图4 倍比稀释法测定猪NMBR基因过表达慢病毒效价(400×)Fig.4 Determination of porcine NMBR gene overexpression lentivirus titer by serial dilution (400×)

A、C,分别为48和72 h组细胞的明场图;B、D,分别为48和72 h组细胞的绿色荧光图 A and C,The bright field diagram of 48 h and 72 h group,respectively;B and D,The green fluorescence diagram of 48 and 72 h group,respectively图5 猪NMBR基因过表达慢病毒转染Leydig细胞效果检测(400×)Fig.5 Transfection effect of porcine Leydig cells with porcine NMBR gene overexpression lentivirus (400×)
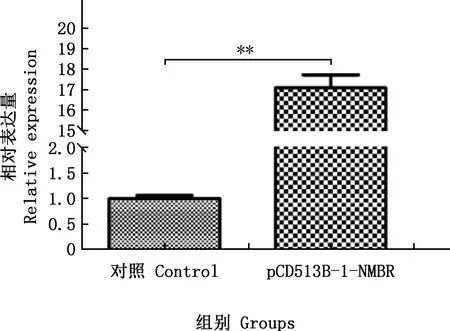
**,差异极显著(P<0.01) **,Significant difference (P<0.01)图6 实时荧光定量PCR检测NMBR mRNA在猪Leydig细胞中的相对表达量Fig.6 The relative expression of NMBR mRNA in porcine Leydig cells detected by Real-time quantitative PCR
3 讨 论
NMBR作为哺乳动物蛙皮素受体家族中的一员,能够与其配体NMB高效结合发挥多种重要的生物学作用[2-3]。NMB最初是在猪脊髓中分离的[16],马志禹等[12]成功克隆了猪NMBR基因,序列分析可知猪NMBR CDS序列为1 173 bp,编码390个氨基酸。本试验通过RT-PCR扩增成功获得了猪NMBR基因全长CDS序列,并在扩增片段的两端添加了不同的酶切位点,为后续构建重组质粒奠定基础。随着研究技术的不断进步,过表达技术在基因功能研究中应用越来越广,但是NMBR基因过表达在猪上的研究鲜见报道。而pCD513B-1质粒作为第3代慢病毒过表达载体,含有强启动因子,能够高效表达外源蛋白,具有易转化、方便检测(含有GFP标签)等优点[17-18]。因此,本试验通过重组成功构建了慢病毒过表达载体pCD513B-1-NMBR,为获得猪NMBR基因过表达慢病毒提供条件。由于第3代慢病毒载体为四质粒系统,所以该试验将重组质粒和辅助质粒(pGag/Pol、pRev和pVSV-G)一起转染HEK-293T细胞包装获得猪NMBR基因过表达慢病毒,但该慢病毒能否增加猪细胞中NMBR基因的表达需要进一步确定。
研究发现,NMBR在中枢神经系统(CNS)的多个脑区(嗅球、海马、丘脑、脊髓等)和外周组织器官的睾丸、胃肠道、食管、脂肪等多个组织中高表达[1-3]。在猪上,组织表达和分布定位研究发现,NMBR在睾丸中高表达,且主要存在于睾丸间质细胞中[12]。在猪和兔上的进一步研究发现,NMB能够调节睾丸间质细胞睾酮合成和分泌、细胞增殖与凋亡[14-15]。而睾丸间质细胞是雄性动物睾丸生成雄激素(主要是睾酮)最重要部位[19],在雄性生殖中发挥重要作用。在体内,NMB通过与NMBR结合激活G蛋白偶联受体信号通路发挥作用[20]。研究发现,NMBR基因过表达能够增强NMB对人子宫平滑肌细胞环氧合酶-2(COX-2)和白介素-6(IL-6)上调作用[21]。因此,可以通过调节NMBR基因的表达来研究NMB的生殖功能。本试验成功将猪NMBR基因过表达慢病毒转染猪Leydig细胞,通过实时荧光定量PCR检测发现慢病毒转染猪Leydig细胞后能够增加NMBR mRNA的表达,证实该载体构建成功。因此,可以通过构建NMBR基因过表达细胞模型来研究NMB在猪Leydig细胞中的功能。除了Leydig细胞,也可以将猪NMBR基因过表达慢病毒转染猪其他细胞中构建NMBR基因过表达模型,研究NMBR基因过表达在猪其他细胞中的功能,为神经肽在猪上的应用和相关产品的研发提供条件。当然,NMBR基因过表达是否能够引起细胞相关功能的变化还需要进一步研究。
4 结 论
本试验成功将扩增的猪NMBR CDS序列插入pCD513B-1质粒,构建了重组质粒pCD513B-1-NMBR;成功包装并获得了猪NMBR基因过表达慢病毒;将慢病毒转染猪Leydig细胞能够显著增加NMBR基因的表达,为后续研究NMBR基因过表达在猪Leydig细胞中的功能奠定基础。
