参七虫草方通过抑制促血管生成因子表达改善大鼠肺组织纤维化实验研究
2022-10-20张念志
何 程,陈 炜,张念志
(安徽中医药大学第一附属医院呼吸科,安徽 合肥 230031)
特发性肺纤维化(Idiopathic pulmonary fibrosis,IPF)是一种起源于肺泡上皮反复发生损伤后的异常修复的间质性肺疾病,其特征是在肺内进行性形成广泛纤维组织[1],5年生存率仅有20%,早期明确诊断困难,病死率高达50%[2-3]。迄今为止,西医治疗选择有限,缺乏对疾病进展显著有效的治疗药物,肺功能逐渐恶化,出现呼吸衰竭、心力衰竭,终致死亡[4-5]。
最新研究表明,炎症反应在IPF的早期损伤阶段发挥重要作用,而IPF发生发展的核心环节是肺损伤后血管生成开关失衡,血管出现过度新生,血管生成的失控必然会引起炎症反应和组织修复的失控[6]。血管新生是由促血管生成因子和抑制血管生成因子的精妙调控,保持动态平衡[7]。IPF过程中,血管生成过程中促血管生长因子如血管内皮生长因子(VEGF)、缺氧诱导因子(HIF-1α)高表达,促进磷酸肌3激酶(PI3K)、蛋白激酶B(AKT)磷酸化,分泌细胞因子,加重炎症反应,形成恶性循环[8-9]。因此,早期干预IPF的血管新生至关重要。
本课题组认为IPF发病的关键环节乃“肺失治节,因虚致瘀”[10]。肺失治节,气血失和,因虚致瘀,痰瘀滞络,出现血管新生,组织重塑,推进IPF的进程。参七虫草方是国医大师韩明向教授“虚瘀”病机理论指导下的临床效验方,前期研究表明[11-15],参七虫草方可减轻炎症反应,改善肺纤维化的程度。本研究在前期研究基础上,观察参七虫草方对模型大鼠血管新生相关因子的动态影响,探究其调控靶点及作用机制。
1 材料与方法
1.1 实验动物 128只8周龄SPF级SD大鼠,体重(220±20)g,由济南朋悦公司提供,动物许可证号:SCXK(鲁)2014-0007。
1.2 主要药物和试剂 参七虫草方(西洋参15 g,冬虫夏草3 g,三七10 g,安徽省中医院草药房提供),氯沙坦钾片(规格50 mg/片,国药准字 H20070264,浙江华海药业),Trizol(批号204403,Life technogies公司);Novostart SYBR qPCR SuperMix Plus(批号0512841,Novoprotein公司),VEGF抗体(批号GR116031-1,美国Abcam公司),PI3K抗体(批号GR221840-1,美国Abcam公司),AKT抗体(批号GR24003-93,美国Abcam公司),HIF-1α(批号GR204055-13,美国Abcam公司)。
1.3 实验仪器 普通PCR仪(杭州晶格公司),荧光定量PCR(Thermo Scientific公司);低速迷你离心机(海门其林贝尔公司),高速台式冷冻离心机(安徽嘉文公司)。
1.4 实验方法
1.4.1 造模、分组及给药:将128只大鼠适应性饲养3 d后,随机分成参七虫草组、氯沙坦组、模型组以及空白组,每组32只。除空白组外均采用博来霉素(BLM)气管内一次性滴注法[16]造IPF模型,将灌胃针置于后咽部,缓慢注入浓度为5 mg/ml的BLM(5 mg/kg)0.2~0.3 ml,注完后迅速将大鼠直立并反复旋转8~10次,使药液均匀在肺内分布,空白组则同上方法向气管内注入等量0.9%氯化钠溶液。造模后,对各组大鼠每日进行灌胃,模型组、空白组均予以0.9%氯化钠溶液1 ml/(kg·d)灌胃,参七虫草组予以0.38 g/(kg·d)参七虫草方灌胃、氯沙坦组予以10 mg/(kg·d)氯沙坦混悬液灌胃。造模成功后,分别予第7、14、21和28天,分别在各组内随机抽取8只大鼠处死,取出肺组织,福尔马林固定左肺下叶,用液氮冷冻保存右肺,以备下一步实验使用。
1.4.2 记录大鼠体重及一般情况:记录四组大鼠第7、14、21、28天的体重,同时观察各组大鼠的精神、活动、毛发、呼吸以及饮食情况。
1.4.3 HE染色观察肺脏病理学变化:取出浸泡在10%甲醛溶液不同时期的左肺下叶,脱水、包埋、切片等常规病理学处理后,观察肺脏炎性细胞浸润,肺泡腔内有无渗出物,有无充血水肿改变等。
1.4.4 Masson染色观察肺脏胶原沉积程度:左侧肺组织切片脱水,封片。观察肺泡结构及纤维结节,胶原沉积情况。
1.4.5 RT-PCR检测肺组织中PI3K、AKT、HIF-1α、VEGF的mRNA表达:取出液氮保存的不同时间点的右肺组织50~100 mg,严格按照TRIzol试剂盒步骤提取各组的总RNA,反转录成cDNA,每个样品重复3次,然后利用PCR仪进行PCR扩增操作,反应条件为95 ℃ 60 s;95 ℃ 20 s,60 ℃ 60 s,共40个循环,用2-△△Ct法计算各指标的表达水平。各检测指标引物见表1。

表1 各检测指标引物

2 结 果
2.1 各组大鼠的一般情况 空白组大鼠造模后的一般情况较佳,与造模前比较无明显改变。模型组大鼠造模后的一般情况日渐下降,较前更为安静,活动减少,毛发无光泽,呼吸浅快,食欲下降,实验的后期,两肺可闻及痰鸣音,体重较前也有不同程度的减轻。氯沙坦组大鼠造模后精神状态不佳,喜静,皮毛光泽度欠佳,实验前期该组大鼠食欲明显下降,伴有呛咳现象,实验后期食欲逐渐恢复正常,呛咳好转,前期体重下降,后期渐增。参七虫草组大鼠实验前期的一般情况与模型组及氯沙坦组相似,但实验后期该组大鼠的精神、活动、毛发、呼吸、饮食以及体重情况逐渐改善,整体状况略优于氯沙坦组,但次于空白组。
2.2 参七虫草方对肺纤维化大鼠体重的影响 各组大鼠在实验初期体重差异不明显,随着时间推移,各组大鼠体重差距逐渐拉大,第28天时,各组大鼠体重由轻到重的顺序依次为模型组、氯沙坦组、参七虫草组、空白组。见表2。
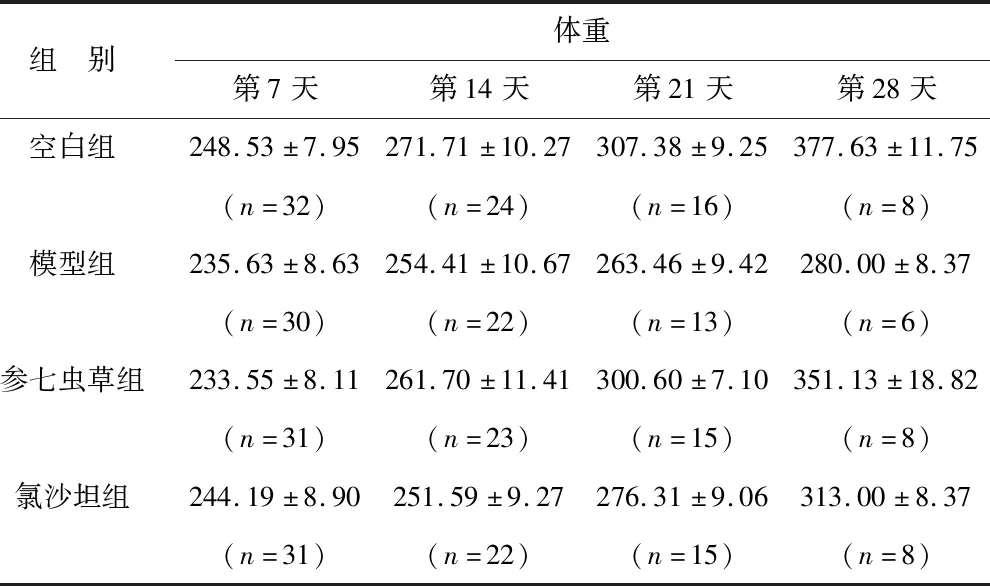
表2 四组大鼠各时间点体重比较(g)
2.3 HE染色 空白组的大鼠在造模后的不同时间点肺组织结构基本正常。在造模7 d后,模型组大鼠肺组织可见肺泡间隔增宽以及水肿,肺泡腔与支气管壁有炎细胞聚集;14 d后,肺泡间隔较前增宽、炎性渗出现象较前加重,肺间质有成纤维细胞增殖以及胶原沉积;21 d后,肺泡内的炎性细胞浸润状况较14 d时有减轻,胶原沉积则增多;28 d后,肺泡结构严重紊乱,纤维增生以及胶原沉积增多,炎性细胞少见。参七虫草组以及氯沙坦组肺组织病理变化的趋势近似于模型组,但各时间点上改变程度均轻于模型组,而参七虫草组又轻于氯沙坦组。见图1。

图1 各组不同时间点肺组织HE染色(×400) 图2 各组不同时间点肺组织Masson染色(×400)
2.4 Masson染色 空白组大鼠在造模后的各个时期其肺组织均未见到明显异常。模型组大鼠随着时间推移,其血管壁以及气管壁附近呈蓝染的胶原纤维面积越大,第28天可在镜下观察到大片的深蓝色胶原纤维沉积。与模型组比较,参七虫草组以及氯沙坦组在同一时间点其肺间质周围的蓝色胶原纤维的面积较小,染色的颜色也相对较轻。与氯沙坦组比较,参七虫草组的蓝染程度以及面积更小。见图2。
2.5 IPF大鼠肺组织第7、14、21、28天的HIF-1α、VEGF、PI3K、AKT mRNA表达水平 各时间点,与空白组比较,模型组、参七虫草组、氯沙坦组大鼠肺组织HIF-1α、VEGF、PI3K、AKT mRNA的表达量均升高,差异具有统计学意义(P<0.05),且表达量与时间成正比。在相同时间节点,氯沙坦组和参七虫草组HIF-1α、VEGF、PI3K、AKT mRNA表达水平低于模型组,差异具有统计学意义(P<0.05)。氯沙坦组和参七虫草组HIF-1α、VEGF、PI3K、AKT mRNA表达量无统计学意义(P>0.05)。见表3~6。

表3 各组不同时间点HIF-1αmRNA相对表达量比较

表4 各组不同时间点VEGF mRNA相对表达量比较

表5 各组不同时间点PI3K mRNA相对表达量比较

表6 各组不同时间点AKT mRNA相对表达量比较
3 讨 论
IPF为肺脏的慢性虚损性疾患,其病机多为本虚标实,肺气虚失却治节之功,日久影响金水相生,肺肾气阴两虚为本;肺失治水,痰浊滞络,瘀血内生,痰瘀滞络为标[17-18]。“肺失治水,痰瘀滞络”,故以益气养阴活血立法的参七虫草方辨治IPF,乃我院独创,由西洋参、冬虫夏草、三七组成,补益肺肾,益气养阴活血,从气血水重建肺之治节之功。本课题组既往研究[15]已证实益气养阴活血能改善肺纤维化状态,因此选用参七虫草方作为本次实验的治疗药物。有研究表明,氯沙坦钾片能够改善由药物BLM滴注造成的大鼠肺组织纤维化,且已有多篇有关于肺纤维化实验选用氯沙坦片作为阳性对照药物[19-20],故本研究选用氯沙坦钾片为对照药物。
IPF的是一种病因不明的难治性间质性肺疾病,其特征是肺功能不可逆下降和高病死率,西医缺乏有效的治疗手段,是肺病科常见的难治病种。因此干预IPF的血管新生对IPF患者。有研究已在动物模型中证实BLM气管滴注,会增多肺组织新生的血管[21]。血管生成在肺血管完整性、肺泡结构维护和肺泡修复性再生中发挥着重要作用,以恢复肺实质损伤后的气体交换功能[22]。本实验采用BLM诱导IPF模型[16,23-24],能够更好的模拟肺组织重塑的特点。病理学结果显示,随着时间的推移,模型组肺泡结构紊乱加重,纤维增生以及胶原沉积增多,造模成功。结合肺组织的病理学可见,参七虫草方干预后,参七虫草组大鼠肺组织胶原沉积减少,血管生成减少,纤维化减轻。
近年来研究发现血管的生成失调与纤维化的发生发展密切相关[25]。VEGF是血管生成和生长的关键因子,在促进血管内皮细胞的增殖、分化和迁移方面发挥重要作用[26-27]。当组织或细胞处于缺氧环境中时,HIF-1α作为机体在缺氧条件下重要的一种转录调节因子,炎症反应中通过促进炎症因子的分泌以及调节VEGF[28-29],发挥促进血管生成的作用。本实验结果发现,参七虫草方不仅能够抑制IPF大鼠肺组织中VEGF的表达,还能够抑制上游HIF-1α的表达。PI3K在VEGF激活后可随之激活,它的活化促使AKT磷酸化,活化后的AKT可进一步激活多种蛋白,参与肺组织的血管新生的调节[30]。本研究结果表明,模型组大鼠肺组织中VEGF的表达量显著升高,同时也伴随着PI3K、AKT mRNA表达量的升高,而在参七虫草方、氯沙坦的干预后,HIF-1α、VEGF、PI3K、AKT mRNA的表达均有不同程度的降低,表明参七虫草方可能通过抑制HIF-1α、VEGF、PI3K、AKT mRNA等促血管生成因子的生成减轻炎症反应及缓解肺纤维化。
综上所述,参七虫草方改善BLM诱导的大鼠肺组织的损伤,其机制可能通过抑制HIF-1α、VEGF、PI3K、AKT mRNA促血管生成因子的生成,延缓其纤维化。这为临床治疗IPF患者提供了新的思路。
