电针对围绝经期失眠大鼠睡眠觉醒脑电图及血清性激素水平的影响
2022-10-20于心同杨文佳陈云飞
于心同,杨文佳,赵 娜,陈云飞
(上海中医药大学附属岳阳中西医结合医院,上海 200437)
围绝经期是女性一生中一个特殊时期,从闭经前第一次月经不规律开始,至闭经1年后结束[1]。失眠是围绝经期女性常见的症状,围绝经期睡眠障碍的患病率与文化和种族密切相关[2],在我国患病率高达51%~55%[3-4],在美国患病率为31%~42%[5],日本为28%,韩国为15.9%[6]。失眠不仅会影响患者心理健康,还会增加心脏和神经系统疾病的发病率和病死率[7-8]。围绝经期失眠(Perimenopausal insomnia,PMI)常与抑郁、潮热、疲劳、食欲下降/增加、体重减轻/增加、夜尿症共存,并可增加与失眠有关的危害[9-10]。研究表明较低的雌二醇和较高的黄体生成激素水平与围绝经期失眠显著相关,但病理机制尚不明确[11-12]。激素替代疗法被围绝经期失眠患者广泛使用,但随着激素的应用,其弊端日益显现,从短期治疗来看,子宫出血和乳房触痛是最主要的不良反应[13-14]。针灸治疗PMI疗效显著[15-16],其通过审因论治、辨证取穴,在改善主客观睡眠指标、启动内源性的调节机制等方面占有明显优势,针灸通过内源性雌激素的调节大大减少了外源性雌激素导致的各种疾病的风险,明显提高了临床治疗PMI的安全性和有效性。电针治疗PMI的报道众多、疗效肯定,但对大鼠睡眠觉醒脑电图的改善报道描述不详[17]。本研究通过客观观察模型大鼠睡眠觉醒脑电图(睡眠觉醒时程、睡眠觉醒累积量、不同持续时间睡眠波出现次数、睡眠觉醒时相转换次数)及血清性激素的水平来探讨电针对PMI大鼠睡眠觉醒的调节作用。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:SPF级雌性SD大鼠,体重(200±20)g,由上海中医药大学附属岳阳中西医结合医院实验动物中心提供,实验动物许可证号:SCXK(沪)2018-0040。实验动物分笼饲养在睡眠觉醒生物解析系统(脑电图监测专用饲养笼)。饲养环境:恒温(24±1)℃、恒湿(60±2)%、隔音、静电屏蔽、7:00 am至7:00 pm(12 h/12 h)明亮黑暗周期(光照度≈100 lux),连续进行大鼠生殖道脱落细胞学观察动情周期,出现典型的动情周期纳入本实验研究。实验过程中严格遵照中华人民共和国科技部2006年颁布的《关于善待实验动物的指导性意见》。适应性饲养后1周后进行实验。
1.1.2 主要实验试剂与仪器:义齿基托树脂 (批号160508,上海张江生物材料有限公司),牙脱粉(批号140316,上海张江生物材料有限公司),戊巴比妥钠(批号20200422,美国默克公司),青霉素钠(批号H13020655,华北制药股份有限公司),大鼠FSH、LH、E2ELISA试剂盒(批号202007,上海哈灵生物科技有限公司),脑立体定位仪(美国Stoelting公司),电钻(28505,PROXXONGET日本株式会社),Neuro Log放大器(Digitimer),睡眠生物解析系统(日本Biotex公司),电脑记录睡眠软件(日本Biotex公司),华佗牌 0.3 mm×13 mm一次性使用无菌针灸针(苏州医疗用品厂有限公司),电针治疗仪(G6805-1A,上海华谊医用仪器有限公司)。
1.2 实验方法
1.2.1 建模及分组:采用随机数字表法将40只大鼠随机均分为对照组、模型组、电针组和假电针组,每组各10只。除对照组外,其余各组大鼠采用双侧卵巢切除的方法构建PMI大鼠模型[18-19]。具体方法:戊巴比妥钠40 μg/g腹腔麻醉,背部手术区域剃毛、75%酒精消毒,大鼠脊柱与两侧髂嵴最高点连线的交点作为标记点,向上做2~3 cm的纵行切口,分离皮肤与筋膜,脊柱标记点左右各旁开1 cm,钝性分离腰肌,完整提出卵巢组织并结扎,切除双侧卵巢,注意包膜是否完整,常规缝合后,伤口处以青霉素处理。对照组采用假手术的方法,摘除卵巢周围少量脂肪组织,并确保卵巢及包膜保持完整。术后恢复3 d,所有大鼠每天行阴道涂片观察生殖道脱落细胞,判定动情周期变化。模型组、电针组和假电针组大鼠阴道涂片连续1周无成熟脱落细胞,证明手术成功。对照组术后出现典型的动情周期变化,证明假手术成功。四组大鼠手术后给予无大豆饮食以排除大豆植物雌激素的影响。
1.2.2 大鼠脑电图记录电极埋置术:四组大鼠均行脑电图记录电极埋置术[20],戊巴比妥钠40 μg/g腹腔麻醉动物,将大鼠固定于脑立体定位仪上,头部剪毛,消毒,纵行剪开头部皮肤,剥离皮下组织,刮除骨膜,充分暴露颅骨,植入脑电图记录电极并埋入肌电记录线。皮层脑电图电极(采用不锈钢针)植入左侧顶叶皮层两点(lambda 前方和侧面各2 mm),额叶皮层(bregma前方和侧面各2 mm)来记录前顶叶脑电活动。将2个直径1 mm的不锈钢螺丝钉植入颅骨内,在额骨正中钻孔安置接地电极。另一对电极线被附着在颈部肌肉以测量肌电活动。用牙科水泥将电极固定于颅骨上,术后2 d内予以抗生素。大鼠术后在睡眠生物解析系统内恢复10 d。同时按照12 h/12 h明暗周期饲养(7:00 am至7:00 pm)。
1.2.3 干预方法:对照组和模型组正常饲养,不予电针干预。电针组:造模及电极埋置术后第10天,取双侧“安眠穴”(EX-HN18) ,安眠穴位于翳风与风池两穴连线之中点[21],取穴定位参照李忠仁主编《实验针灸学》,用0.5寸(针身长13 mm)30号毫针斜刺,每天上午8:00~10:00接G6805-Ⅱ型电针仪,连续波,2 Hz,电压2 V,强度以大鼠颈部轻微振动、无嘶叫为度,正负极分别接两侧“安眠穴”,每天1次,每次20 min,共治疗7次。假电针组:按照参考文献[22],将针灸针刺入大鼠穴位皮下后连接电针,但不予通电,其余操作同上述电针组方法。
1.2.4 动情周期监测:采集阴道分泌物进行涂片,右手持吸有少量0.9%氯化钠溶液的光滑吸管。将其缓慢冲入阴道内冲洗数次,吸取少量阴道液并缓慢抽出,均匀涂抹于载玻片上,干燥后放入盛有95%乙醇的盒内固定,采用巴氏染色法,光镜下观察大鼠阴道上皮细胞的变化情况,用于监测大鼠的动情周期。
1.2.5 血清FSH、LH、E2水平检测:末次电针治疗后,深度麻醉大鼠,腹主动脉取血。室温血液自然凝固10~20 min,离心20 min(2000~3000 r/min),仔细收集血清,保存过程中如出现沉淀,应再次离心。应用双抗体夹心法测定,用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中大鼠血清FSH、LH、E2水平。
1.2.6 脑电图记录与分析:经睡眠生物解析系统记录完成的大鼠脑电(EEG)和肌电(EMG)信号经系统放大、滤波、数模转换后,用软件实时记录。EEG/EMG记录结束后,运用分析软件,按统一设定的标准自动扫描判别出觉醒(Wake)、快速眼动睡眠(REMs)和非快速眼动睡眠(NREMs)。自动扫描完成后,进行人工检查,综合判读脑电与肌电,必要时改正[20]。
1.2.7 大鼠24 h睡眠觉醒时程分析:观察睡眠觉醒量,分析睡眠觉醒昼夜节律以及睡眠异常出现的时间。以昼夜24 h为横坐标,以每小时各睡眠觉醒时相的量为纵坐标,绘制出24 h时程曲线。
1.2.8 大鼠睡眠觉醒累积量分析:观察睡眠觉醒量,分析昼夜12 h/12 h各个时相的累积量,如数据点集中出现在某一区段,则计算这一区段的睡眠觉醒累积量,绘制出直方图。睡眠觉醒累计量直方图反应的是昼夜12 h/12 h或是某一时间段的睡眠变化。
1.2.9 大鼠不同持续时间睡眠波出现次数:观察睡眠觉醒结构,分析不同时长睡眠片段出现的次数,考察睡眠状态维持的能力。
1.2.10 大鼠睡眠觉醒时相转换次数:观察睡眠觉醒结构,分析各睡眠觉醒时相之间的转换次数,考察睡眠的稳定性、中途觉醒等。

2 结 果
2.1 各组大鼠动情周期变化比较 见表1。电针后,与对照组比较,模型组、电针组和假电针组大鼠动情周期紊乱率显著增高(P<0.05,P<0.01);与模型组比较,电针组大鼠动情周期紊乱率显著降低(P<0.05)。

表1 各组大鼠动情周期变化比较
2.2 各组大鼠24 h睡眠觉醒时程比较 见图1。电针后,与对照组比较,模型组和假电针组大鼠24 h睡眠觉醒昼夜节律减弱,白天觉醒增多,NREMs减少,尤其在白天的12:00和17:00觉醒增多、11:00和17:00 NREMs减少(P<0.05,P<0.01)。与模型组比较,电针组24 h睡眠觉醒昼夜节律趋势接近对照组,白天12:00和17:00觉醒减少、11:00和17:00 NREMs增多(P<0.05,P<0.01)。REMs组间比较无统计学差异(P>0.05)。

A:各组大鼠24 h觉醒时间;B:各组大鼠24 h REM睡眠时间;C:各组大鼠24 h NREM睡眠时间。与对照组比较,*P<0.05,△P<0.01;与模型组比较,#P<0.05,▲P<0.01
2.3 各组大鼠睡眠觉醒累积量比较 见图2。电针后,与对照组比较,模型组和假电针组大鼠睡眠觉醒累积量在12 h白天和24 h全天觉醒增多、NREMs减少(P<0.01)。与模型组比较,电针组大鼠在12 h白天和24 h全天觉醒减少、NREMs增多(P<0.05,P<0.01)。REMs组间比较差异无统计学意义(P>0.05)。

A:各组大鼠白天、夜间、全天觉醒时间累积量;B:各组大鼠白天、夜间、全天REM睡眠时间累积量;C:各组大鼠白天、夜间、全天NREM睡眠时间累积量。与对照组比较,△P<0.01;与模型组比较,#P<0.05,▲P<0.01
2.4 各组大鼠不同持续时间睡眠波出现次数比较 见图3。电针后,与对照组比较,模型组和假电针组大鼠NREMs在12 h白天和12 h夜间睡眠片段化明显,短时程次数增多、长时程次数减少,尤其短时程(0~16 s)增多、长时程(64~128 s)减少(P<0.05,P<0.01)。与模型组比较,电针组大鼠在12 h白天和12 h夜间睡眠片段化恢复,短时程(0~16 s)减少、长时程(64~128 s)增多(P<0.05,P<0.01)。REMs组间比较差异无统计学意义(P>0.05)。
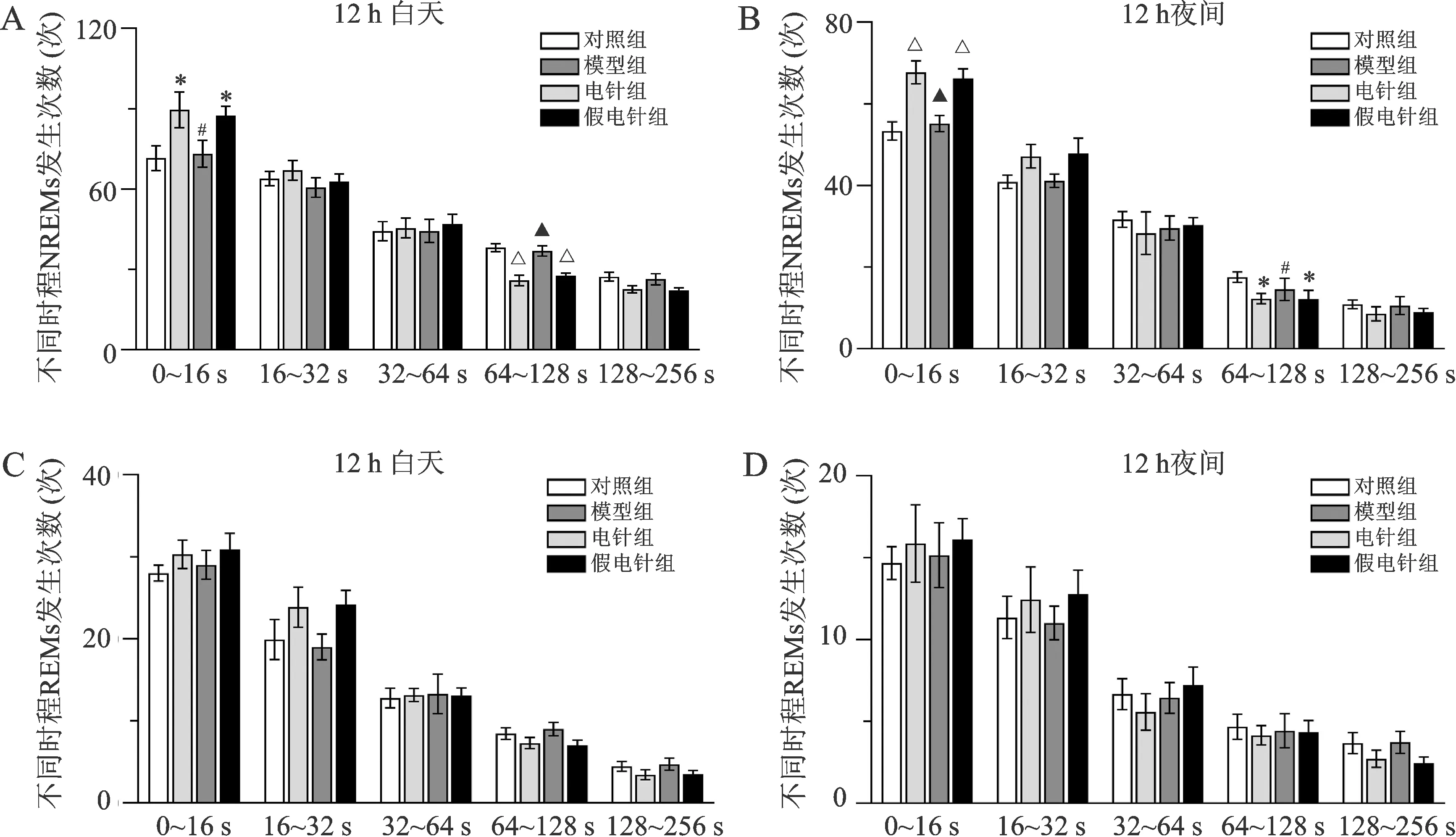
A:各组大鼠白天不同时长NREM睡眠片段发生次数;B:各组大鼠夜间不同时长NREM睡眠片段发生次数;C:各组大鼠白天不同时长REM睡眠片段出现的次数;D:各组大鼠夜间不同时长REM睡眠片段出现的次数。
2.5 各组大鼠睡眠觉醒时相转换次数比较 见图4。 电针后,与对照组比较,模型组和假电针组大鼠12 h白天慢波睡眠到觉醒(S-W)之间的转换增多(P<0.05,P<0.01),与模型组比较,电针组大鼠在12 h白天 S-W之间的转换减少(P<0.05),睡眠维持稳定。12 h白天除S-W之间的转换以及12 h夜间所有时相之间的转换比较均无统计学差异(P>0.05)。

A:各组大鼠白天各睡眠觉醒时相之间的转换次数;B:各组大鼠夜间各睡眠觉醒时相之间的转换次数。
2.6 各组大鼠血清FSH、LH、E2水平变化比较 见表2。 电针后,与对照组比较,模型组和假电针组大鼠血清FSH、LH水平升高(P<0.01)、E2水平降低(P<0.01),电针组大鼠血清FSH升高(P<0.05)、E2水平降低(P<0.01);与模型组比较,电针组大鼠血清FSH、LH水平降低(P<0.05)、E2水平升高(P<0.05)。

表2 各组大鼠血清FSH、LH、E2水平变化比较
3 讨 论
睡眠是一种高度保守的生命现象,与生物进化、物种繁衍和个体生存发展等密切相关。失眠等睡眠问题是妇女围绝经期及绝经后的主要主诉,随着人们对身心健康的逐渐重视,门诊中睡眠问题患者越来越多,女性步入绝经期后逐渐出现失眠并进展为慢性失眠,严重影响患者的社会功能。该阶段是女性一生所必须经历的生理过程,卵巢功能一旦衰竭或被切除和破坏,卵巢分泌的雌激素就会减少。随着社会的发展,人们精神压力增加,卵巢早衰的情况也在增加,睡眠觉醒障碍发病率升高,失眠即成为围绝经期女性最常见的主诉之一[23-24]。
PMI的发病因素多样,且相互关联。此时若不及时医治,可导致围绝经期时间延长,患老年病几率增高,工作效率降低,生活质量下降,并增加家庭矛盾,破坏家庭关系。长期失眠不仅会对患者的正常活动产生很大影响,而且还会降低患者的生理功能并引起一系列并发症[25-26]。与睡眠好的绝经妇女比较,睡眠差的绝经妇女更容易伴发慢性疾病以及更差的健康状况,因此有必要为绝经相关失眠症提供有效的疗法。提高围绝经期女性生活质量,让每个围绝经期女性都可以安心健康地过渡到下一个人生阶段,非常重要。
中医学中并无“围绝经期失眠”的专属名词,但依据其主要发病时间和临床特点,可将之归属于“经断前后诸证”“不寐”等范畴。围绝经期失眠因其所处的特殊生理阶段,因此与普通失眠又有不同,与“脏躁”“百合病”“郁病”相关。《内经·上古天真论》曰:“七七,任脉虚,太冲脉衰,天癸竭,地道不通,故形坏而无子”,该阶段女性天癸将竭,肾气渐衰,冲任空虚亏损,导致脏腑失于濡养,阴阳失于平衡而失眠。同时,围绝经期失眠,存在精血亏虚、阴血不足的基本病机,而在此基础上出现心神受扰,神魂不安。综合围绝经期女性的生理特点,极易发生失眠。
激素替代疗法、催眠药和精神药物一直用于围绝经期失眠患者的治疗,但这些药物都有严重的不良反应[27]。失眠的认知行为疗法和睡眠限制疗法已开始用于PMI的治疗,但临床运用比较局限。课题组之前评估了针灸治疗PMI患者的短期疗效[28],研究表明针刺可以明显降低PMI患者失眠严重程度(ISI)评分、匹兹堡睡眠质量指数(PSQI)评分,显著提升睡眠效率和夜晚整体睡眠时间,并显著降低夜间觉醒时间,尤其可以减少患者浅睡眠时间,针灸在主观和客观上促进PMI的临床相关改善。另有研究评估了电针对PMI患者睡眠和生活质量短期和长期的影响[29],结果证实电针治疗优于假电针治疗,是一种更安全、更有效的治疗方法,可以改善绝经后患者的睡眠质量,并具有长期的疗效和出色的安全性。
女性进入围绝经期前后,体内的卵巢激素也会发生相应的变化,在此阶段,卵巢体积变小,卵泡发育欠佳,雌激素水平降低、孕酮分泌含量生理性地减少,卵巢激素的波动而对睡眠产生影响[30]。本研究采用ELISA法测定大鼠血清FSH、LH、E2水平的变化情况,与对照组比较,模型组大鼠阴道脱落细胞显示动情周期紊乱或消失,血清FSH、LH水平升高、E2水平降低。与模型组比较,电针组大鼠血清FSH、LH水平降低、E2水平升高。说明电针可以调节PMI大鼠血清性激素水平,调节体内卵巢激素水平的变化。
实验研究发现,去卵巢小鼠不能有效维持觉醒,活动期睡眠量增加,表现出类似绝经期白天嗜睡样睡眠障碍[18]。电针可影响PMI大鼠睡眠时相,延长REMS、SWS1 时间[17],能增加去卵巢大鼠NREM睡眠时间,减少觉醒时间,改善去卵巢大鼠的睡眠觉醒状态[31]。脑电记录是睡眠研究的必要手段,本实验研究了电针对去卵巢大鼠睡眠觉醒脑电图的改变,通过对大鼠睡眠觉醒时程、睡眠觉醒累积量、不同持续时间睡眠波出现次数、睡眠觉醒时相转换次数的分析,说明了电针对PMI大鼠睡眠觉醒量、睡眠结构的改善。研究发现:模型组大鼠24 h睡眠觉醒时程在白天的觉醒增多、NREMs减少,白天和夜间短时程NREMs出现次数增多、长时程NREMs出现次数减少,白天睡眠到觉醒之间的转换增多。啮齿类大鼠为夜行动物,睡眠问题发生在白天与人类夜间睡眠相符。电针治疗后,电针组大鼠白天的觉醒减少、NREMs增多,白天和夜间短时程NREMs出现次数减少、长时程增多,白天睡眠到觉醒之间的转换减少。说明电针可以改善围绝经期失眠大鼠的睡眠觉醒状态,减少觉醒量,增加睡眠量,对于睡眠结构有显著影响,可提升睡眠的质量,保持睡眠维持能力和稳定性。
综上所述,电针对PMI大鼠睡眠觉醒脑电图具有积极的改善作用,可减少觉醒时间,增加睡眠时间,改善其睡眠结构,提升睡眠质量,我们认为电针可以作为治疗PMI或卵巢早衰的临床手段,其机制可能与血清性激素水平有关。
